Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Live Cell Imaging der Segregation der Chromosomen während der Mitose
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine einfache und bequeme Methode zum Beschriften und visualisieren live Chromosomen in mitotischen Zellen mit Histone2B-GFP BacMam 2.0-Gütezeichen und einer drehenden Scheibe konfokalen Mikroskopie System.
Zusammenfassung
Chromosomen müssen zuverlässig und gleichmäßig in Tochterzellen während der mitotische Zellteilung getrennt werden. Treue der chromosomalen Segregation wird durch mehrere Mechanismen gesteuert, die die Spindel Baugruppe Checkpoint (SAC) enthalten. Der SAC ist Teil eines komplexen Feedbacksystems, das Prävention einer Zelle Fortschritte durch Mitose zu verantworten hat, es sei denn alle chromosomalen Kinetochore angebracht haben, um die Mikrotubuli Spindel. Chromosomale rückständigen und abnorme Chromosom Segregation ist ein Indikator der dysfunktionalen Zellzyklus Kontrolle Checkpoints und kann verwendet werden, um die genomische Stabilität der teilenden Zellen zu messen. Deregulierung des SAC kann die Umwandlung von einer normalen Zelle in einer malignen Zelle durch die Anhäufung von Fehlern während der chromosomalen Segregation führen. Umsetzung des SAC und die Bildung von komplexen Kinetochor sind streng reguliert durch Wechselwirkungen zwischen Kinasen und Phosphatase wie Protein Phosphatase 2A (PP2A). Dieses Protokoll beschreibt live Cell Imaging rückständiger Chromosomen in Maus embryonalen Fibroblasten isoliert von Mäusen, die einen Ko von der regulatorischen Untereinheit PP2A-B56γ hatte. Diese Methode überwindet die Mängel anderer Zellzyklus Kontrolle bildgebender Verfahren wie Durchflusszytometrie oder Immunocytochemistry, die nur eine Momentaufnahme eines Zelle Zytokinese Status anstelle einer dynamischen räumlich-zeitliche Visualisierung der Chromosomen während der Mitose.
Einleitung
In das folgende Protokoll beschreiben wir eine bequeme Methode, um die chromosomalen Segregation und mitotischen Fortschreiten im Zellzyklus in Maus embryonalen Fibroblasten mit 2 b-GFP Histone, BacMam 2.0 Kennzeichnung und live Cell Imaging zu visualisieren.
Zellzyklus Kontrolle Checkpoints überwachen Chromosom Abtrennung und spielen eine wichtige Rolle bei der Aufrechterhaltung der die genetische Integrität der Zelle 1,2,3. Ansammlung von MIS getrennten Chromosomen führt zu Aneuploidie, die ist ein Markenzeichen von soliden Tumoren 4. Daher, Erkennung von rückständigen Chromosomen als Methode lässt sich um chromosomale Instabilität zu studieren.
Proteine können verwendet werden, live Chromosom Abtrennung zu visualisieren und chromosomalen hinkt aber die Generation der mCherry-Tags oder H2B-GFP markiert Protein erfordert umfangreiches Wissen von gen Lieferung und Molekularbiologie 5Eindringmittel gekennzeichnet. Hier beschreiben wir die Verwendung von CellLight Histone2B-GFP BacMam 2.0-Reagenz, CL-HB Regent, der Einfachheit halber nachfolgend genannt. Dieses Reagenz ist sofort einsetzbar und damit Bedenken Vektor Qualität und Integrität. Darüber hinaus erfordert das Reagenz nicht den Einsatz von potenziell schädlichen Behandlungen oder Lipide und Farbstoff-Loading Chemikalien. Im Gegensatz zu herkömmlichen Fluoreszenzmarkierungen Flecken die CL-HB-Regent unabhängig von Funktion (zB., Membranpotential). Die CL-HB-Regent kann einfach hinzugefügt, um die Zellen und Protein-Expression über Nacht inkubiert. Die CL-HB-Regent repliziert nicht in Säugetierzellen und Biosafety Niveau (BSL) 1 Labor Einstellungen verwendet werden. Auch kann dieses transiente Transfektion nach Übernachtung Inkubation für bis zu 5 Tage, genügend Zeit nachgewiesen werden, zur dynamischsten zellulären Analysen durchführen.
Alternativ konnte Chromosomenanomalien durch verschiedene Techniken wie Durchflusszytometrie, Immunohistochemistry oder Fluoreszenz in Situ Hybridisierung (FISH) 6untersucht werden. Durchflusszytometrie kann verwendet werden, um Aneuploidie, die gemessen werden kann anhand der DNA-Gehalt und die Phase der Zellen in den Zellzyklus zu studieren. Obwohl Durchflusszytometrie Aneuploidie Messen verwendet werden kann, bietet es keine Informationen auf MIS chromosomalen Segregation. Fisch und immunhistochemische Techniken verwenden fluoreszierende Sonden binden an DNA oder Chromosomen. Obwohl diese Techniken eine Momentaufnahme des Status von einer Bevölkerung der Zellen bieten, erlauben sie nicht live Cell imaging, dadurch fehlen Informationen, die durch räumlich-zeitliche Visualisierung der Zytokinese in bestimmten Zellen, die über einen bestimmten Zeitraum hinweg verfolgt.
Dieses Protokoll wurde verwendet, um rückständige Chromosomen oder chromosomalen MIS Segregation im Nocodazole behandelt Maus embryonalen Fibroblasten (MEFs) von PP2A-B56γ-Mäusen isoliert zu studieren. Zusätzlich zu oben Anwendung bietet dieses Protokoll ein einfaches Tool zum Beschriften und chromosomalen Segregation in verschiedenen Zelltypen, die zur Regulierung des Zellzyklus Untersuchung oder chromosomale Instabilität in Tumorzellen zu visualisieren. Darüber hinaus kann es auch chromosomale Instabilität verursacht durch verschiedene medikamentöse Behandlungen zu studieren oder Studie zu den Auswirkungen von gen Knock-out führt MIS chromosomalen Segregation verwendet werden.
Protokoll
Alle Experimente, die in diesen Studien wurden gemäß Protokollen durch die institutionelle Animal Care and Use Committee bei der Food and Drug Administration (FDA) Forschungseinrichtung genehmigt durchgeführt.
1. Isolierung und Kultur der Maus embryonalen Fibroblasten (MEFs)
- Isolieren Sie Maus embryonalen Fibroblasten (MEFs) aus einem PP2A-B56γ-Maus-Stamm und Wildtyp Wurfgeschwistern, indem Sie standard-Protokoll 7,8,9.
- ExpandMEFs für 3 Durchgänge, Einfrieren und lagern bis für Experimente 8benötigt.
2. Kultivierung Mefs in 2-Well gekammerten Deckglas für Live-Imaging
- Bereiten Sie 500 mL MEF Wachstumsmedien Dulbecco geändert Eagle Medium (DMEM/F12) mit 10 % mit fetalen Bovine Serum (FBS), 1 X Penicillin/Streptomycin Antibiotika, L-Glutamin (200 mM) und 1 X nicht-essentiellen Aminosäuren (NEAA) in einen 500-mL-Medien-Flasche.
- Tauen Sie Fläschchen mit gefrorenen MEFs vom Wildtyp und PP2A-B56γ-Mäuse in der Passage 3 in vorgewärmten Wasserbad bei 37 ° C.
- Transfer MEFs, 15-mL-Röhrchen aufgetaut und die 15-mL-Röhrchen mit einer 10 mL-Pipette langsam tropfenweise 20 mL DMEM/F12 Medien hinzufügen.
- Übertragen Sie MEFs zusammen mit 20 mL DMEM/F12 Wachstumsmedien in T75 Kolben, und erweitern Sie sie, bis die Zellen 70 % Zusammenfluss sind. Konfluenz dürfte mit einem inversen Mikroskop bei 4 X oder 10 X Vergrößerung.
- Aspirat das Wachstumsmedium mit einer Glas-Weide pipette ein Vakuum-System in der Haube befestigt, 3 mL 0,25 % Trypsin/EDTA und Inkubation bei 37 ° C für 5 min. Add 3 mL DMEM/F12 Wachstumsmedium, die Reaktion zu stoppen.
- Zentrifugieren Sie die Zellen mit geringer Geschwindigkeit (300 X g) für 5 min bei Raumtemperatur. Nehmen Sie des Überstands vorsichtig und erneut aussetzen der Zelle Pellet in 1 mL DMEM/F12 Nährmedium bei 37 ° C in einem Wasserbad vorgewärmt.
- Auflisten von Zellen unter Verwendung der Trypan blau Ausschluss-Methode oder anderen entsprechenden Zelle zählen Methode 8.
- Etwa 20.000 Samen MEFs/Brunnen in einer 2-gut gekammerten Deckglas. Fügen Sie 200 µL/Well DMEM/F12 Wachstumsmedium und lassen Sie die Zellen durch brüten sie über Nacht bei 37 ° C und 5 % CO2befestigen.
3. Synchronisation
- Synchronisieren von MEFs in G0/G1-Phase durch Inkubation der Zellen in DMEM/F12 Wachstumsmedien mit 0,1 % FBS für 24 h, um eine maximale Anzahl von Zellen in der G0/G1-Phase zu erhalten.
Hinweis: Obwohl Serum Hunger als Methode des Geschmacks verwendet wurde, können verschiedene andere Methoden je nach der mitotischen Phase verwendet werden bei denen Zellen erforderlich sind, um verhaftet 10sein.
4. Kennzeichnung
- Bereiten Sie 1,5 mg/mL Stammlösung von Nocodazole in DMSO. Nocodazole Festnahmen durch Hemmung der Mikrotubuli Bildung 10Zellen in G2/M-Phase.
- Drei Tage nach Synchronisation, fügen Sie 200 µL Wachstumsmedium (mit 10 % FCS), 200 ng/mL Nocodazole und CL-HB Regent (Histon 2 b-GFP BacMam 2.0).
- Berechnen Sie die CL-HB-Regent Partikel pro Zelle (PPC) Zellen wie folgt hinzugefügt werden:
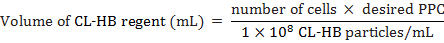
Wo die Anzahl der Zellen die geschätzte Gesamtzahl der Zellen zum Zeitpunkt der Kennzeichnung ist, PPC ist die Anzahl der Teilchen pro Zelle, und 1 × 108 ist die Anzahl der Teilchen pro mL Reagenz. Z. B. auf Label 20.000 Zellen mit einem PPC 30
Hinweis: CL-HB Regent funktioniert gut mit den meisten Zelltypen zwischen 10 und 50 PPC. Allerdings funktionierte 30 PPC am besten für diese Studie. - 18 h bei 37 ° C und 5 % CO2MEFs inkubieren.
Hinweis: Für das aktuelle Experiment trat Visualisierung von Chromosomen in mitotischen Zellen, die Flucht des Spindel Baugruppe Prüfpunkt 18 h nach Zellzyklus Festnahme mit Nocodazole.
(5) Visualisierung rückständiger Chromosomen
- Visualisieren Sie Maus embryonalen Fibroblasten (MEFs) mit einem drehenden Scheibe confocal Mikroskopsystem eine Klimakammer mit einem Ölimmersion, 63 X Objektiv ausgestattet.
- Verwenden Sie Erregung Wellenlänge von 488 nm und Emission Wellenlänge 450 nm für die GFP Kanal Bildaufnahme.
- Verwenden Sie ein Datenträgersystem confocal Mikroskop Spinnen mit der Fähigkeit der motorisierten Scan Stufen, Z-Piezo einfügt, Bühne-Top Inkubation und direkte Fluoreszenz Erholung nach dem Foto bleichen für diese Technik.
- Einen Tag vor Bildgebung, schalten Sie die Klimakammer macht und über Nacht die ganze Kammer bei 37 ° C erwärmen.
- Schalten Sie Strom für Mikroskopstativ, Kamera, Spinning Disk Unit, Beleuchter, Argonlaser, Computer und motorisierte Bühne.
- Lassen Sie das System 3 min. warmlaufen; Starten Sie den Argonlaser durch Drehen am Zündschlüssel. Schalten Sie den Kippschalter für Argonlaser aus dem "Standby", "laser"-Lauf.
- Die Daten-Erfassung und Verarbeitung-Software zu starten.
- Den CO-2 -Controller für die Bühne Top Inkubator zu initiieren und die Konzentration von CO2 auf 5 % festgesetzt. Dies muss vor Beginn der Bildgebung.
- Entfernen Sie die gekammerten Deckglas aus dem Inkubator und stellen auf der Bühne für die Visualisierung. Zellen über ein Öl eintauchen 63 X Objektiv (NA1.4) zu visualisieren.
- Blick durch das Okular Objektive, das Bild zu konzentrieren und eine Zelle in Kernhülle Aufschlüsselung (NEBD) Phase zu identifizieren.
- Geeigneten Laser (488 nm Argonlaser Histone2B-GFP zu visualisieren) zu initiieren.
- Übernahme-Kontroll-Fenster zu öffnen und Belichtungszeit für den GFP-Kanal eingestellt. Eine Zelle im NEBD zu identifizieren.
- Manuell bestimmen Sie die Zielzelle oben und unten Brennebene, und geben Sie die Xyz optische Einstellungen-Schnitt.
- Beobachten Sie es für 20 min; Wenn die Zelle nicht durch Zellteilung fort, stoppen Sie Bildaufnahme nach 20 min zu, und fahren Sie mit der nächsten Zelle NEBD.
- Ca. 1 h pro Zelle ist Bild rückständigen Chromosomen während der Mitose in PP2A-B56γ-Zellen notwendig, der aus der SAC entkommen. Um Daten für einen Film zu erhalten, fotografieren Sie alle 3 Minuten.
Hinweis: Wildtyp Zellen zu verhaften und komme nicht voran, vorbei an NEBD wenn mit Nocodazole behandelt. - Speichern von Bildern in Zvi-Datei-Format zur weiteren Analyse.
6. Verarbeitung und Analyse von Bildern
Hinweis: Führen Sie dreidimensionale Bildverarbeitung und-Analyse mit jeder verfügbaren Software wie Axiovision Version 4.8.2 oder Imaris Version 8.2. Für diese Studie die ImageJ wurde Software verwendet.
- Öffnen Sie die Bildsequenz. Wenn die Bilder bereits in einem Stapel-Format sind, fahren Sie mit dem nächsten Schritt fort. Wenn nicht, kombinieren alle relevanten Bilder in einem Stapel mit "Bild > Stacks > Bilder zum Stapel" in der Menüleiste.
- Durchführen Sie alle Einstellungen je nach Bedarf, Helligkeit/Kontrast und Ebenen.
- Der Film einen Zeitstempel hinzu:
- Gehen Sie auf "Bild > Stacks > Label..." in der Menüleiste.
- Wählen Sie das entsprechende Format Zeit Startwert und der zeitliche Abstand zwischen jedem Bild.
- Aktivieren Sie das Kontrollkästchen "Vorschau" und passen Sie Speicherort und das Format Einstellungen an. Drücken Sie "OK", um den Zeitstempel anzuwenden.
- Der Film eine Maßstabsleiste hinzufügen:
- Legen Sie die Bildskalierung unter "Analyze > Set Maßstab" in der Menüleiste.
- Geben Sie im Feld "Abstand in Pixel" eine Anzahl von Pixeln, wo die Entfernung bekannt ist, und geben Sie im Feld "Bekannte Distanz" den Abstand. Legen Sie die richtige Einheit der Länge für den Abstand, z. B.in µm. Drücken Sie 'OK', um die Anwendung der Skala auf den Stapel.
- Gehen Sie auf "Analyze > Tools > Skala Bar..." die Maßstabsleiste hinzufügen. Die Größe des Balkens als "Breite in µm", und passen Sie die verbleibenden Formatierung Optionen nach Bedarf. Kontrollkästchen Sie das "Beschriften Sie alle Scheiben" um den gesamten Stapel die Maßstabsleiste hinzufügen.
- Eine Vorschau des Films durch einen Klick auf den dreieckigen Play-Button am unteren linken Rand des Bildfensters. Passen Sie die Frame Rate mit "Bild > Stacks > Animation > Animationsoptionen in der Menüleiste.
- Exportieren Sie die Filmdatei durch die Auswahl "Datei > Speichern unter > AVI..." und wählen Sie die Bildrate und Kompression.
- Drücken Sie 'OK', um das Speichern wählen Speicherort und den Dateinamen. Drücken Sie "Save", um die Filmdatei speichern.
Ergebnisse
MEFs vom Wildtyp und PP2A-B56γ-Mäuse waren in einem 2-Well-Kammer Abdeckung Glas ausgesät und legen durfte. Am 2. Tag, MEFs wurden synchronisiert mit 0,1 % FBS für 24 h. Am 3. Tag, MEFs in Medien mit 200 ng/mL inkubiert Nocodazole und 30 PPC CL-HB Regentwere 18 h bei 37° C und 5 % CO2. Am 4. Tag wurden die Zellen abgebildet mit einem drehenden Scheibe confocal Mikroskopsystem (Abbildung 1). Live Cell Imaging wurde verwendet, um das ...
Diskussion
Zellzyklus Kontrolle Checkpoints, die genaue Chromosom Abtrennung sicherstellen zu verhindern, dass Aneuploidie und Zelle Transformation 1,2,3. In der vorliegenden Studie fanden wir die Inaktivierung von PP2A-B56γ führte zu einem geschwächten Spindel Baugruppe Checkpoint. Live Cell Imaging konnten wir beobachten, dass chromosomale MIS Trennung während der Mitose in PP2A-B56γ MEFs mit Nocodazole 9beha...
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Wir möchten Dr. Guo-Chiuan Hung und Dr. Bharatkumar Joshi für wertvolle Kommentare bedanken, die das Manuskript verbessert.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
Referenzen
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten