需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
有丝分裂过程中染色体分离的活体细胞成像
摘要
该协议描述了一种简便、方便的方法, 用 Histone2B-GFP BacMam 2.0 标签和旋转椎间盘共焦显微系统对有丝分裂细胞中的活染色体进行标记和可视化。
摘要
染色体在有丝分裂细胞分裂过程中必须可靠地和均匀地隔离成子细胞。染色体隔离的保真度由包括主轴装配检查点 (SAC) 在内的多个机制控制。该囊是一个复杂的反馈系统的一部分, 负责防止细胞的进展, 通过有丝分裂, 除非所有染色体动粒连接到纺锤管。染色体滞后和异常染色体分离是功能障碍细胞周期控制检查点的指示器, 可用于测量细胞的基因组稳定性。解除对囊的放松会导致正常细胞通过染色体分离过程中的错误积累而转化为恶性细胞。该囊的实施和动粒复合体的形成由激酶和磷酸酶 (如蛋白磷酸酶 2A (PP2A)) 之间的相互作用紧密调节。该协议描述了小鼠胚胎成纤维细胞中的滞后染色体的活细胞成像, 这些老鼠的 PP2A-B56γ调节亚基被挖空。这种方法克服了其他细胞周期控制成像技术的缺点, 如流式细胞术或免疫细胞化学, 只提供一个胞质分裂的状态的快照, 而不是一个动态的时空可视化的染色体有丝分裂期间。
引言
在下面的协议中, 我们描述了一个方便的方法来可视化的染色体分离和有丝分裂进展在小鼠胚胎成纤维细胞使用组蛋白 2 b-GFP, BacMam 2.0 标记和活细胞成像。
细胞周期控制检查点监视染色体隔离, 并在维护细胞的基因完整性方面发挥重要作用1,2,3。分离的染色体的积累可能导致体检, 这是大多数实体肿瘤的标志4。因此, 对滞后染色体的检测可以作为一种研究染色体不稳定性的方法。
荧光标记的蛋白质可用于可视化活染色体分离和染色体滞后, 但 mCherry 标记或 H2B-GFP 标记蛋白的产生需要大量的基因传递和分子生物学知识5。在这里, 我们描述使用 CellLight Histone2B-GFP BacMam 2.0 试剂, 此后称为 CL-HB 摄政, 为了简单。这种试剂可以立即使用, 从而消除了对矢量质量和完整性的关注。此外, 该试剂不需要使用潜在的有害治疗或脂质和染料加载化学品。不同于传统的荧光标签, CL-HB 摄政污点独立功能 (i. e, 膜电位)。CL-HB 摄政可以简单地添加到细胞和孵化过夜的蛋白质表达。CL-HB 不复制哺乳动物细胞, 可用于生物安全水平 (BSL) 1 实验室设置。此外, 这种瞬变转染可以检测后, 夜间孵化长达5天, 足够的时间进行最动态的细胞分析。
另外, 可以通过流式细胞术、免疫组化或荧光原位杂交 (鱼) 6等多种技术研究染色体异常。流式细胞术可用于研究体检, 可根据细胞周期中 DNA 含量和细胞相的相位进行测量。虽然流式细胞术可以用来测量体检, 但它并没有提供染色体错误隔离的信息。鱼类和免疫组化技术使用荧光探针绑定到 DNA 或染色体。虽然这些技术提供了一个细胞种群状态的快照, 但它们不允许活细胞成像, 从而错过了任何信息, 通过时空可视化胞质分裂在特定的细胞后一段时间。
本协议用于研究 nocodazole 处理的小鼠胚胎成纤维细胞 (MEFs) 离体 PP2A-B56γ的滞后染色体或染色体错隔离。除上述应用外, 本协议还提供了一种简单的工具, 用于标记和可视化各种细胞类型的染色体分离, 可用于研究肿瘤细胞的细胞周期调节或染色体不稳定性。此外, 它还可用于研究各种药物治疗引起的染色体不稳定性, 或研究基因敲出导致染色体错误隔离的效果。
研究方案
在这些研究中进行的所有实验都是按照《食品和药物管理局 (FDA) 研究机构机构动物保育和使用委员会批准的议定书》进行的。
1. 小鼠胚胎成纤维细胞的分离培养 (MEFs)
- 通过标准协议7,8,9, 从 PP2A-B56γ鼠株和野生型窝中分离出小鼠胚成纤维细胞 (MEFs)。
- ExpandMEFs 3 通道, 冻结和存储, 直到实验需要8。
2. 在2井腔盖玻璃中培养 Mefs 的活体成像技术
- 准备500毫升的 MEF 生长培养基, 其中含有 Dulbecco 修饰的鹰培养基 (DMEM/F12), 10% 胎牛血清 (血清), 1 X 青霉素/链霉素抗生素, l-谷氨酰胺 (200 毫米) 和1X 非必需氨基酸 (NEAA) 在500毫升的培养基瓶中。
- 在37摄氏度前预热水浴中, 从野生型和 PP2A-B56γ小鼠处解冻 MEFs 的冷冻瓶。
- 转移解冻 MEFs 到15毫升管和慢慢地添加滴状20毫升 DMEM/F12 介质到15毫升管使用10毫升吸管。
- 转移 MEFs 与20毫升的 DMEM/F12 生长培养基在 T75 烧瓶, 并扩大它们, 直到细胞70% 汇合。融合估计使用的是4x 或10x 放大的逆显微镜。
- 使用附着在罩内真空系统上的玻璃牧场吸管吸入生长培养基, 加入3毫升0.25% 胰蛋白酶/EDTA, 在37摄氏度处孵育5分钟. 添加3毫升的 DMEM/F12 生长培养基以停止反应。
- 在室温下将细胞以低速 (300 x g) 的速度离心成5分钟。小心移除上清, 并在水浴中在37摄氏度前预热1毫升的 DMEM/F12 生长培养基中重新悬浮细胞颗粒。
- 使用台盼蓝排除方法或其他适当的单元计数方法8枚举单元格。
- 种子大约 2万 MEFs/井在2井腔盖玻璃。添加200µL DMEM/F12 生长培养基, 通过在37摄氏度和 5% CO2上过夜, 使细胞通过孵化来附加。
3. 同步
- 同步 MEFs 在 G0/G1 阶段通过孵化细胞在 DMEM/F12 生长培养基中含有0.1% 的24小时, 以获得最大数量的细胞在 G0/G1 阶段。
注: 虽然血清饥饿被用作一种首选方法, 但各种其他方法都可以根据需要被逮捕的细胞的有丝分裂阶段10来使用。
4. 标签
- 在亚砜中制备1.5 毫克/毫升 nocodazole 的溶液。Nocodazole 通过抑制微管形成10, 在 G2/M 阶段逮捕细胞。
- 三天后同步, 添加200µL 生长培养基 (10% FCS), 200 ng/毫升 nocodazole 和 CL-HB (组蛋白 2 b-GFP BacMam 2.0)。
- 计算每个单元格 (PPC) 中的 CL-HB 晶粒子, 以如下所示添加到单元格中:
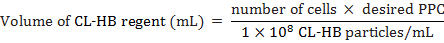
如果细胞数是标记时的估计总细胞数, PPC 是每个细胞的粒子数, 1 x 108是试剂每毫升的粒子数。例如, 将2万个单元格标记为30的 PPC
注意: CL-HB 在10和 50 PPC 之间的大部分细胞类型工作良好。然而, 30 PPC 为本研究提供了最好的效果。 - 孵化 MEFs 为18小时在37°c 和 5% CO2。
注: 在目前的实验中, 在 nocodazole 细胞周期骤停后, 有丝分裂细胞中脱离纺锤体组装检查点的染色体可视化发生18小时。
5. 滞后染色体的可视化
- 用旋转圆盘共聚焦显微镜系统 MEFs 小鼠胚胎成纤维细胞 (), 配备一个环境室和一个油浸泡, 63x 物镜。
- 使用 488 nm 和发射波长 450 nm 的激发波长进行 GFP 通道图像采集。
- 采用旋转圆盘共焦显微镜系统, 具有机动扫描阶段、Z 压电插入、顶部孵化和光漂后直接荧光恢复等功能。
- 在成像前的前一天, 将环境室的电源打开, 并在一夜之间将整个房间预热37摄氏度。
- 打开显微镜架、照相机、旋转圆盘单元、光源、氩激光、计算机和机动舞台的电源。
- 让系统预热3分钟;启动氩激光通过打开点火键。将氩激光器的切换开关从 "待机" 切换到 "激光运行"。
- 启动数据采集和处理软件。
- 为舞台顶部孵化器启动 co2控制器, 并将 co2的浓度设置为5%。这必须在成像开始前完成。
- 从孵化器中取出腔盖玻璃, 并将其放置在舞台上进行可视化。通过油浸泡63x 物镜 (NA1.4) 可视化细胞。
- 通过眼镜查看, 聚焦图像, 识别核包络击穿 (NEBD) 阶段的细胞。
- 启动适当的激光 (488 nm 氩激光可视化 Histone2B-GFP)。
- 打开获取控制窗口并设置 GFP 通道的曝光时间。标识处于 NEBD 中的单元格。
- 手动确定目标单元格的顶部和底部焦点平面, 然后输入 xyz 光学切片设置。
- 观察20分钟;如果单元格不进行单元格划分, 请在20分钟后停止图像获取, 然后移动到 NEBD 中的下一个单元格。
- 在 PP2A-B56γ细胞有丝分裂过程中, 每细胞需要大约1小时来成像滞后染色体。要获取影片的数据, 请每隔3分钟拍照一次。
注: 野生型细胞在 nocodazole 治疗的过程中, 在 NEBD 的情况下不会取得进展。 - 以齐文件格式保存图像以进行进一步分析。
6. 图像处理与分析
注意: 使用任何可用的软件 (如 Axiovision 版本4.8.2 或 Imaris 版本 8.2) 执行三维图像处理和分析。为这项研究使用了 ImageJ 软件。
- 打开图像序列。如果图像已处于堆栈格式, 请继续执行下一步。如果不是, 将所有相关的图像合并到一个堆栈中, 使用 "图像 > 堆栈 > 图像堆叠" 在菜单栏中。
- 根据需要对亮度/对比度和级别执行任何调整。
- 要向影片中添加时间戳:
- 在菜单栏中转到 "图像 > 堆栈 > 标签..."。
- 选择相应的格式、起始时间值和每个图像之间的时间间隔。
- 检查 "预览" 框并调整位置和格式设置。按 "确定" 以应用时间戳。
- 要向影片中添加缩放栏:
- 在菜单栏中的 "分析 > 设置比例" 下设置图像缩放。
- 在 "距离像素" 字段中, 输入距离已知的多个像素, 并在 "已知距离" 字段中输入距离。在µm 中设置距离的正确长度单位,例如. 按 "确定" 将比例应用于堆栈。
- 转到 "分析 > 工具 > 缩放栏..." 以添加缩放条。将条形图的大小设置为 "µm 中的宽度", 并根据需要调整其余的格式选项。选中 "标签所有切片" 框, 将缩放条添加到整个堆栈中。
- 通过单击图像窗口左下边缘的三角形播放按钮预览影片。在菜单栏中使用 "图像 > 堆栈 > 动画 > 动画选项" 调整帧速率。
- 通过选择 "文件" > "保存为 > AVI..." 来导出影片文件, 并选择帧速率和压缩。
- 按 "确定" 选择保存位置和文件名。按 "保存" 保存影片文件。
结果
MEFs 从野生型和 PP2A-B56γ小鼠种子在2井室盖玻璃, 并允许附加。在2天, MEFs 的同步使用0.1% 的血清24小时。在3天, MEFs 在 200 ng/毫升 nocodazole 和 30 PPC CL regentwere 的介质中, 在 37°c 和 5% CO2上孵化18小时。在4天, 这些细胞是使用旋转圆盘共聚焦显微镜系统 (图 1) 进行成像的。活细胞成像被用来可视化的命运, 个别细胞, 因为他们从 NEBD 的进展, ...
讨论
细胞周期控制检查点, 确保准确的染色体隔离防止体检和细胞转换1,2,3。在本研究中, 我们发现 PP2A-B56γ的失活导致了一个薄弱的主轴装配检查点。活体细胞成像允许我们观察染色体错误隔离在有丝分裂期间 PP2A-B56γ MEFs 治疗 nocodazole 9。
该协议利用 BacMam 2.0 技术生成的 Histone2B-GFP 标签来标?...
披露声明
作者声明他们没有竞争的财政利益。
致谢
我们要感谢郭 Chiuan 和 Bharatkumar 博士的宝贵意见, 改进了手稿。
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
参考文献
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。