このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞分裂時の染色体分配の生きているセルイメージ投射
要約
このプロトコルでは、ラベルおよび Histone2B GFP BacMam 2.0 ラベルおよび回転のディスク共焦点顕微鏡システム使用して分裂期の細胞で生きている染色体の視覚化に簡単で便利な方法について説明します。
要約
染色体分離されねばならない確実かつ均一に娘細胞に細胞分裂の間に。染色体分離の再現性は、紡錘アセンブリ チェックポイント (SAC) を含む複数のメカニズムによって制御されます。SAC は、有糸分裂を通して細胞の進行の防止のため、すべての染色体がスピンドル微小管に接続している場合を除き、複雑なフィード バック システムの一部です。染色体のラギングおよび異常な染色体分離機能不全の細胞周期制御チェックポイントの指標し、細胞分裂のゲノムの安定性を測定する使用ことができます。SAC の規制緩和は、染色体の分離中にエラーの蓄積により悪性細胞に正常な細胞の変形で起因できます。SAC の実装と複雑な動原体の形成は、キナーゼとホスファターゼ プロテインホスファターゼ 2 a などの相互作用で厳しく規制 (PP2A)。このプロトコルでは、遅れていた PP2A B56γ 調節サブユニットのノックアウト マウスから分離されたマウス萌芽期繊維芽細胞における染色体の生きているセルイメージ投射について説明します。このメソッドは、その他細胞周期制御イメージング技術フローサイトメトリーなど免疫細胞化学染色体の動的な時空間の可視化ではなく、細胞分裂の状態のスナップショットを提供するだけの欠点を克服します。有糸分裂の間。
概要
次のプロトコルでは染色体の分離とヒストン 2B GFP、BacMam 2.0 のラベリングおよび生きているセルイメージ投射使用してマウス萌芽期繊維芽細胞の細胞周期の間に細胞分裂の進行を可視化する便利な方法をについて説明します。
細胞周期制御チェックポイントは、染色体分配を監視し、セル1,2,3の遺伝的整合性の維持に重要な役割を果たします。誤隔離された染色体の蓄積異数性、ほとんどの固体腫瘍4の認刻極印である可能性があります。したがって、染色体不安定性を勉強する方法として染色体の遅れの検出を使用できます。
蛍光標識タンパク質ライブ染色体分配を視覚化するために使用される、mCherry タグの生成が遅れている染色体または H2B GFP タグ付きタンパク質遺伝子配達および分子生物学5相当な知識が必要です。ここで簡潔にするため、CL HB リージェントを呼びます CellLight Histone2B GFP BacMam 2.0 試薬の使用について述べる。この試薬は、すぐに使用することができます、従ってベクトル品質と完全性の心配がありません。さらに、この試薬では、潜在的に有害な治療または脂質や色素負荷化学物質の使用は必要ありません。従来の蛍光ラベルとは異なり CL HB リージェント汚れとは無関係 (すなわち。、膜電位)。CL HB 摂政を単にセルに追加し、タンパク質発現の夜通し孵化することができます。CL HB リージェントは、哺乳動物細胞ではレプリケートされません、バイオ セーフティ レベル (BSL) 研究所 1 の設定で使用できます。また、最もダイナミックな細胞分析を遂行する 5 日前まで、十分な時間のため一晩インキュベートした後このトランスフェクションを検出できます。
また、染色体の異常は、フローサイトメトリー、免疫組織化学または蛍光性の現場の交配 (魚) の6のなど様々 な技術によって調査できます。フローサイトメトリーは、異数性、測定することができる DNA 含量と細胞周期の細胞の位相に基づく研究に使用できます。フローサイトメトリーは、異数性を測定する使用できますが、染色体の誤った分離に関する情報は記載していません。魚および免疫組織化学の手法は、DNA や染色体に結合する蛍光プローブを使用します。これらの技術は細胞の人口の状態のスナップショットを提供する、彼らは生細胞イメージングにより行方不明の期間続く特定の細胞分裂の時空間的可視化を通じて取得する情報を許可しません。
このプロトコルは、遅れて染色体やノコダゾール扱われるマウス萌芽期繊維芽細胞 (MEFs) で PP2A-B56γ-マウスから分離した誤偏析染色体研究に使用されました。上記のアプリケーションのほかは、このプロトコルは、ラベルおよび細胞周期制御を研究するために使用できる様々 な細胞タイプにおける染色体分離または腫瘍細胞の染色体不安定性を視覚化するシンプルなツールを提供します。さらに、それも使用できますさまざまな薬物治療によって引き起こされる染色体不安定性の研究、遺伝子が染色体の誤った分離の結果ノックアウトの効果を研究します。
プロトコル
食品医薬品局 (FDA) の研究施設で機関動物ケアおよび使用委員会によって承認されたプロトコルに従い、これらの研究実験を行った。
1. 分離と培養マウス胚性線維芽細胞 (MEFs)
- 標準プロトコル7,8,9PP2A B56γ マウス系統と野生型の同腹仔からマウス萌芽期繊維芽細胞 (MEFs) を分離します。
- 3 通路の ExpandMEFs は凍結し、実験8必要になるまでを格納します。
2. 培養 Mefs 2 ウェル カバーグラスチェンバー用のライブ イメージング
- 500 ml ダルベッコ変更イーグル培地 (DMEM/f12 キー) を 10% 含む MEF 成長媒体の胎仔ウシ血清 (FBS)、1 X ペニシリン/ストレプトマイシン抗生物質、L-グルタミン (200 mM)、非本質的なアミノ酸 (NEAA) メディア 500 mL ボトル × 1。
- 37 ° C で予め温めておいた水風呂通路 3 野生型から冷凍 MEFs、PP2A-B56γ-マウスのバイアルを解凍します。
- 15 mL チューブに解凍 MEFs を転送し、ゆっくりと 10 mL のピペットを使用して 15 mL チューブに DMEM/F12 メディアの 20 mL の滴を追加します。
- T75 フラスコに DMEM/F12 成長媒体の 20 mL と共に MEFs を転送し、細胞が 70% 合流までそれらを展開します。密度は 4 倍または 10 倍の倍率で逆の顕微鏡を使用して推定されます。
- 吸引ガラスの牧草地を使用して培ピペットのボンネットの真空システムに接続された 0.25% トリプシン/EDTA の 3 mL を加える、DMEM/F12 成長媒体の反作用を停止する 5 分追加 3 mL 37 ° C で孵化させなさい。
- 室温で 5 分間 (300 x g) を低速度で細胞を遠心します。慎重に上澄みを除去し、再 37 の ° C の水浴中で加温 DMEM/F12 成長培地 1 mL の細胞ペレットを中断します。
- トリパン ブルー排除法またはその他の適切なセルを数える方法8を使用して細胞を列挙します。
- MEFs/ウェル 2 ウェル カバーグラスチェンバーの種子約 20,000。200 μ L/ウェル/F12 DMEM 培を追加し、37 ° C、5% CO2でそれらを一晩インキュベートして接続するセルを許可します。
3. 同期
- G0/G1 期で 0.1 %dmem/F12 成長培地で細胞を培養して MEFs を同期 G0/G1 期のセルの最大数を取得する、24 時間 FBS。
注: 血清飢餓は、好みの方法として使用された、さまざまな方法を逮捕10に必要な細胞の分裂の段階に応じて使用できます。
4. ラベリング
- 1.5 mg/mL の DMSO でノコダゾールの原液を準備します。ノコダゾールは G2/m 期で10微小管形成を阻害することによって細胞を逮捕します。
- 3 日後に同期、200 μ L (10 %fcs) と成長媒体の 200 ng/mL ノコダゾール CL HB リージェント (ヒストン 2B GFP BacMam 2.0) を追加します。
- CL HB リージェント粒子ごとのセル (PPC) のセルに次のように追加するを計算します。
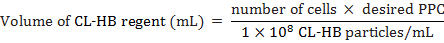
セルの数がラベルの時にセルの推定合計数は、PPC はセルごとの粒子の数と 1 × 10 の8は、試薬の mL あたり粒子の数。たとえば、30 の ppc ラベル 20,000 セルに
メモ: CL HB リージェント 10 および 50 の PPC の間ほとんどの細胞の種類とうまく動作します。しかし、この研究の最高 30 PPC の仕事。 - MEFs を 37 ° C、5% CO2で 18 h にインキュベートします。
注: 現在の実験用スピンドル集合チェックポイントをエスケープ分裂期の細胞の染色体の可視化後に発生した 18 h ノコダゾールと細胞周期の停止。
5. 染色体の遅れの可視化
- マウス萌芽期の繊維芽細胞 (MEFs) 環境チャンバーと油浸漬、63 x 対物レンズ装備回転ディスク共焦点顕微鏡システムを使用して可視化します。
- GFP チャネル イメージ獲得のため、励起波長 488 nm の発光波長 450 nm を使用します。
- モーターを備えられたスキャン段階の機能を持つ回転するディスク共焦点顕微鏡システムを使用、Z ピエゾ ステージ トップ インキュベーションと写真がこの手法の漂白後の直接蛍光回復を挿入します。
- 1 日前にイメージング、環境室の電源を on し、一晩 37 ° C で全体の部屋を暖めます。
- 顕微鏡スタンド、カメラ、回転ディスク装置、照明装置、アルゴン レーザー、コンピューター、電動ステージの電源をオンにします。
- システムのウォーム アップに、3 分。イグニッションキーをオンにするには、アルゴン レーザーを起動します。「実行レーザー」を「スタンバイ」からアルゴン レーザー用トグル スイッチを切り替えます。
- データの取得と処理のソフトウェアを起動します。
- ステージ トップ インキュベーターの CO2のコント ローラーを開始し、CO2の濃度を 5% に設定します。これは、イメージングの開始前に行う必要があります。
- 可視化のための段階にインキュベーターと場所から、カバーグラスチェンバーを削除します。油浸漬 63 x 対物レンズ (NA1.4) 細胞を可視化します。
- 眼のレンズを通して表示、イメージを集中させおよび核膜崩壊 (NEBD) 段階でセルを識別します。
- 適切なレーザー (488 nm アルゴン レーザー Histone2B GFP を可視化する) を開始します。
- 取得コントロール ウィンドウを開き、GFP チャネル用の露光時間を設定します。NEBD のセルを識別します。
- 手動でターゲット セルの上部と下部の焦点面を決定し、xyz を光学的に切断の設定を入力します。
- 20 分間の観察します。細胞が細胞分裂を通じて進まない場合 20 分後の画像集録を停止し、NEBD は、次のセルに移動します。
- セルあたり約 1 h 画像遅れて染色体嚢から脱出した PP2A B56γ 細胞における有糸分裂時必要です。映画のデータを取得するには、3 分毎写真を撮る。
注: 野生型細胞を逮捕、NEBD ノコダゾールと扱われたとき過去進歩していません。 - さらに分析の zvi ファイル形式で画像を保存します。
6. 画像処理と解析
注: は、三次元画像処理と Axiovision バージョン 4.8.2 や Imaris バージョン 8.2 など任意の利用可能なソフトウェアを使用して解析を実行します。今回、ImageJ のソフトウェアを使用しました。
- イメージ シーケンスを開きます。画像が既にスタック形式の場合は、次の手順に進みます。そうでない場合は使用してスタックにすべての関連する画像を組み合わせる 'イメージ > スタック > スタックに画像' メニュー バー。
- 明るさ/コントラスト、レベルに必要な調整を実行します。
- 映画にタイムスタンプを追加: する
- ' イメージ > スタック > ラベル...' メニュー バー。
- 適切な形式では、開始時刻の値、各画像間の時間間隔を選択します。
- 「プレビュー」にチェック、の場所と形式設定を調整します。タイム ・ スタンプを適用する [OK] を押します。
- 映画に縮尺記号を追加: する
- 画像のスケーリングを設定 '分析 > スケールを設定' メニュー バー。
- 「距離 (ピクセル単位)」フィールド距離が既知の場合、ピクセル数を入力してください、'知られている距離' フィールドに距離を入力。スタックにスケールを適用する ' OK' を押して μ m で正しいの距離、例えば長さの単位を設定します。
- '分析 > ツール > スケール バー]' スケール バーを追加します。'Μ m 幅' で、バーのサイズを設定し、残りの適切なオプションを書式設定を調整します。スタック全体に縮尺記号を追加する 'すべてのスライスのラベル' チェック ボックスを選択します。
- イメージ ウィンドウの端を画面左下の三角の再生ボタンをクリックして、ムービーをプレビューします。フレーム レートを使用して調整 ' イメージ > スタック > アニメーション > アニメーション オプションのメニュー バーにします。
- ムービー ファイルを選択してエクスポート ' ファイル > 名前を付けて保存 > AVI. '、フレーム レートと圧縮を選択。
- 保存先を選択するには、[OK] をクリックしての場所とファイル名。動画ファイルを保存する [保存] を押します。
結果
野生型と PP2A-B56γ-マウスから MEFs 2 よくチャンバー カバー ガラスのシードし、の接続を許可しました。2 日目、MEFs は 0.1% を使用して同期された FBS の 24 h。200 ng/mL メディアで MEFs 第 3 日ノコダゾールと 30 PPC CL HB regentwere は 37 で 18 時間培養° C、5 %co2。4 日目、回転するディスク共焦点顕微鏡システム (図 1) を使用してセルをイ?...
ディスカッション
正確な染色体分離を確保する細胞周期制御チェックポイントは、異数性とセル変換1,2,3を防ぐため。本研究でわかったその不活性化 PP2A B56γ 弱体化した紡錘アセンブリ チェックポイントで起因しました。ライブセル イメージング ノコダゾール9奏効した PP2A B56γ MEFs における有糸分裂時誤偏析染色体を観?...
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
博士郭 Chiuan hung さんと博士 Bharatkumar 女子の原稿を改善した貴重なコメントをありがとうしたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
参考文献
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved