A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תא חי הדמיה של הפרדה בין כרומוזום במהלך מיטוזה
In This Article
Summary
פרוטוקול זה מתאר שיטה קלה ונוחה כדי לתייג והמחש בשידור חי הכרומוזומים בתאים mitotic באמצעות תווית 2.0 BacMam Histone2B-GFP ומערכת מיקרוסקופיה קונפוקלית דיסק מסתובב.
Abstract
כרומוזומים חייב להיות אמין, בצורה אחידה הפרדה לתאי הבת במהלך חלוקת התא mitotic. נאמנות של סגרגציה כרומוזומלית נשלטת על ידי מנגנונים מרובים הכוללים את מחסום הרכבה פלך (שק). הקרום הוא חלק מערכת משוב מורכבים כי הוא אחראי למניעת התקדמות התא באמצעות מיטוזה אלא אם כל kinetochores כרומוזומלית יש מחובר ציר microtubules. לקרטע כרומוזומלית, כרומוזום נורמלית סגרגציה הוא מחוון של מחזור התא לקוי שליטה מחסומים והוא יכול לשמש כדי למדוד את יציבות גנומית של חלוקת תאים. הסרת הפיקוח של הקרום יכול לגרום הטרנספורמציה של תאים נורמליים לתא ממאיר דרך ההצטברות של שגיאות במהלך ההפרדה כרומוזומלית. יישום של השק ואת היווצרות קינטוכור מורכבים מוסדרים בחוזקה על ידי אינטראקציות בין kinases פוספטאז כגון 2A חלבון פוספטאז (PP2A). פרוטוקול זה מתאר תא חי הדמיה של משתרך כרומוזומים בתוך העכבר מתחלקים fibroblasts מבודד מן העכברים היה נוקאאוט של יחידת משנה התקינה PP2A-B56γ. שיטה זו גוברת על החסרונות של מחזור התא שליטה הדימות האחרות כגון cytometry זרימה או immunocytochemistry רק לספק תמונת מצב ציטוקינזה תא, במקום פריט חזותי ייתכן דינמי של כרומוזומים במהלך מיטוזה.
Introduction
בפרוטוקול הבא, אנו מתארים שיטה נוחה להמחיש סגרגציה כרומוזומלית והתקדמות mitotic במהלך מחזור התא בהעכבר מתחלקים fibroblasts באמצעות היסטון 2B-GFP, BacMam 2.0 תיוג והדמיה תא חי.
מחזור התא שליטה מחסומים לפקח על כרומוזום סגרגציה, יש תפקיד חשוב בשמירה על שלמות גנטי של התא 1,2,3. הצטברות של כרומוזומים אי הפרדה יכול להוביל aneuploidy, אשר מהווה סימן היכר של גידולים מוצקים ביותר 4. לפיכך, זיהוי מפגרות כרומוזומים יכול לשמש כשיטה ללמוד יציבות כרומוזומלית.
Fluorescently שכותרתו חלבונים יכולים להיות בשימוש לדמיין חיים כרומוזום סגרגציה, כרומוזומלית מפגרות אבל הדור של מתויג mCherry או חלבון ויזת עבודה H2B-GFP מתויג דורש ידע משמעותי של ג'ין משלוח וביולוגיה מולקולרית 5. כאן נתאר את השימוש ריאגנט CellLight Histone2B-GFP BacMam 2.0, להלן בשם ריג'נט CL-HB, למען הפשטות. ריאגנט הזה יכול לשמש מיד ומסלקת ובכך חששות לגבי וקטורית באיכות ויושרה. בנוסף, ריאגנט הזה אינו דורש את השימוש טיפולים מזיקים או שומנים וכימיקלים העמסה לצבוע. שלא כמו תוויות פלורסנט קונבנציונלי, ההנהלה CL-HB כתמים ללא תלות פונקציה (כלומר., קרומית אפשרית). ההנהלה CL-HB יכול להיות פשוט להוסיף את התאים, מודגרות ללילה עבור ביטוי חלבון. ההנהלה CL-HB לא לשכפל תאים בתרבית של, ניתן להשתמש בהגדרות מעבדה 1 (BSL) אבטחה ברמה. בנוסף, ניתן להבחין תקנים ארעי זה לאחר לילה דגירה עד 5 ימים, מספיק זמן כדי לבצע ניתוחים הסלולר הדינמיים ביותר.
לחלופין, העיוותים כרומוזומלית יכול להילמד על ידי טכניקות שונות כגון cytometry זרימה, אימונוהיסטוכימיה או קרינה פלואורסצנטית באתרו הכלאה (דגים) 6. Cytometry זרימה ניתן ללמוד aneuploidy, אשר ניתן למדוד בהתבסס על תוכן ה-DNA, השלב של תאים במחזור התא. למרות cytometry זרימה יכול לשמש כדי למדוד aneuploidy, אינה מספקת מידע על סגרגציה שגויה כרומוזומלית. דגים וטכניקות אימונוהיסטוכימיה להשתמש הגששים פלורסנט כדי לאגד דנ א או כרומוזומים. ואילו טכניקות אלה מספקים תמונת המצב של אוכלוסיה של התאים, הם אינם מאפשרים תא חי הדמיה ובכך חסר מידע שהושג דרך ייתכן החזיית ציטוקינזה תאים מסוימים אחריו על פני תקופה של זמן.
פרוטוקול זה שימש ללמוד לקרטע כרומוזומים או סגרגציה שגויה כרומוזומלית ב nocodazole התייחסו העכבר מתחלקים fibroblasts (MEFs) מבודד PP2A-B56γ-עכברים. בתוספת מעל היישום, פרוטוקול זה מספק כלי פשוט כדי לתייג והמחש כרומוזומלית הפרדה בין סוגי תאים שונים אשר יכול לשמש כדי ללמוד מחזור התא תקנה או בחוסר יציבות כרומוזומלית תאים סרטניים. בנוסף, זה יכול לשמש גם ללמוד יציבות כרומוזומלית נגרמת על ידי טיפולים תרופות שונות, או לחקור את ההשפעות של ג'ין מדהימה וכתוצאה מכך כרומוזומלית סגרגציה שגויה.
Protocol
כל הניסויים שנערכו במחקרים אלה בוצעו על פי פרוטוקולים אושרה על ידי טיפול בעלי חיים מוסדיים ועדת שימוש במתקן המחקר והתרופות האמריקני (FDA) ואוכל.
1. בידוד והתרבות של העכבר מתחלקים Fibroblasts (MEFs)
- לבודד את העכבר מתחלקים fibroblasts (MEFs) זן PP2A-B56γ-עכבר, הארנבונים מאותה פראי סוג ב פרוטוקול סטנדרטי 7,8,9.
- ExpandMEFs עבור 3 קטעים, להקפיא ולאחסן עד לצורך ניסויים 8.
2. culturing Mefs 2-ובכן תאיים כיסוי זכוכית עבור Live הדמיה
- הכנת 500 מ"ל של המדיה צמיחה MEF המכילה בינוני נשר שונה של Dulbecco (DMEM/F12) עם 10% סרום שור עוברית (FBS), 1 X פניצילין/סטרפטומיצין אנטיביוטיקה, -גלוטמין (200 מ מ) ו- 1 X חומצות אמינו שאינן הכרחיות (NEAA) בבקבוק 500-mL מדיה.
- הפשרת צלוחיות של MEFs קפוא מסוג הפרוע, PP2A-B56γ-עכברים-מעבר 3 באמבט מים מראש ומחוממת ב 37 º C.
- להעביר MEFs המופשרים 15-mL צינורות ולהוסיף לאט לאט dropwise 20 מ"ל של מדיה DMEM/F12 הצינורות 15-mL באמצעות פיפטה של 10-mL.
- העברת MEFs יחד עם 20 מ של התקשורת צמיחה DMEM/F12 T75 מבחנות ולהרחיב אותם עד התאים הם 70% confluent. Confluency מוערך באמצעות מיקרוסקופ הופכי ב 4 x או 10 x הגדלה.
- וביופסיה מדיום הגידול באמצעות מרעה זכוכית פיפטה המחובר למערכת ואקום בשכונה, להוסיף 3 מ"ל של 0.25% טריפסין/EDTA, דגירה ב 37 מעלות צלזיוס במשך 5 דק להוסיף 3 מ"ל של מדיום הגידול DMEM/F12 כדי לעצור את התגובה.
- Centrifuge התאים במהירות נמוכה-(x 300 גר') עבור 5 דקות בטמפרטורת החדר. בזהירות להסיר את תגובת שיקוע והשהה מחדש בגדר תא ב 1 מ"ל של מדיום הגידול DMEM/F12 להתחמם מראש ב 37 מעלות צלזיוס בתוך אמבט מים.
- ספירת תאים באמצעות שיטת מניעה כחול trypan או אחרים תאים מתאים ספירת השיטה 8.
- זרע כ 20,000 MEFs/טוב בכוס 2-ובכן chambered כיסוי. להוסיף 200 µL/טוב DMEM/F12 מדיום הגידול ולאפשר לתאים לצרף על-ידי המקננת אותם בן לילה-CO 37 ° C ו- 5%2.
3. סינכרון
- סינכרון MEFs בשלב G0/G1 מאת המקננת בתאים DMEM/F12 צמיחה המדיה המכילה 0.1% FBS במשך 24 שעות ביממה, כדי לקבל מספר מרבי של תאים בשלב G0/G1.
הערה: למרות הרעב סרום שימשה כשיטה של העדפה, שיטות שונות ניתן בהתאם mitotic השלב שבו תאים יש צורך להיות נעצר 10.
4. תיוג
- להכין מלאי תמיסת nocodazole ב דימתיל סולפוקסיד 1.5 mg/mL. Nocodazole מעצרים תאים בשלב G2/M על ידי עיכוב היווצרות microtubule 10.
- שלושה ימים פוסט סינכרון, להוסיף 200 200 ng/mL nocodazole µL של מדיום הגידול (עם 10% FCS), ו- CL-HB ריג'נט (BacMam 2B-GFP-היסטון 2.0).
- לחשב ההנהלה CL-HB חלקיקים לכל תא (PPC) להוסיף תאים כדלקמן:
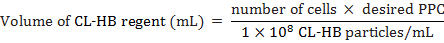
איפה מספר התאים המספר הכולל המשוער של תאים בזמנו של תיוג, PPC הוא מספר החלקיקים לכל תא, 1 × 10-8 מספר החלקיקים לכל מיליליטר הכימית. לדוגמה, כדי תווית 20,000 תאים עם PPC של 30
הערה: CL-HB ריג'נט עובד טוב עם רוב סוגי תאים בין 10 ל-50 PPC. עם זאת, 30 PPC עבד בצורה הטובה ביותר במחקר זה. - תקופת דגירה MEFs של 18 h-CO 37 ° C ו-5%2.
הערה: עבור הניסוי הנוכחי, ויזואליזציה של הכרומוזומים בתאים mitotic בריחה במחסום הרכבה פלך אירעה 18 h לאחר מחזור התא מעצר עם nocodazole.
5. ויזואליזציה של משתרך כרומוזומים
- דמיינו העכבר מתחלקים fibroblasts (MEFs) באמצעות מערכת דיסק מסתובב מיקרוסקופ קונפוקלי מצוידים עם חדר סביבתיים הטבילה שמן, 63 x עדשה אובייקטיבי.
- השתמש עירור גל של 488 ננומטר, פליטה גל 450 nm עבור ייבוא תמונות של ערוץ ה-GFP.
- להשתמש במערכת מיקרוסקופ קונפוקלי דיסק מסתובב עם היכולת של שלבי סריקה ממונע, Z-Piezo מוסיף, העליונה שלב הדגירה ושחזור פלורסצנטיות ישיר לאחר צילום הלבנה על טכניקה זו.
- יום אחד לפני הדמיה, להפוך על כוח סביבתי קאמרית, לחמם את החדר כולו ב 37 מעלות צלזיוס למשך הלילה.
- להפעיל כוח על דוכן מיקרוסקופ, מצלמה, ספינינג דיסק יחידה, המאייר, ללייזר, המחשב ו הבמה ממונע.
- . תן למערכת לחמם 3 דקות; התחל את לייזר ארגון על-ידי הפעלת מפתח ההצתה. מתג הבורר דו-מצביים ללייזר ממצב "המתנה" "לייזר לרוץ".
- השקת התוכנה רכישת ועיבוד נתונים.
- ליזום הבקר2 CO עבור החממה העליון שלב ולהגדיר את ריכוז CO2 ב-5%. זה חייב להתבצע לפני תחילת הדמיה.
- הסר הזכוכית המכסה chambered החממה ואת המקום על הבמה עבור פריט חזותי. דמיינו תאים באמצעות עדשת המטרה 63 x טבילה (NA1.4) שמן.
- הצג מבעד לעדשות עינית, למקד את התמונה ולזהות תא בשלב מעטפת הגרעין התמוטטות (NEBD).
- ליזום המתאים לייזר (488 ננומטר לייזר ארגון לדמיין Histone2B-GFP).
- לפתוח חלון שליטה רכישה ולהגדיר זמן החשיפה לערוץ ה-GFP. לזהות תא הנמצא NEBD.
- באופן ידני לקבוע העליון תא היעד ואת התחתון במישור המוקד והזן את xyz אופטי חלוקתה הגדרות.
- במשך 20 דקות; אם התא לא ממשיך דרך חלוקת התא, להפסיק ייבוא תמונות לאחר 20 דקות ולהמשיך הלאה לתא הבא שנמצא NEBD.
- כ 1 h בכל תא יש צורך התמונה לקרטע הכרומוזומים במהלך מיטוזה בתאים PP2A-B56γ-ברח מן השק. כדי לקבל נתונים עבור סרט, לצלם תמונות כל 3 דקות.
הערה: פראי סוג התאים לעצור, לא התקדמות העבר NEBD כאשר מטופלים עם nocodazole. - שמירת תמונות בתבנית קובץ צבי לצורך ניתוח נוסף.
6. תמונה עיבוד וניתוח
הערה: לבצע עיבוד תמונה תלת-ממדית וניתוח באמצעות תוכנה זמינים כגון Axiovision גירסה 4.8.2 או Imaris גירסה 8.2. במחקר זה, ImageJ התוכנה היה בשימוש.
- פתח את רצף תמונות. אם התמונות הן כבר בתבנית מחסנית, המשך לשלב הבא. אם לא, לשלב כל תמונות רלוונטיות באמצעות מחסנית ' תמונה > ערימות > תמונות למחסנית ' בשורת התפריטים.
- לבצע כיוונונים כנדרש בהירות/חדות, רמות.
- כדי להוסיף חותמת זמן הסרט:
- עבור אל ' תמונה > ערימות > תווית. ' בשורת התפריטים.
- בחר תבנית המתאימה את הערך ההתחלתי של הזמן, מרווח הזמן בין כל תמונה.
- סמן את התיבה 'תצוגה מקדימה' והתאם הגדרות מיקום ותבנית. לחץ על 'אישור' כדי להחיל חותמת הזמן.
- כדי להוסיף פס סולם לסרט:
- להגדיר את התמונה דרוג תחת ' נתח > קבע קנה מידה ' בשורת התפריטים.
- בשדה 'מרחק בפיקסלים', הזן מספר הפיקסלים שבו המרחק ידוע ולאחר בשדה 'מרחק ידוע' הזן את המרחק. הגדר את יחידת הנכון של אורך על המרחק, למשלמיקרומטר לחץ על 'אישור' כדי להחיל את קנה המידה על הערימה.
- עבור אל ' נתח > כלים > סולם והבעת ' כדי להוסיף סרגל קנה מידה. להגדיר את הגודל של הבר כמו 'רוחב מיקרומטר', והתאם את הנותרים אפשרויות בהתאם לצורך עיצוב. סמן את התיבה 'תווית כל הפרוסות' כדי להוסיף את סרגל קנה מידה הערימה כולה.
- תצוגה מקדימה של הסרט על ידי לחיצה על כפתור play משולשים בתחתית לקצה של חלון תמונת הימני. להתאים את קצב המסגרת באמצעות ' תמונה > ערימות > אנימציה > אפשרויות הנפשה בשורת התפריטים.
- ייצוא קובץ הסרט על-ידי בחירת ' קובץ > שמירה בשם > אבי. ' ובחר את קצב המסגרות ואת הדחיסה.
- לחץ על 'אישור' כדי לבחור השמירה שם קובץ ומיקום. לחץ על 'שמור' כדי לשמור את קובץ הסרט.
תוצאות
MEFs פראי סוג ו PP2A-B56γ-עכברים נזרע בכוס כיסוי תא 2-ובכן, מותר לצרף. יום 2, MEFs סונכרנו באמצעות 0.1% FBS במשך 24 שעות ביממה. יום 3, MEFs בתקשורת עם 200 ng/mL nocodazole ו 30 regentwere PPC CL-HB מודגרות עבור 18 h ב- 37° C ו- 5% CO2. יום 4, התאים היו עם תמונה באמצעות מערכת מיקרוסקופ קונפוקלי דיסק מסתובב (
Discussion
מחזור התא שליטה מחסומים להבטיח הפרדה בין כרומוזום מדויק למנוע אנאפלואידיה ותא טרנספורמציה 1,2,3. במחקר הנוכחי, מצאנו את איון של PP2A-B56γ, גרמו מחסום הרכבה פלך נחלש. הדמיה חיה תא אפשר לנו להתבונן כרומוזומלית סגרגציה שגויה במהלך מיטוזה ב PP2A-B56γ ME...
Disclosures
המחברים מצהירים כי יש להם אינטרסים כלכליים אין מתחרים.
Acknowledgements
ברצוננו להודות Hung גואו-Chiuan ד ר ד ר Bharatkumar ג'ושי להערות יקר זה לשפר את כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
References
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved