A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أسلوب قياس ألوان لقياس محتوى الحديد في النباتات
In This Article
Summary
نقدم بروتوكول بسيط ويمكن الاعتماد عليها لقياس محتوى الحديد في الأنسجة النباتية باستخدام الأسلوب الأزرق البروسية اللونية.
Abstract
الحديد، واحدة من أهم المغذيات الدقيقة في الكائنات الحية، وتشارك في العمليات الأساسية، مثل التنفس والتمثيل الضوئي. محتوى الحديد منخفضة بدلاً من ذلك في جميع الكائنات الحية، تصل في النباتات إلى حوالي 0.009% وزن الجاف. وحتى الآن، هو أحد الأساليب الأكثر دقة لقياس تركيز الحديد في الأنسجة النباتية لهب الامتصاص الذري الطيفي. بيد أن هذا النهج هو مضيعة للوقت ومكلفة وتتطلب معدات معينة لا توجد عادة في مختبرات مصنع. ولذلك، هناك حاجة إلى أسلوب أبسط، ولكن الدقيقة التي يمكن أن تستخدم بشكل روتيني. بشكل منتظم يستخدم الأسلوب الأزرق البروسية اللونية لنوعية الحديد تلطيخ في أقسام الأنسجة الحيوانية والنباتية. في هذه الدراسة، علينا تكييف الأزرق البروسية يترك طريقة لقياس كمية الحديد في التبغ. علينا التحقق من دقة هذا الأسلوب باستخدام التحليل الطيفي الذري والأزرق البروسي تلطيخ لقياس محتوى الحديد في نفس العينات ووجدت انحدار خطي (ص2 = 0.988) بين الإجراءين. ونحن نستنتج أن الأسلوب الأزرق البروسية لقياس كمية الحديد في الأنسجة النباتية دقيقة وبسيطة وغير مكلفة. ومع ذلك، قد لا يكون الانحدار الخطي المعروض هنا الملائمة للأنواع النباتية الأخرى، بسبب التفاعلات المحتملة بين العينة والكاشف. وهكذا يلزم إنشاء منحنى الانحدار للأنواع النباتية المختلفة.
Introduction
الحديد (Fe) هو المغذيات هامة في جميع الكائنات الحية. في النباتات، هو المغذيات الدقيقة أساسية1 بسبب تورطها في العمليات الأساسية، مثل التنفس والتمثيل الضوئي والكلوروفيل الحيوي. ارتفاع تراكم أيونات الحديد مجاناً مضر لزرع الخلايا بسبب ردود الفعل التي أدت إلى الإفراج عن الجذور الحرة التي تسبب الأكسدة. للحفاظ على التوازن الحديد داخل الخلية النباتية، المخزنة في vacuoles الأيونات والمحتبس داخل فيريتينس والبروتين أقفاص المعنيين مباشرة بالحديد التوازن2 وبنية التخزين الرئيسي للحديد في جميع الكائنات الحية. في الوقت نفسه، يؤثر فقر الدم بعوز الحديد على نسبة كبيرة من السكان، أدى إلى تزايد حاجة إلى مصنع الحديد بيوفورتيفيكيشن. نظراً للخصائص الفريدة لمصنع فيريتين، يقدم إثراء الأغذية بالحديد فيريتين استراتيجية واعدة لمكافحة هذه المشكلة من سوء التغذية3.
أيونات الحديد أساسا وجدت في أكسدة دولتين، هما الحديدية (Fe ديفالينت2 + أو الحديد (II)) والحديديك (Fe تمكنت3 + أو الحديد (III)) أشكال. وتوجد عدة أشكال أخرى من الحديد، مثل كتل الحديد4، أيضا في الخلايا. يتم تخزين الحديد كأكسيد الحديد داخل الخلية ومن الطبيعي أشكال هيماتيتيس (Fe2س3) وفيريهيدريتيس ((Fe3 +)2س3•0.5 ح2س) تحت الظروف الفسيولوجية5. وقد هيدروكسيدات شكلت في ردود الفعل هذه، لا سيما النموذج الحديديك، الذوبان منخفضة جداً. الاحتفاظ بالحديد وبالتالي تتأثر درجة حموضة الحل، وهو إلى حد كبير في حالة صلبة الأس الهيدروجيني 56أعلاه.
نظراً لضعف القابلية للذوبان وتفاعلية عالية من الحديد، يجب أن يكون نقلها بين الأنسجة النباتية والأجهزة المرتبطة بها مع جزيئات شيلاتينغ مناسبة. وعلاوة على ذلك، يجب أن تسيطر الدول الأكسدة بين الأشكال الحديدية والحديديك1 . ضمن أوراق، وجدت في خلايا التمثيل الضوئي، نظراً لدورها الأساسي في نظام نقل الإلكترون، في التركيب الحيوي سيتوتشروميس، والكلوروفيل وغيرها جزيئات الهيم، حوالي 80% الحديد وفي تشكيل الحديد-S7مجموعات. وفي حالة الحديد الزائد داخل الخلية، الفائض هو ذوبانها في المنقبضة حيث يتم تخزين المعدن في جزيئات فيريتين8.
ويمكن قياس الحديد في الأنسجة النباتية من عدة طرق، بما في ذلك لهب الامتصاص الذري الطيفي9 (FAAS) أو فحوصات قياس الألوان10، السابقة ويجري الآن أكثر دقة من هذا الأخير. FAAS هو تقنية دقيقة للغاية التي تمكن واحد لتحديد تكوين عنصري من عينة على أساس الانبعاثات الكهرومغناطيسية للعناصر الفردية. تحويل FAAS الأيونات المعدنية إلى الدول الذري باللهب-تدفئة العينة، مما يؤدي إلى الإثارة أيون وانبعاث موجه محددة عندما يعود أيون معين إلى حالة الأرض. الانبعاثات من الأيونات مختلفة مفصولة مونوتشروماتور والكشف عنها بواسطة استشعار امتصاص11. وهكذا يقدم FAAS لقياس تركيزات الحديد مباشرة. ومع ذلك، من تتوفر تقنيات أخرى لتصور الحديد في الأنسجة البيولوجية. مطيافية الكتلة البلازما إلى جانب الحث (برنامج المقارنات الدولية-MS)12 تقنية دقيقة جداً لقياس الحديد وغيرها من العناصر النزرة ولكن بسبب نقص المعدات، سواء بالنسبة FAAS، وبرنامج المقارنات الدولية--مرض التصلب العصبي المتعدد، مشكلة مشتركة. من ناحية أخرى، قياس الحديد ب قياس الألوان ثيوسيانات13 يفتقر إلى الدقة وفشل للكشف عن الاختلافات الصغيرة بين العينات. الأزرق البروسي تلطيخ،14،،من151617 أسلوب غير مباشرة استناداً إلى رد فعل فيروسيانيد البوتاسيوم الحديديك (ك4Fe(CN)6) مع الكاتيونات Fe، إنتاج لون أزرق قوي، وهو يستخدم للكشف عن نوعية الحديد في أقسام النسيجي للأنسجة الحيوانية والنباتية.
الحديد المعدني (صفر-بالينت) أمر نادر الحدوث في القشرة الأرضية. شكل أيونى غير الرصاصية المهيمنة من الحديد في البيئة معظمها تمليه كمية الأوكسجين في المناطق المحيطة بها، مع الحديد الحديدية يجري نسبيا أكثر وفرة في البيئات وصول والحديديك الحديد غلبة في مواقع الهوائية. وهذا الشكل الأخير أيضا المهيمنة في البيئات الحمضية جداً، على الرغم من أن العوامل المسببة لأكسدة الحديد الحديدية غالباً ما تختلف في محيط الحمضية ووصول18. عندما يتم سولوبيليزيد الحديد في 4% HCl (pH 0) في بيئة هوائية، يوجد الجزء الأكبر من الحديد المخفف كما تشكل الحديديك (Fe3 +)19،20.
ردود الفعل بين أيونات الحديد وك4Fe(CN)6 على ما يلي:
Fe3 +: فيكل3 +4ك Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 فيكل2 + 2 ك4Fe(CN)6 =4(Fe(CN)6) Fe2 + 8 بوكل
في هذه الدراسة، سألنا عما إذا كان تلطيخ الأزرق البروسي يمكن أن تكون مفيدة لقياس مستويات الحديد في الحل.
في البداية، يمكننا التحقق من العلاقة بين تركيز الحديد في محلول مائي وتلطيخ الأزرق البروسي. وتم قياس تركيز الحديد (فيكل2، فيكل3 أو 1:1 مزيج من الاثنين) في المحاليل كل من التحليل الطيفي الذري وامتصاص (OD) بعد إضافة الأزرق البروسية. ويبين الشكل 1 منحنيات الانحدار الخطي للقياسات التي تم الحصول عليها بكل طريقة. خلصنا إلى أنه يمكن استخدام الأسلوب الأزرق البروسي للتحليل الكمي لتركيز الحديد في الحل.
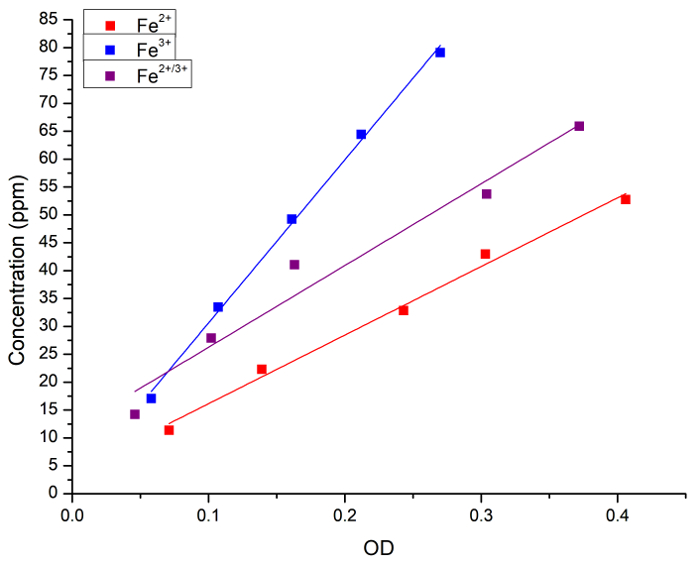
الشكل 1: قياس التراجع الخطي بين تركيز الحديد FAAS وامتصاص الضوء (OD، 715 nm) التي تم الحصول عليها بواسطة الأسلوب الأزرق البروسي. وتمثل المربعات الأزرق والخط Fe2 + الحل وتمثل المربعات الحمراء وخط الحديد3 + الحل والمربعات السوداء وخط تمثل خليط 1:1 بين Fe2 + و Fe3 +. تم الحصول على انحدارات التالية: [Fe2 +] = OD x 3 + 123، r = 0.996، ص2 = 0.989؛ [Fe3 +] = 1 + 292 OD x, r = 0.999، ص2 = 0.997؛ و [Fe2 + 3 +] = 11 + 146 OD x, r = 0.983، ص2 = 0.956. Fe2 + المانحين فيكل2 والحديد3 + المانحين فيكل3. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
التكيف مع أسلوب الأزرق البروسي اللونية لتحليل كمية الحديد في الأنسجة النباتية، محتوى الحديد من رماد نبات التبغ تم قياسه بواسطة لهب الامتصاص الذري الطيفي وتلطيخ الأزرق البروسي. وكان هناك علاقة جيدة بين النتائج من قبل اثنين من التقنيات.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-زراعة المواد وظروف النمو
- بذور التبغ واحدة (الصنف سامسون) البذور في وعاء 5 سم × 5 سم مليئة المتوسطة وعاء قياسي. وضع الأواني على الصواني. تنمو النباتات في غرفة نمو تحت ظروف يوم طويل (16/8 ح الضوء/الظلام) في درجة حرارة ثابتة 23 درجة مئوية. ري بماء الصنبور حتى تستنزف الماء من الوعاء.
- وبعد أيام 50±5، بدء العلاجات Fe في الري، وفقا لتركيزات مناسب للتجربة. على سبيل المثال، قمنا باستخدام طائفة من تركيزات الحديد من 0 إلى 6 مم، يكمله تشيلاتور Fe القابلة لذوبان (Fe ادها). ري النباتات مع الحل المناسب كل يومين (لتجنب الجفاف) لمدة 6-8 أيام.
2-إعداد الأوراق لقياس الحديد
ملاحظات: يجب أن تكون جميع المواد التي ستستخدم خالية من الحديد بغية الحد من خطر التلوث بالحديد. تنظيف الهاون والمدقة مرتين بحل HCl 4% وجاف مع ورق الترشيح في كل مرة قبل الاستخدام. إذا كان يتم إعادة استخدام أي مادة، تنظيفه بحل HCl 4% مرتين وجاف مع أوراق الترشيح.
- فصل الأوراق من الساق باليد، باستخدام قفازات (لا تستخدم أية معدات معدنية). استخدام حوالي 10 غم أوراق (الوزن الطازج) لكل عينة. قم بتنظيف كل ورقة مع الماء المقطر مزدوجة (دو) باستخدام زجاجة رذاذ. تعد هذه الخطوة مهمة لتجنب التلوث بالحديد.
- الجاف للأوراق على منشفة ورقية ووضعها في كيس من ورق. نقل أكياس الورق إلى فرن في درجة حرارة ثابتة 80 درجة مئوية لمدة 2-3 أيام.
- عندما تجف، سحق الأوراق إلى مسحوق باستخدام مدافع الهاون والمدقة ونقل إلى أنابيب بلاستيكية معقمة 15 مل.
3-حرق الأوراق للرماد
ملاحظات: هو يعني استخدام حل انخفاض الأس الهيدروجيني (بالقرب من 0) من HCl زيادة قابلية الذوبان في الحديد. ويستخدم الصوف الصخري للحيلولة دون هروب القنينة أثناء حرق الغازات.
- وزن قنينة مختومة وجديدة 20 مل التﻷلؤ دون غطاء لها. قم بتدوين القيمة أو تعيين القيمة إلى صفر باستخدام الزر الفارغ. إضافة الأوراق المجففة سحقت (عينة) إلى القنينة.
- وزن العينة والحاويات وقم بتدوين القيمة. أغلق القنينة مع الصوف الصخري.
- تزن 3 قنينات إضافية دون إضافة عينات وملاحظة القيم الخاصة بهم. سيتم استخدام هذه القنينات كعناصر لتقييم كمية الصوف الصخري يمكن أن تؤدي إلى أي زيادة في الوزن عينة.
- وضع قنينات العينات والتحكم في فرن وبدء النسخ باستخدام الخطوات التالية درجة الحرارة: درجة حرارة الغرفة، وزيادة سرعة 425 درجة مئوية، وأخيراً، 425 درجة مئوية لمدة 4 ساعات. قبل هذا الوقت، أوراق الشجر الجافة سوف تحولت إلى رماد.
- السماح لتبرد العينات وصولاً إلى حوالي 100 درجة مئوية ولكن لا أقل درجة الحرارة هذه للخطوتين التاليتين لتجنب الرطوبة، التي يمكن أن تؤثر على الوزن النهائي للعينة. استخدام قفازات ثقيلة، إزالة العينات من الفرن بملاقط، عقد القنينة اكستيريورلي.
- وضع في قنينة على سطح مستو وإزالة الصوف الصخري وإغلاق قنينة مع تلك الأغطية الأصلي.
- وزن قنينات التحكم 3 (انظر 3.3) وحساب زيادة الوزن المتوسط. إذا كان الوزن يساوي أو أعلى إلى 1% وزن الرماد (راجع الخطوة 4، 2)، باستخدام هذه القيمة كتقدير للخطأ القياس.
4-إعداد الرماد لقياس الحديد
ملاحظات: يتم حساب تركيز الحديد النهائية في العينة الأولى كوزن رماد مقسوماً على حجم HCl المضافة.
- إعداد حل HCl 1 م (4% HCl) عن طريق إضافة 12.5 مل حل الأسهم HCl 37 في المائة إلى 87.5 مل دو (في قارورة البلاستيك أو الزجاج).
- تزن 15 مل أنبوب بلاستيكي ولاحظ القيمة أو تعيين القيمة إلى صفر باستخدام الزر الفارغ. نقل الرماد للأنبوب، وزن، وقم بتدوين القيمة. هذا هو وزن الرماد.
- إضافة 5 مل من 1 M HCl إلى الرماد. تصفية الرماد من خلال عامل تصفية 22 ميكرومتر، وإضافة 5 مل إضافية من 1 M HCl من خلال عامل التصفية نفسه.
- يجب أن تكون وحدة التخزين النهائي 10 مل. لاحظ أنه سيتم فقدان جزء من الحل في عامل التصفية.
ملاحظة: النماذج جاهزة الآن لقياس الحديد FAAS أو بالأسلوب الأزرق البروسية. - اجعل منحنى معايرة مع تركيز الحديد قياس الطيف الذري والأسلوب الأزرق البروسي (انظر الشكل 4) لكل نوع من الأنواع النباتية. وفي وقت لاحق، يمكن قياس تركيز الحديد بطريقة الأزرق البروسي وحدها.
5-قياس تركيز الحديد ب FAAS
- إزالة 4 مل من كل عينة للقياس حسب FAAS.
- تقسيم النتائج التي تم الحصول عليها من قياس FAAS بوزن الرماد. تقسيم القيمة الناتجة من 0.01 (لأنه كان سولوبيليزيد الرماد في 10 مل). القيمة الناتجة هي تركيز الحديد كل غرام الرماد (ppm).
6-إعداد الأزرق البروسية تلطيخ الحل
- تعد نسبة 4% الأزرق البروسي الحل عن طريق إضافة ز 4 ك4Fe(CN)6 إلى 100 مل دو ودوامه (وحدات التخزين و/أو تجمعات أخرى يمكن استخدامها لمطالب مختلفة). تجدر الإشارة إلى أن في هذه الدراسة، مركزة أقل مما سبق الإبلاغ عنها (20 في المائة)14 واستخدمت حل الأزرق البروسي.
- يبقى الحل في الظلام في 4 درجات مئوية حتى الاستخدام. الحل مستقر لمدة 6 أشهر عند تخزينها في مثل هذه الظروف.
7-توليد منحنى معايرة لأسلوب البروسية الأزرق باستخدام نتائج FAAS
ملاحظة: حساب تركيز الحديد في رماد باستخدام الصيغة التالية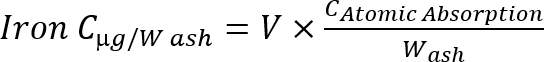 معادلة 1
معادلة 1
C: تركيز، حجم العينة، والخامس: w: الرماد الوزن (ز).
- مزيج 0.50 مل من حل الأزرق البروسي و 0.50 مل من 1 M HCl. وهذا سيكون بمثابة الحل فارغة.
- مزيج 0.5 مل عينة (رماد في 4% HCl، كما هو موضح في القسم 3) و 0.5 مل من محلول أزرق البروسي (الخطوة 6.1) قبل بيبيتينج. انتظر دقيقة واحدة على الأقل ولكن ليس أكثر من 5 دقائق. بعد 5 دقائق، سوف يحدث الترسيب في العينات.
- تحويل المزيج إلى ومبومو وقياس التوجيه التشغيلي في 715 نانومتر باستخدام جهاز المطياف الضوئي. قم بتدوين القيمة.
- قسمة القيمة OD (الخطوة 7، 3) وزن الرماد (الخطوة 3، 2) من العينة. وتمثل النتيجة OD كل غرام الرماد.
- ارسم الانحدار الخطي بين تركيزات الحديد التي تم الحصول عليها من القياسات FAAS (محور ص) وقيم التطوير التنظيمي (X المحور). استخدام النتائج التي تم الحصول عليها في الخطوات 5، 2 و 7-4. حساب الصيغة الانحدار، Y = + bX، حيث تمثل Y تركيز الحديد، ويمثل امتصاص تتقاطع، ب يمثل المنحدر امتصاص والعاشر في التطوير التنظيمي.
8-استخدام أسلوب الأزرق البروسية لتحديد مستويات الحديد في عينات أخرى من نفس نوع النبات
الملاحظات: وبالفعل أنشئت منحنى معايرة لهذا النوع من النبات، تركيز الحديد في أي عينات جديدة من نفس نوع النبات يمكن مباشرة حساب استخدام الصيغة الانحدار الخطي.
- تنفيذ الخطوات الموجودة في المقاطع 3 و 4، تليها خطوات 7.1 إلى 7.4.
- حساب تركيز الحديد في الحل باستخدام الصيغة التي تم الحصول عليها من الانحدار الخطي (الخطوة 7، 5).
Access restricted. Please log in or start a trial to view this content.
النتائج
عندما نفذت هذا البروتوكول بشكل صحيح، واحد يجب أن تحصل على العلاقة الممتازة بين النتائج التي تم الحصول عليها بطرق التحليل الطيفي الأزرق البروسي والذرى. ولذلك، الأسلوب الأزرق البروسي بسهولة استخدامها للحصول قياس دقيق لتركيز الحديد في عينات النباتات، كما تنعكس في التجربة...
Access restricted. Please log in or start a trial to view this content.
Discussion
قياس الحديد في الأنسجة النباتية مهم جداً لتقييم آثار الري أو غيرها من الظروف البيئية. هنا، يمكننا وصف طريقة قياس ألوان سهلة ودقيقة لقياس محتوى الحديد في أوراق التبغ، الذي يمكن أن يسهل تكييفها للأنواع النباتية والأنسجة الأخرى.
في تحسين الظروف لأسلوب قياس الألوان، استخدمنا ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
إسرائيل وزارة العلوم والتكنولوجيا وسباسيند تدعمها منحة من عالم كبير من وزارة الزراعة (#16-16-0003) الإسرائيلية هذا العمل.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M. Soils and soil fertility. Louis, M., Troeh, F. R., Thompson, L. M. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- JoVE Science Education Database. Analytical Chemistry. Calibration Curves. , Journal of Visualized Experiments. Cambridge, MA. Available from: https://www.jove.com/science-education/10188/calibration-curves (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved