A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטה ערכי צבע מוחלטים למדידת תכולת ברזל צמחים
In This Article
Summary
אנו מציגים פרוטוקול פשוטה ואמינה למדידת תוכן ברזל ברקמות הצמח באמצעות השיטה כחול פרוסי ערכי צבע מוחלטים.
Abstract
ברזל, אחד של יסודות קורט החשוב ביותר אורגניזמים חיים, מעורב תהליכים בסיסיים, כגון נשימה, פוטוסינתזה. תוכן ברזל הוא נמוכות למדי בכל היצורים, בהיקף של צמחים כ- 0.009 אחוז משקל יבש. עד כה, באחת השיטות המדויקות ביותר למדידת ריכוז ברזל ברקמות הצמח הוא הלהבה ספקטרום בליעה אטומית. עם זאת, גישה זו הוא יקרה ועתירת ואינה דורשת ציוד ספציפי לא נפוץ למצוא צמח מעבדות. לכן, דרושה שיטה פשוטה אך מדויקת יכול לשמש באופן שגרתי. השיטה כחול פרוסי ערכי צבע מוחלטים משמש באופן קבוע ברזל איכותי מכתים בסעיפים היסטולוגית מהחי והצומח. במחקר זה, שינינו את כחול פרוסי שיטת מדידות כמותיים של ברזל טבק עלים. נוכל לאמת את הדיוק של שיטה זו באמצעות ספקטרוסקופיה אטומית והן כחול פרוסי מכתים כדי למדוד את התוכן ברזל הדגימות באותו ומצא רגרסיה ליניארית (R2 = 0.988) בין שני ההליכים. אנו מסיקים כי השיטה כחול פרוסי למדידה כמותית ברזל ברקמות הצמח הוא מדויק, פשוטה וזולה. עם זאת, הרגרסיה הליניארית המובאת כאן לא ייתכן המתאים עבור מינים אחרים של הצמח, בשל פוטנציאל אינטראקציות בין המדגם הכימית. הקמתה של עיקול רגרסיה ובכך צורך עבור מינים שונים.
Introduction
הברזל (Fe) הוא micronutrient חשוב בכל היצורים החיים. בצמחים, זה micronutrient חיוני1 בגלל מעורבותה תהליכים בסיסיים, כגון נשימה, פוטוסינתזה, כלורופיל ביוסינטזה. הצטברות גבוהה של ברזל חינם יונים מזיק לשתול תאים עקב תגובות מוביל שחרור של רדיקלים חופשיים גורם סטרס חמצוני. כדי לשמור על הומאוסטזיס ברזל בתוך התא צמח, יונים המאוחסן וקואלות, מבודדות בתוך ferritins, חלבון הכלובים מעורבים ישירות הומאוסטזיס ברזל2 ומבנה האחסון העיקרי של ברזל בכל היצורים החיים. במקביל, אנמיה מחוסר ברזל משפיע על חלק ניכר של האוכלוסייה האנושית, וכתוצאה מכך הצורך הגובר צמח Fe biofortification. בשל תכונותיו הייחודיות של הצמח קשירת ברזל, העשרת מזון עם קשירת ברזל-ברזל מציע אסטרטגיה מבטיח להילחם בבעיה הזאת של תת-תזונה3.
יונים של ברזל הם בעיקר שנמצאו שתי חמצון מדינות, כלומר ברזלי (כלט Fe2 + או ברזל (II)), ferric (כ Fe3 + או ברזל (III)) טפסים. כמה צורות אחרות של ברזל, כגון ברזל אשכולות4, ניתן למצוא גם בתאים. Fe מאוחסן בתור תחמוצת ברזל בתוך התא, באופן טבעי צורות hematites (Fe2O3), ferryhidrites ((Fe3 +)2O3•0.5 H2O) תחת תנאים פיזיולוגיים5. והידרוקסידים שהוקמה ב תגובות אלו, במיוחד את הטופס ferric, יש מסיסות נמוכה מאוד. ברזל השמירה מושפע וכתוצאה מכך רמת ה-pH של התמיסה, במידה רבה במצב מוצק מעל pH 56.
בהתחשב המסיסות המסכן תגובתיות גבוהה של Fe, את ההעברה בין הצמח רקמות ואיברים חייב להיות מקושר עם מולקולות chelating מתאימים. יתר על כן, המדינות חמצון-חיזור בין צורות ומתכות ferric1 חייבים להיות מבוקרים. בתוך עלים, כ- 80% של הברזל הוא נמצא תאים פוטוסינתטיים, עקב שלה תפקידים חיוניים במערכת התחבורה אלקטרון, ביוסינטזה של cytochromes, כלורופיל, מולקולות אחרות heme, ואת היווצרות Fe-S אשכולות7. במקרה של ברזל עודף בתוך התא, העודף הוא translocated לתוך חלולית שבו המתכת מאוחסן בקשירת ברזל מולקולות8.
ניתן למדוד ברזל ברקמות הצמח על ידי מספר שיטות, כולל להבה בליעה אטומית ספקטרוסקופיה9 (FAAS) או מבחני ערכי צבע מוחלטים10, לשעבר להיות הרבה יותר מדויק מאשר לאחרון. FAAS היא טכניקה מאוד מדויקת המאפשר לנו לקבוע הרכב היסודות של מדגם על בסיס הפליטה האלקטרומגנטית של הרכיבים הבודדים. FAAS ממיר יונים מתכתיים למדינות אטומי מאת להבה-חימום של המדגם, המוביל עירור יון פליטה של גל מסוים יון נתון יחזור למצבו הקרקע. פליטת היונים שונה המופרדים באמצעות monochromator, זוהה על ידי חיישן הקליטה11. FAAS מגישה לכן ישירות לכמת ריכוזי ברזל. טכניקות אחרות המדגימה ברזל ברקמות ביולוגיות זמינים, אולם. מצמידים inductively פלזמה המוני ספקטרוסקופיה (ICP-MS)12 היא טכניקה מאוד מדוייק למדידת ברזל ויסודות קורט אחרים אבל העדר ציוד, גם FAAS וגם ICP-MS, היא בעיה נפוצה. מצד שני, ברזל המדידה על-ידי thiocyanate colorimetry13 חסר דיוק, לא יצליח לזהות וריאציות קטנות בין דגימות. כחול פרוסי מכתים14,15,16,17 היא שיטה עקיפה בהתבסס על התגובה של אשלגן ferric ferrocyanide (K4Fe(CN)6) עם קטיונים Fe, ייצור צבע כחול חזק, והוא משמש לזיהוי ברזל איכותי בסעיפים היסטולוגית של רקמות הגוף.
ברזל מתכתי (אפס-עמודים ולנטיין) הוא נדיר ליתוספירה. הצורה השלטת יוניים שאינם ומורכבת של ברזל בסביבת מוכתב בעיקר על ידי כמות החמצן בסביבה, עם ברזל ברזלי להיות יחסית שופע יותר בסביבות אנאוקסיים וברזל ferric predominating באתרים אירובי. זה באחרון גם הוא דומיננטי בסביבות מאוד חומצי, למרות הסוכנים סיבתי של ברזל ברזלי חמצון לעיתים קרובות נבדלים סביבה חומצית אנאוקסיים18. מתי ברזל solubilized ב 4% HCl (pH 0) בסביבה אירובית, החלק העיקרי של הברזל מדולל קיים כפי ferric הטופס (Fe3 +)19,20.
התגובות בין יונים Fe ו- K4Fe(CN)6 הן כדלקמן:
Fe3 +: FeCl3 + K-4-Fe(CN)-6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2 K-4-Fe(CN)-6 = Fe4(Fe(CN)6)2 + 8 אשלגן כלורי
במחקר הנוכחי, ביקשנו אם צביעת כחול פרוסי יכול להיות שימושי עבור מדידת רמות ברזל בתמיסה.
בתחילה, נוכל לאמת את המתאם בין ריכוז Fe בתמיסה המימית מכתים כחול פרוסי. ריכוז Fe (כפי FeCl2, FeCl3 או תערובת של 1:1 של השני) בתחום פתרונות מימית נמדדה על ידי ספקטרוסקופיה אטומית והן על ידי ספיגת (OD) לאחר תוספת של כחול פרוסי. איור 1 מציג את עקומות רגרסיה ליניארית למדידות מתקבל על ידי כל שיטה. הגענו למסקנה כי השיטה כחול פרוסי יכול לשמש עבור ניתוח כמותי של ברזל ריכוז בתמיסה.
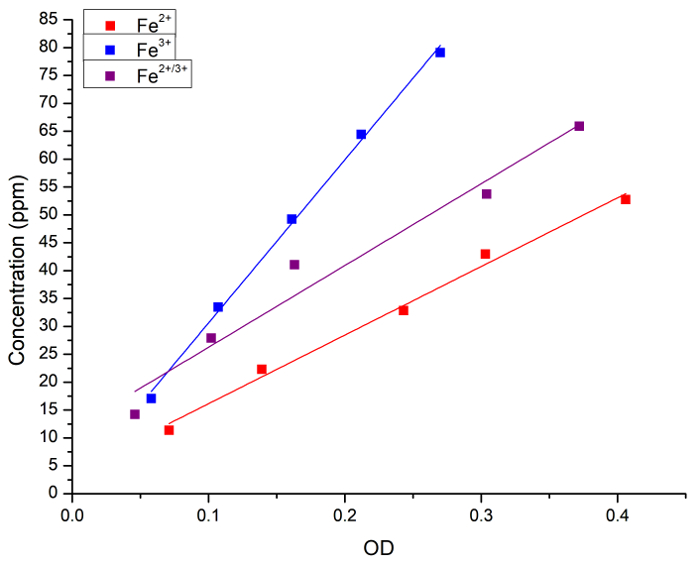
איור 1: regressions ליניארי בין ריכוז Fe נמדדת FAAS ואת ספיגת האור (OD, 715 ננומטר) מתקבל על ידי שיטת כחול פרוסי. ריבועים כחול וקו מייצג הפתרון2 + Fe, ריבועים אדומים וקו הפתרון3 + Fe מייצגים את ריבועים שחורים וקו מייצג תערובת 1:1 בין Fe2 + ו Fe3 +. Regressions הבאים התקבלו: [Fe2 +] = 3 + 123 x OD, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 x OD, r = 0.999, R2 = 0.997; ו [Fe2 + 3 +] = 11 + 146 x OD, r = 0.983, R2 = 0.956. התורם2 + Fe FeCl2 , היה התורם Fe3 + FeCl3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
להתאים את שיטת כחול פרוסי ערכי צבע מוחלטים לניתוח כמותי ברזל של רקמות הצמח, התוכן ברזל של האפר עלה טבק נמדדה על ידי להבה ספקטרום בליעה אטומית מכתים כחול פרוסי. היה מתאם טוב בין התוצאות של ידי שתי שיטות.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. לשתול חומר, תנאי הגידול
- זרע זרע אחד טבק (לדבורי לסאמסון) לכל 5 ס"מ x 5 ס"מ סיר מלא בינונית בסיר רגיל. מניחים את הסירים על המגשים. לגדל את הצמחים בחדר גדילה בתנאים יום ארוך (16/8 h/כהה) בטמפרטורה קבועה של 23 מעלות צלזיוס. להשקיית עם מי ברז עד ניקוז המים מהסיר.
- לאחר ימים 50±5, להתחיל טיפולים Fe ההשקייה, לפי ריכוז המתאימים לניסוי. לדוגמה, השתמשנו מגוון של ריכוזי ברזל מ- 0 עד 6 מ מ, שיושלם על-ידי chelator מסיסים Fe (Fe EDDHA). להשקיית הצמחים עם הפתרון המתאים בכל יומיים (כדי למנוע התייבשות) 6-8 ימים.
2. הכנת את העלים למדידה ברזל
הערות: כל החומרים כדי לשמש חייבים להיות נטולי ברזל כדי להפחית את הסיכון של זיהום ברזל. מכתש ועלי פעמיים עם 4% HCl פתרון יבש ונקי עם נייר סינון בכל פעם לפני השימוש. אם היא להשתמש בכל חומר, זה פעמיים עם 4% HCl פתרון יבש ונקי עם נייר סינון.
- לנתק את העלים מן הגבעול בכתב יד, באמצעות כפפות (אל תשתמש כל ציוד מתכת). השתמש בערך 10 גרם של עלים (משקל טריים) עבור כל דגימה. נקה כל עלה עם כפול מים מזוקקים (DDW) באמצעות בקבוק ספריי. השלב זה חשוב למנוע זיהום Fe.
- לייבש את העלים על מגבת נייר, לשים אותם בשקית נייר. להעביר את שקיות נייר תנור בטמפרטורה קבועה של 80 מעלות צלזיוס במשך 2-3 ימים.
- כאשר יבש, למחוץ את העלים כדי אבקת באמצעות פצצות מרגמה, איחדו העברת צינורות פלסטיק סטרילית 15 מ"ל.
3. שריפת העלים לאפר
הערות: השימוש של פתרון pH נמוך (קרוב ל 0) של HCl נועד להגביר את מסיסות ברזל. צמר סלעים משמש כדי למנוע בריחה את המבחנה במהלך שריפת הגזים.
- שוקלים בקבוקון נצנוץ חדש, אטום בפטרת ללא המכסה. שים לב לערך או להגדיר את הערך אפס באמצעות לחצן טרה. להוסיף עלים יבשים כתוש (דוגמה) למבחנה.
- שוקל את הדגימה ואת מיכל ורשום את הערך. סגור את המבחנה עם צמר סלעים.
- שוקל 3 מבחנות נוספות מבלי להוסיף דוגמאות ורשום את הערכים שלהם. את שתי המבחנות ישמש כפקדי כדי להעריך את כמות צמר סלעים יכול שהובילו לכך כל עלייה קטנה במשקל לדוגמה.
- למקם את הבקבוקונים מדגם ושליטה תנור, להתחיל לצרוב באמצעות השלבים הבאים טמפרטורה: בטמפרטורת החדר, עלייה מהירה 425 ° C, ו, לבסוף, 425 מעלות צלזיוס למשך 4 שעות. בזמן הזה, שהעלים היבשים הפכו לאפר.
- ומצננים את דגימות עד כ 100 ° C. אבל לא מתחת לטמפרטורה זו על שני השלבים הבאים למנוע לחות, אשר יכול להשפיע על המשקל הסופי של המדגם. באמצעות כפפות כבדות, הסר את הדגימות בכבשן עם פינצטה, מחזיק את הצנצנת מבחינה חיצונית וגם מבחינה.
- מניחים את הבקבוקונים על משטח שטוח, להסיר את צמר סלעים ולסגור את הבקבוקונים בשלמותם המקורי שלהם.
- שוקל את הבקבוקונים שליטה 3 (ראה 3.3) ולחשב שלהם במשקל ממוצע. אם במשקל שווה או מעל 1% ממשקל האפר (ראה שלב 4.2), השתמש בערך זה כהערכה לשגיאת המדידה.
4. מכינים את האפר למדידה ברזל
הערות: ריכוז הברזל הסופי במדגם הראשונית מחושבת המשקל של האפר מחולק נפח נוסף של HCl.
- להכין פתרון HCl 1 מ' (4% HCl) על-ידי הוספת מ"ל של פתרון מניות של HCl 37% 87.5 מ ל DDW (בבקבוקון פלסטיק או זכוכית).
- שוקל צינור פלסטיק 15 מ"ל, שים לב לערך או להגדיר את הערך אפס באמצעות לחצן טרה. להעביר את האפר הצינור, שוקל, שים לב לערך. זהו המשקל אפר.
- הוסף 5 מ של 1 M HCl האפר. לסנן את האפר דרך מסנן מיקרומטר 22 ולהוסיף אוטם 5 נוספים של 1 M HCl דרך המסנן אותו.
- עוצמת הקול הסופי צריך להיות 10 מ"ל. שימו לב כי חלק מהפתרון יאבדו במסנן.
הערה: הדגימות. אתה מוכן למדידה Fe FAAS או באמצעות פעולת השירות כחול פרוסי. - הופכים את עקומת כיול עם ריכוז Fe נמדד לפי מסות אטומי ולפי השיטה כחול פרוסי (ראה איור 4) עבור כל מיני צמחים. לאחר מכן, ניתן למדוד ריכוז Fe בשיטה כחול פרוסי לבד.
5. מדידת ריכוז Fe מאת FAAS
- הסר 4 מ"ל כל מדגם למדידה מאת FAAS.
- לחלק את התוצאות שהתקבלו המדידה FAAS לפי המשקל של האפר. לחלק את הערך שהתקבל ב- 0.01 (כי האפר היו solubilized ב- 10 מ ל). הערך המתקבל הוא ריכוז הברזל לכל גרם אפר (ppm).
6. הכנת את כחול פרוסי מכתים פתרון
- להכין a 4% כחול פרוסי פתרון על-ידי הוספת 4 g K4Fe(CN)6 עד 100 מ"ל DDW ו מערבולת (אמצעי אחסון אחרים ו/או ריכוז יכול לשמש עבור דרישות שונות). יצוין, כי במחקר זה, פחות מרוכזים פתרון כחול פרוסי (20%) שדווחה בעבר14 היה בשימוש.
- לשמור את הפתרון בחושך ב 4 ° C עד השימוש. הפתרון הוא יציב במשך 6 חודשים כאשר הוא מאוחסן בתנאים.
7. הפקת את עקומת כיול עבור השיטה כחול פרוסי באמצעות FAAS תוצאות
הערה: לחשב את ריכוז הברזל באפר באמצעות הנוסחה הבאה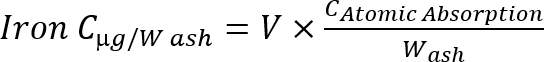 משוואה 1
משוואה 1
C: ריכוז, v: לדגום נפח, w: אפר משקל (g).
- מערבבים 0.50 מ של פתרון כחול פרוסי, מ 0.50 ל 1 M HCl. זה ישמש הפתרון ריק.
- לערבב 0.5 מ של דגימה (האפר 4% HCl, כמתואר בסעיף 3) ו- 0.5 מ של פתרון כחול פרוסי (שלב 6.1) על ידי pipetting. המתן לפחות 1 דקה אך לא יותר מחמש דקות. לאחר 5 דקות, שקיעת הדגימות תתרחש.
- להעביר את התערובת cuvette ולמדוד OD-715 nm באמצעות ספקטרופוטומטרים. שים לב לערך.
- לחלק את הערך OD (שלב 7.3) לפי המשקל אפר (שלב 3.2) של המדגם. התוצאה מייצג OD לכל גרם אפר.
- להתוות את הרגרסיה הליניארית בין ריכוז הברזל המתקבל המדידות FAAS (ציר Y) ואת הערכים OD (ציר X). השתמש התוצאות המתקבלות שלבים 5.2 ו- 7.4. לחשב את נוסחת הרגרסיה, Y = + bX, כאשר Y מייצג ריכוז הברזל, מייצג ספיגת מצטלבים, b מייצג השיפוע ספיגת ו X מייצג OD.
8. בשיטת כחול פרוסי לקביעת רמות הברזל בדגימות אחרים מאותו סוג הצמח?
הערות: מאז עקומת כיול כבר הוקמה עבור סוג זה של הצמח, ריכוז הברזל בדוגמיות חדש מאותו סוג הצמח ניתן ישירות לחשב באמצעות הנוסחה רגרסיה ליניארית.
- בצע את השלבים בסעיפים 3 ו- 4, ואחריו צעדים 7.1 ל 7.4.
- חשב את ריכוז ברזל בתמיסה תוך שימוש בנוסחה המתקבל של רגרסיה ליניארית (שלב 7.5).
Access restricted. Please log in or start a trial to view this content.
תוצאות
כאשר פרוטוקול זה מתבצעת כהלכה, יכול לעשות קורלציה מצוינת בין התוצאות המתקבלות על-ידי השיטות ספקטרוסקופיה כחול פרוסי, אטומי. לכן, השיטה כחול פרוסי בקלות ניתן להשיג של מדידה מדויקת של ריכוז הברזל דגימות צמח, כפי שמשתקף בניסוי הבא.
צמחי הטבק ...
Access restricted. Please log in or start a trial to view this content.
Discussion
מדידה ברזל ברקמות הצמח חשוב מאוד להעריך את ההשפעות של השקיה או תנאים סביבתיים אחרים. כאן, אנחנו תיאר שיטה קלה ומדויקת ערכי צבע מוחלטים למדידה תוכן Fe טבק העלים, אשר ניתן להתאים בקלות מיני צמחים ורקמות אחרות.
תוך אופטימיזציה של תנאי עבור פעולת ערכי צבע מוחלטים, השתמשנו pH נמוך ב...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי משרד המדע, הטכנולוגיה הלוהט על ידי מענק של המדען הראשי של משרד החקלאות (#16-16-0003).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M. Soils and soil fertility. Louis, M., Troeh, F. R., Thompson, L. M. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- JoVE Science Education Database. Analytical Chemistry. Calibration Curves. , Journal of Visualized Experiments. Cambridge, MA. Available from: https://www.jove.com/science-education/10188/calibration-curves (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved