Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Колориметрический метод измерения содержания железа в растениях
В этой статье
Резюме
Мы представляем простой и надежный протокол для измерения содержания железа в тканях растений, с помощью метода колориметрические лазурь.
Аннотация
Железо, один из самых важных микроэлементов в живых организмов, участвует в основных процессов, таких как дыхания и фотосинтеза. Содержание железа является довольно низким во всех организмах, равнозначно примерно 0,009% от сухого веса в растениях. На сегодняшний день, один из наиболее точных методов для измерения концентрации железа в тканях растений является пламя атомной абсорбционной спектроскопии. Однако этот подход является длительным и дорогостоящим и требует специального оборудования, не встречаются в лабораториях завода. Поэтому необходима более простой, но точный метод, который может использоваться регулярно. Колориметрический метод лазурь регулярно используется для качественного железа, пятнать в гистологических срезах животных и растений. В этом исследовании мы адаптировали лазурь, метод для количественных измерений железа в табачных листьев. Мы проверить точность этого метода, с помощью атомной спектроскопии и лазурь пятнать измерить содержание железа в том же образцах и нашли линейной регрессии (R2 = 0.988) между этими двумя процедурами. Мы заключаем, что метод лазурь для измерения количественных железа в тканях растений точный, простой и недорогой. Однако линейной регрессии, представленные здесь могут не подходить для других видов растений, из-за потенциального взаимодействия между образцом и реагент. Создание кривой регрессии таким образом необходима для различных видов растений.
Введение
Железо (Fe) является важным микроэлементов во всех живых организмах. В растениях это важнейших микроэлементов1 из-за его участия в основных процессов, таких как биосинтеза хлорофилла, дыхание и фотосинтез. Высокое накопление ионов свободного железа вредно для растительных клеток за счет реакции, ведущие к освобождению свободных радикалов, вызывая оксидативного стресса. Для поддержания гомеостаза железа в растительной клетке, ионы хранятся в вакуоли и поглощенных внутри ferritins, белок клеток, непосредственно участвующих в Железный гомеостаза2 и структуры основного хранения железа во всех живых организмах. В то же время железо дефицитной анемии затрагивает значительную долю населения, привело растущую потребность растений рекомендовавшая Fe. Благодаря уникальным свойствам растений ферритина обогащение пищи с ферритина железом предлагает перспективные стратегии для борьбы с этой проблемой недоедания3.
Ионы железа, главным образом в двух окисления, а именно черных (двухвалентной Fe2 + или железа (II)) и железа (Fe трехвалентного3 + или железа (III)) формы. Несколько других форм железа, например кластеров железа4, также находятся в клетках. FE хранится в виде оксида железа в клетки и естественно форм hematites (Fe2O3) и ferryhidrites ((Fe)3 +2O3•0.5 H2O) при физиологических условиях5. Гидроксиды, сформированные в этих реакциях, особенно железа форме, имеют очень низкую растворимость. Удержание железа поэтому зависит от рН раствора и в значительной степени в твердом состоянии выше рН 5-6.
Учитывая плохая растворимость и высокая реакционная способность Fe ее передачи среди растительных тканей и органов должен быть связан с подходящим хелатирующий молекул. Кроме того необходимо контролировать его редокс государств между черной и железа формы1 . В листьях около 80% железа находится в фотосинтезирующих клеток, из-за ее существенную роль в транспортная система электронов, в биосинтезе цитохромов, хлорофилл и других молекул гема и в формировании Fe-S7кластеров. В случае железа избыток в ячейке излишек является перемещен в вакуоль, где Металл хранится в ферритина молекул8.
Железо может измеряться в тканях растений на несколько методов, включая пламени атомной абсорбционной спектроскопии9 (ФААС) или колориметрический анализов10, бывший, будучи гораздо более точным, чем последний. ФААС это очень точная техника, которая позволяет одному определить химический состав выборки на основе электромагнитного излучения отдельных элементов. ФААС преобразует ионов металлов в атомной государствам, пламя Отопление образца, привело к Ион возбуждения и выбросов определенной длины волны, когда данный Ион возвращается в состояние земли. Выбросы из различных ионов разделенных монохроматора и обнаружен датчик поглощения11. ФААС таким образом служит для непосредственно количественного определения концентрации железа. Другие методы для визуализации железа в биологических тканях доступны, однако. Индуктивно связанная плазма масс-спектрометрия (ИСП-МС)12 является очень точный метод измерения железа и других микроэлементов, но отсутствие оборудования, как для ФААС и ИСП-МС, является общей проблемой. С другой стороны измерения железа тиоцианат колориметрии13 недостает точности и не удается обнаружить небольшие вариации между выборками. Прусский синий окрашивание,14,,151617 это косвенный метод, основанный на реакции железа Ферроцианид калия (K4Fe(CN)6) с катионов Fe, производство сильный синий цвет и используется для обнаружения качественной железа в гистологических срезах тканей животных и растений.
Металлические (нулевой Валент) железо является редким в литосфере. Доминирующей не complexed ионной форме железа в окружающей среде основном диктуется количество кислорода в окрестностях, с будучи относительно более обильные в анаэробной среде черных и железа чугуна, преобладающая в аэробных сайтов. Эта последняя форма также является доминирующей в крайне-кислых средах, хотя возбудители черных железа окисления часто отличаются в анаэробных и кислой окрестности18. Когда железа солюбилизирован в 4% HCl (рН 0) в аэробных условиях, большая часть разреженных железа существует как железа (Fe)3 +19,20.
Реакции между ионами Fe и K4Fe(CN)6 являются следующие:
FE3 +: FeCl K4Fe(CN)6 +3 = KFe(III)Fe(II)(CN)6¯ + 3KCl
FE2 +: 4 FeCl2 + 2 K4Fe(CN)6 =4(Fe(CN)6) Fe2 + 8 KCl
В настоящем исследовании мы спросили ли Прусский голубой окраски может быть полезен для измерения уровня железа в растворе.
Первоначально мы проверили корреляции между концентрацией Fe в водном растворе и прусского синего окрашивания. Концентрация в водных растворах Fe (как FeCl2, FeCl3 или 1:1 смесь двух) был измерен атомной спектроскопии и поглощения (OD) после добавления лазурь. Рисунок 1 показывает кривые линейной регрессии для измерений, полученных каждым методом. Мы пришли к выводу, что Прусский синий метод может использоваться для количественного анализа концентрации железа в растворе.
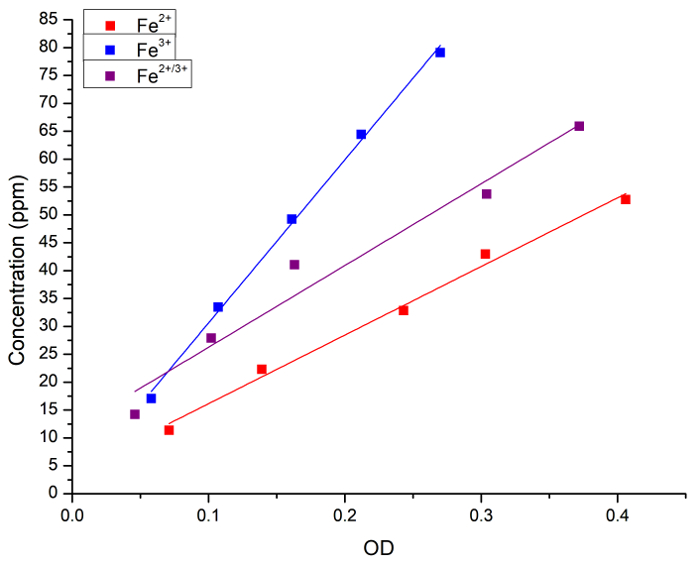
Рисунок 1: линейной регрессии между Fe концентрация измеряется ФААС и поглощения света (OD, 715 Нм) получены методом Прусский синий. Синие квадраты и линии представляют собой Fe2 + решение, красные квадраты и линии представляют собой решение3 + Fe и черные квадраты и линии представляют собой смесь 1:1 между Fe2 + и Fe3 +. Были получены следующие регрессии: [Fe2 +] = 3 + 123 x ОД, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 x ОД, r = 0,999, R2 = 0,997; и [Fe2 +/ 3 +] = 11 + 146 x ОД, r = 0.983, R2 = 0.956. Fe2 + доноров был FeCl2 и Fe3 + доноров был FeCl3. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Адаптировать колориметрические Прусский синий метод для анализа количественных железа растительных тканей, содержание железа табачных листьев пепел был измерен пламени атомной абсорбционной спектроскопии и Прусский синий окрашивания. Там была хорошая корреляция между результаты из двух методов.
Access restricted. Please log in or start a trial to view this content.
протокол
1. завод материал и условия роста
- Семян один табака (сорт Самсун) семян на 5 х 5 см горшок заполнены среднего стандарта горшок. Поместите горшки на поддоны. Растут растения в комнате роста в условиях насыщенного дня (16/8 h свет/темно) при постоянной температуре 23 ° c. Орошения с водопроводной водой до водостоков из горшка.
- После 50±5 дней Начните лечение Fe в ирригации, согласно концентрации подходит для эксперимента. Например мы использовали широкий спектр концентрации железа от 0 до 6 мм, дополнена растворимых хелатором Fe (Fe EDDHA). Поливать растения с подходящим решением каждые два дня (чтобы избежать обезвоживания) для 6-8 дней.
2. подготовка листья для измерения железа
Примечания: Все материалы, используемые должны быть бесплатно утюг с тем, чтобы снизить риск загрязнения железом. Очистить ступку и пестик дважды с 4% раствор HCl и высушить фильтровальную бумагу каждый раз перед использованием. Если повторно любой материал, очистить его дважды с 4% раствор HCl и высушить фильтровальную бумагу.
- Отсоедините листья от ствола вручную, используя перчатки (не использовать любое оборудование, металлические). Используйте около 10 г листьев (свежего веса) для каждого образца. Очистите каждый лист с двойной дистиллированной воды (DDW), используя распылитель. Этот шаг важен избежать загрязнения Fe.
- Сухие листья на бумажное полотенце и положите их в бумажный пакет. Передавать бумажные мешки в духовке при постоянной температуре 80 ° c на 2-3 дней.
- При сухой, раздавить листья порошок, используя ступку и пестик и передачи для стерильных 15 мл пластиковых труб.
3. сожжение листья ясеня
Примечания: Использование низкого pH (ближе к 0) раствор HCl предназначен для повышения растворимости железа. Минеральная вата используется для предотвращения побега флакона во время сжигания газов.
- Весят новый, запечатанном 20мл флаконе сцинтилляционные без его крышкой. Обратите внимание на значение или задать значение ноль с помощью кнопки тары. Добавьте измельченные сухие листья (образец) флакон.
- Взвесить образец и контейнера и обратите внимание на значение. Закройте флакон с ватой.
- Весят 3 дополнительных флаконах без добавления образцов и запишите их значения. Эти пузырьки будут использоваться как элементы управления для оценки объема минваты, что могло бы вызвать любое увеличение веса пробы.
- Поместите образец и контроля ампул в печи и начать запись, используя следующие шаги температуры: температура в помещении, быстрый рост за 4 часа до 425 ° C и, наконец, 425° C. К этому времени сухие листья будет превратились в пепел.
- Пусть прохладно образцы около 100 ° c, но не ниже этой температуры для следующих двух шагов избежать влажности, которые могут повлиять на окончательный вес образца. С помощью тяжелого перчатки, удалите образцы из печи с помощью пинцета, держа флакон внешне.
- Поместите флаконов на плоскую поверхность, удалить минеральной ваты и закрыть флаконы с их оригинальной крышками.
- Весят 3 управления флаконы (см. 3.3) и вычислить их средний прирост веса. Если увеличение веса равна или выше 1% массы золы (см. шаг 4.2), это значение используется в качестве оценки погрешности измерения.
4. Подготовка пепла для измерения железа
Примечания: Концентрация окончательный железа в первоначальной выборки вычисляется как вес пепла, разделенных добавлен объем HCl.
- Приготовляют раствор HCl 1 M (4% HCl), добавив 12,5 мл Стоковый раствор HCl 37% до 87,5 мл DDW (в пластиковые или стеклянные колбы).
- Взвешивать 15 мл пластиковую трубку и обратите внимание на значение или задать значение ноль с помощью кнопки тары. Перенести прах на трубу, весят и обратите внимание на значение. Это вес золы.
- Добавьте 5 мл 1 M HCl в пепел. Через 22 мкм фильтр фильтр пепла и добавить еще 5 мл 1 М HCl через тот же фильтр.
- Окончательный объем должен быть 10 мл. Обратите внимание, что часть решения будет потеряно в фильтре.
Примечание: Образцы теперь готовы для Fe измерения ФААС либо методом лазурь. - Сделать калибровочной кривой с Fe концентрация измеряется атомная спектроскопия и Прусский синий методом (см. Рисунок 4) для каждого вида растений. Впоследствии Fe концентрация может быть измерен только метод Прусский синий.
5. измерение концентрации Fe, ФААС
- Удалите из каждого образца для измерения, ФААС 4 мл.
- Разделите результаты, полученные от ФААС измерения веса пепла. Разделите полученное значение на 0,01 (потому что пепла были солюбилизирован в 10 мл). Полученное значение является концентрация железа на грамм золы (ppm).
6. Подготовка лазурь, окрашивание раствора
- Подготовка 4% Прусский синий раствор путем добавления 4 g K4Fe(CN)6 до 100 мл DDW и вихревые (другие тома или концентрации может использоваться для различных требований). Следует отметить, что в этом исследовании, менее концентрированный раствор Прусский синий, чем сообщалось ранее (20%)14 .
- Держите решение в темноте при температуре 4 ° C до использования. Решение является стабильным за 6 месяцев при хранении в таких условиях.
7. Создание Калибровочная кривая для метода лазурь, использованием ФААС результаты
Примечание: Рассчитайте концентрации железа в пепел, по следующей формуле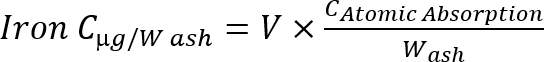 Уравнение 1
Уравнение 1
C: концентрация, объем образца V:, W: золы вес (г).
- Смешайте 0,50 мл раствора Прусский синий и 0,50 мл 1 M HCl. Это будет служить пустое решение.
- Перемешать 0,5 мл образца (пепел в 4% HCl, как описано в разделе 3) и 0,5 мл раствора (шаг 6.1) прусский Синий, закупорить. Подождите, по крайней мере 1 минута, но не более 5 минут. После 5 минут будет происходить седиментации в образцах.
- Передача смеси в кювет и измерить ОД на 715 Нм, используя спектрофотометр. Обратите внимание на значение.
- Разделите значение OD (шаг 7.3) масса золы (шаг 3.2) образца. Результат представляет собой ОД за грамм золы.
- Участок линейной регрессии между концентрации железа, полученных из ФААС измерениях (ось Y) и ОД значения (ось X). Используйте результаты, полученные в пунктах 5.2 и 7.4. Вычислить формулу регрессии Y = a + bX, где Y представляет концентрации железа, представляет поглощения пересекаются, b представляет собой поглощение склона и X представляет ОД.
8. использование метода лазурь для определения уровня железа в других образцах из того же типа растений
Примечания: Поскольку калибровочной кривой уже создана для этого вида растений, концентрации железа в любых новых образцов из того же типа растений могут быть непосредственно рассчитаны с использованием формулы линейной регрессии.
- Выполните шаги в разделах 3 и 4, а затем шаги 7.1-7.4.
- Рассчитайте концентрации железа в растворе с использованием формулы, полученные от линейной регрессии (шаг 7.5).
Access restricted. Please log in or start a trial to view this content.
Результаты
Когда этот протокол осуществляется правильно, один должен получить отличную корреляцию между результаты, полученные методами Прусский синий и атомной спектроскопии. Таким образом метод Прусский синий может легко использоваться для получения точного измерения конц?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Измерения железа в тканях растений очень важно для оценки влияния орошения или других экологических условий. Здесь мы описали, легкой и точной колориметрический метод для Fe содержимого измерения в табачных листьев, которые могут быть легко адаптированы для других видов растений и тка?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Израиля Министерства науки, технологии и Spaceand грант от главного ученого израильского министерства сельского хозяйства (#16-16-0003).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Ссылки
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M. Soils and soil fertility. Louis, M., Troeh, F. R., Thompson, L. M. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- JoVE Science Education Database. Analytical Chemistry. Calibration Curves. , Journal of Visualized Experiments. Cambridge, MA. Available from: https://www.jove.com/science-education/10188/calibration-curves (2018).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены