È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo colorimetrico per la misurazione del ferro contenuto nelle piante
In questo articolo
Riepilogo
Vi presentiamo un protocollo semplice e affidabile per misurare il contenuto di ferro nei tessuti vegetali, utilizzando il metodo colorimetrico di blu di Prussia.
Abstract
Ferro, uno dei più importanti micronutrienti negli organismi viventi, è coinvolto in processi di base, come la respirazione e la fotosintesi. Contenuto di ferro è piuttosto bassa in tutti gli organismi, pari a piante a circa 0,009% del peso secco. Ad oggi, uno dei metodi più precisi per misurare la concentrazione di ferro nei tessuti vegetali è fiamma spettroscopia di assorbimento atomico. Tuttavia, questo approccio è che richiede tempo e costoso e richiede attrezzature specifiche non comunemente trovate in laboratori di pianta. Pertanto, è necessario un metodo più semplice, ma preciso che può essere utilizzato regolarmente. Il metodo colorimetrico di blu di Prussia è regolarmente utilizzato per ferro qualitativo colorazione nelle sezioni istologiche di animali e vegetali. In questo studio, abbiamo adattato il metodo per la misurazione quantitativa del ferro nel tabacco lascia il blu di Prussia. Abbiamo validato la precisione di questo metodo utilizzando sia la spettroscopia atomica e blu di Prussia macchiatura per misurare il contenuto di ferro negli stessi campioni e trovato una regressione lineare (R2 = 0,988) fra le due procedure. Concludiamo che il metodo di blu di Prussia per la misurazione quantitativa del ferro nei tessuti vegetali è preciso, semplice e poco costoso. Tuttavia, la regressione lineare qui presentata non può essere appropriata per altre specie di piante, a causa di potenziali interazioni tra il campione e il reagente. Istituzione di una curva di regressione è quindi necessaria per diverse specie di piante.
Introduzione
Ferro (Fe) è un micronutriente importante in tutti gli organismi viventi. Nelle piante, è un micronutriente essenziale1 a causa del suo coinvolgimento in processi di base, come la respirazione, la fotosintesi e la clorofilla biosintesi. Elevato accumulo di ioni di ferro libero è nociva alla pianta cellule a causa di reazioni che portano alla liberazione di radicali liberi che causano stress ossidativo. Per mantenere l'omeostasi del ferro all'interno della cellula vegetale, gli ioni sono memorizzati nei vacuoli e sequestrati all'interno di ferritine, gabbie di proteina direttamente coinvolte nell' omeostasi di ferro2 e la struttura di archiviazione principale del ferro in tutti gli organismi viventi. Allo stesso tempo, l'anemia sideropenica colpisce una percentuale significativa della popolazione umana, risultante in un crescente bisogno di pianta Fe bioarricchimento. A causa delle proprietà uniche di ferritina pianta, arricchimento di cibo con ferritina-ferro offre una strategia promettente per combattere questo problema della malnutrizione3.
Gli ioni di ferro sono principalmente trovati in due stati di ossidazione, vale a dire i metalli ferrosi (ferro (II) o bivalente Fe2 + ) e ferrico (ferro (III) o trivalente Fe3 + ) forme. Diverse altre forme di ferro, come ferro cluster4, si trovano anche nelle cellule. Fe è memorizzato come ossido di ferro all'interno della cella e naturalmente ematiti forme (Fe2O3) e ferryhidrites ((Fe3 +)2O30,5 H2O) sotto condizioni fisiologiche5. Idrossidi formate in queste reazioni, soprattutto la forma ferrica, hanno solubilità molto bassa. Ritenzione di ferro conseguenza è influenzata dal pH della soluzione ed è in gran parte in uno stato solido sopra pH 56.
Considerando la scarsa solubilità e l'alta reattività del Fe, suo trasferimento tra organi e tessuti vegetali deve essere associato a molecole chelanti adatte. Inoltre, i suoi Stati redox tra i moduli ferrosi e ferrici1 devono essere controllati. All'interno di foglie, circa l'80% del ferro si trova nelle cellule fotosintetiche, a causa di suoi ruoli essenziali del sistema di trasporto dell'elettrone, nella biosintesi dei citocromi, clorofilla e altre molecole di eme e nella formazione di Fe-S cluster7. Nel caso di ferro in eccesso all'interno della cellula, l'eccedenza è traslocata nel vacuolo dove il metallo è memorizzato in molecole di ferritina8.
Ferro da stiro può essere misurata nei tessuti vegetali da diversi metodi, tra cui fiamma spettroscopia ad assorbimento atomico9 (FAAS) o saggi colorimetrici10, il primo è molto più precisa rispetto al secondo. FAAS è una tecnica estremamente precisa che consente di determinare la composizione elementare di un campione con l'emissione elettromagnetica dei singoli elementi. FAAS converte ioni metallici stati atomici di fiamma-riscaldamento del campione, che conduce agli ioni eccitazione e di emissione di una specifica lunghezza d'onda quando un determinato ione ritorna al suo stato fondamentale. Le emissioni da diversi ioni sono separate da un monocromatore e rilevate da un sensore di assorbimento11. FAAS quindi serve a quantificare direttamente le concentrazioni di ferro. Altre tecniche per la visualizzazione di ferro nei tessuti biologici sono, tuttavia, disponibili. Spettroscopia di massa del plasma ad accoppiamento induttivo (ICP-MS)12 è una tecnica molto precisa per la misurazione del ferro e altri oligoelementi, ma la mancanza di attrezzature, sia per FAAS e ICP-MS, è un problema comune. D'altra parte, misura del ferro di tiocianato colorimetria13 manca di precisione e non riesce a rilevare piccole variazioni tra campioni. 14,15,16,di colorazione blu di Prussia17 è un metodo indiretto basato sulla reazione di ferrocianuro ferrico di potassio (K4Fe(CN)6) con cationi di Fe, producendo un colore blu forte e viene utilizzato per la rilevazione qualitativa di ferro nelle sezioni istologiche dei tessuti animali e vegetali.
Ferro metallico (zero-valent) è rara nella litosfera. La forma ionica non complessato dominante di ferro nell'ambiente è principalmente dettata dalla quantità di ossigeno nei dintorni, con ferro ferroso, essendo relativamente più abbondante in ambienti anossici e ferro ferrico che predomina nei siti di aerobiche. Quest'ultima forma è anche dominante in ambienti estremamente acidi, anche se gli agenti causali di ossidazione del ferro ferroso spesso differiscono in un ambiente anossico e acide18. Quando il ferro viene solubilizzato in 4% HCl (pH 0) in un ambiente aerobico, la maggior parte del ferro diluito esiste come forma il ferrico (Fe3 +)19,20.
Le reazioni tra ioni Fe e K4Fe(CN)6 sono come segue:
Fe3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2K4Fe(CN)6 = Fe4(Fe(CN)6)2 + 8 KCl
Nello studio presente, abbiamo chiesto se la colorazione blu di Prussia può essere utile per misurare i livelli di ferro in soluzione.
Inizialmente, abbiamo verificato la correlazione tra la concentrazione di Fe in soluzione acquosa e colorazione blu di Prussia. La concentrazione di Fe (come FeCl2, FeCl3 o una miscela di 1:1 dei due) in soluzioni acquose è stata misurata sia di assorbanza (OD) di spettroscopia atomica dopo l'aggiunta del blu di Prussia. La figura 1 Mostra le curve di regressione lineare per misurazioni ottenute da ciascun metodo. Abbiamo concluso che il metodo prussiano blu può essere utilizzato per l'analisi quantitativa della concentrazione di ferro in soluzione.
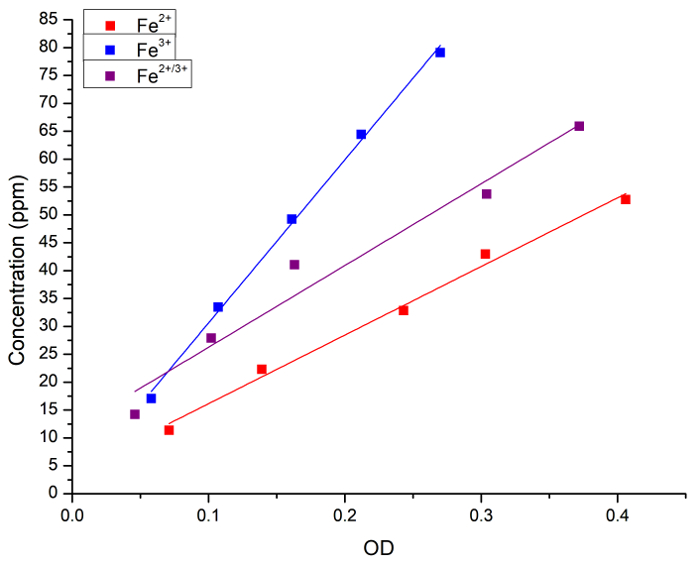
Figura 1: regressione lineare tra concentrazione di Fe misurata FAAS e assorbanza della luce (OD, 715 nm) ottenuti con il metodo prussiano blu. I quadrati blu e linea rappresentano la soluzione di Fe2 + , i quadrati rossi e linea rappresentano la soluzione3 + Fe e i quadrati neri e linea rappresentano una miscela 1:1 tra Fe2 + e Fe3 +. Le regressioni seguenti sono state ottenute: [Fe2 +] = 3 + 123 x OD, r = 0,996, R2 = 0,989; [Fe3 +] = 1 + 292 x OD, r = 0,999, R2 = 0.997; e [Fe2 + 3 +] = 11 + 146 x OD, r = 0,983, R2 = 0.956. Il Fe2 + donatore era FeCl2 e il Fe3 + donatore era FeCl3. Clicca qui per visualizzare una versione più grande di questa figura.
Per adattare il metodo colorimetrico blu di Prussia per l'analisi quantitativa di ferro dei tessuti vegetali, il contenuto di ferro delle ceneri di foglia di tabacco è stato misurato dalla spettroscopia di assorbimento atomico di fiamma e colorazione blu di Prussia. C'era buona correlazione tra i risultati di due tecniche.
Protocollo
1. materiale e le condizioni di crescita della pianta
- Semi di semi di tabacco di una (cultivar Samsun) per vaso di 5cm x 5cm riempito con mezzo vaso standard. Posizionare i vasi su vassoi. Crescere le piante in una stanza di crescita in condizioni di giorno lungo (16/8 h chiaro/scuro) ad una temperatura costante di 23 ° C. Irrigare con acqua di rubinetto fino a quando gli scoli dell'acqua dalla pentola.
- Dopo giorni di 50 ± 5, iniziare trattamenti di Fe nell'irrigazione, secondo le concentrazioni adatte per l'esperimento. Ad esempio, abbiamo utilizzato un intervallo di concentrazioni di ferro da 0 a 6 mM, completato da un chelatore Fe solubile (Fe EDDHA). Irrigare le piante con la soluzione appropriata ogni due giorni (per evitare la disidratazione) per 6-8 giorni.
2. preparazione delle foglie per la misura di ferro
Note: Tutti i materiali da utilizzare devono essere esente da ferro in modo da ridurre il rischio di contaminazione da ferro. Pulire il mortaio e il pestello due volte con soluzione di HCl 4% e asciugare con carta da filtro ogni volta prima dell'uso. Se qualsiasi materiale viene riutilizzato, pulirlo due volte con una soluzione di HCl 4% e asciugare con carta da filtro.
- Staccare le foglie dal gambo a mano, utilizzando guanti (non utilizzare qualsiasi apparecchiatura del metallo). Utilizzare circa 10 g di foglie (peso fresco) per ogni campione. Pulire ogni foglia con doppia acqua distillata (DDW) utilizzando un flacone spray. Questo passaggio è importante per evitare la contaminazione di Fe.
- Asciugare le foglie su un tovagliolo di carta e metterli in un sacchetto di carta. Trasferire i sacchi di carta da forno ad una temperatura costante di 80 ° C per 2-3 giorni.
- Quando asciutto, schiacciare le foglie in polvere utilizzando un mortaio e pestello e trasferimento a tubi in plastica sterili da 15 mL.
3. bruciare le foglie di frassino
Note: L'utilizzo di una basso pH (vicino a 0) soluzione di HCl è destinato per aumentare la solubilità del ferro. La lana di roccia viene utilizzata per impedire i gas di fuggire il flaconcino durante la masterizzazione.
- Pesare una fiala di scintillazione 20ml nuovo, sigillato senza coperchio. Prendere nota del valore o impostare il valore su zero utilizzando il tasto tare. Aggiungere i fogli secchi schiacciati (campione) nel flaconcino.
- Pesare il campione e il contenitore e prendere nota del valore. Chiudere la cuvetta con lana di roccia.
- Pesare 3 fiale aggiuntive senza aggiungere campioni e notare i loro valori. Queste fiale usarsi come controlli per valutare la quantità di lana di roccia che potrebbe condurre ad un aumento in peso del campione.
- Posizionare le fiale del campione e controllo in una fornace e avviare la masterizzazione utilizzando la seguente procedura di temperatura: temperatura ambiente, rapido aumento di 425 ° C e, infine, a 425° C per 4 ore. Entro questo tempo, le foglie secche si sono rivolti alla cenere.
- Lasciate raffreddare il campioni a circa 100 ° C, ma non sotto questa temperatura per i due passaggi seguenti evitare l'umidità, che potrebbe pregiudicare il peso finale del campione. Utilizzando guanti pesanti, rimuovere i campioni dalla fornace con le pinzette, tenendo il flaconcino esteriormente.
- Posizionare le fiale su una superficie piana, rimuovere la lana di roccia e chiudere i flaconi con i loro coperchi originali.
- Pesare le fiale di 3 controllo (Vedi 3.3) e calcolare il loro guadagno di peso medio. Se l'aumento di peso è uguale o superiore all'1% del peso della cenere (Vedi punto 4.2), utilizzare questo valore come una stima dell'errore di misurazione.
4. preparare le ceneri per la misura di ferro
Note: La concentrazione di ferro finale nel campione iniziale viene calcolata come il peso delle ceneri diviso per il volume aggiunto di HCl.
- Preparare una soluzione di HCl 1 M (4% HCl) con l'aggiunta di 12,5 mL di una soluzione madre di HCl 37% a 87,5 mL di DDW (in un fiasco di vetro o plastica).
- Pesare un tubo di plastica da 15 mL e prendere nota del valore o impostare il valore su zero utilizzando il tasto tare. Trasferire le ceneri sul tubo, pesare e prendere nota del valore. Questo è il peso di cenere.
- Aggiungere 5 mL di 1 M HCl per le ceneri. Le ceneri filtrare su un filtro 22 µm e aggiungere un ulteriore 5 mL di 1 M HCl attraverso lo stesso filtro.
- Il volume finale deve essere di 10 mL. Si noti che parte della soluzione sarà perso nel filtro.
Nota: I campioni sono ora pronti per la misurazione di Fe FAAS oppure dal metodo blu di Prussia. - Fare una curva di calibrazione con la concentrazione di Fe misurata mediante Spettrometria atomica e dal metodo prussiano blu (Vedi Figura 4) per ogni specie di pianta. Successivamente, concentrazione di Fe può essere misurata con il metodo prussiano blu da solo.
5. misurazione della concentrazione di Fe da FAAS
- Rimuovere da 4 mL di ogni campione per la misura di FAAS.
- Dividere i risultati ottenuti dalla misurazione FAAS dal peso delle ceneri. Dividere il valore risultante da 0,01 (perché le ceneri erano solubilizzate in 10 mL). Il valore risultante è la concentrazione di ferro per grammo cenere (ppm).
6. preparare il blu di Prussia macchiatura soluzione
- Preparare un 4% soluzione di blu di Prussia con l'aggiunta di 4 g di K4Fe(CN)6 a 100 mL DDW e vortice (altri volumi e/o concentrazioni possono essere utilizzate per diverse esigenze). Si noti che in questo studio, un meno concentrata soluzione blu di Prussia che è stato utilizzato precedentemente segnalati (20%)14 .
- Mantenere la soluzione al buio a 4 ° C fino all'utilizzo. La soluzione è stabile per 6 mesi se conservato a tali condizioni.
7. generazione di una curva di calibrazione per il metodo di blu di Prussia utilizzando FAAS risultati
Nota: Calcolare la concentrazione di ferro nella cenere utilizzando la seguente formula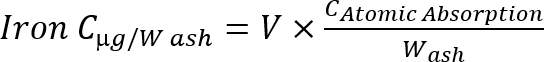 Equazione 1
Equazione 1
C: concentrazione, v: volume, peso di w: cenere (g) del campione.
- Mescolare 0,50 mL di soluzione di blu di Prussia e 0,50 mL di 1 M HCl. Questo servirà come la soluzione vuota.
- Mescolare 0,5 mL di campione (ceneri nel 4% HCl, come descritto nella sezione 3) e 0,5 mL di soluzione di blu di Prussia (punto 6.1) di pipettaggio. Attendere almeno 1 minuto, ma non più di 5 minuti. Dopo 5 minuti, si verificherà la sedimentazione nei campioni.
- Trasferire il mix in una cuvetta e misurare il diametro esterno a 715 nm utilizzando uno spettrofotometro. Prendere nota del valore.
- Dividere il valore di OD (punto 7.3) per il peso della cenere (punto 3.2) del campione. Il risultato rappresenta OD al grammo cenere.
- Tracciare la regressione lineare fra le concentrazioni di ferro ottenuti da misurazioni FAAS (asse Y) e i valori di OD (asse X). Utilizzare i risultati ottenuti ai punti 5.2 e 7.4. Calcolare la formula di regressione, Y = a + bX, dove Y rappresenta la concentrazione di ferro, una rappresenta l'assorbanza si intersecano, b rappresenta la pendenza di assorbanza e X rappresenta il OD.
8. utilizzando il metodo di blu di Prussia per determinare i livelli di ferro in altri campioni provenienti dallo stesso tipo di pianta
Note: Dal momento che una curva di taratura è già stata stabilita per questo tipo di pianta, concentrazione di ferro in qualsiasi nuovi campioni provenienti dallo stesso tipo di pianta può essere direttamente calcolato utilizzando la formula di regressione lineare.
- Eseguire i passaggi nelle sezioni 3 e 4, seguita da passaggi 7.1 a 7.4.
- Calcolare la concentrazione di ferro in soluzione mediante la formula ottenuta dalla regressione lineare (punto 7.5).
Risultati
Quando questo protocollo viene eseguito correttamente, si dovrebbe avere ottima correlazione tra i risultati ottenuti con i metodi di spettroscopia atomica e blu di Prussia. Pertanto, il metodo blu di Prussia può essere facilmente utilizzato per ottenere una misurazione accurata della concentrazione di ferro in campioni di piante, come risulta il seguente esperimento.
Piante di tabacco erano cresciute come descritto nel protoco...
Discussione
Misurazione di ferro nei tessuti vegetali è molto importante per la valutazione degli effetti di irrigazione o altre condizioni ambientali. Qui, abbiamo descritto un metodo colorimetrico facile e preciso per la misurazione del contenuto Fe in foglie di tabacco, che può essere facilmente adattato ad altre specie di piante e tessuti.
Nell'ottimizzazione delle condizioni per il metodo colorimetrico, abbiamo usato un mezzo a basso pH (pH < 1.0) per consentire la solubilità del ferro. Il process...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato da l'Israele Ministero della scienza, tecnologia e progettuali da una sovvenzione del Chief Scientist del Ministero israeliano dell'agricoltura (n. 16-16-0003).
Materiali
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Riferimenti
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon