Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode colorimétrique pour mesurer la teneur en fer chez les plantes
Dans cet article
Résumé
Nous présentons un protocole simple et fiable pour mesurer la teneur en fer dans les tissus végétaux à l’aide de la méthode colorimétrique de bleu de Prusse.
Résumé
Fer, l’un des plus importants micronutriments dans les organismes vivants, est impliqué dans les procédures de base, comme la respiration et la photosynthèse. Teneur en fer est plutôt faible dans tous les organismes, s’élevant dans les usines à environ 0,009 % du poids sec. A ce jour, une des méthodes plus précis pour mesurer la concentration de fer dans les tissus végétaux est flamme Spectroscopie atomique. Toutefois, cette approche est long et coûteux et nécessite du matériel spécifique ne trouve pas couramment dans les laboratoires de l’usine. Par conséquent, il faut une méthode plus simple, et pourtant précise qui peut être utilisée de façon routinière. La méthode colorimétrique de bleu de Prusse est régulièrement utilisée pour fer qualitative de coloration dans les coupes histologiques animales et végétales. Dans cette étude, nous avons adapté la méthode pour des mesures quantitatives de fer dans le tabac rend de bleu de Prusse. Nous avons validé la précision de cette méthode en utilisant la spectroscopie atomique et bleu de Prusse pour mesurer la teneur en fer dans les mêmes échantillons et a constaté une régression linéaire (R2 = 0,988) entre les deux procédures. Nous concluons que la méthode de bleu de Prusse pour la mesure quantitative de fer dans les tissus végétaux est précis, simple et peu coûteux. Toutefois, la régression linéaire présentée ici peut ne pas convenir à autres espèces végétales, en raison des interactions entre l’échantillon et le réactif. Mise en place d’une courbe de régression est donc nécessaire pour différentes espèces de plantes.
Introduction
Fer (Fe) est un oligo-élément important dans tous les organismes vivants. Chez les plantes, c’est un oligo-élément essentiel1 en raison de son implication dans les procédures de base, tels que de la biosynthèse de la respiration, de la photosynthèse et de la chlorophylle. Forte accumulation d’ions de fer libre est-il dangereux pour planter des cellules en raison de réactions aboutissant à la libération de radicaux libres provoquant le stress oxydatif. Pour maintenir l’homéostasie du fer dans la cellule végétale, les ions sont stockées dans les vacuoles et séquestrées dans les Ferritines, cages de protéines directement impliqués dans de l’homéostasie du fer2 et la structure de stockage principal de fer dans tous les organismes vivants. Dans le même temps, l’anémie ferriprive affecte une proportion importante de la population humaine, ce qui entraîne un besoin croissant de plante biofortification Fe. En raison des propriétés uniques de ferritine de plante, l’enrichissement alimentaire avec ferritine-fer vous propose une stratégie prometteuse pour lutter contre ce problème de malnutrition3.
Les ions de fer sont principalement trouvées dans deux États d’oxydation, à savoir les ferreux (bivalent Fe2 + ou fer (II)) et ferrique (trivalent Fe3 + ou fer (III)) formes. Plusieurs autres formes de fer, tels que les amas de fer4, se trouvent également dans les cellules. Fe est stocké sous forme d’oxyde de fer au sein de la cellule et naturellement hématites de formes (Fe2O3) et ferryhidrites ((Fe3 +)2O3•0.5 H2O) sous des conditions physiologiques5. Les hydroxydes formés dans ces réactions, en particulier la forme ferrique, ont très peu solubles. Rétention du fer est par conséquent affectée par le pH de la solution et est en grande partie à l’État solid au-dessus de pH 56.
Compte tenu de la faible solubilité et de la forte réactivité de Fe, son transfert chez les tissus végétaux et organes doit être associé à des molécules chélateurs adaptés. En outre, ses États d’oxydo-réduction entre les formes de métaux ferreux et ferrique1 doivent être contrôlées. Dans les feuilles, environ 80 % du fer se trouve dans les cellules photosynthétiques, en raison de son rôle essentiel dans le système de transport des électrons, dans la biosynthèse des cytochromes, de chlorophylle et d’autres molécules d’hème et la formation de Fe-S de clusters7. Dans le cas de fer excédentaire au sein de la cellule, l’excédent est transloqué dans la vacuole où le métal est stocké dans des molécules de ferritine8.
Fer peut être mesurée dans les tissus végétaux par plusieurs méthodes, y compris flame atomic absorption spectroscopy9 (FAAS) ou les dosages colorimétriques10, le premier étant beaucoup plus précis que ce dernier. FAAS est une technique très précise qui permet de déterminer la composition élémentaire d’un échantillon sur la base de l’émission électromagnétique de chaque élément. FAAS convertit des ions métalliques en États atomiques par flamme-chauffage de l’échantillon, qui mène à ion excitation et d’émission d’une longueur d’onde spécifique quand un ion donné retourne à son état fondamental. Les émissions produites par les différents ions sont séparés par un monochromateur et détectés par un capteur d’absorption11. FAAS sert ainsi de quantifier directement les concentrations de fer. Autres techniques de visualisation de fer dans les tissus biologiques sont toutefois disponibles. 12 de la spectroscopie de masse à plasma inductif (ICP-MS) est une technique très précise pour la mesure de fer et autres oligo-éléments, mais le manque d’équipement, aussi bien pour FAAS et ICP-MS, est un problème commun. En revanche, mesure du fer par le thiocyanate colorimétrie13 manque de précision et ne parvient pas à détecter de légères variations entre les échantillons. Bleu de Prusse coloration14,15,16,17 est une méthode indirecte basée sur la réaction du ferrocyanure ferrique de potassium (K4Fe(CN)6) avec les cations Fe, produisant une forte couleur bleue et est utilisé pour la détection qualitative de fer dans les coupes histologiques des tissus animaux et végétaux.
Le fer métallique (zérovalent) est rare dans la lithosphère. La forme ionique non complexée dominante du fer dans l’environnement est principalement dictée par la quantité d’oxygène dans les environs, avec le fer ferreux étant relativement plus abondantes dans les milieux anoxiques et fer ferrique prédomine dans les sites aérobies. Cette dernière forme est dominante dans des environnements extrêmement acides, aussi bien que les agents causals de l’oxydation du fer ferreux diffèrent souvent dans un environnement anoxique et acide18. Quand le fer est solubilisé dans 4 % HCl (pH 0) dans un milieu aérobie, la majeure partie du fer dilué existe comme le ferrique (Fe3 +)19,20.
La réaction entre les ions Fe et K4Fe(CN)6 est les suivantes :
Fe3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2 K4Fe(CN)6 = Fe4(Fe(CN)6)2 + 8 KCl
Dans la présente étude, nous avons demandé si la coloration bleu de Prusse peut être utile pour mesurer les concentrations de fer dans une solution.
Au départ, nous avons vérifié la corrélation entre la concentration de Fe en solution aqueuse et coloration bleu de Prusse. La concentration de Fe (comme FeCl2, FeCl3 ou un mélange de 1:1 des deux) en solution aqueuse a été mesurée par spectroscopie atomique et par absorbance (do) après l’ajout de bleu de Prusse. La figure 1 montre les courbes de régression linéaire pour les mesures obtenues par chaque méthode. Nous avons conclu que le bleu de Prusse méthode peut être utilisé pour l’analyse quantitative de la concentration de fer dans la solution.
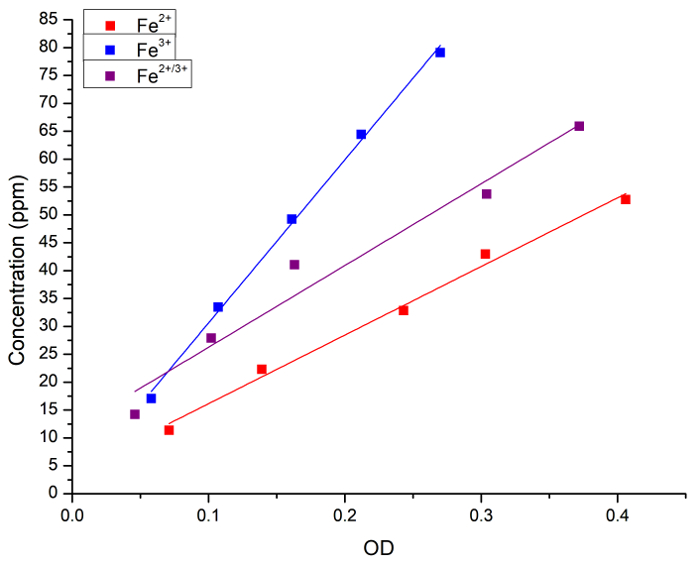
Figure 1 : les régressions linéaires entre concentration Fe mesurée par FAAS et absorbance légère (OD, 715 nm) obtenus par la méthode de bleue de Prusse. La ligne et les cases bleues représentent la solution de Fe2 + , la ligne et les carrés rouges représentent la solution de Fe3 + et les carrés noirs et ligne représentent un mélange de 1:1 entre Fe2 + et Fe3 +. Les régressions suivantes ont été obtenues : [Fe2 +] = 3 + 123 x OD, r = 0,996, R2 = 0,989 ; [Fe3 +] = 1 + 292 x OD, r = 0,999, R2 = 0,997 ; et [Fe2 + / 3 +] = 11 + 146 x OD, r = 0,983, R2 = 0,956. Le Fe2 + donneur était FeCl2 et le Fe3 + donneur était FeCl3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Pour adapter la méthode colorimétrique de bleue de Prusse pour l’analyse quantitative de fer des tissus végétaux, la teneur en fer des cendres de feuilles de tabac a été mesurée par spectroscopie atomique de flamme d’absorption et de coloration bleu de Prusse. Il y avait de bonne corrélation entre les résultats de par les deux techniques.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. matériel et Conditions de croissance des plantes
- Semences d’un tabac (cultivar Samsun) par pot de 5 cm x 5 cm rempli de moyen pot standard. Placez les pots sur des plateaux. Cultiver les plantes dans une chambre de croissance dans des conditions de longue journée (16/8 h de lumière/obscurité) à une température constante de 23 ° C. Irriguer avec l’eau du robinet jusqu'à ce que les drains de l’eau dans le pot.
- Après 50±5 jours, commencer les traitements de Fe dans l’irrigation, selon les concentrations appropriées pour l’expérience. Par exemple, nous avons utilisé une gamme de concentrations de fer de 0 à 6 mM, complété par un chélateur soluble de Fe (Fe EDDHA). Arroser les plantes avec la solution appropriée tous les deux jours (pour éviter la déshydratation) pendant 6 à 8 jours.
2. préparer les feuilles pour la mesure de fer
Remarques : Tous les matériaux à utiliser doivent être exempt de fer afin de réduire le risque de contamination de fer. Nettoyer le mortier et pilon deux fois avec une solution de HCl de 4 % et les sécher avec du papier filtre chaque fois avant de l’utiliser. Si n’importe quel matériel est réutilisé, nettoyez-le deux fois avec une solution de HCl de 4 % et les sécher avec du papier filtre.
- Détacher les feuilles de la tige à la main, à l’aide de gants (ne pas utiliser n’importe quel matériel métallique). Utilisez environ 10 g de feuilles (poids frais) pour chaque échantillon. Nettoyer chaque feuille avec l’eau bidistillée (DDW) à l’aide d’un vaporisateur. Cette étape est importante pour éviter la contamination de Fe.
- Sécher les feuilles sur du papier absorbant et mettez-les dans un sac en papier. Transférer les sacs en papier dans une étuve à une température constante de 80 ° C pendant 2-3 jours.
- Une fois sec, écraser les feuilles en poudre à l’aide d’un mortier et un pilon et un transfert de tubes en plastique stérile de 15 mL.
3. brûler les feuilles de frêne
Note : L’utilisation d’une solution de pH faible (proche de 0) de HCl est censée augmenter la solubilité du fer. La laine de roche est utilisée pour empêcher les gaz de s’échapper le flacon durant la combustion.
- Peser un flacon à scintillation de nouveau, scellées 20 mL sans son couvercle. Notez la valeur ou la valeur à zéro en utilisant le bouton de tare. Ajouter les feuilles séchées écrasées (échantillon) dans le flacon.
- Peser l’échantillon et le récipient et noter la valeur. Fermer le flacon avec de la laine de roche.
- Peser 3 flacons supplémentaires sans ajout d’échantillons et noter leurs valeurs. Ces flacons servira comme témoins pour évaluer la quantité de laine de roche qui aurait pu conduire à une augmentation de poids de l’échantillon.
- Placer les flacons d’échantillon et témoin dans un four et commence à brûler les étapes suivantes de la température : température ambiante, une augmentation rapide à 425 ° C et, enfin, 425° C pendant 4 heures. À cette époque, les feuilles sèches seront sont tournés vers ash.
- Laisser refroidir les échantillons jusqu'à environ 100 ° C, mais pas cette température pendant les deux étapes suivantes afin d’éviter l’humidité, qui pourrait affecter le poids final de l’échantillon. En utilisant des gants épais, enlever les échantillons de la fournaise avec des pincettes, en tenant le flacon extérieurement.
- Placer les fioles sur une surface plane, enlever la laine de roche et fermer les flacons avec leurs couvercles originales.
- Peser les 3 flacons (voir 3.3) et calculer leur gain de poids moyen. Si le gain de poids est égal ou supérieur à 1 % de la masse de cendres (Voir l’étape 4.2), utiliser cette valeur comme une estimation de l’erreur de mesure.
4. préparer les cendres pour la mesure de fer
Notes : La concentration de fer final dans l’échantillon initial est calculée comme le poids des cendres divisée par le volume supplémentaire de HCl.
- Préparer une solution de HCl 1 M (4 % HCl) en ajoutant 12,5 mL d’une solution mère de chlorhydrate de 37 % à 87,5 mL de DDW (dans une fiole en plastique ou en verre).
- Peser un tube en plastique de 15 mL et notez la valeur ou la valeur à zéro en utilisant le bouton de tare. Transférer les cendres au tube, peser et notez la valeur. C’est le poids de cendres.
- Ajouter 5 mL de 1 M HCl dans les cendres. Les cendres du filtre par un filtre 22 µm et ajouter 5 mL d’HCl de M 1 supplémentaire à travers le même filtre.
- Le volume final devrait être de 10 mL. Notez que la partie de la solution se perdra dans le filtre.
NOTE : Les échantillons sont maintenant prêts pour la mesure de Fe FAAS ou par la méthode de bleu de Prusse. - Faire une courbe d’étalonnage la concentration Fe mesurée par spectrométrie atomique et de la méthode de bleue de Prusse (voir Figure 4) pour chaque espèce végétale. Par la suite, la concentration Fe peut être mesurée par la méthode de bleue de Prusse seule.
5. mesure de la Concentration de Fe par FAAS
- Prélever 4 mL de chaque échantillon pour la mesure de FAAS.
- Divisez les résultats obtenus par la mesure de FAAS par le poids des cendres. Diviser la valeur obtenue par 0,01 (parce que les cendres sont solubilisées dans 10 mL). La valeur résultante est la concentration de fer par gramme de cendres (ppm).
6. préparer la Solution de coloration de bleu de Prusse
- Préparer un 4 % solution de bleue de Prusse en ajoutant 4 g de K4Fe(CN)6 à 100 mL DDW et vortex (autres volumes et/ou des concentrations peuvent être utilisées pour différentes demandes). Il est à noter que dans cette étude, moins concentré solution de bleue de Prusse celui utilisé précédemment signalés (20 %)14 .
- Conserver la solution dans l’obscurité à 4 ° C jusqu'à l’utilisation. La solution est stable pendant 6 mois à ces conditions.
7. générer une courbe d’étalonnage de la méthode de bleu de Prusse à l’aide de résultats FAAS
Remarque : Calculer la concentration de fer dans les cendres à l’aide de la formule suivante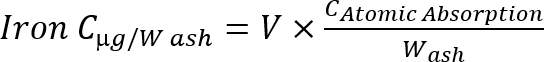 Équation 1
Équation 1
C: concentration, v : volume d’échantillon, w : ash poids (g).
- Mélanger 0,50 mL de solution de bleue de Prusse et 0,50 mL de 1 HCl de M. Ce sera la solution.
- Mélangez 0,5 mL d’échantillon (cendres dans 4 % HCl, tel que décrit à l’article 3) et 0,5 mL de solution de bleue de Prusse (étape 6.1) par pipetage. Attendre au moins 1 minute, mais pas plus de 5 minutes. Après 5 minutes, la sédimentation dans les échantillons se produira.
- Transférer le mélange dans une cuvette et mesurer le diamètre extérieur à 715 nm à l’aide d’un spectrophotomètre. Notez la valeur.
- Divise la valeur de l’OD (étape 7.3) par le poids de cendres (étape 3.2) de l’échantillon. Le résultat représente OD par gramme de cendres.
- Tracer la régression linéaire entre la concentration de fer obtenu à partir des mesures FAAS (axe Y) et les valeurs de l’OD (axe X). Utiliser les résultats obtenus lors des étapes 5,2 et 7,4. Calculer la formule de régression, Y = a + bX, où Y représente la concentration de fer, a représente l’absorbance se croisent, b représente la pente de l’absorbance et X représente la Division d’opposition.
8. à l’aide de la méthode de bleu de Prusse pour déterminer les concentrations de fer dans les autres échantillons d’un même Type de plante
Notes : Car une courbe d’étalonnage a déjà été établie pour ce type de plante, concentration de fer dans les tout nouveaux échantillons d’un même type de plante peut être directement calculée à l’aide de la formule de régression linéaire.
- Suivez les étapes dans les sections 3 et 4, suivie de mesures 7.1 à 7.4.
- Calculer la concentration de fer dans une solution à l’aide de la formule obtenue de la régression linéaire (étape 7,5).
Access restricted. Please log in or start a trial to view this content.
Résultats
Lorsque ce protocole est effectué correctement, on devrait obtenir excellente corrélation entre les résultats obtenus par les méthodes de Spectroscopie atomique et du bleu de Prusse. Par conséquent, la méthode de bleue de Prusse facilement utilisable pour obtenir une mesure précise de la concentration de fer dans des échantillons de végétaux, comme en témoigne l’expérience suivante.
Plants de tabac ont été cultiv...
Access restricted. Please log in or start a trial to view this content.
Discussion
Mesure du fer dans les tissus végétaux est très important pour évaluer les effets d’irrigation ou d’autres conditions environnementales. Ici, nous avons décrit une méthode colorimétrique facile et précise pour la mesure de contenu Fe dans les feuilles de tabac, qui peut être facilement adaptée à d’autres espèces végétales et les tissus.
En optimisant les conditions de la méthode colorimétrique, nous avons utilisé un milieu à pH faible (pH < 1,0) pour permettre la solubi...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’Israel Ministry of Science, la technologie et l’étalement par une subvention de l’expert scientifique en chef du ministère israélien de l’Agriculture (#16-16-0003).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Références
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M. Soils and soil fertility. Louis, M., Troeh, F. R., Thompson, L. M. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- JoVE Science Education Database. Analytical Chemistry. Calibration Curves. , Journal of Visualized Experiments. Cambridge, MA. Available from: https://www.jove.com/science-education/10188/calibration-curves (2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon