É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método colorimétrico para medir o teor de ferro nas plantas
Neste Artigo
Resumo
Apresentamos um protocolo simples e confiável para medir o teor de ferro em tecidos vegetais usando o método colorimétrico do azul da Prússia.
Resumo
Ferro, dentre os mais importantes micronutrientes em organismos vivos, está envolvido em processos básicos, tais como a respiração e a fotossíntese. Teor de ferro é bastante baixo em todos os organismos, que se elevam em plantas para cerca de 0,009% do peso seco. Até à data, um dos métodos mais precisos para medir a concentração de ferro nos tecidos da planta é chama espectroscopia de absorção atômica. No entanto, esta abordagem é demorado e caro e requer equipamento específico não comumente encontrado em laboratórios da planta. Portanto, um método mais simples, mas preciso que pode ser usado rotineiramente é necessária. O método colorimétrico do azul da Prússia é usado regularmente para ferro qualitativo em cortes histológicos animais e vegetais de coloração. Neste estudo, adaptamos o método para medições quantitativas de ferro no tabaco deixa o azul da Prússia. Nós validado a precisão deste método usando espectroscopia atômica e azul da Prússia coloração para medir o teor de ferro nas mesmas amostras e encontrou uma regressão linear (R2 = 0.988) entre os dois processos. Concluímos que o método azul da Prússia para medição quantitativa de ferro nos tecidos da planta é preciso, simples e barato. No entanto, a regressão linear apresentada aqui pode não ser apropriada para outras espécies de plantas, devido a possíveis interações entre a amostra e o reagente. Estabelecimento de uma curva de regressão, portanto, é necessária para diferentes espécies de plantas.
Introdução
Ferro (Fe) é um micronutriente importante em todos os organismos vivos. Em plantas, é um micronutriente essencial1 por causa de seu envolvimento em processos básicos, tais como respiração, fotossíntese e a clorofila biossíntese. Alta acumulação de íons de ferro livre é prejudicial às células devido a reações, levando à liberação de radicais livres, causando estresse oxidativo vegetais. Para manter a homeostase de ferro dentro da célula vegetal, íons são armazenadas em vacúolos e sequestrados dentro ferritins, gaiolas de proteína diretamente envolvidas na homeostase de ferro2 e a estrutura de armazenamento principal de ferro em todos os organismos vivos. Ao mesmo tempo, a anemia por deficiência de ferro afeta uma proporção significativa da população humana, resultando em uma crescente necessidade de planta Fe biofortificação. Devido as propriedades únicas de ferritina de planta, enriquecimento de alimentos com ferro-ferritina oferece uma promissora estratégia para combater este problema de desnutrição de3.
Íons de ferro são principalmente encontrados em dois Estados de oxidação, ou seja, o ferrosos (divalentes Fe2 + ou ferro (II)) e férrico (trivalente Fe3 + ou ferro (III)) formas. Várias outras formas de ferro, tais como aglomerados de ferro4, também são encontradas nas células. Fe é armazenado como óxido de ferro dentro da célula e, naturalmente, hematita formas (Fe2O3) e ferryhidrites ((Fe3 +)2O30,5 H2O) sob condições fisiológicas5. Os hidróxidos formados nessas reacções, especialmente o formulário férrico, têm muito baixa solubilidade. Retenção de ferro é consequentemente afetada pelo pH da solução e é em grande parte em um estado sólido acima de pH 56.
Considerando o pobre solubilidade e alta reatividade de Fe, sua transferência entre tecidos vegetais e órgãos deve ser associada com moléculas quelantes apropriadas. Além disso, seus Estados de redox entre os formulários ferroso e férrico1 devem ser controlados. Dentro de folhas, cerca de 80% do ferro é encontrado nas células fotossintéticas, devido à suas funções essenciais no sistema de transporte de elétrons, na biossíntese de citocromos, clorofila e outras moléculas de heme e na formação de Fe-S7de clusters. No caso de ferro em excesso dentro da célula, o excedente é translocado para o vacúolo, onde o metal é armazenado em moléculas de ferritina8.
Ferro pode ser medido em tecidos vegetais por vários métodos, incluindo chama absorção atômica espectroscopia9 (faby) ou ensaios colorimétricos10, o primeiro sendo muito mais precisos do que o último. Faby é uma técnica de alta precisa que permite que se determine a composição elementar de uma amostra com base a emissão eletromagnética dos elementos individuais. Faby converte íons metálicos para Estados atômicos, flama-aquecimento da amostra, levando a excitação do íon e a emissão de um comprimento de onda específico quando um determinado íon retorna ao seu estado fundamental. As emissões de íons de diferentes são separadas por um monocromador e detectadas por um sensor de absorção11. Faby, portanto, serve para quantificar diretamente as concentrações de ferro. Outras técnicas para a visualização de ferro nos tecidos biológicos são, no entanto, disponíveis. Espectroscopia de massa de plasma indutivamente acoplado (ICP-MS)12 é uma técnica muito precisa para medição de ferro e outros oligoelementos, mas a falta de equipamento, tanto para faby e ICP-MS, é um problema comum. Por outro lado, a medição de ferro por tiocianato colorimetria13 carece de precisão e falha detectar pequenas variações entre as amostras. Prussian blue coloração14,15,16,17 é um método indireto baseado na reação de férrico de ferrocianeto de potássio (K4Fe(CN)6) com cátions Fe, produzindo um cor azul forte e é utilizado para detecção qualitativa de ferro em cortes histológicos de tecidos animais e vegetais.
Ferro metálico (zero-valente) é raro na litosfera. A forma iônica não-complexado dominante de ferro no ambiente é ditada principalmente pela quantidade de oxigênio na atmosfera, com ferro ferroso, sendo relativamente mais abundantes em ambientes anóxica e ferro férrico, predominando em sites aeróbios. Esta última forma é também dominante em ambientes extremamente ácidas, embora os agentes causadores da oxidação de ferro ferroso diferem frequentemente em ambiente anóxico e ácido18. Quando o ferro é solubilizado em 4% HCl (pH 0) em um ambiente aeróbio, a maior parte do ferro diluído existe como forma a férrico (Fe3 +)19,20.
As reações entre íons de Fe e K4Fe(CN)6 são como segue:
Fe3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + K 24Fe(CN)6 =4(Fe(CN)6) de Fe2 + 8 KCl
No presente estudo, perguntamos se a coloração azul prussiano pode ser útil para medir os níveis de ferro na solução.
Inicialmente, verificamos que a correlação entre a concentração de Fe em solução aquosa e coloração azul prussiano. A concentração de Fe (como FeCl2, FeCl3 ou uma mistura de 1:1 dos dois) em soluções aquosas foi medida por espectroscopia atômica e pela absorvância (OD) após a adição de azul da Prússia. A Figura 1 mostra as curvas de regressão linear para as medições obtidas por cada método. Concluímos que o método Prussian blue pode ser usado para análise quantitativa da concentração de ferro na solução.
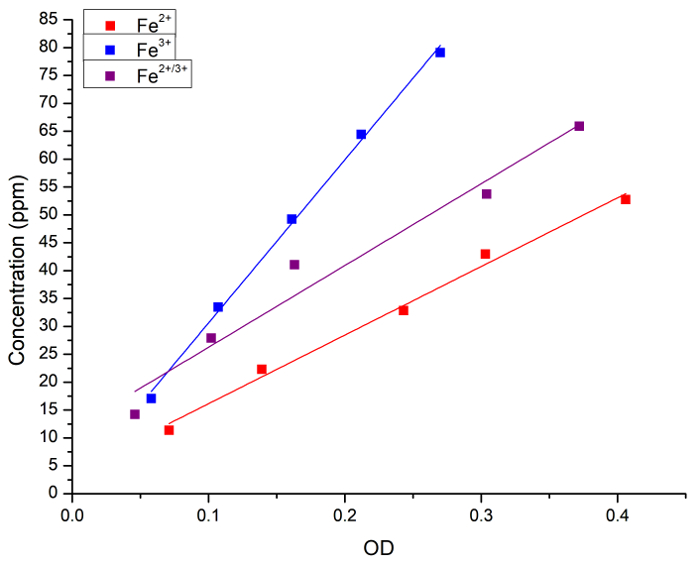
Figura 1: regressões lineares entre concentração de Fe medido por faby e absorbância de luz (OD, 715 nm) obtidos pelo método Prussian blue. Os quadrados azuis e linha representam a solução de Fe2 + , os quadrados vermelhos e linha representam a solução de Fe3 + e os quadrados pretos e linha representam uma mistura 1:1 entre Fe2 + e Fe3 +. Obtiveram-se as regressões a seguintes: [Fe2 +] = 3 + 123 x OD, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 OD x, r = 0.999, R2 = 0.997; e [Fe2 + 3 +] = 11 + 146 x OD, r = 0.983, R2 = 0.956. O Fe2 + doador era FeCl2 e o Fe3 + doador era FeCl3. Clique aqui para ver uma versão maior desta figura.
Para adaptar o método colorimétrico azul prussiano para análise quantitativa do ferro de tecidos vegetais, o teor de ferro de cinzas de folhas de tabaco foi medido por espectroscopia atômica de absorção de chama e coloração azul prussiano. Houve boa correlação entre os resultados pelas duas técnicas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Material e condições de crescimento da planta
- Sementes de um tabaco (cultivar Samsun) sementes por vaso de 5 cm x 5 cm cheio de médio padrão pot. Coloque os potenciômetros em bandejas. Crescem as plantas em uma sala de crescimento sob condições de dia longo (16/8 h claro/escuro) a uma temperatura constante de 23 ° C. Irrigue com água da torneira até drenos de água da panela.
- Depois de 50±5 dias, inicie tratamentos de Fe na irrigação, de acordo com as concentrações adequadas para o experimento. Por exemplo, usamos uma gama de concentrações de ferro, de 0 a 6 mM, complementado por um quelante de Fe solúvel (Fe EDDHA). Irriga as plantas com a solução adequada a cada dois dias (para evitar desidratação) por 6-8 dias.
2. preparar as folhas para medição de ferro
Notas: Todos os materiais a ser utilizado devem ser isento de ferro a fim de reduzir o risco de contaminação de ferro. Limpe o pilão duas vezes com solução de HCl de 4% e seque com papel de filtro cada vez antes de usar. Se qualquer material é reutilizado, limpe-o duas vezes com solução de HCl de 4% e seque com papel de filtro.
- Separe as folhas do tronco à mão, usando luvas (não utilize qualquer equipamento de metal). Use cerca de 10 g de folhas (peso fresco) para cada amostra. Limpe cada folha com água bidestilada (DDW) usando um frasco do pulverizador. Este passo é importante para evitar a contaminação de Fe.
- Seque as folhas em uma toalha de papel e colocá-los em um saco de papel. Transferi os sacos de papel para um forno a uma temperatura constante de 80 ° C durante 2-3 dias.
- Quando secar, esmaga as folhas em pó usando um almofariz e um pilão e transferência para tubos de plástico estéril 15 mL.
3. queimar as folhas em cinzas.
Notas: O uso da solução de HCl com pH baixo (perto de 0) destina-se a aumentar a solubilidade de ferro. A lã de rocha é usado para evitar que os gases escapem do frasco durante a queima.
- Pese um frasco de cintilação de novo e lacrado 20 mL sem tampa. Observe o valor ou defina o valor como zero utilizando o botão de Tara. Adicione as folhas secas esmagadas (amostra) para o frasco.
- Pesar a amostra e o recipiente e observe o valor. Feche o frasco com lã de rocha.
- Pesar 3 frascos adicionais sem adição de amostras e Observe seus valores. Estes frascos serão usados como controles para avaliar a quantidade de lã de rocha que poderia ter levado a qualquer aumento no peso de amostra.
- Coloque os frascos de amostra e controle em uma fornalha e começar a queimar usando as seguintes etapas de temperatura: temperatura ambiente, o rápido aumento de 425 ° C e, finalmente, a 425° C por 4 horas. Por esta altura, as folhas secas serão transformaram-se em cinzas.
- Deixe-o esfriar amostras até cerca de 100 ° C, mas não abaixo desta temperatura para as seguintes duas etapas evitar a umidade, que pode afetar o peso final da amostra. Usando luvas pesadas, remova as amostras da fornalha com uma pinça, segurando o frasco exteriormente.
- Colocar os frascos em uma superfície plana, remover a lã de rocha e fechar os frascos com as tampas originais.
- Pesar os frascos de 3 controle (ver 3.3) e calcular o seu ganho de peso médio. Se o ganho de peso é igual ou superior a 1% do peso da cinza (consulte a etapa 4.2), usar esse valor como uma estimativa do erro de medição.
4. preparar as cinzas para medição de ferro
Notas: A concentração final de ferro na amostra inicial é calculada como o peso das cinzas dividido pelo volume de HCl adicionado.
- Preparar uma solução de HCl 1 M (4% HCl) adicionando 12,5 mL de uma solução de HCl de 37% a 87,5 mL de DDW (em um frasco plástico ou vidro).
- Pesar um tubo plástico de 15 mL e observe o valor ou defina o valor como zero utilizando o botão de Tara. Transferir as cinzas para o tubo, pesar e observe o valor. Este é o peso das cinzas.
- Adicione 5 mL de 1 M de HCl para as cinzas. Filtrar as cinzas num filtro de 22 µm e adicionar um adicional 5 mL de 1 M de HCl através do mesmo filtro.
- O volume final deve ser de 10 mL. Note que o filtro vai perder parte da solução.
Nota: As amostras agora estão prontas para a medição de Fe faby ou pelo método azul da Prússia. - Faça uma curva de calibração com a concentração de Fe medida por espectrometria atômica e pelo método Prussian blue (ver Figura 4) para cada espécie de planta. Posteriormente, a concentração de Fe pode ser medida pelo método azul prussiano.
5. medir a concentração de Fe por faby
- Remova 4 mL de cada amostra para medição por faby.
- Divida os resultados obtidos com a medição de faby pelo peso das cinzas. Divida o valor resultante por 0,01 (porque as cinzas foram solubilizadas em 10 mL). O valor resultante é a concentração de ferro por grama cinza (ppm).
6. preparar a solução de coloração azul da Prússia
- Preparar um 4% solução Prussian blue adicionando 4 g de K4Fe(CN)6 a 100 mL DDW e vortex (outros volumes e/ou concentrações podem ser usadas para diferentes demandas). Note-se que neste estudo, um menos Prussian blue solução concentrada do que o utilizado anteriormente relatados (20%)14 .
- Manter a solução no escuro a 4 ° C até o uso. A solução é estável por 6 meses quando armazenado em tais condições.
7. gerando uma curva de calibração para o método azul da Prússia, usando resultados de faby
Nota: Calcular a concentração de ferro nas cinzas usando a seguinte fórmula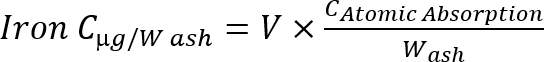 Equação 1
Equação 1
C: concentração, v: volume de amostra, w: peso das cinzas (g).
- Misture a 0,50 mL de solução de azul prussiano e 0,50 mL de 1 M de HCl. Isto servirá como solução em branco.
- Misturar 0,5 mL da amostra (cinzas em 4% HCl, conforme descrito na seção 3) e 0,5 mL de solução de azul prussiano (etapa 6.1) por pipetagem. Espere pelo menos 1 minuto, mas não mais de 5 minutos. Após 5 minutos, vai ocorrer sedimentação nas amostras.
- Transfira a mistura para uma cubeta e medir a D.O. a 715 nm, utilizando um espectrofotômetro. Observe o valor.
- Divida o valor de OD (passo 7.3) pelo peso das cinzas (passo 3.2) da amostra. O resultado representa OD por grama de cinzas.
- Plotar a regressão linear entre as concentrações de ferro obtidos a partir das medições de faby (eixo Y) e os valores de OD (eixo X). Use os resultados obtidos nas etapas 5.2 e 7,4. Calcular a fórmula de regressão, Y = a + bX, onde Y representa a concentração de ferro, um representa a absorvância se cruzam, b representa a inclinação de absorvância e X representa o OD.
8. usando o método azul da Prússia para determinar os níveis de ferro em outras amostras do mesmo tipo de planta
Notas: Uma vez que já foi estabelecida uma curva de calibração para este tipo de planta, concentração de ferro em qualquer novas amostras do mesmo tipo de planta pode ser diretamente calculada usando a fórmula de regressão linear.
- Execute as etapas nas seções 3 e 4, seguido por etapas 7.1 a 7.4.
- Calcule a concentração de ferro em solução usando a fórmula obtida a regressão linear (passo 7.5).
Access restricted. Please log in or start a trial to view this content.
Resultados
Quando este protocolo é realizado corretamente, um deve ficar excelente correlação entre os resultados obtidos com os métodos de espectroscopia atômica e azul prussiano. Portanto, o método Prussian blue pode ser facilmente usado para obter uma medição precisa da concentração de ferro em amostras de plantas, como refletido no seguinte experimento.
Plantas de tabaco foram cultivadas, conforme descrito no protocolo e irri...
Access restricted. Please log in or start a trial to view this content.
Discussão
Medição de ferro nos tecidos da planta é muito importante para avaliar os efeitos da irrigação ou outras condições ambientais. Aqui, descrevemos um método colorimétrico fácil e preciso para a medição de conteúdo Fe em folhas de tabaco, que podem ser facilmente adaptados para outras espécies de plantas e tecidos.
Na otimização de condições para o método colorimétrico, usamos um médio baixo pH (pH < 1.0) para permitir que a solubilidade de ferro. O processo de gravação foi...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Israel Ministério da ciência, tecnologia e espaço do Comitê o cientista-chefe do Ministério israelense da agricultura (#16-16-0003).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Referências
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M. Soils and soil fertility. Louis, M., Troeh, F. R., Thompson, L. M. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- JoVE Science Education Database. Analytical Chemistry. Calibration Curves. , Journal of Visualized Experiments. Cambridge, MA. Available from: https://www.jove.com/science-education/10188/calibration-curves (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados