Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein kolorimetrischen Verfahren zur Messung der Eisengehalt in Pflanzen
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen ein einfaches und zuverlässiges Protokoll zur Messung der Eisengehalt im Pflanzengewebe mit der kolorimetrischen Preußischblau-Methode.
Zusammenfassung
Eisen, eines der wichtigsten Mikronährstoffe in lebenden Organismen, engagiert sich in grundlegenden Prozesse, wie Atmung und Photosynthese. Gehalt an Eisen ist in allen Organismen, in Höhe von ca. 0,009 % Trockensubstanz in Pflanzen eher gering. Bis heute ist eine der genauesten Methoden zur Messung der Eisenkonzentration im Pflanzengewebe Flamme Absorption Atomspektroskopie. Aber dieser Ansatz ist zeitaufwändig und teuer und erfordert speziellen Geräte, die in Anlage Labors nicht häufig zu finden. Daher braucht man eine einfachere, aber genaue Methode, die routinemäßig eingesetzt werden kann. Die farbmetrische Preußischblau Methode wird regelmäßig für qualitative Eisen Färbung in Tier- und histologischen Abschnitte verwendet. In dieser Studie haben wir die Preußischblau Methode zur quantitativen Messungen des Eisens im Tabak Blätter angepasst. Wir überprüft die Genauigkeit dieser Methode mit Atomspektroskopie und Preußischblau beflecken, zum Messen der Eisengehalt in den gleichen Proben und fand eine lineare Regression (R2 = 0.988) zwischen den beiden Verfahren. Wir schlussfolgern, dass die Preußischblau Methode zur quantitativen Eisen-Messung im Pflanzengewebe präzise, einfach und kostengünstig ist. Die lineare Regression, die hier vorgestellten möglicherweise jedoch nicht geeignet für andere Pflanzenarten, wegen möglicher Wechselwirkungen zwischen der Probe und Reagenz. Einrichtung einer Regression Kurve benötigt somit für verschiedene Pflanzenarten.
Einleitung
Eisen (Fe) ist ein wichtiger Mikronährstoff in allen lebenden Organismen. In Pflanzen ist es ein wesentlicher Mikronährstoff-1 wegen seiner Beteiligung an grundlegenden Prozesse, wie Atmung, Photosynthese und Chlorophyll Biosynthese. Hohe Ansammlung von freien Eisenionen ist schädlich für die Pflanzenzellen durch Reaktionen führt zur Freisetzung von freien Radikalen verursacht oxidativen Stress. Um Eisen in der Pflanzenzelle Homöostase sind Ionen in Vakuolen gespeichert und innerhalb Ferritins, Protein Käfige direkt beteiligt sind Eisen-Homöostase-2 und der wichtigsten Speicherstruktur von Eisen in allen lebenden Organismen abgesondert. Zur gleichen Zeit betrifft Eisenmangel Anämie einen Großteil der menschlichen Bevölkerung, was zu einem steigenden Bedarf an Anlage Fe biofortifikation. Aufgrund der einzigartigen Eigenschaften der Pflanze Ferritin bietet Essen Anreicherung mit Ferritin-Eisen eine vielversprechende Strategie zur Bekämpfung dieses Problems der Unterernährung3.
Eisen-Ionen sind hauptsächlich gefunden in zwei Oxidationsstufen, nämlich dem Eisen (zweiwertigen Fe2 + oder Eisen (II)) und Eisen (dreiwertiges Fe3 + oder Eisen (III)) Formen. Verschiedene andere Formen von Eisen, z. B. Eisen-Cluster4, finden sich auch in den Zellen. FE wird gespeichert als Eisenoxid innerhalb der Zelle und natürlich Formen Hematites (Fe2O3) und Ferryhidrites ((Fe3 +)2O3•0.5 H2O) unter physiologischen Bedingungen5. Die hydroxide gebildet in diesen Reaktionen, vor allem Eisen Form, haben sehr geringe Löslichkeit. Eisen-Aufbewahrung richtet sich daher nach den pH-Wert der Lösung und ist weitgehend in einen festen Zustand über pH 5-6.
Angesichts der schlechten Löslichkeit und hohe Reaktivität der Fe muss die Übertragung unter den pflanzlichen Geweben und Organen geeignete Komplexbildner Moleküle zugeordnet werden. Darüber hinaus müssen die Redox-Staaten zwischen dem Eisen und Eisen Formen1 gesteuert werden. In Blätter etwa 80 % des Eisens findet sich in photosynthetischen Zellen durch seine wesentliche Rollen in das elektronentransportsystem, bei der Biosynthese von Zellfarbstoffe, Chlorophyll und anderen Häm-Moleküle, und bei der Bildung von Fe-S-Cluster7. Im Falle von Eisen Übermaß innerhalb der Zelle ist der Überschuss in die Vakuole umgesiedelt, wo das Metall in Ferritin-Moleküle8gespeichert ist.
Eisen kann durch mehrere Methoden, einschließlich Flamme Atom-Absorptions-Spektroskopie9 (FAAS) oder farbmetrische Assays10, das ehemalige sein viel präziser als die letzteren in Pflanzengeweben gemessen werden. FAAS ist eine hochpräzise Technik, mit der man die elementare Zusammensetzung einer Probe auf der Grundlage der elektromagnetischen Emissionen der einzelnen Elemente bestimmen kann. FAAS konvertiert Metallionen in Zustände durch Flamme erhitzen der Probe, was zu Ionen-Anregung und Emission einer bestimmten Wellenlänge, wenn eine bestimmte Ion in seinem Grundzustand zurückkehrt. Die Emissionen aus den verschiedenen Ionen sind getrennt durch einen Monochromator und durch Absorption Sensor11erkannt. FAAS dient somit direkt Eisen-Konzentrationen zu quantifizieren. Andere Techniken zur Visualisierung von Eisen in biologischen Geweben sind jedoch verfügbar. Induktiv-gekoppelte Plasma-Massenspektrometrie (ICP-MS)12 ist eine sehr präzise Technik zur Messung von Eisen und anderen Spurenelementen, sondern der Mangel an Ausrüstung, sowohl für FAAS und ICP-MS, ist ein häufiges Problem. Auf der anderen Seite Eisen Messung von Thiocyanat Farbmetrik13 nicht präzise genug und nicht geringe Schwankungen zwischen Proben erkennt. Preußischen blaue Färbung14,15,16,17 ist eine indirekte Methode basiert auf der Reaktion von dreiwertigem Kaliumferrocyanid (K4Fe(CN)6) mit Fe-kationen, produzieren ein starke blaue Farbe, und dient zur qualitativen Eisen-Erkennung in histologischen Abschnitten von tierischen und pflanzlichen Geweben.
Metallic (null-Valent) Eisen ist selten in der Lithosphäre. Die dominierende nicht komplexiert Ionische Form des Eisens in der Umgebung richtet sich vor allem durch die Menge an Sauerstoff in der Umgebung mit Eisen Eisen als relativ häufiger in anoxischen Umgebungen und dreiwertigem Eisen überwiegt in aeroben Websites. Diese letztere Form ist auch in extrem sauren Umgebungen, dominierend, obwohl die Erreger der eisenhaltige Eisenoxidation oft in anoxischen und sauren Umgebung18unterscheiden. Wenn Eisen ist in 4 % solubilisiert HCl (pH 0) in einer aeroben Umgebung, der Großteil der verdünnten Eisen vorhanden ist, als das Eisen (Fe3 +)19,20bilden.
Die Reaktionen zwischen Fe-Ionen und K4Fe(CN)6 lauten wie folgt:
FE3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
FE2 +: 4 FeCl2 + 2 K4Fe(CN)6 Fe4(Fe(CN)6)2 + 8 = KCl
In der vorliegenden Studie fragten wir ob preußischen Blaufärbung zur Messung der Eisengehalt in Lösung nützlich sein kann.
Wir überprüft zunächst die Korrelation zwischen der Konzentration von Fe in wässriger Lösung und preußischen Blaufärbung. Die Fe (als FeCl2, FeCl3 oder ein 1:1 Mischung aus beidem) Konzentration in wässrigen Lösungen wurde sowohl durch Atomspektroskopie Extinktion (OD) nach Zugabe von Preußischblau gemessen. Abbildung 1 zeigt die lineare Regression-Kurven für Messungen von jeder Methode. Wir festgestellt, dass die preußische blaue Methode zur quantitativen Analyse von Eisen-Konzentration in der Lösung verwendet werden kann.
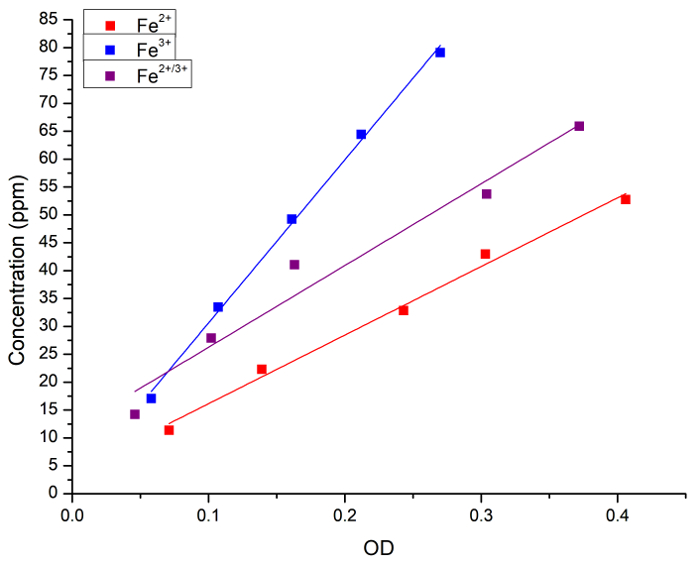
Abbildung 1: lineare Regressionen zwischen Fe-Konzentration gemessen an FAAS und leichte Extinktion (OD, 715 nm) durch die preußische blau-Methode erhalten. Die blauen Quadrate und Linie stellen die Fe2 + Lösung dar, die roten Quadrate und Linie repräsentieren die Fe3 + Lösung und die schwarzen Quadrate und Linie repräsentieren eine 1:1 Mischung aus Fe2 + und Fe3 +. Die folgenden Regressionen wurden erzielt: [Fe2 +] = 3 + 123 X OD, R = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 X OD, R = 0,999, R2 = 0.997; und [Fe2 + / 3 +] = 11 + 146 X OD, R = 0.983, R2 = 0.956. Fe2 + Spender war FeCl2 und Fe3 + Spender war FeCl3. Bitte klicken Sie hier für eine größere Version dieser Figur.
Um die farbmetrischen preußische blau Methode für quantitative Eisen Analyse von Pflanzengewebe anzupassen, war der Eisengehalt von Tabak Blatt Asche gemessen Flamme Absorption Atomspektroskopie und preußischen Blaufärbung. Es gab gute Korrelation zwischen den Ergebnissen aus durch die beiden Techniken.
Protokoll
(1) Pflanzenmaterial und Wachstumsbedingungen
- Samen einer Tabak (Sorte Samsun) Samen pro Topf 5 x 5 cm mit standard Topf Medium gefüllt. Stellen Sie die Töpfe auf Tabletts. Wachsen Sie die Pflanzen im Wachstum Zimmer unter anstrengenden Bedingungen (16/8 h hell/dunkel) bei einer konstanten Temperatur von 23 ° C. Spülen Sie mit Wasser aus dem Wasserhahn bis Wasser fließt aus dem Topf.
- Beginnen Sie nach 50±5 Tagen Fe Behandlungen in der Bewässerung, entsprechend die Konzentrationen geeignet für das Experiment. Zum Beispiel haben wir eine Reihe von Eisen-Konzentrationen von 0 bis 6 mM, ergänzt durch eine lösliche Fe Chelator (Fe EDDHA) verwendet. Spülen Sie die Pflanzen mit der entsprechenden Lösung alle zwei Tage (um Austrocknung zu vermeiden) für 6-8 Tage.
2. Vorbereitung der Blätter für Eisen-Messung
Hinweise: Alle Materialien, die verwendet werden müssen eisenfrei Reduzierung des Risikos von Eisen Verunreinigungen. Reinigen Sie den Mörser und Stößel zweimal mit 4 % HCl-Lösung und trocknen Sie jedes Mal vor dem Gebrauch mit Filterpapier. Wenn irgendein Material wiederverwendet wird, zweimal mit 4 % HCl-Lösung reinigen Sie und trocknen Sie mit Filterpapier.
- Lösen Sie die Blätter aus dem Stamm von hand mit Handschuhen (verwenden Sie nicht metallischen Geräten). Verwenden Sie etwa 10 g Blätter (Frischgewicht) für jede Probe. Reinigen Sie jedes Blatt mit doppelt destilliertem Wasser (DDW) mit einer Sprühflasche. Dieser Schritt ist wichtig zur Vermeidung von Kontaminationen Fe.
- Trocknen Sie die Blätter auf einem Papiertuch und setzen Sie sie in eine Papiertüte. Übertragen Sie die Papiertüten zum Ofen bei einer konstanten Temperatur von 80 ° C für ca. 2-3 Tage
- Nach dem Trocknen Zerkleinern Sie die Blätter zu Pulver mit einem Mörser und Stößel und Transfer zum sterilen 15 mL-Kunststoff-Rohre.
3. verbrennen die Blätter zu Asche
Hinweise: Die Verwendung einer niedrigen pH-Wert (nahe 0) Lösung von HCl soll Eisen Löslichkeit erhöhen. Die Steinwolle wird verwendet, um zu verhindern, dass die Gase entweicht das Fläschchen beim Brennen.
- Wiegen Sie eine neue, versiegelte 20 mL Funkeln Fläschchen ohne Deckel. Notieren Sie den Wert oder festlegen Sie den Wert auf NULL mit der Tara-Taste. Das Fläschchen die zerkleinerten getrockneten Blätter (Probe) hinzufügen.
- Wägen Sie die Probe und Container und notieren Sie den Wert. Schließen Sie das Fläschchen mit Steinwolle.
- Wiegen Sie 3 zusätzliche Fläschchen ohne Zugabe von Proben und notieren Sie sich ihre Werte. Diese Fläschchen werden als Steuerelemente verwendet werden, um die Menge der Steinwolle auszuwerten, die zu jeder Probe Gewichtszunahme geführt haben könnte.
- Legen Sie die Probe und Kontrolle Fläschchen in einem Ofen und brennen mit den folgenden Schritten Temperatur: Raumtemperatur, schnelle Zunahme bis 425 ° C, und schließlich 425° C für 4 Stunden. Zu diesem Zeitpunkt werden die trockenen Blätter zu Asche geworden.
- Die Proben auf ca. 100 ° C abkühlen lassen, aber nicht unterhalb dieser Temperatur für die folgenden zwei Schritte um Feuchtigkeit zu vermeiden, die das endgültige Gewicht der Probe beeinflussen könnte. Mit dicken Handschuhen, entfernen Sie die Proben aus dem Ofen mit einer Pinzette, hält das Fläschchen Traktorprofils.
- Legen Sie die Fläschchen auf eine flache Oberfläche, entfernen Sie die Steinwolle und schließen Sie die Fläschchen mit ihren original Deckeln.
- 3 Kontrollfläschchen (siehe 3.3) wiegen und ihre durchschnittliche Gewichtszunahme zu berechnen. Wenn Gewichtszunahme gleich oder über 1 % des Gewichts Asche (siehe Punkt 4.2), verwenden Sie diesen Wert als eine Schätzung der Messfehler.
4. Vorbereitung der Asche für Eisen-Messung
Hinweise: Die endgültige Eisenkonzentration in der ursprünglichen Probe errechnet sich aus dem Gewicht der Asche dividiert durch das zusätzliche Volumen von HCl.
- Bereiten Sie eine 1 M HCl-Lösung (4 % HCl) durch Zugabe von 12,5 mL eine 37 % HCl Stammlösung auf 87,5 mL DDW (in Kunststoff oder Glas Kolben).
- Wiegen Sie ein Kunststoffrohr 15 mL und notieren Sie den Wert oder legen Sie den Wert auf NULL mit der Tara-Taste. Übertragen der Asche am Rohr, wiegen, und notieren Sie den Wert. Dies ist das Gewicht der Asche.
- Die Asche 5 mL 1 M HCl hinzufügen. Filtern Sie der Asche durch einen 22 µm-Filter und fügen Sie eine zusätzliche 5 mL 1 M HCl durch den gleichen Filter hinzu.
- Das Endvolumen sollte 10 mL betragen. Beachten Sie, dass Teil der Lösung in den Filter verloren geht.
Hinweis: Die Muster sind sofort messbereit Fe FAAS oder durch die preußisch-blau-Methode. - Machen eine Eichkurve mit der Fe-Konzentration durch atomare Spektrometrie und von der preußischen blau-Methode gemessen (siehe Abbildung 4) für jede Pflanzenart. Anschließend kann die preußische blau Methode allein Fe-Konzentration gemessen werden.
5. Messung von Fe-Konzentration von FAAS
- Jede Probe für die Messung von FAAS entnehmen Sie 4 mL.
- Teilen Sie die Ergebnisse aus der FAAS-Messung durch das Gewicht der Asche. Teilen Sie des resultierenden Wertes von 0,01 (weil die Asche in 10 mL solubilisiert waren). Der resultierende Wert ist die Eisenkonzentration pro Gramm Asche (ppm).
6. Vorbereitung der Färbelösung preußisch-blau
- Bereiten Sie eine 4 % preußischen blaue Lösung durch Zugabe von 4 g K4Fe(CN)6 bis 100 mL DDW und Vortex (andere Mengen oder Konzentrationen können für unterschiedliche Anforderungen verwendet werden). Es sei darauf hingewiesen, dass in dieser Studie weniger preußische blaue Lösung konzentriert, als bereits berichtet (20 %)14 verwendet wurde.
- Halten Sie die Lösung im Dunkeln bei 4 ° C bis zur Verwendung. Die Lösung ist für 6 Monate stabil, wenn bei solchen Bedingungen gelagert.
7. eine Eichkurve für die preußisch-blau-Methode mit FAAS Ergebnisse generieren
Hinweis: Berechnen Sie die Eisenkonzentration in der Asche mit der folgenden Formel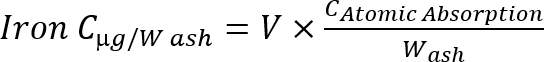 Gleichung 1
Gleichung 1
C: Konzentration, V: Probenvolumen, W: Asche Gewicht (g).
- Mischen Sie 0,50 mL des preußischen blaue Lösung und 0,50 mL 1 M HCl. Dies wird als die leere Lösung dienen.
- Mischen Sie 0,5 mL der Probe (Asche in 4 % HCl, wie in Abschnitt 3 beschrieben) und 0,5 mL der preußischen blaue Lösung (Schritt 6.1) durch pipettieren. Warten Sie mindestens 1 Minute lang aber nicht länger als 5 Minuten. Nach 5 Minuten wird die Sedimentation in den Proben auftreten.
- Übertragen Sie die Mischung auf eine Küvette und messen die OD bei 715 nm mit einem Spektralphotometer. Notieren Sie den Wert.
- Teilen Sie den OD-Wert (Schritt 7.3) durch das Gewicht der Asche (Schritt 3.2) der Probe. Das Ergebnis entspricht OD pro Gramm Asche.
- Plot der lineare Regression zwischen die Eisen-Konzentrationen von FAAS Messungen (y-Achse) und die OD-Werte erhalten (X-Achse). Verwenden Sie die Ergebnisse in den Schritten 5.2 und 7.4. Berechnen die Regressionsformel, Y = ein + bX, wo Y steht für Eisen-Konzentration, ein stellt die Extinktion überschneiden, b steht für die Extinktion Steigung und X für OD.
8. unter Verwendung der preußisch-blau-Methode zur Bestimmung des Eisenspiegels in anderen Proben aus der gleichen Pflanze Typ
Hinweise: Da eine Eichkurve für diese Art von Anlage bereits etabliert hat, kann Eisenkonzentration in jede neue Proben des gleichen Typs Pflanze direkt berechnet werden mit Hilfe der linearen Regressionsformel.
- Führen Sie die Schritte in den Abschnitten 3 und 4, gefolgt von Schritten 7.1 und 7.4.
- Berechnen Sie die Eisenkonzentration in Lösung mit Hilfe der Formel aus der linearen Regression (Schritt 7,5) gewonnen.
Ergebnisse
Wenn dieses Protokoll korrekt durchgeführt wird, sollte man ausgezeichnete Korrelation zwischen den Ergebnissen der preußischen blau und atomare Spektroskopie-Methoden. Daher die preußische blaue Methode leicht lässt sich eine genaue Messung der Eisenkonzentration in Pflanzenproben, wie Sie sich in das folgende Experiment.
Tabakpflanzen waren gewachsen, wie im Protokoll beschrieben und bewässert mit Wasser, die verschiedene...
Diskussion
Eisen-Messung im Pflanzengewebe ist sehr wichtig für die Bewertung der Auswirkungen der Bewässerung oder andere Umweltbedingungen. Wir hier eine einfache und genaue kolorimetrischen Verfahren zur Fe Content Messung in Tabakblättern, die ohne weiteres auf andere Pflanzenarten und Gewebe angepasst werden können.
Bedingungen für die kolorimetrischen Verfahren zu optimieren, haben wir einen niedrigen pH-Wert Medium (pH < 1.0) um Eisen Löslichkeit zu ermöglichen. Der Brennvorgang wurde durch...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss aus dem Hauptamt des israelischen Ministeriums für Landwirtschaft (#16-16-0003) von Israel Ministerium für Wissenschaft, Technologie und Spaceand unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
Referenzen
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin - a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy - Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions - The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten