A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مجهرية التعريب متعدد الألوان البروتينات الغشاء واحدة في العضيات الحية خلايا الثدييات
In This Article
Summary
نقدم هنا، بروتوكولا للترجمة متعدد الألوان من البروتينات الغشاء واحدة في العضيات خلايا الحية. لإرفاق فلوروفوريس، تستخدم البروتينات الذاتية التوسيم. البروتينات، يقع في المقصورات الأغشية المختلفة من عضية نفسه، يمكن أن تكون مترجمة بدقة ~ 18 شمال البحر الأبيض المتوسط.
Abstract
المعرفة بشأن إضفاء الطابع المحلي على البروتينات في سوبكومبارتمينتس الخلوية أمر حاسم لفهم وظيفتها المحددة. نقدم هنا، تقنية فائقة قرار الذي يسمح لتحديد ميكروكومبارتمينتس التي يمكن الوصول إليها للبروتينات بتوليد التعريب وتتبع الخرائط لهذه البروتينات. وعلاوة على ذلك، بالفحص المجهري التعريب متعدد الألوان، التعريب وتتبع ملامح بروتينات في سوبكومبارتمينتس مختلفة يتم الحصول عليها في وقت واحد. التقنية محددة للخلايا الحية ويقوم على تصوير متكررة من البروتينات الغشاء متنقلة واحدة. تنصهر فيها البروتينات التي تهم وراثيا مع علامات التوسيم ذاتية محددة، ما يسمى. هذه العلامات هي الإنزيمات التي تتفاعل مع الركازة بطريقة تساهمي. يضاف إلى هذه ركائز صبغات الفلورسنت. رد فعل البروتينات معلم الإنزيم مع الأسفار المسماة النتائج ركائز في البروتينات المسماة. هنا، تيتراميثيلرهوداميني (ترانسنيستريا) و "السليكون والرودامين" (السير) تستخدم الأصباغ الفلورية يعلق على ركائز للإنزيمات. باستخدام تركيزات الركيزة في الساعة إلى نطاق شمال البحر الأبيض المتوسط، ووسم المقايسة الفرعية يتحقق التي ينتج عنها إشارات مميزة. وقد تمت ترجمة هذه الإشارات مع ~ 15 – 27 دقيقة شمال البحر الأبيض المتوسط. التقنية تسمح للتصوير متعدد الألوان من جزيئات مفردة، حيث يقتصر عدد الألوان الأصباغ نفاذية الأغشية المتاحة ومرجع ذاتي وسم الإنزيمات. نحن إظهار جدوى هذه التقنية بتحديد التعريب إنزيم مراقبة الجودة (فتن)-التي يسببها كيناز 1 (PINK1) في الأقسام المختلفة المتقدرية أثناء معالجة به فيما يتعلق بغيرها من البروتينات الغشاء. اختبار التفاعلات الفيزيائية الحقيقية بين البروتينات واحد مسمى بشكل مختلف من جزيء واحد الحنق أو تتبع المشارك مقيد، رغم ذلك، نظراً لانخفاض درجات التوسيم إنقاص احتمال لوجود اثنين من البروتينات المجاورة المسمى في الوقت نفسه. بينما التقنية قوية للتصوير البروتينات في الغشاء المقصورات، في معظم الحالات من غير المناسب تحديد إضفاء الطابع المحلي على البروتينات القابلة للذوبان كثيري التنقل.
Introduction
والهدف من هذا البروتوكول توفير طريقة تصوير لتوطين وتعقب غشاء واحد البروتينات داخل الخلايا الحية. ونحن ندعو هذا الأسلوب تتبع والتعريب مجهرية (تألم)1،2. مثل العشوائية بصري التعمير مجهرية (العاصفة)3 و4،Fluorescence فوتواكتيفيشن التعريب مجهرية ((و) النخيل)5، تألم وأسلوب تعريب fluorescence المستندة إلى جزيء واحد. ومع ذلك، أنها متميزة في الطريق أن تنقل بروتينات الغشاء في تركيبة مع التصوير المتكرر لنفس المسمى جزيء في المواقف المختلفة يكشف عن ميكروكومبارتمينت التي يمكن الوصول إليها للبروتين المتنقلة. وبعبارة أخرى، يتم تعيين تعريب ممكن من البروتين بنية عضية، والتنقل من البروتين1. الأسلوب مكمل لشتى أخرى القرار فائقة تقنيات6،7،8 نظراً لأنها تكشف عن التعريب ومسار الخرائط بالبروتينات النقالة التصوير. العلامات يستند إلى استخدام البروتينات الانصهار المهندسة وراثيا التي في حد ذاتها غير الفلورية. يتم وسم هذه البروتينات الانصهار الذاتي الإنزيمات التي تتفاعل تساهمي مع الركازة مترافق بصبغة. ويمتاز هذا الإجراء يمكن أن درجة وصفها يسيطر عليها كمية الركازة المضافة. وعلاوة على ذلك، يتيح تختلف لون الأسفار، اعتماداً على صبغ مترافق المختار. إنزيم التوسيم الذاتي عدة-العلامات هي المتوفرة9. ميزة أخرى لاستخدام الذاتي وسم العلامات الإنزيم، أن الأصباغ مترافق عادة ما تكون أكثر استقرارا وأكثر إشراقا من البروتينات الفلورية1 والبروتينات الفردية ولذلك يمكن تسجيل أطول وأكثر تحديداً حتى أنها المبيضة. وهذا يسمح لتسجيل مسارات للبروتينات المتنقلة واستخراج نشر معاملات10،11.
هنا، نحن إثبات جدوى تألم مع بروتينات الغشاء الميتوكوندريا، ولكن يمكن أيضا تطبيقها للبروتينات الغشاء داخل وخارج الخلايا الأخرى، بما في ذلك أنواع مختلفة من الخلية12،13. نظهر أن تألم متعدد الألوان كما يسمح للتفريق المتزامن للبروتينات في سوبكومبارتمينتس مختلفة في التكامل القائمة القرار فائقة fluorescence المجهري تقنيات14،15، 16. تألم متوافق مع الخلايا الحية التصوير17. الصور--الفيزياء من رهودامينيس الذي تم اختياره تيتراميثيلرهوداميني (ترانسنيستريا) والسليكون-رهودامين (السير)، لا سيما السطوع، والاستقرار، ويسمح للبروتينات الغشاء واحد سجل على إطارات متعددة توفير خرائط التعريب (ومساره). ومع ذلك، تألم يقتصر لإضفاء الطابع المحلي على البروتينات القابلة للذوبان مع معاملات نشر عالية منذ الضبابية مرتفع جداً والفوتونات التي جمعت كل إطار منخفضة جداً للتعريب السليم. وعلاوة على ذلك، يتطلب تألم طاقة الإثارة أقل على سبيل المثال العاصفة أو نضوب الانبعاثات وحفز (STED) مجهرية6،7، تقليل آثار سمي ضيائي. هذا أمر مهم، إذ غالباً ما يؤثر الإجهاد سمي ضيائي مورفولوجيا أورجانيلار18 ومن ثم تنقل التحليل19. وباختصار، نحن نقدم تألم متعدد الألوان في الخلايا الحية كأسلوب ليملأ فجوة بين أساليب الفحص المجهري التعريب العاصفة/STED/النخيل (F) وتقنيات تحليل التنقل البروتين مثل الأسفار الانتعاش بعد فوتوبليتشينج (اربط)20 ،21والأسفار ارتباط مطيافية (FCS)22، والأسفار عبر ارتباط التحليل الطيفي (فككس)11،23.
Access restricted. Please log in or start a trial to view this content.
Protocol
البروتوكول التالي يتبع المبادئ التوجيهية للجنة أخلاقيات البحوث مؤسسة محلية.
1-الأساليب
-
خلية ثقافة
- زراعة الخلايا، على سبيل المثال هيلا الخلايا (سرطان عنق الرحم البشرية)، في T25 قارورة ثقافة خلية التي تحتوي على 5 مل متوسط النمو في 37 درجة مئوية و 5% CO2.
ملاحظة: للتصوير، وتقسيم الخلايا على استعداد كوفيرسليبس (راجع الخطوات 1.3 و 1.4) وتبقى في التصوير المتوسطة.
- زراعة الخلايا، على سبيل المثال هيلا الخلايا (سرطان عنق الرحم البشرية)، في T25 قارورة ثقافة خلية التي تحتوي على 5 مل متوسط النمو في 37 درجة مئوية و 5% CO2.
-
تعداء الخلايا
ملاحظة: استخدام خطوط الخلايا ستابلي تعبر عن البروتينات المعلمة كلما أمكن24 لتجنب overexpression قوية. تعداء عابرة، التكيف مع مقدار بلازميد الحمض النووي يستخدم تعداء. على سبيل المثال، عند استخدام Ca2 + تعداء الفوسفات25 ، ترانسفيكت الخلايا (80 – 90% كونفلوينسي) في صحن ثقافة خلية 3.5 سم مع 2.5 – 5 ميكروغرام من بلازميد الحمض النووي. عند أداء تعداء مزدوجة، استخدام 2.5 ميكروغرام لكل بناء بلازميد.- لإجراء التجارب على لون مزدوج، استخدام خط خلية مع التعبير مستقرة من البروتين التوسيم الذاتي واحد وعابر ترانسفيكت مع بلازميد ترميز أخرى ذاتية التوسيم البروتين17.
ملاحظة: هنا، لتجارب اللون المزدوج، خلايا هيلا استخدمت أن ستابلي أعرب عن البروتينات الذاتية التوسيم PINK1-هالة-العلامة والعلامة-Tom20-فسناب.
- لإجراء التجارب على لون مزدوج، استخدام خط خلية مع التعبير مستقرة من البروتين التوسيم الذاتي واحد وعابر ترانسفيكت مع بلازميد ترميز أخرى ذاتية التوسيم البروتين17.
-
تنظيف كوفيرسليبس
- مكان كوفيرسليبس في كوب. إضافة 30 مل ح2س في الكأس التي تحتوي على كوفيرسليبس وتهز برفق لإزالة الغبار من على سطح الأرض.
- جمع في كوفيرسليبس مع ملاقط وتجفيفها بتيار نيتروجين.
- قم بإزالة أي تلوث العضوية على السطح كوفيرسليبس، مثلاً، عن طريق تنظيف البلازما.
ملاحظة: لتفادي المزيد من تلوث المواد الزجاجية، ارتداء القفازات أثناء التعامل مع كوفيرسليبس.
تنبيه: عندما يتم تنظيف كوفيرسليبس بالبلازما التنظيف، يتم تنظيف فقط الجانب العلوي من كوفيرسليبس؛ استخدم هذا الجانب لطلاء مع بولي-L-يسين-البولي إيثيلين جليكول-ارجينين-جليكاين-اسبارتاتي (PLL-شماعة-إدارات) (الفرع 1-4) وخلية البذر (القسم 1.5).
-
طلاء ساترة مع PLL-شماعة-إدارات
ملاحظة: PLL-شماعة-إدارات مشتق (PLL) بولي-L-يسين المرفقة مع البولي إيثيلين غليكول (3,000 دا) وببتيد سيستينيجليسينيارجينينيجليسينياسبارتاتيسيريني (كجرجدس). PLL يربط إلى سطح الزجاج مشحونة سلبا وأشكال فرشاة الوتد. وهذا يخفض بشكل كبير ملزمة غير محدد من الأصباغ الفلورية مشحونة. وباﻹضافة إلى ذلك، عزر إدارات يقلد الببتيد إشارة من مستقبلات إنتغرين ومما يعزز التزام إنتغرين بوساطة الخلايا بخلاف ذلك لا بسهولة تتقيد.- إعداد PLL-شماعة-إدارات كما هو موضح سابقا26. وباختصار، حل 0.8 ملغ PLL-شماعة-إدارات في 1 مل من برنامج تلفزيوني. إضافة 10 ميليلتر من الحل PLL-شماعة-إدارات في الجانب العلوي من ساترة نظيفة.
- تأخذ ساترة ثانية ووضعه مع سطحه نظيفة رأسا على ساترة الأولى (التي قد إسقاط PLL-شماعة-إدارات في الأعلى)؛ هذه النتائج في ساندويتشينج الحل PLL-شماعة-إدارات بين هذين كوفيرسليبس.
- ضع كوفيرسليبس تقع في كوب واحتضانها ح 1 في درجة حرارة الغرفة في بيئة خالية من الغبار جافة بعناية.
- بعد ح 1، إضافة 30 مل ح2س للكأس تغطية كامل كوفيرسليبس مع الماء.
- اهتز الكأس بلطف حتى كوفيرسليبس فصلها عن بعضها البعض.
- استخدام الملقط لجمع كوفيرسليبس من الماء وتجفيفها تحت تيار غاز النيتروجين.
ملاحظة: يمكن تخزين كوفيرسليبس المغلفة في زجاجة معقمة وجافة طبق بيتري مع غطاء لبضعة أيام.
-
إعداد نموذج للتصوير
- نقل كوفيرسليبس المغلفة مفردة إلى طبق ثقافة خلية 35 ملم، مع سطح مصقول PLL-شماعة-إدارات تواجه التصاعدي وإضافة 2 مل من التصوير المتوسطة على أعلى.
- إضافة خلايا تريبسينيزيد ~ 500,000 (200 – 500 ميليلتر) التي تعبر عن العلامات الذاتية وضع العلامات على بروتينات الغشاء كل منهما إلى 2 مل التصوير متوسطة في الطبق ثقافة الخلية مع ساترة المغلفة. اهتز بلطف باليد ضمان توزيع متجانس للخلايا للحصول على شكل موحد خلية طبقة.
- احتضان خلايا في 37 درجة مئوية و 5% CO2 حتى يتم التوصل إلى كونفلوينسي 80%.
ملاحظة: يجب أن تكون عينات الخلايا المصنف 3 أيام قبل التصوير وقبل تعداء يوم 1. الخلايا التي ستابلي التعبير عن البروتين للفائدة، يمكن أن يكون المصنف 2 أيام قبل التصوير. في وقت لاحق، يتم تصويرها فقط الخلايا التي نمت على ساترة.
-
وسم البروتينات المعلمة
ملاحظة: ركائز الفلورسنت الأكثر يجب أن يحل في [دمس] خالية من المياه. ننصحك باستخدام حلول الأسهم من 1 ميكرومتر الفلورسنت الركيزة عند تركيز وضع العلامات النهائية هي 0.2 – 30 نانومتر17. للتصوير غشاء البروتينات داخل الخلايا، واستخدم ركائز الفلورسنت نفاذية الغشاء.- الاحماء المتوسط التصوير إلى 37 درجة مئوية في حمام مائي.
- "الماصة؛" 1 مل المتوسط التصوير المعالجون مسبقاً في أنبوب 2 مل مع غطاء. إضافة 0.2 – 30 ميليلتر من ركائز الفلورسنت من حلول 1 ميكرومتر الأسهم أن تعد بوصفها الحل النهائي (التركيز النهائي: 0.2 – 30 نانومتر).
- دوامة الحل وضع العلامات لمدة 10 ق.
- استبدال المتوسطة في الطبق الثقافة 35 ملم مع الخلايا في ساترة (راجع الخطوة 1.5) من 1 مل من استعداد وسم الحل.
- احتضان الخلايا في حل وضع العلامات على 37 درجة مئوية و 5% CO2 لمدة 20 – 30 دقيقة.
- تغسل الخلايا مع 2 مل من برنامج تلفزيوني مرة واحدة، ثم مع 2 مل من التصوير المتوسط مرتين. وأخيراً، "الماصة؛" 1 مل الطازجة المتوسطة تصوير إلى صحن الخلية ووضع العينة إلى الحاضنة في 37 درجة مئوية و 5% CO2 على الأقل 1 ح. قبل التصوير، وتبادل المتوسطة التصوير مرة أخرى.
ملاحظة: عند تشغيل هذه التجربة للمرة الأولى، تؤكد استهداف الصحيح من البروتينات المسماة ذاتيا للأغشية أورجانيلار بتلوين العضيات مع عضية المتاحة تجارياً صبغات محددة27،28. وفي هذه الحالة، أيضا استخدام 100-200 نانومتر من الركازة للإنزيمات الذاتية التوسيم لإنتاج إشارات قوية.
-
إعداد عينة حبة نيون
ملاحظة: بغية تحديد الانحراف البصري ومحاذاة صور قنوات مختلفة، يتم استخدام الخرز متعدد الألوان الفلورية (0.1 ميكرومتر). مع الصور المسجلة، سيتم إنشاء مصفوفة تحويل أفيني لقنوات الانبعاثات اثنين.- تمييع حل الخرز إلى % 1 مع نقية H2o.
- 5 مكان قطرات الحل مستعدة مع الخرز fluorescence في خمسة مواقع مختلفة في ساترة تنظيفها (راجع الخطوة 1، 3).
- واسمحوا حبة الفلورسنت العينة الجاف على مقاعد البدلاء نظيفة.
ملاحظة: النموذج يمكن إعادة استخدامها؛ ولذلك، تغطي العينة مع رقائق الألومنيوم تجنب التلوث وإبقائه في 4 درجات مئوية.
2-الفحص المجهري
-
الإعداد التجريبية
ملاحظة: يستند نظام الفحص المجهري أساسية لتصوير جزيء ثنائي-لون واحد مجهر مقلوب: وهي مجهزة بأشعة الليزر اثنين إلى جانب عن طريق استقطاب متعدد مودي-بصرية صيانة الألياف الربطة في انعكاس داخلية مجموع واحد (TIR) المكثف، وهدفا غمر نفط مصممة ل TIRF وعوامل انبعاث بوليباند، تقسيم صورة، وكاميرا حساسة للغاية (الشكل 1). مكثف تير المسبق يسمح بضبط مستمر من زاوية الحادث للتبديل بين برنامج التحصين الموسع-، يميل عاليا والورقة الضوئية مغلفة (الإضاءة رقيقة جداً يميل (حلو)29)، ومع وضع الإثارة TIRF الأمثل عمق الاختراق. يتم الحصول على الصور باستخدام نظام تبريد حساسة للغاية للكشف عن، وضرب مثلاً خلفية مضيئة إلكترون المحملة الكاميرا إلى جانب الجهاز (امككد) (كفاءة الكم QE > 90%) أو كاميرا سكموس (QE > 80 – 90%).- تحديد الانحراف البصري بالتصوير الفلورسنت الخرز (راجع الخطوة 2، 2) تحت نفس الظروف كتلك التي في وقت لاحق ستستخدم للتجربة، مثلاً، عندما تسجل إطارات 10,000 في التجربة، سجل أيضا 10,000 إطارات مع عينة حبة. لتحديد الانحراف البصري، قارن وضع الخرز في الإطار الأول والإطار الأخير المكتسبة (الشكل 1B). إذا لزم الأمر، بعد تصحيح سلسلة الصورة للانجراف بصري30 و/أو استخدام بيئات مستقرة الانجراف.
- تجهيز المكعب تصفية مع التقسيم شعاع مزدوج اللون المناسب، مثلاً، للأسفار البرتقالي والأحمر بالإضافة إلى عوامل التصفية الانبعاثات كافية للأسفار البرتقالي والأحمر الفلورية. تزويد المقسم والصورة مع عوامل التصفية المناسبة. التحقق من إمكانية تسرب الإشارات من قناة واحدة إلى قناة أخرى عن طريق تسجيل عينات لون واحد في كلتا القناتين (الشكل 1).
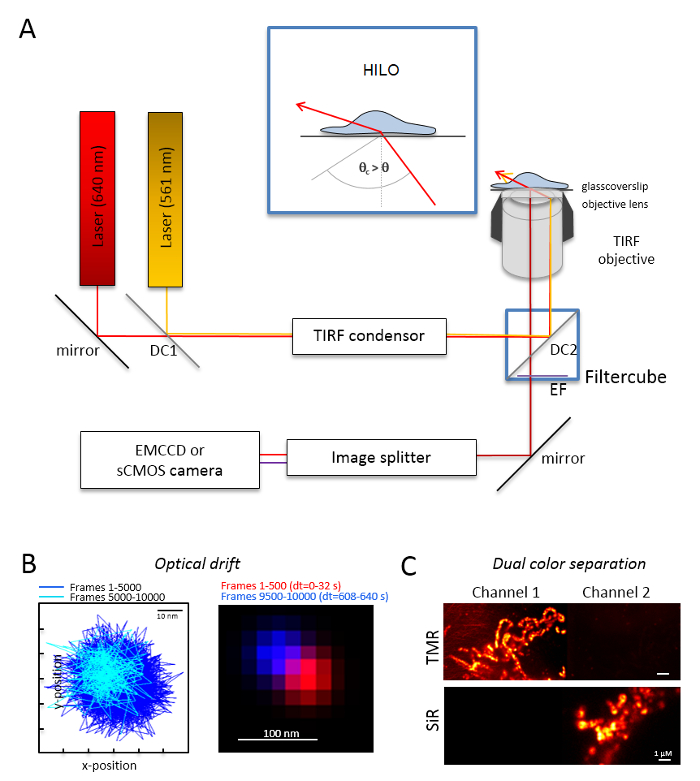
الشكل 1 : تخطيط البصرية لمتعدد الألوان مجهرية التعقب والتعريب (تألم) مع بواعث البرتقالي والأحمر. (أ) إعداد مجهر مقلوب مع اثنين على الأقل من أشعة الليزر الإثارة ومكثف TIRF، هدفا مناسباً TIRF، تقسيم صورة وكاميرا حساسة. داخلي: إثارة العضيات داخل الخلايا، زاوية شعاع الحادث يجب تعيين أصغر من زاوية حرجة ل TIRF لتحقيق الغاية يميل ومغلفة الإضاءة الورقة الضوئية (حلو). DC1: مرآة مزدوج اللون 1؛ DC2: مرآة مزدوج اللون 2. EF: الانبعاثات عامل التصفية. (ب) اختبار على الانجراف الضوئية بالتصوير مواقف حبة الفلورسنت للإطارات 10,000 مع معدل الإطار نفسه اعتبارا من التجارب التالية (هنا: 15 هرتز). وتظهر مواقف متصلة من الإطارات 500 أولاً وإطارات آخر 500 الانجراف. أيضا، تظهر صورة مدمجة مع وضع الأول وآخر إطار في الأحمر والأزرق انجراف الحد أدنى. الانحراف المسافة بين مركز الإشارات مقسوماً على وقت تسجيل إجمالي، هنا 125 م/س. الاختيار (ج) على الفصل الواضح للإشارات، هنا جمهورية ترانسنيستريا المولدوفية والسير. لكل القنوات، تم توليد الصور المبلغ التراكمي من إطارات 3,000 (جمهورية ترانسنيستريا المولدوفية في القناة 1) والسير في القناة 2. تم إرفاقه سيديهتل Tom20-هالوتاج وجمهورية ترانسنيستريا المولدوفيةهتل إلى أوكسفوس معقدة الخامس-هالوتاج. الألوان هي ألوان كاذبة. تغيير حجم أشرطة = 100 نانومتر (ب) و 1 ميكرومتر (ج). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
المحاذاة المادي لتقسيم الصورة التي تم إنشاؤها بالصور
ملاحظة: لتركيب النموذج المعد في ساترة، حامل عينة عصامي يمكن استخدامها (الشكل 2A). لتجنب الغبار، إلخ الوقوع في العينة، ضع غطاء الطبق الثقافة فضفاضة على رأس الدائرة، عندما شنت. يمكن استخدام صاحب العينة نفسها جبل ساترة مع الخرز الفلورسنت أو الخلايا؛ عندما يتم تصويرها الخلايا، إضافة 0.5 – 0.8 مل من التصوير المتوسطة. التقسيم صورة تقسم الصورة إلى قسمين أو أكثر طيفيا فصل القنوات ومشاريع لهم جنبا بجنب على الكاميرا نفسها. يحتمل أن تكون هذه العملية يدخل التشوهات المنهجية بين القنوات بسبب مسارات بصرية متميزة اجتاز ويعوق تحليل كولوكاليزيشن مباشرة. لذلك، أولاً إجراء المحاذاة المادي والثانية، وبعد تصحيح محاذاة مع مصفوفة تحول. لكلتا العمليتين المحاذاة، ينبغي توزيع حبات الفلورسنت المتجانس طوال مجال الرؤية.- جبل العينة المعدة مع الخرز الفلورسنت في العينة صاحب بين تترافلوروايثيلين (PTFE)-خاتم والخاتم المطاط الأحمر (الشكل 2A).
- بدء تشغيل المجهر، جميع مكونات الأجهزة، وجميع البرمجيات اللازمة للفحص المجهري.
- تنظيف الهدف والجزء السفلي من ساترة مع مسح أنسجة خالية من الوبر ترطب مع الكحول. ثم الجاف لكل الأصناف مع أنسجة طازجة خالية من الوبر. وضع قطرات زيت الغمر على التلميذ للعدسة الهدف.
- مكان صاحب العينة بعينه حبة على خشبة المسرح مجهر حتى أسفل ساترة اتصالات النفط. التركيز على الخرز باستخدام ضوء انتقال أو خط ليزر.
- ضبط قوة الليزر الإثارة اثنين لتحقيق كثافة إشارة مماثلة في قناتين الأسفار. البحث عن منطقة مع كثير من الإشارات الفلورسنت متميزة.
- إنشاء طريقة عرض مدمجة من القنوات الفلورسنت باستخدام برنامج مراقبة الكاميرا. ثم استخدام المسامير في التقسيم الصورة يدوياً إمالة المرايا الداخلية للتقسيم الصورة لتحقيق أفضل تراكب الإشارات من قناتين الفلورسنت (الشكل 2).
ملاحظة: انتباه! لا تتجاوز النطاق الديناميكي للكاميرا.
-
محاذاة قنوات طيفيا المنفصلين عن ذويهم بأداء التحول المكاني للبرنامج
ملاحظة: يظهر الجزء التالي بعد تصحيح محاذاة وإجراءات التعريب مع لدينا البرنامج المساعد (متوفرة عند الطلب).- بدء تشغيل المجهر TIRF مراقبة البرامج واختيار عرض القنوات الفردية في وضع تيار مباشر. أن من الأسفار صورة لقطة مثيرة في جميع القنوات (الشكل 2).
- استخدم هذه الصورة لقطة لإنتاج مصفوفة التحول (انظر الشكل 2).
ملاحظة: يتم استخدام مصفوفة التحويل لتحويل مكانية، عادة واحد أفيني، تقوم بتصحيح للترجمة (الاختلاف في إشارات من مصدر نقطة واحدة بين قناتين). - بدء تشغيل البرنامج المساعد تحليل البرمجيات (يمكن الحصول عليها عند الطلب من لدينا مختبر، انظر الشكل 2).
- تحميل صور اللون المزدوج المسجلة سابقا (راجع الخطوة 2، 2) الخرز الفلورسنت في البرنامج. اختيار اتجاه تستخدم القنوات الفلورسنت. ثم انقر فوق 'نعم' عندما سئل عن 'معايرة الصور' وحدد اللقطة المتخذة سابقا.
- افتح "إدارة وحدة" لتحديد وحدة عوامل التحويل (حجم بكسل، معدل الإطار، معامل التحويل فوتون).
- افتح "إدارة الترجمة". تحديد النقطة توزيع الدالة (PSF) أولاً. اضغط على زر: "نصف قطرها PSF". في الإطار "مقدر PSF" الذي يفتح، تحدد الفتحة العددية وانبعاث الحد الأقصى. بدء تشغيل "تقدير PSF دائرة نصف قطرها" بالنقر فوق. تقبل تعريف PSF. التجريبية التي تم الحصول عليها في المربع تقييم، وتستخدم لحساب عدد الحلقات الانكماش، والنوى كم من جهاز الكمبيوتر. اضغط على "تعريب" لبدء من المناسب توزيع كثافة الجسيمات واحد بوظيفة غاوسي متماثل 2D (الشكل 2).
- "قبول" تعريف PSF. التجريبية التي تم الحصول عليها في مربع التقييم، وتستخدم لحساب عدد الحلقات الانكماش، والنوى كم من جهاز الكمبيوتر. اضغط على "تعريب" لبدء من المناسب توزيع كثافة الجسيمات واحد بوظيفة غاوسي متماثل 2D (الشكل 2).
- افتح "إدارة المعايرة". وترد في الصورة المدمجة المقدمة من القناتين، الإشارات الأصلية ومراكز محلية. اختيار وضع "أفيني". الاتصال يدوياً أزواج المقابلة من مراكز محلية في اثنين من القنوات التي تكون قد نشأت من حبة الفلورسنت نفسه من رسم خط اتصال.
- قم بتوصيل الإشارات المقابلة موزعة في جميع أنحاء مجال الرؤية. بعد ذلك، اضغط على "قبول". حفظ المعايرة.
ملاحظة: أخذ عينات في كل حبة الفلورسنت التحول المكاني ومحرف في ما بين. دالة تحويل المستخرج يمثل Δr(x,y) ميدان تشرد الذي يستخدم بعد ذلك تصحيح تعريب تجريبي جزيء واحد ثنائي اللون بحيث أنهم تراكب داخل على دقة الترجمة. مصفوفة التحول المكاني هو عادة واحد أفيني تقوم بتصحيح للترجمة، والقياس، والتناوب بين القنوات بدقة نانومتر، وأنه يمكن أن يستنتج من هذا دليل تعيين رأس برأس (الشكل 2).
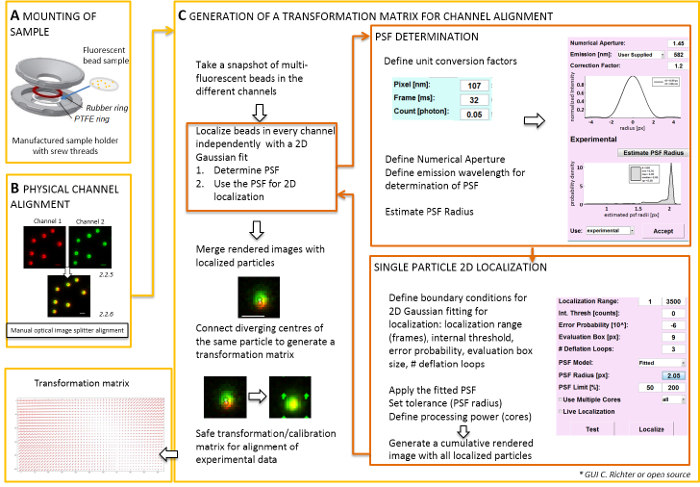
الشكل 2 : سير العمل لمحاذاة اللون المزدوج. (أ) ساترة مع الخرز الفلورسنت محمل في حامل عينة بين PTFE وحزام مطاط. ثم انسحب الجزء العلوي والسفلي من الدائرة هي معا. (ب) المحاذاة المادي آراء القناة التي يتم إنشاؤها بواسطة التقسيم الصورة. تسجيل إشارات مضيئة من الخرز (0.1 ميكرومتر) في قناتين (الأخضر والأحمر، ألوان كاذبة) يتم دمجها. مسامير المقابلة في التقسيم الصورة الضوئية يتم تشغيل يدوياً حتى يتم تحقيق تراكب أفضل من إشارات مختلفة (اللون الأصفر، لوحة أقل). (ج) توليد مصفوفة التحول لمحاذاة قناة بوستبروسيسيفي. لدقة الترجمة من الجسيمات، من الضروري تحديد النقطة نشر الدالة (PSF) في الاعتماد على الطول الموجي الانبعاثات والفتحة العددية للهدف. يمكن تحديد مركز PSF بصورتها كثافة تحليلها بواسطة ضبابي ثنائي الأبعاد متماثل تناسب. ثم يتوقع التعريب الناتجة من ذروة إشارة على إشارات الأصلي، غير واضحة. في صورة مدمجة، تتصل مراكز محلية للإشارات من القناتين بتوليد مصفوفة تحول الذي يتم استخدامه في وقت لاحق لمحاذاة البيانات التجريبية بوستبروسيسيفي. تغيير حجم أشرطة = 1 ميكرومتر (ب، ج). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
تصوير جزيء واحد من البروتينات غشاء الميتوكوندريا
ملاحظة: تجري جميع التجارب في درجة حرارة الغرفة. يجب أن تكون معطلة تي-الخلايا أو الخلايا غير ملتصقة في [اغروس] قبل التصوير31.- تحميل العينة مع خلايا ملتصقة على ساترة بين المطاط وخواتم PTFE (الشكل 3A). ملء الدائرة مع 0.5 – 0.8 مل التصوير المتوسطة.
- كرر الخطوات 2.2.2–2.2.5.
- قم بضبط زاوية الإضاءة TIRF المجهر مراقبة البرامج لإنشاء زاوية حادث أصغر من زاوية حرجة لوضع اتفاقية النقل البري الدولي لإثارة منطقة محددة من الفائدة عن طريق ورقة حلو32 (الوضع حلو، الشكل 1A).
تحذير: تجنب الاتصال المباشر بالعين مع شعاع الليزر! - تعيين كسب م واختيار وقت تعرض مناسب للتجربة التي تقوم بجمع الفوتونات كافية لكل إطار.
- تعيين السلطة الليزر لتحقيق إشارة عالية للضوضاء (S/N) نسبة (الشكل 3B)، نظراً لدقة الترجمة مباشرة يناظر S/N33 (الشكل 3).
- العثور على منطقة في محيط الخلية مع الميتوكوندريا غير متداخلة، وممدود وإشارات جزيء واحد (الشكل 3D؛ الفيديو التكميلي 1). إذا كانت لا توجد إشارات جزيء واحد مرئية، الانتظار حتى تبيض النتائج في ظهور إشارات جزيء واحد (الرقم 3E).
- سجل حتى عدد إشارات منخفضة جداً لاستمرار معقولة (عادة إطارات 1,000 – 10,000 تبعاً لسلوك تبيض صبغة الفلورسنت، الرقم 3F).
- البدء تصوير تجهيز البرمجيات والتحقق من وجود هياكل المتقدرية بتوليد صورة تراكمية مبلغ المقدم للإطارات المسجلة على الأقل 1,000 (الشكل 3).
ملاحظة: بأسرع معدل ممكن تمليه منطقة قراءات. هو خفض مجال الرؤية لقناة واحدة بتقسيم المزدوج-لون صورة (512 × 512 بكسل) إلى 256 × 512 بكسل، ورباعية لون إلى 256 × 256 بكسل. وهكذا، لاستخدام الفاصل صورة لونين، هذا هو 30 هرتز. مجموعة وضع نقل الإطار تحقيق أقل من زمن قراءات ممكنة. - بدء تشغيل برنامج تحليل البرنامج المساعد وتحميل البيانات الخام. حدد قناة الاتجاه وتحميل الصور. استخدام مصفوفة التحول من الخطوة 2.3.9 عندما سئل عن "معايرة الصور". سيتم عرض القنوات بشكل منفصل.
- افتح "إدارة وحدة" كما كان من قبل لتحديد عوامل التحويل وحدة لكل قناة. افتح "إدارة الترجمة" لكل قناة. ثم قم بتعريف مربع التقييم، عدد الحلقات الانكماش، إضافة PSF النظري لشروط استخدامها وتعيين النوى كم من الكمبيوتر المستخدمة لحساب. وأخيراً، اضغط على "تعريب" للحصول على جزيئات مفردة المترجمة (الشكل 3 ح؛ فيديو تكميلي 2).
- علما أن البرنامج سيولد أخيرا صورة تراكمية سوبيريسولوشن عرض ترجمة كافة الجسيمات (الرقم 3I).
- إجراء تحليل، مثلاً، من برمجيات المصدر المفتوح أو برنامجنا متاح عند الطلب.
- تتبع الجزيئات واحدة في كلتا القناتين مترجمة، مثلاً، مع التتبع متعددة-الهدف10
ملاحظة: الخطوة 2.4.13 الاحتياجات الأولية المعرفة (تجريبية) حول ديفوسيبيليتي البروتينات ذات الصلة بتعيين شروط الحدود بشكل صحيح. عادة، إيجاد شروط الحدود الصحيحة عملية تكرارية.
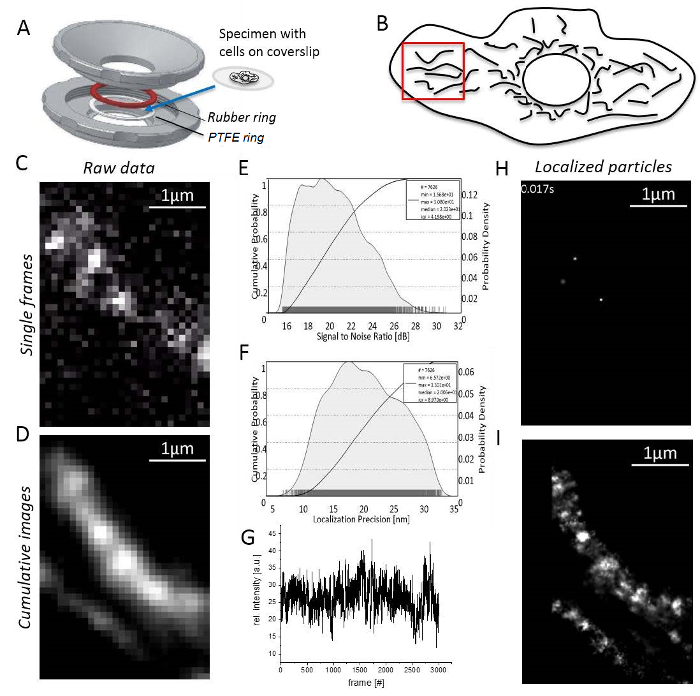
الشكل 3 : خطوات أثناء الفحص المجهري التعريب جزيء واحد. يتم تحميل ساترة (A) A مع العينة بين الجزء العلوي والسفلي (رمادي) لصاحب العينة محلية الصنع (مصممة حسب J. بريتر-هان). حلقة مطاط (أحمر) وعصابة PTFE (أبيض) ختم النظام من أعلى وأسفل ساترة، عندما تكون أجزاء العينة-حامل الترباس معا. (ب) إشارة إلى نسبة الضوضاء إشارة جمهورية ترانسنيستريا المولدوفية. (ج) حساب التعريب دقة الرسم البياني لجزيئات كل مترجم. (د) اختيار منطقة معقولة للتصوير، وهنا، على هامش الخلية بوضوح فصل الميتوكوندريا. (ه) تسجيل ومعالجة الصور: يتم عرض إطار واحد مع إشارات مميزة جزيء واحد (هنا، سجلت الجزيئات واحدة من السيرة الذاتية-هالوتاج/جمهورية ترانسنيستريا المولدوفيةهتل ). (و) "كثافة لجمهورية ترانسنيستريا المولدوفية" على وقت التسجيل. (ز) المجموع التراكمي صورة إطارات 3,000، غير المجهزة. (ح) جسيمات من السيرة الذاتية-هالوتاج/جمهورية ترانسنيستريا المولدوفيةهتل المترجمة مع وظيفة غاوسي 2D من إطار واحد. (أنا) التراكمية، تقديم الصورة مجموع عرض جميع الجسيمات السيرة الذاتية-هالوتاج/جمهورية ترانسنيستريا المولدوفيةهتل مترجمة من إطارات 3,000. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Access restricted. Please log in or start a trial to view this content.
النتائج
يمكن أن يساعد تحليل التصوير وكولوكاليزيشن متعدد الألوان تحديد الترجمة sub-أورجانيلار للبروتينات. أظهرنا ذلك في وقت سابق مع الفوسفاتيز سيتوسوليك وتنزين المناظرة، PINK1، يحتوي على مواقع فرعية المتقدرية مختلفة نظراً للتجهيز البروتياز المتقدرية17. PINK1 عاملاً هاما...
Access restricted. Please log in or start a trial to view this content.
Discussion
هنا، قدم تقنية للتعريب جزيء واحد لون مزدوج من البروتينات الغشاء المتنقلة. بعد البروتوكول، وبروتينات الغشاء تنصهر فيها لذاتي وسم البروتينات التي تتفاعل مع الأصبغة والرودامين جمهورية ترانسنيستريا المولدوفية وسيدي مترافق لركائز كل منها على. والرودامين الأصباغ هي مشرق وفوتوستابل، وتسمح ب?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
المؤلف يود أن يشكر مجموعة الفيزياء الحيوية وبلير جاكوب في جامعة أوسنابروك للدعم المستمر وولاديسلاو كول للمساعدة التقنية، وإعداد المواد ومجلس سيلنانوس لتقديم مجاهر للاستخدام. وقد مولت المشروع SFB 944.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M) (HEPES) | Biochrom | #1104E | |
| DC1: Dichroid beam splitter | Chroma | 640 dcxr | NC506031 |
| DC2: Polychroic Mirror, beamsplitter | Chroma | zt405/488/561/640rpc | discontinued |
| Dulbecco´s Phosphate-Buffered Saline (PBS) 1x (w/o Ca & Mg) | Sigma-Aldrich & Co. | #RNBF8311 | |
| Earle´s MEM without phenol red, without L-Glutamine and without NaHCO3 containing 1% FBS, 0.1% HEPES, 0.1% NEAA, 0.1% Alanyl-L-Glutamine and 34.78% sodium hydrogen carbonate (NaHCO3 0.75g/l) | Imaging medium | ||
| Earle´s minimum essential medium (MEM) with phenol red, containing 1% Fetal Bovine Serum Superior (FBS), 0.1% HEPES (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M), and 0.1% non-essential amino acids (NEAA) | Growth medium | ||
| EF: Emission filter quadbandpass | AHF analysentechnik | F72-866 | Brightline HC 446 nm/523 nm/600 nm/677 nm |
| EMCCD camera | Andor | Andor iXON 897 | EMCCD camera |
| Emission filter QuadView filter cubes, orange | AHF analysentechnik | F39-637 | bandpass 582 - 619 nm |
| Emission filter QuadView filter cubes, red | Chroma | bandpass 655 - 725 nm (HQ 690/70) | |
| FBS (Fetal bovine serum) superior | Biochrom | S0615 | |
| Fluorescent beads: TetraSpeck™ Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Thermo Fisher Scientific | T7279 | fluorescent microspheres |
| Glutamine | Biochrom | #0951C | |
| HeLa cells | DSMZ | ACC-57 | Cervical carcinoma cells from patient Henrietta Lacks |
| Hela cells CI::paGFP, stable | Muster et al., PLOSOne 2010 | ||
| Hela cells CV g::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Hela cells Tom20::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Image splitter | Photometrics | Dual-View QV2 | image splitter emission |
| Imaging processing software | ImageJ2 / Fiji | freeware | |
| Immersion Oil - ImmersolTM 518 F (ne = 1.518, ve = 45) | Carl Zeiss Jena GmbH | 444960-0000-000 | |
| Inverted epifluorescence microscope | Olympus IX-71/73/83 | ||
| Laser 561 nm, 200 mW | CrystaLaser | CL-561-200 | 561 nm emission |
| Laser 642 nm, 140 mW | Omicron | Luxx-642-140 | 642 nm emission |
| MATLAB | MathWorks | version R2013a | |
| MEM with Earle's Balanced Salt Solution 2.2 g/L NaHCO3, stable glutamine w/o PR | Biochrom | FG-0385 | |
| MEM with Earle's Balanced Salt Solution with 2.2 g/L NaHCO3, stable glutamine, Phenolred | Biochrom | FG-0325 | |
| MitoTracker® Deep Red FM | Thermo Fisher Scientific | M22426 | dye |
| MitoTracker® Green FM | Thermo Fisher Scientific | M7514 | dye |
| Multi-mode-optical polarization maintaining monomode fiber | Pointsource/Qioptiq | KineFLEX | |
| NHS-PEG-MAL, Rapp Polymer | Rapp Polymere GmbH Tübingen | coverslip coating | |
| non-essential amino acids (NEAA) | Biochrom | #0802E | |
| PEG 800 (Polyethylene glycol) 10 % | Carl Roth GmbH | Art No. 0263.1 | coverslip coating |
| Penicillin/Streptomycin | Biochrom | #0122E | |
| Plasmid for PINK1-Halo7-Tag expression | Beinlich et al., ACS Chemical Biology 2015 | ||
| Poly-L-lysine (1.2 mg/ml) | Sigma-Aldrich & Co. | Cat. No.P9155 | coverslip coating |
| RGD Peptide (Ac-CGRGDS-COOH) | Coring System Diagnostix GmbH, Gernsheim | coverslip coating / Intergrin receptor motif | |
| Silicon Rhodamine linked to HaloTag®-Ligand (SiRHTL) | personal gift from Kai Johnson | dye | |
| Software analysis plugin | self-written C. P. Richter, Biophysik Osnabrück | SLIMFAST 16g | |
| Tetramethylrhodamine / SNAP-Cell® TMR-Star linked to SNAP-Ligand (TMRstar) | New England Biolab® | S9105S | dye |
| Tetramethylrhodamine linked to HaloTag®-Ligand (TMRHTL) | Promega | G8251 | dye |
| TIRF condensor | Olympus | Cell^TIRF MITICO System | TIRF condensor |
| TIRF microscope controlling software | Olympus cellSens 1.12 | ||
| TIRF objective | Olympus | 150x oil objective (N.A. 1.45; Olympus UAPO) | |
| Trypsin/EDTA 10x | Biochrom | #0266 | |
| Water H2O 99,5 % Rotipuran® Low organic | Carl Roth GmbH | Art. No. HN57.1 |
References
- Appelhans, T., Richter, C., Wilkens, V., Hess, S., Piehler, J., Busch, K. Nanoscale organization of mitochondrial microcompartments revealed by combining tracking and localization microscopy. Nano Letters. 12 (2), 610-616 (2012).
- Appelhans, T., Busch, K. Single Molecule Tracking and Localization of Mitochondrial Protein Complexes in Live Cells. Methods Mol Biol. 1567, 273-291 (2017).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3 (10), 793-795 (2006).
- Gould, T. J., Verkhusha, V. V., Hess, S. T. Imaging biological structures with fluorescence photoactivation localization microscopy. Nat Protoc. 4 (3), 291-308 (2009).
- Pennacchietti, F., Gould, T. J., Hess, S. T. The Role of Probe Photophysics in Localization-Based Superresolution Microscopy. Biophys J. 113 (9), 2037-2054 (2017).
- Wegel, E., Göhler, A., Lagerholm, B. C., Wainman, A. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific reports. , Available from: https://www.nature.com/articles/srep27290?WT.feed_name=subjects_physical-sciences (2016).
- Pellett, P., et al. Two-color STED microscopy in living cells. Biomedical Optics Express. 2 (8), (2011).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79(2016).
- Liss, V., Barlag, B., Nietschke, M., Hensel, M. Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy. Scientific Reports. 5, 17740(2015).
- Sergé, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nat Methods. 5 (8), (2008).
- Appelhans, T., Busch, K. B. Dynamic imaging of mitochondrial membrane proteins in specific sub-organelle membrane locations. Biophysical reviews. 9 (4), 345-352 (2017).
- Wilmes, S., et al. Triple-color super-resolution imaging of live cells: resolving submicroscopic receptor organization in the plasma membrane. Angewandte Chemie. 51 (20), 4868-4871 (2012).
- Niewidok, B., et al. Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. J Cell Biol. , (2018).
- Wurm, C. A., Jakobs, S. Differential protein distributions define two sub-compartments of the mitochondrial inner membrane in yeast. FEBS Lett. 580 (24), 5628-5634 (2006).
- Schmidt, R., Wurm, C. A., Punge, A., Egner, A., Jakobs, S., Hell, S. W. Mitochondrial cristae revealed with focused light. Nano Lett. 9 (6), 2508-2510 (2009).
- Kukat, C., Wurm, C. A., Spahr, H., Falkenberg, M., Larsson, N. G., Jakobs, S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Beinlich, F., Drees, C., Piehler, J., Busch, K. Shuttling of PINK1 between Mitochondrial Microcompartments Resolved by Triple-Color Superresolution Microscopy. ACS chemical biology. 10 (9), 1970-1976 (2015).
- Shim, S., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. 109 (35), 13978-13983 (2012).
- Sbalzarini, I., Mezzacasa, A., Helenius, A., Koumoutsakos, P. Effects of Organelle Shape on Fluorescence Recovery after Photobleaching. Biophysical Journal. 89 (3), 1482-1492 (2005).
- Reits, E., Neefjes, J. From fixed to FRAP: measuring protein mobility and activity in living cells. Nature Cell Biology. 3 (6), E145-E147 (2001).
- Goehring, N., Chowdhury, D., Hyman, A., Grill, S. FRAP Analysis of Membrane-Associated Proteins: Lateral Diffusion and Membrane-Cytoplasmic Exchange. Biophysical Journal. 99 (8), 2443-2452 (2010).
- Bacia, K., Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: principles and applications. Cold Spring Harbor protocols. 2014 (7), 709-725 (2014).
- Sukhorukov, V., Dikov, D., Busch, K., Strecker, V., Wittig, I., Bereiter-Hahn, J. Determination of protein mobility in mitochondrial membranes of living cells. Biochimica et biophysica acta. 1798 (11), 2022-2032 (2010).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Graham, F. L., van der Eb, A. J. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52 (2), 456-467 (1973).
- Wedeking, T., et al. Spatiotemporally Controlled Reorganization of Signaling Complexes in the Plasma Membrane of Living Cells. Small. 11 (44), 5912-5918 (2015).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280 (1), 715-721 (2005).
- Poot, M., et al. Analysis of mitochondrial morphology and function with novel fixable fluorescent stains. J Histochem Cytochem. 44 (12), 1363-1372 (1996).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells (vol 5, pg 159). Nature Methods. 5 (5), 455(2008).
- Elmokadem, A., Yu, J. Optimal Drift Correction for Superresolution Localization Microscopy with Bayesian Inference. Biophys J. 109 (9), 1772-1780 (2015).
- Barlag, B., et al. Single molecule super-resolution imaging of proteins in living Salmonella enterica using self-labelling enzymes. Sci Rep. 6, 31601(2016).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5 (2), 159-161 (2008).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat Methods. 7 (5), 377-381 (2010).
- Jin, S., Youle, R. J. PINK1- and Parkin-Mediated Mitophagy at a Glance. Journal of Cell Science. 125, 795-799 (2013).
- Yamano, K., Youle, R. J. PINK1 is degraded through the N-end rule pathway. Autophagy. 9 (11), 1758-1758 (2013).
- Wiedemann, N., et al. Machinery for protein sorting and assembly in the mitochondrial outer membrane. Nature. 424 (6948), 565-571 (2003).
- Thompson, R., Larson, D., Webb, W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved