需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活体哺乳动物细胞器中单膜蛋白的多色定位显微术
摘要
在这里, 我们提出了一个协议的多颜色本地化的单膜蛋白在细胞器的活体细胞。要附加显影, 使用自贴标蛋白。蛋白质, 位于同一细胞器的不同的细胞膜车厢, 可以本地化的精度为 18 nm。
摘要
了解细胞 subcompartments 中蛋白质的定位是理解其特定功能的关键。在这里, 我们提出了一种超分辨率技术, 允许通过生成这些蛋白质的定位和跟踪图来确定蛋白质的 microcompartments。此外, 通过多色定位显微术, 可同时获得不同 subcompartments 蛋白质的定位和跟踪特征。该技术是特定的活细胞, 是基于重复成像的单一移动膜蛋白。感兴趣的蛋白质与特定的, 所谓的自我标记标签基因融合。这些标记是以共价键方式与基体反应的酶。共轭这些基板是荧光染料。酶标记的蛋白质与荧光标记的基质的反应导致标记的蛋白质。在这里, 四甲基罗丹明 () 和硅罗丹明 (先生) 被用作附着在酶基板上的荧光染料。通过在 pM 到 nM 范围内的基质浓度, 实现了分化学计量标记, 从而产生明显的信号。这些信号是本地化的 ~ 15–27纳米精度。该技术允许单一分子的多色成像, 即颜色的数量受可用的膜渗透染料和自标记酶的汇辑的限制。我们通过确定质量控制酶 (Pten) 诱导激酶 1 (PINK1) 在不同线粒体隔间的加工过程中对其他膜蛋白的定位, 证明了该技术的可行性。然而, 由于低标号度降低了同时标记两个相邻蛋白质的概率, 因此, 对单个分子的不同标记的单个蛋白质之间的真实物理相互作用的测试受到限制。虽然该技术对膜室中的成像蛋白很强, 但在大多数情况下, 不适宜确定高流动性可溶性蛋白的定位。
引言
本协议的目标是提供一种成像方法来定位和跟踪活细胞内的单膜蛋白。我们称这种方法跟踪和定位显微镜 (TALM)1,2。像随机光学重建显微镜 (风暴)3和荧光 Photoactivation 定位显微镜 ((F) 棕榈)4,5, TALM 是一个单一的分子为基础的荧光定位技术。然而, 这是不同的方式, 膜蛋白的流动性与重复成像的同一标记分子在不同的位置显示的 microcompartment, 可用于移动蛋白。换句话说, 蛋白质的可能的定位由细胞器的建筑学和由蛋白质1的流动性设置。该方法是互补的其他各种超分辨率技术6,7,8 , 因为它揭示了定位和弹道图的图像移动蛋白。标签是基于使用的基因工程融合蛋白本身是非荧光的。这些融合蛋白是自我标记的酶, 反应共价键与基体共轭染料。该程序具有标记度可由添加基板的数量控制的优点。此外, 它允许改变荧光的颜色, 取决于所选的共轭染料。几个自我标记酵素标记是可利用的9。使用自标记酶标签的另一个好处是, 共轭染料通常比荧光蛋白更稳定和明亮1 , 因此, 单个蛋白质可以记录更长更精确, 直到它们被漂白。这允许记录移动蛋白的轨迹和扩散系数的提取10,11。
在这里, 我们展示了 TALM 线粒体膜蛋白的可行性, 但它也可以应用于其他细胞内和外膜蛋白, 包括不同的细胞类型12,13。我们表明, 多色 TALM 进一步允许在不同 subcompartments 中的蛋白质同时区别于现有超分辨率荧光显微技术14,15, 16. TALM 与活细胞成像17兼容。所选 rhodamines 四甲基罗丹明和硅 Rhodamien (SiR) 的光物理, 特别是它们的亮度和稳定性, 允许在提供定位 (和轨迹) 图的多个帧上记录单个膜蛋白。然而, 由于运动模糊度太高, 且每帧采集的光子过低, 无法进行适当的定位, TALM 对高扩散系数可溶性蛋白的定位有限。此外, TALM 需要较少的励磁功率比例如风暴或被刺激的尾气损耗 (STED) 显微镜6,7, 减少光毒性作用。这是重要的, 因为光毒性重音经常影响 organellar 形态学18和因而机动性分析19。总之, 我们提出多色 TALM 在活细胞作为一种技术, 填补了本地化显微镜方法风暴/STED/(F) 棕榈和技术, 分析蛋白质的流动性, 如荧光恢复后漂白 (酶)20 ,21, 荧光相关光谱学 (FCS)22, 和荧光交叉相关光谱学 (FCCS)11,23。
Access restricted. Please log in or start a trial to view this content.
研究方案
以下议定书遵循地方机构研究道德委员会的准则。
1. 方法
-
细胞培养
- 培养细胞, 例如 HeLa 细胞 (人宫颈癌), 在一个 T25 细胞培养瓶包含5毫升生长培养基在37°c 和 5% CO2。
注: 用于成像, 将单元格拆分到准备好的盖玻片 (参见步骤1.3 和 1.4) 并保持成像介质。
- 培养细胞, 例如 HeLa 细胞 (人宫颈癌), 在一个 T25 细胞培养瓶包含5毫升生长培养基在37°c 和 5% CO2。
-
细胞转染
注: 使用细胞线稳定地表达标记的蛋白质, 只要可能24 , 以避免强烈的过度表达。对于瞬态转染, 应调整用于转染的质粒 DNA 量。例如, 当使用 Ca2 +磷酸盐转染25 , 染细胞 (80–90% 融合) 在3.5 厘米细胞培养皿与2.5–5µg 的质粒 DNA。在执行双转染时, 每种质粒结构使用2.5 µg。- 在双色实验中, 使用一个具有稳定表达的自贴标蛋白和瞬时染的细胞系与其他自标记蛋白17的质粒进行编码。
注: 在这里, 对于双色实验, 用 HeLa 细胞来稳定表达自标记蛋白 PINK1-Halo-Tag 和 Tom20-fSNAP-Tag。
- 在双色实验中, 使用一个具有稳定表达的自贴标蛋白和瞬时染的细胞系与其他自标记蛋白17的质粒进行编码。
-
清洁盖玻片
- 把盖玻片放在烧杯里。在装有盖玻片的烧杯中加入30毫升的 H2O, 轻轻摇动以除去表面的灰尘。
- 用镊子收集盖玻片, 用氮气流干。
- 清除盖玻片表面的任何有机污染,例如通过等离子清洗。
注: 为避免玻璃材料进一步污染, 在处理盖玻片时戴上手套。
注意: 当盖玻片被等离子清洗清洗时, 只有盖玻片的上部被清洗;使用这一侧的涂料与聚 l-赖氨酸-聚乙二醇-精氨酸-氨基氨酸-天门冬氨酸 (锁相环 PEG) (1.4) 和细胞播种 (第1.5 节)。
-
锁相环盖玻片涂层
注: PLL 是一种聚 l-赖氨酸 (pll) 衍生物, 附于聚乙二醇 (3000 Da) 和半胱氨酸-甘氨酸-氨酰胺-氨基乙酸-天门冬氨酸 (CGRGDS) 肽。锁相环绑定到负电荷的玻璃表面, 形成一个 PEG 刷。这大大减少了带电荧光染料不特异的结合。此外, 它还模仿整合素受体的信号肽, 从而促进整合蛋白介导的细胞黏附, 否则不容易坚持。- 准备 PLL, 如前所述26。简而言之, 在1毫升的 PBS 中溶解0.8 毫克的锁相环 PEG。在清洁盖玻片的上部添加10µL 的 PLL--
- 采取第二个盖玻片, 并将其干净的表面颠倒到第一个盖玻片 (有锁相环-在顶端下降);这就导致了两个盖玻片之间的锁相夹解。
- 小心地放置在烧杯中的夹盖玻片, 并在室温下孵化1小时的无尘干燥环境。
- 1小时后, 在烧杯中加入30毫升的 h2O, 以充分覆盖盖玻片的水。
- 轻轻摇动烧杯, 直到盖玻片分离。
- 用镊子将盖玻片从水中收集出来, 在氮气流下晾干。
注: 涂层的盖玻片可以储存在干燥, 无菌玻璃培养皿与盖子几天。
-
成像标本的制备
- 将单个涂层的盖玻片转移到35毫米细胞培养皿中, 锁相环--在表面朝上, 并在上面添加2毫升的成像介质。
- 添加 ~ 50万 trypsinized 细胞 (200–500µL), 在各自的膜蛋白上表达自贴标标签到2毫升成像培养基的细胞培养皿与涂层盖玻片。用手轻轻摇动, 以确保细胞均匀分布以获得均匀的细胞层。
- 孵育细胞在37°c 和 5% CO2直到80% 融合被到达。
注: 细胞标本应在成像前3天播种, 1 天前转染。细胞, 稳定表达的蛋白质的兴趣, 可以播种2天前成像。后来, 只有在盖玻片上生长的细胞才会被成像。
-
标记的蛋白质标记
注: 大多数荧光基底必须在无水的亚砜中溶解。当最终的标签浓度为 0.2–30 nM17时, 我们建议使用1µM 荧光基板的库存溶液。对于细胞内的成像膜蛋白, 使用膜通透荧光基质。- 在水浴中预热成像介质到37摄氏度。
- 将预热后的成像介质的1毫升吸管注入2毫升的管盖。添加0.2–30µL 的荧光基板从1µM 的库存解决方案, 以准备最终的标签解决方案 (最终浓度: 0.2–30 nM)。
- 漩涡的标签解决方案, 十年代。
- 用35毫米培养皿中的培养基替代盖玻片上的细胞 (见步骤 1.5), 用1毫升的制备标记溶液。
- 在37摄氏度和 5% CO2的标记溶液中孵化细胞 20–30 min。
- 用2毫升的 PBS 冲洗细胞, 然后用2毫升的成像培养基两次。最后, 将1毫升的新鲜成像培养基注入到细胞盘中, 并将样品放回孵化器中37摄氏度和 5% CO2 , 至少1小时。成像前, 再次交换成像介质。
注意: 第一次运行实验时, 通过用商用的细胞器特异性染料27、28来染色, 确认对自标记蛋白的正确靶向 organellar 膜。在这种情况下, 也使用100–200纳米基质为自标记酶产生强烈的信号。
-
荧光珠样品的制备
注意: 为了确定不同通道的光漂移和对齐图像, 使用了多色荧光珠 (0.1 µm)。利用所记录的图像, 将生成两个发射通道的仿射变换矩阵。- 将珠子的溶液稀释至 1%, 纯 H2O。
- 放置5滴准备好的解决方案与荧光珠在五个不同的位置上清洗盖玻片 (见步骤 1.3)。
- 让荧光珠样品干燥在干净的长凳上。
注: 样品可重复使用;因此, 用铝箔覆盖样品, 以避免污染, 并保持在4摄氏度。
2. 显微学
-
实验设置
注: 一种用于双色单分子成像的基本显微系统是以倒置显微镜为基础的: 它配备两个激光耦合, 通过多模光极化维持单模光纤进入单个总内反射 (公路)。冷凝器, 一种用于 TIRF、polyband 发射过滤器、图像分配器和高度敏感相机 (图 1) 的油浸泡目标。需要一个 TIRF 的冷凝器, 允许连续调谐的入射角度之间切换的 epi-, 高度倾斜和层压光学板 (高倾角薄照明 (希洛)29), 和优化的激励模式穿透深度。图像是获得一个高度敏感的冷却探测器系统,例如,一个背面照明电子倍增充电耦合设备 (EMCCD) 相机 (量子效率 QE > 90%) 或 sCMOS 相机 (QE > 80–90%)。- 确定光学漂移的成像荧光珠 (见步骤 2.2) 在相同的条件下将用于实验,例如, 当1万帧被记录在实验中, 记录也1万帧与珠样品。对于光学漂移的测定, 比较第一帧和最后获得的帧中的珠子位置 (图 1B)。如有必要, 以后更正图像系列为光学漂移30和/或使用漂移稳定的环境。
- 将过滤器立方体与适当的分色光束分配器 (例如, 用于橙色和红色荧光) 以及橙色荧光和红色荧光的适当发射过滤器一起装备。用合适的过滤器装备图像分配器。通过在两个通道中记录单个颜色样本 (图 1C), 检查从一个通道到另一个通道的信号可能泄漏。
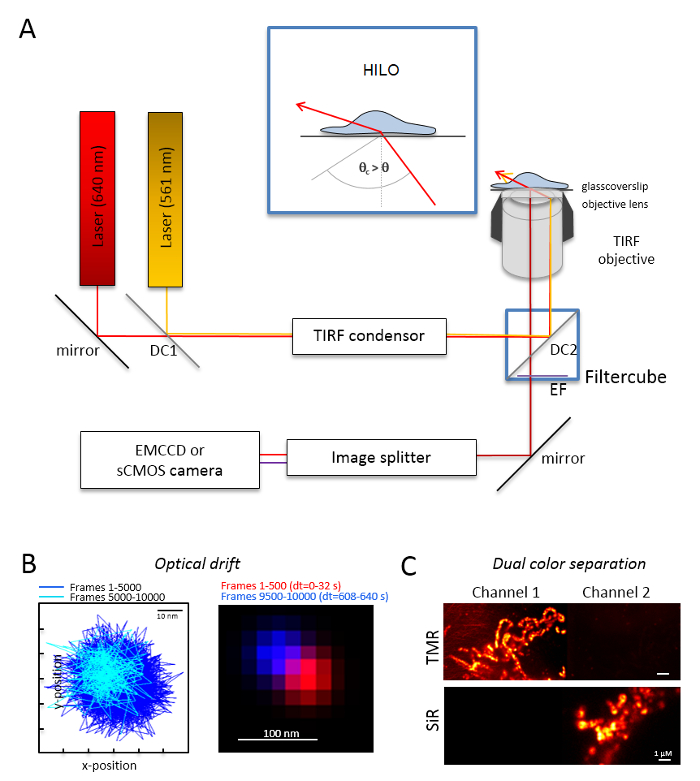
图 1: 用于多色跟踪和定位显微术 (TALM) 的光学布局, 带有橙色和红色发射器.(a) 倒置显微镜设置, 至少有两个励磁激光器, 一个 TIRF 冷凝器, 一个 TIRF 合适的目标, 一个图像分配器, 和一个敏感的相机。嵌入: 为了激发细胞内的胞器, 入射光束的角度必须设置小于 TIRF 的临界角, 以达到高度倾斜和层压的光片照明 (希洛)。DC1: 分色镜 1;DC2: 分色镜2。发射过滤器。(B) 对1万帧具有相同帧速率的荧光珠的成像位置进行光学漂移测试 (这里:15 Hz)。前500帧的连接位置和最后500帧显示漂移。此外, 与第一个和最后一帧的位置在红色和蓝色的合并图像显示最小漂移。漂移是信号中心之间的距离除以总记录时间, 这里 125 pm/秒. (C) 检查信号的清晰分离, 这里是和先生。对于这两种通道, 生成了来自3000帧 (1 通道和2通道中的 SiR) 的累计总和图像。HTL爵士隶属于 Tom20-HaloTag 和HTL OxPhos 复杂的 V HaloTag。颜色是假颜色。刻度条 = 100 毫微米 (B) 和1µm (C)。请单击此处查看此图的较大版本.
-
图像拆分器生成图像的物理对齐方式
注: 对于安装在盖玻片上的试样, 可以使用自制的样品架 (图 2A)。为了避免灰尘等落入样品中, 在安装时将培养基的盖子松散地放在房间的顶部。同样的样品持有者可用于安装盖玻片与荧光珠或细胞;当细胞被成像, 添加 0.5–0.8 mL 的成像介质。图像拆分器将图像拆分为两个或两个以上的光谱分离通道, 并将它们并排投射到同一台照相机上。这一过程可能会导致通道之间的系统扭曲, 由于不同的光学路径走过和阻碍直接定位分析。因此, 首先执行物理对齐和第二个, 后校正与转换矩阵的对齐。对于两个对准过程, 荧光珠应 homogenously 分布在整个视野。- 将所制备的样品与聚四氟乙烯 (PTFE) 环和红色橡胶环 (图 2A) 之间的样品夹中的荧光珠装上。
- 开始显微镜, 所有的硬件组件, 和所有的显微镜所需的软件。
- 清洁的目的和底部的盖玻片与无绒组织擦拭湿润与异丙醇。然后用新鲜的不起毛的纸巾把两个东西都晒干。在物镜的瞳孔上放置一滴浸入油。
- 将样品持有人与珠子样品放到显微镜台上, 使盖玻片的底部与油接触。使用透射光或激光线将焦点放在珠子上。
- 调整两个励磁激光器的功率, 在两个荧光通道中达到相似的信号强度。搜索具有许多不同荧光信号的区域。
- 使用照相机控制软件生成荧光通道的合并视图。然后使用图像拆分器上的螺钉手动倾斜图像分配器的内部镜像, 以实现两个荧光通道中信号的最佳叠加 (图 2B)。
注意:注意!不要超过相机的动态范围。
-
利用空间变换软件实现光谱分离信道的对准
注: 以下部分显示了与我们的软件插件 (根据要求提供) 后校正和本地化程序。- 启动 TIRF 显微镜控制软件, 并选择在实时流模式下显示各个频道。在所有通道中拍摄快照图像激发荧光 (图 2C)。
- 使用此快照图像可生成转换矩阵 (请参见图 2)。
注: 转换矩阵用于空间变换, 通常为仿射式, 用于修正平移 (信号从单点源到两通道之间的发散)。 - 启动软件分析插件 (可以根据要求从我们的实验室获得, 见图 2C)。
- 加载以前录制的双色图像 (参见步骤 2.2) 的荧光珠进入软件。选择荧光通道的使用方向。 然后, 当要求 "校准图像" 并选择以前拍摄的快照时, 单击 "是"。
- 打开 "单元管理器" 以定义单位换算因子 (像素大小、帧速率、光子转换因子)。
- 打开 "本地化管理器"。首先确定点扩展函数 (PSF)。按下按钮: "PSF 半径"。在打开的 "PSF 估计" 窗口中, 定义数值孔径和发射最大值。单击 "估计 PSF 半径"。接受所获得的实验性的聚砜. 定义评估框、通货紧缩循环数以及计算机的核心用于计算。按 "本地化" 开始拟合一个2D 对称高斯函数的单个粒子的强度分布 (图 2C)。
- "接受" 获得的实验性聚砜. 定义评估框、通货紧缩循环数以及计算机的核心用于计算。按 "本地化" 开始拟合一个2D 对称高斯函数的单个粒子的强度分布 (图 2C)。
- 打开 "校准管理器"。在两个通道的呈现合并图像中, 显示原始信号和本地化中心。选择 "仿射" 模式。通过绘制连接线, 手动连接来自同一荧光珠的两个通道中相应的本地化中心对。
- 连接在整个视野中分布的相应信号。在此之后, 按 "接受"。保存校准。
注意: 空间变换在每个荧光珠上取样并插在中间。提取的转换函数表示一个位移场Δr (x, y), 用于随后纠正实验性双色单分子定位, 使它们覆盖在其定位精度。空间变换矩阵通常是一个仿射式的, 它可以校正具有纳米精度的通道之间的平移、缩放和旋转, 并可从本手册一对一映射中推断出 (图 2C)。
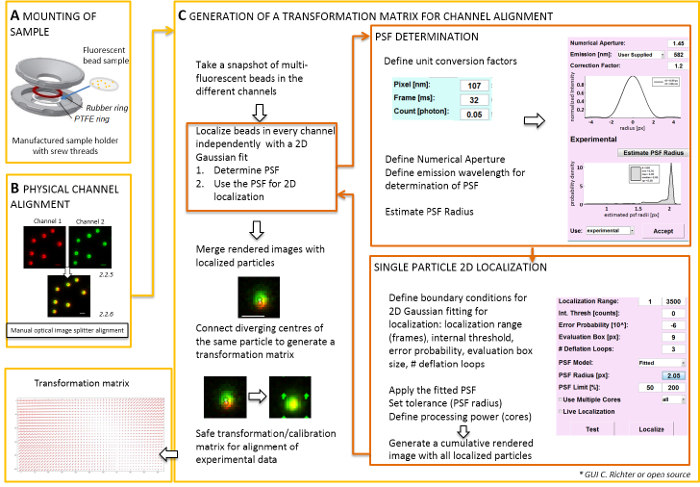
图 2: 双色对齐的工作流.(a) 与荧光珠的盖玻片安装在聚四氟乙烯和橡胶环之间的样品架上。然后, 房间的上部和下部被栓在一起。(B) 图像拆分器生成的通道视图的物理对齐方式。从珠子 (0.1 µm) 在两个通道 (绿色和红色, 假颜色) 的记录荧光信号合并。在光学图像分配器上的相应螺钉被手动转动, 直到达到不同信号的最佳叠加 (黄色、下面板)。(C) 生成用于后过程性通道对齐的转换矩阵。为了精确定位粒子, 有必要确定点扩散函数 (PSF) 依赖于发射波长和数值孔径的目标。通过对称二维高斯拟合的强度剖面, 可以确定聚砜的中心。由此产生的信号峰值的定位, 然后投射到原始的, 模糊的信号。在合并图像中, 两个通道中信号的本地化中心连接以生成一个转换矩阵, 以后用于实验数据的后过程性对齐。刻度条 = 1 µm (B, C)。请单击此处查看此图的较大版本.
-
线粒体膜蛋白的单分子成像
注: 所有实验均在室温下进行。在31成像前, T 细胞或非黏附细胞必须固定在琼脂糖中。- 在橡胶和聚四氟乙烯环之间的盖玻片上贴上附着细胞的标本 (图 3A)。用 0.5–0.8 mL 成像培养基填充腔室。
- 重复步骤 2.2. 2–2.2. 5。
- 调整光照角度 TIRF 显微镜控制软件, 以创建一个比临界角度小的入射角度, 以激发特定区域的兴趣通过希洛表32 (希洛模式,图 1A)。
注意: 避免与激光光束直接接触! - 设置 EM 增益, 并选择合适的曝光时间为实验收集足够的光子每帧。
- 设置激光功率以实现高信号到噪声 (S/n) 比率 (图 3B), 因为定位精度直接对应于33 (图 3C)。
- 在细胞周围找到一个不重叠、拉长的线粒体和单个分子信号的区域 (图 3D;辅助视频 1)。如果没有单一的分子信号是可见的, 等待, 直到漂白结果出现单分子信号 (图 3E)。
- 记录, 直到信号的数量过低, 以合理的延续 (通常1,000–10,000 帧取决于荧光染料的漂白行为,图 3F)。
- 启动图像处理软件并检查线粒体结构, 方法是生成至少1000个记录帧的累计呈现总和图像 (图 3G)。
注意: 最快的帧速率由读出区域决定。一个通道的视图字段由双色图像拆分器 (512 x 512 像素) 减少到 256 x 512 像素, 并将四色到 256 x 256 像素。因此, 对于使用两种颜色的图像拆分器, 这是 30 Hz. 设置帧传输模式以达到尽可能低的读出时间。 - 启动软件分析插件并加载原始数据。选择通道方向并加载图像。当要求 "校准图像" 时, 请使用步骤2.3.9 中的转换矩阵。通道将被单独显示。
- 像以前一样打开 "单元管理器" 来定义每个通道的单位换算系数。为每个通道打开 "本地化管理器"。然后定义评估框, 通货紧缩循环的数量, 添加理论的 PSF 为使用的条件和设置多少核心的计算机用于计算。最后, 按 "本地化" 获取局部化的单粒子 (图 3H;辅助视频 2)。
- 请注意, 该程序最终会生成一个显示所有本地化粒子的累计分辨图像 (图 3I)。
- 执行分析,例如, 通过开源软件或我们的软件可根据要求提供。
- 跟踪两个局部通道中的单个分子,例如, 用多目标示踪器10
注意: 步骤2.4.13 需要对感兴趣的蛋白质的扩散进行初步 (实验) 知识, 以正确设置边界条件。通常, 找到正确的边界条件是一个迭代过程。
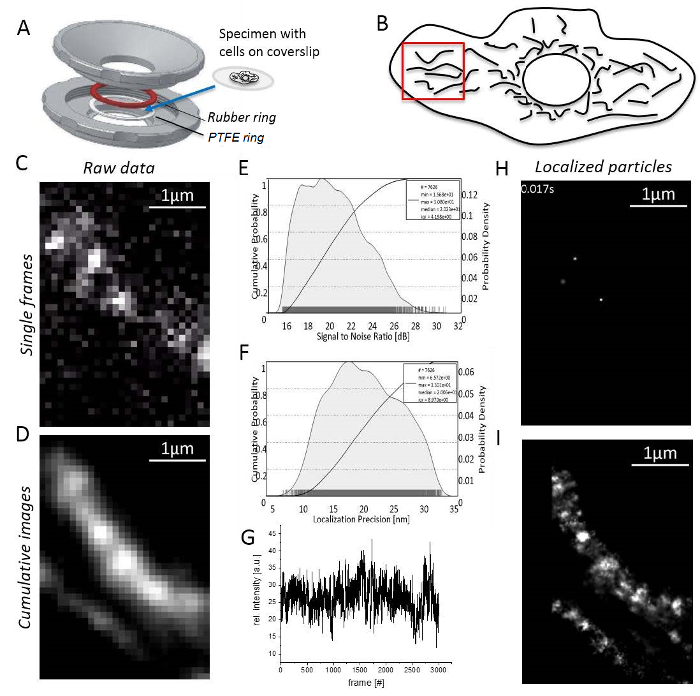
图 3: 单分子定位显微镜下的步骤.(a) 在自制样品持有者的顶部和底部 (灰色) 之间安装有标本的盖玻片 (j Bereiter-汉娜设计)。橡胶环 (红色) 和聚四氟乙烯环 (白色) 密封系统从上面和下面的盖玻片, 当样品持有人的零件是螺栓在一起。(B) 对该信号的信噪比。(C) 计算出所有局部粒子的定位精度直方图。(D) 选择一个合理的区域进行成像, 这里, 细胞周围有明确分离的线粒体。(E) 记录和图像处理: 显示单一的单一分子信号帧 (在这里, 记录 HaloTag/HTL的单分子)。(F) 在记录时间内的沿岸密度。(G) 3000 帧的累计总和图像, 未加工。(H) HaloTag/HTL的粒子在单个框架内与2D 高斯函数进行局部定位。(一) 累计、渲染和图像, 显示所有本地化的 CV HaloTag/HTL粒子来自3000帧。请单击此处查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
多色成像和定位分析可以帮助确定蛋白质的亚 organellar 定位。我们早先证明了这一点与胞浆磷酸酶和张力同系物, PINK1, 有不同的亚线粒体位置由于其处理的线粒体蛋白酶17。PINK1 是保证线粒体功能34,35的重要因素。为确定 PINK1 在不同线粒体隔间的定位过程 (图 4A), 进行了多色超分辨显微镜?...
Access restricted. Please log in or start a trial to view this content.
讨论
本文提出了一种移动膜蛋白双色单分子定位技术。根据该协议, 膜蛋白被融合到自我标记的蛋白质, 与罗丹明染料的反应, 和先生共轭他们各自的基质。罗丹明染料是明亮和 photostable, 从而允许重复成像1。为了取得成功, 必须牢记几个条件和关键主题。
首先, 选择适当的过滤器和分配器, 以便将其信号与船长分开是很重要的。为了减少细胞外的背景, 盖玻片的 pr...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者要感谢 Osnabrück 大学生物物理小组和雅各 Piehler 不断的支持, Wladislaw 科尔的技术援助和材料的制备, 以及 CellNanOs 板提供显微镜供使用。该项目由 SFB 944 资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M) (HEPES) | Biochrom | #1104E | |
| DC1: Dichroid beam splitter | Chroma | 640 dcxr | NC506031 |
| DC2: Polychroic Mirror, beamsplitter | Chroma | zt405/488/561/640rpc | discontinued |
| Dulbecco´s Phosphate-Buffered Saline (PBS) 1x (w/o Ca & Mg) | Sigma-Aldrich & Co. | #RNBF8311 | |
| Earle´s MEM without phenol red, without L-Glutamine and without NaHCO3 containing 1% FBS, 0.1% HEPES, 0.1% NEAA, 0.1% Alanyl-L-Glutamine and 34.78% sodium hydrogen carbonate (NaHCO3 0.75g/l) | Imaging medium | ||
| Earle´s minimum essential medium (MEM) with phenol red, containing 1% Fetal Bovine Serum Superior (FBS), 0.1% HEPES (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M), and 0.1% non-essential amino acids (NEAA) | Growth medium | ||
| EF: Emission filter quadbandpass | AHF analysentechnik | F72-866 | Brightline HC 446 nm/523 nm/600 nm/677 nm |
| EMCCD camera | Andor | Andor iXON 897 | EMCCD camera |
| Emission filter QuadView filter cubes, orange | AHF analysentechnik | F39-637 | bandpass 582 - 619 nm |
| Emission filter QuadView filter cubes, red | Chroma | bandpass 655 - 725 nm (HQ 690/70) | |
| FBS (Fetal bovine serum) superior | Biochrom | S0615 | |
| Fluorescent beads: TetraSpeck™ Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Thermo Fisher Scientific | T7279 | fluorescent microspheres |
| Glutamine | Biochrom | #0951C | |
| HeLa cells | DSMZ | ACC-57 | Cervical carcinoma cells from patient Henrietta Lacks |
| Hela cells CI::paGFP, stable | Muster et al., PLOSOne 2010 | ||
| Hela cells CV g::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Hela cells Tom20::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Image splitter | Photometrics | Dual-View QV2 | image splitter emission |
| Imaging processing software | ImageJ2 / Fiji | freeware | |
| Immersion Oil - ImmersolTM 518 F (ne = 1.518, ve = 45) | Carl Zeiss Jena GmbH | 444960-0000-000 | |
| Inverted epifluorescence microscope | Olympus IX-71/73/83 | ||
| Laser 561 nm, 200 mW | CrystaLaser | CL-561-200 | 561 nm emission |
| Laser 642 nm, 140 mW | Omicron | Luxx-642-140 | 642 nm emission |
| MATLAB | MathWorks | version R2013a | |
| MEM with Earle's Balanced Salt Solution 2.2 g/L NaHCO3, stable glutamine w/o PR | Biochrom | FG-0385 | |
| MEM with Earle's Balanced Salt Solution with 2.2 g/L NaHCO3, stable glutamine, Phenolred | Biochrom | FG-0325 | |
| MitoTracker® Deep Red FM | Thermo Fisher Scientific | M22426 | dye |
| MitoTracker® Green FM | Thermo Fisher Scientific | M7514 | dye |
| Multi-mode-optical polarization maintaining monomode fiber | Pointsource/Qioptiq | KineFLEX | |
| NHS-PEG-MAL, Rapp Polymer | Rapp Polymere GmbH Tübingen | coverslip coating | |
| non-essential amino acids (NEAA) | Biochrom | #0802E | |
| PEG 800 (Polyethylene glycol) 10 % | Carl Roth GmbH | Art No. 0263.1 | coverslip coating |
| Penicillin/Streptomycin | Biochrom | #0122E | |
| Plasmid for PINK1-Halo7-Tag expression | Beinlich et al., ACS Chemical Biology 2015 | ||
| Poly-L-lysine (1.2 mg/ml) | Sigma-Aldrich & Co. | Cat. No.P9155 | coverslip coating |
| RGD Peptide (Ac-CGRGDS-COOH) | Coring System Diagnostix GmbH, Gernsheim | coverslip coating / Intergrin receptor motif | |
| Silicon Rhodamine linked to HaloTag®-Ligand (SiRHTL) | personal gift from Kai Johnson | dye | |
| Software analysis plugin | self-written C. P. Richter, Biophysik Osnabrück | SLIMFAST 16g | |
| Tetramethylrhodamine / SNAP-Cell® TMR-Star linked to SNAP-Ligand (TMRstar) | New England Biolab® | S9105S | dye |
| Tetramethylrhodamine linked to HaloTag®-Ligand (TMRHTL) | Promega | G8251 | dye |
| TIRF condensor | Olympus | Cell^TIRF MITICO System | TIRF condensor |
| TIRF microscope controlling software | Olympus cellSens 1.12 | ||
| TIRF objective | Olympus | 150x oil objective (N.A. 1.45; Olympus UAPO) | |
| Trypsin/EDTA 10x | Biochrom | #0266 | |
| Water H2O 99,5 % Rotipuran® Low organic | Carl Roth GmbH | Art. No. HN57.1 |
参考文献
- Appelhans, T., Richter, C., Wilkens, V., Hess, S., Piehler, J., Busch, K. Nanoscale organization of mitochondrial microcompartments revealed by combining tracking and localization microscopy. Nano Letters. 12 (2), 610-616 (2012).
- Appelhans, T., Busch, K. Single Molecule Tracking and Localization of Mitochondrial Protein Complexes in Live Cells. Methods Mol Biol. 1567, 273-291 (2017).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3 (10), 793-795 (2006).
- Gould, T. J., Verkhusha, V. V., Hess, S. T. Imaging biological structures with fluorescence photoactivation localization microscopy. Nat Protoc. 4 (3), 291-308 (2009).
- Pennacchietti, F., Gould, T. J., Hess, S. T. The Role of Probe Photophysics in Localization-Based Superresolution Microscopy. Biophys J. 113 (9), 2037-2054 (2017).
- Wegel, E., Göhler, A., Lagerholm, B. C., Wainman, A. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific reports. , Available from: https://www.nature.com/articles/srep27290?WT.feed_name=subjects_physical-sciences (2016).
- Pellett, P., et al. Two-color STED microscopy in living cells. Biomedical Optics Express. 2 (8), (2011).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79(2016).
- Liss, V., Barlag, B., Nietschke, M., Hensel, M. Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy. Scientific Reports. 5, 17740(2015).
- Sergé, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nat Methods. 5 (8), (2008).
- Appelhans, T., Busch, K. B. Dynamic imaging of mitochondrial membrane proteins in specific sub-organelle membrane locations. Biophysical reviews. 9 (4), 345-352 (2017).
- Wilmes, S., et al. Triple-color super-resolution imaging of live cells: resolving submicroscopic receptor organization in the plasma membrane. Angewandte Chemie. 51 (20), 4868-4871 (2012).
- Niewidok, B., et al. Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. J Cell Biol. , (2018).
- Wurm, C. A., Jakobs, S. Differential protein distributions define two sub-compartments of the mitochondrial inner membrane in yeast. FEBS Lett. 580 (24), 5628-5634 (2006).
- Schmidt, R., Wurm, C. A., Punge, A., Egner, A., Jakobs, S., Hell, S. W. Mitochondrial cristae revealed with focused light. Nano Lett. 9 (6), 2508-2510 (2009).
- Kukat, C., Wurm, C. A., Spahr, H., Falkenberg, M., Larsson, N. G., Jakobs, S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Beinlich, F., Drees, C., Piehler, J., Busch, K. Shuttling of PINK1 between Mitochondrial Microcompartments Resolved by Triple-Color Superresolution Microscopy. ACS chemical biology. 10 (9), 1970-1976 (2015).
- Shim, S., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. 109 (35), 13978-13983 (2012).
- Sbalzarini, I., Mezzacasa, A., Helenius, A., Koumoutsakos, P. Effects of Organelle Shape on Fluorescence Recovery after Photobleaching. Biophysical Journal. 89 (3), 1482-1492 (2005).
- Reits, E., Neefjes, J. From fixed to FRAP: measuring protein mobility and activity in living cells. Nature Cell Biology. 3 (6), E145-E147 (2001).
- Goehring, N., Chowdhury, D., Hyman, A., Grill, S. FRAP Analysis of Membrane-Associated Proteins: Lateral Diffusion and Membrane-Cytoplasmic Exchange. Biophysical Journal. 99 (8), 2443-2452 (2010).
- Bacia, K., Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: principles and applications. Cold Spring Harbor protocols. 2014 (7), 709-725 (2014).
- Sukhorukov, V., Dikov, D., Busch, K., Strecker, V., Wittig, I., Bereiter-Hahn, J. Determination of protein mobility in mitochondrial membranes of living cells. Biochimica et biophysica acta. 1798 (11), 2022-2032 (2010).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Graham, F. L., van der Eb, A. J. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52 (2), 456-467 (1973).
- Wedeking, T., et al. Spatiotemporally Controlled Reorganization of Signaling Complexes in the Plasma Membrane of Living Cells. Small. 11 (44), 5912-5918 (2015).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280 (1), 715-721 (2005).
- Poot, M., et al. Analysis of mitochondrial morphology and function with novel fixable fluorescent stains. J Histochem Cytochem. 44 (12), 1363-1372 (1996).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells (vol 5, pg 159). Nature Methods. 5 (5), 455(2008).
- Elmokadem, A., Yu, J. Optimal Drift Correction for Superresolution Localization Microscopy with Bayesian Inference. Biophys J. 109 (9), 1772-1780 (2015).
- Barlag, B., et al. Single molecule super-resolution imaging of proteins in living Salmonella enterica using self-labelling enzymes. Sci Rep. 6, 31601(2016).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5 (2), 159-161 (2008).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat Methods. 7 (5), 377-381 (2010).
- Jin, S., Youle, R. J. PINK1- and Parkin-Mediated Mitophagy at a Glance. Journal of Cell Science. 125, 795-799 (2013).
- Yamano, K., Youle, R. J. PINK1 is degraded through the N-end rule pathway. Autophagy. 9 (11), 1758-1758 (2013).
- Wiedemann, N., et al. Machinery for protein sorting and assembly in the mitochondrial outer membrane. Nature. 424 (6948), 565-571 (2003).
- Thompson, R., Larson, D., Webb, W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。