このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単一の膜タンパク質生きた哺乳類細胞の細胞内小器官のマルチカラー ローカリゼーション顕微鏡
要約
生きた細胞の細胞内小器官のマルチカラー単一膜蛋白質のローカリゼーションのためのプロトコルを紹介します。蛍光物質を添付、自己ラベリング タンパク質を使用します。~ 18 の精度と同じ細胞小器官の異なる膜コンパートメントに位置するタンパク質をローカライズできる nm。
要約
特定の機能を理解する細胞間のタンパク質の局在についての知識は欠かせません。ローカリゼーションを生成し、これらのタンパク質のマップを追跡によって蛋白質のためアクセスされる microcompartments の定量では、超解像技術を紹介します。また、マルチカラー ローカリゼーション顕微鏡による局在と別の間の蛋白質のプロファイルを追跡ができた。技術は生きているセルの特定、単一のモバイル膜タンパク質の反復的なイメージングに基づきます。興味の蛋白質遺伝子特定、いわゆる自主表示のタグが付いています。これらのタグは、共有結合に基質と反応する酵素です。蛍光染料は、これらの基板に活用されます。蛍光とタグ付きの酵素タンパク質の反応は、分類された蛋白質の基板結果をラベル付けします。ここでは、Tetramethylrhodamine (TMR) とシリコン ローダミン (SiR) は、酵素の基板に接続されている蛍光色素として使用されます。NM の範囲に午後の基質濃度を使用して、亜化学量論的ラベリングを実現、明確なシグナル。これらの信号は 〜 15-27 でローカライズされた nm 精度。テクニックが利用可能な膜透過性染料と酵素を自己ラベリングのレパートリーによって色の数を制限するという単一の分子のマルチカラー イメージングできます。品質管理酵素 (Pten) の局在を決定することにより技術の実現可能性を示す-他の膜タンパク質に関連して処理中に別のミトコンドリア コンパートメントにキナーゼ 1 (PINK1) を誘発します。1 分子 FRET または共同追跡によって異なるラベルの単一蛋白質の物理的な相互作用真のテストは、低ラベル度同時にラベルの付いた 2 つの隣接する蛋白質を持っていることの確率を減少するため、しかし制限です。テクニックは膜コンパートメントに蛋白質のイメージングのために強いが、ほとんどの場合じゃない機動性の高い水溶性タンパク質の局在を決定する適切です。
概要
このプロトコルの目標は、ローカライズし、生きた細胞内の単一の膜タンパク質を追跡するイメージング法を提供することです。このメソッドの追跡およびローカリゼーション顕微鏡 (TALM) の1,2と呼びます。確率光再建顕微鏡 (嵐)3など蛍光光局在顕微鏡 ((F) パーム)4、5TALM、単一分子蛍光ローカリゼーション手法です。ただし、同じ反復法を用いた膜タンパク質の組み合わせの移動はモバイルの蛋白質にアクセス microcompartment の明らかに異なる位置で分子をラベル方法で明瞭です。つまり、タンパク質の可能な限りのローカライズは、細胞小器官の構造、蛋白質1の移動に設定されています。メソッドは、ローカリゼーションおよび軌道イメージング モバイル蛋白質によってマップを明らかにするために様々 な他超解像技術6,7、8を補完するものです。ラベルは、それ自体非蛍光性は、遺伝子組み換えの融合蛋白質を使用してに基づいています。これらの融合蛋白質を染料に共役基板と反応して共有結合酵素自己ラベリングします。この手順ラベリング度ことができる利点があります追加基板の量によって制御されます。さらに、選択した共役系色素によって蛍光の色が変化することができます。自主表示タグ酵素がいくつかは、使用可能な9です。彼らは漂白まで正確に酵素タグを自己ラベリングは、共役系色素が通常より安定し、蛍光タンパク質1と個々 の蛋白質従って記録できるもはやより明るいなどを使用して別の利点。これにより、モバイルの蛋白質の軌跡の記録と拡散係数10,11の抽出。
ここでは、ミトコンドリア膜タンパク質と TALM の可能性を示すが、別のセル型12,13を含む、他の内極細胞膜タンパク質も適用できます。マルチカラー TALM さらに既存超解像蛍光顕微鏡技術14,15,に補完の別の間で蛋白質の同時の区別のためにことを示す16. ライブセル イメージング17と互換性のある TALM。光物理 Tetramethylrhodamine (TMR) とシリコン Rhodamien (SiR) の選ばれた rhodamines の特に明るさと安定性、そのすることができますレコードの単一膜タンパク質局在 (および軌道) のマップを提供する複数のフレームを。しかし、TALM は、モーション ブラーが高すぎると、フレームごと収集した光子が適切なローカライズの低すぎるので高拡散係数を持つ可溶性タンパク質の局在化のため制限されます。以外にも、TALM は、光毒性の影響を減らすよりも、たとえば嵐または誘導放出の枯渇 (STED) 顕微鏡6,7励振電力を必要とします。核形態18およびこうして移動解析19光毒性ストレスにしばしば影響を与えるので、これは重要です。合計では、ローカリゼーション顕微鏡方法嵐/STED の間のギャップを埋める手法として生きている細胞のマルチカラー TALM を提示 (F) パームと退色後蛍光回復など蛋白質の移動性を分析する手法 (FRAP)20/蛍光、蛍光相関分光法 (FCS)22, ,21クロス相関分光法 (FCCS)11,23。
プロトコル
次のプロトコル ローカル施設研究倫理委員会のガイドラインに従います。
1. メソッド
-
細胞培養
- たとえば HeLa 細胞 (ひと子宮頚部癌)、37 ° C、5% CO2で成長培地 5 mL を含むコート t25 フラスコ細胞培養用フラスコ、細胞を養います。
注: 画像処理、(1.3 と 1.4 の手順を参照してください) 準備のカバーガラス上セルを分割および媒体をイメージングしてください。
- たとえば HeLa 細胞 (ひと子宮頚部癌)、37 ° C、5% CO2で成長培地 5 mL を含むコート t25 フラスコ細胞培養用フラスコ、細胞を養います。
-
細胞のトランスフェクション
注: が安定して可能な限りの付けられた蛋白質を表現する細胞を使用して強力な発現を避けるために24 。一過性トランスフェクションのプラスミド DNA トランスフェクションに使用量を適応します。たとえば、Ca2 +リン酸トランスフェクション25を使用すると、2.5-5 μ g のプラスミド DNA と 3.5 cm 細胞培養皿の細胞 (80-90% の confluency) を transfect します。ダブル トランスフェクションを実行すると、各プラスミド構築あたり 2.5 μ g を使用します。- デュアル カラー実験のセルラインを使用し 1 つの自己ラベリング タンパク質を安定に発現とエンコード、他自己ラベリング タンパク質17プラスミド transfect 一過性。
注: ここでは、デュアル カラー実験、HeLa 細胞使用された安定 PINK1-ハロー-タグと Tom20 fSNAP タグ セルフラベ蛋白質を表現します。
- デュアル カラー実験のセルラインを使用し 1 つの自己ラベリング タンパク質を安定に発現とエンコード、他自己ラベリング タンパク質17プラスミド transfect 一過性。
-
Coverslips のクリーニング
- ビーカーに coverslips の場所。含む、coverslips ビーカーに H2O の 30 mL を追加し、軽く振る彼らの表面のほこりを除去します。
- ピンセットで、coverslips を収集し、窒素のストリームで乾かします。
- プラズマ クリーニング coverslips、例えばの表面の任意の有機物汚染を削除します。
注: さらにガラス材料の汚染を防止するには、coverslips の処理中に手袋を着用します。
注意: coverslips のプラズマ洗浄による清掃は、coverslips の上側だけがヨキします。ポリ L リジン ポリエチレン グリコール-アルギニン-グリシン-アスパラギン酸 (PLL-ペグ-RGD) (セクション 1.4) のコーティングとの細胞播種 (セクション 1.5) のこの側面を使用します。
-
PLL ペグ RGD Coverslip コーティング
注: PLL ペグ RGD、ポリエチレン ・ グリコール (3,000 Da) と cysteine-glycine-arginine-glycine-aspartate-serine (CGRGDS) ペプチド付けポリ L リジン (PLL) 派生したものです。PLL は負荷電ガラス表面に結合し、PEG ブラシを形成します。これは大幅に充電蛍光染料の非特異的結合を減少します。さらに、RGD モチーフはインテグリン受容体の信号のペプチッドを模倣し、それ以外の場合、簡単に準拠していない細胞のインテグリンを介する付着をそれにより促進します。- 上記26として PLL ペグ RGD を準備します。一言で言えば、1 mL の PBS で PLL ペグ RGD の 0.8 mg を溶解します。きれいなカバーガラスの上側に PLL ペグ RGD 溶液 10 μ L を追加します。
- 2 番目の coverslip を取るし、(つまり PLL ペグ RGD ドロップを上にして) 最初 coverslip; に逆さまそのきれいな表面に配置この結果、2 つ coverslips 間 PLL ペグ RGD ソリューションを挟みます。
- 慎重にビーカーに挟まれた coverslips と無塵乾燥した環境で室温で 1 時間インキュベートします。
- 1 時間後 H2O の 30 mL を水で coverslips を完全にカバーするビーカーに追加します。
- Coverslips に分離するまで、ビーカーを軽く振る。
- ピンセットを使用して水から coverslips を集め、窒素ガスの流れの下でそれらを乾燥します。
注: コーティング coverslips は乾燥、滅菌ガラスふた付きシャーレで数日間格納できます。
-
イメージング用標本の作製
- PLL ペグ RGD 塗装面は上向きで 35 mm 細胞培養ディッシュ単一コーティング coverslips に転送し、媒体上の画像の 2 mL を追加します。
- セルを追加 〜 500,000 トリプシン (200-500 μ L) でコーティングされた coverslip で細胞培養皿の中をイメージング 2 mL にそれぞれ膜蛋白質自主表示のタグを表す。取得する細胞の均一な分布を確実に手で軽く振る、均一に細胞層。
- 80% の confluency に到達するまでは、37 ° C および 5% の CO2のセルを孵化させなさい。
注: セルのサンプルをイメージング前後 1 トランスフェクション前日の 3 日シードする必要があります。安定した興味の蛋白質を表現する細胞は、イメージングの前に 2 日をシード処理できます。その後、栽培上、セルだけが作成されます。
-
タグ付きタンパク質の分類
注: 最も蛍光基板水無料 DMSO に溶解する必要があります。最終表示濃度が 0.2-30 nM171 μ M 蛍光基板の原液を使用する勧めします。膜タンパク質の細胞内イメージング、膜透過性蛍光基板を使用します。- ウォーム アップ 37 の ° C の水浴中にイメージング媒体。
- ふた付き 2 mL チューブに予め温めておいた画像中の 1 mL のピペットします。最終的なラベル ソリューションを準備する 1 μ M 原液から蛍光基板の 0.2 – 30 μ L を追加 (最終濃度: 0.2-30 nM)。
- 渦 10 ラベル ソリューション s。
- 代わりに、上のセルで 35 mm ディッシュの培地 (手順 1.5 参照) 準備の 1 ml ラベル ソリューション。
- 20-30 分のための 37 ° C および 5% の CO2のラベル ソリューション内のセルを孵化させなさい。
- 一度、2 mL の PBS を 2 mL の培地を 2 回イメージング細胞を洗います。最後に、セル料理新鮮イメージング培地 1 mL をピペット、サンプルを 37 ° C、5% CO2で少なくとも 1 h の定温器に戻します。画像、前にイメージング媒体をもう一度交換します。
注: 初めての実験を実行すると、市販細胞小器官特定の染料27,28細胞内小器官の汚損によって核膜に自己分類された蛋白質の正しいターゲットの設定を確認します。この場合、強い信号を生成する自己ラベリングの酵素のための基板の 100-200 nM も使用します。
-
蛍光ビーズ サンプルの調製
注: 光学のドリフトを決定するために、別のチャンネルの画像を配置する、マルチカラー蛍光ビーズ (0.1 μ m) が使用されます。記録された画像と 2 つの放出チャネルのアフィン変換行列が生成されます。- 希薄溶液 1% 純粋な H2o. のビーズの
- 場所 5 滴洗浄 coverslip の 5 つの異なる位置に蛍光ビーズに調製した溶液 (手順 1.3 参照)。
- クリーン ベンチの乾燥蛍光ビーズ サンプルを聞かせてください。
注: サンプル再使用される;したがって、汚染を避けるために、4 ° C で維持するアルミ箔でサンプルをカバーします。
2. 顕微鏡
-
実験のセットアップ
注: デュアル色単一分子イメージングのための基本的な顕微鏡システム倒立顕微鏡に基づきます: 単一の全内部反射 (TIR) に多モード光偏 monomode 繊維を介して結合 2 つのレーザーを装備コンデンサー、油浸対物レンズを全反射、polyband 排出フィルター、イメージ分割、高感度カメラ (図 1)。TIR のコンデンサーが必要ですを切り替える、エピ-、高傾斜入射角の連続的な調整が可能、積層光学シート (高傾斜薄い照明 (ヒロ)29) および全反射蛍光励起モードと最適化溶込み深さ。高感度冷却器システムで画像を取得、結合デバイス (EMCCD) カメラを充電など、裏面照射型電子乗算 (量子効率 QE > 90%) または sCMOS カメラ (QE > 80-90%)。- これらは、後に使用する実験では、例えば実験で 10,000 のフレームが記録されると、ビーズのサンプルにも 10,000 フレームを記録と同じ条件下で蛍光ビーズ (手順 2.2 参照) をイメージングによる光のドリフトを決定します。光のドリフトによる、最初のフレームと最後の取得したフレーム (図 1 b) のビーズの位置を比較します。必要に応じて、後で光ドリフト30の一連のイメージを訂正またはドリフト安定した環境を使用します。
- オレンジと赤の蛍光プラス オレンジ蛍光と赤い蛍光性の十分な発光フィルターの適切なダイクロイック ビームスプリッター、例えば、フィルター キューブを装備します。適切なフィルターを画像スプリッターを装備します。両方のチャネル (図 1) に単一の色のサンプルを記録することによって他のチャネルへの 1 つのチャネルからの信号の可能なリークをチェックします。
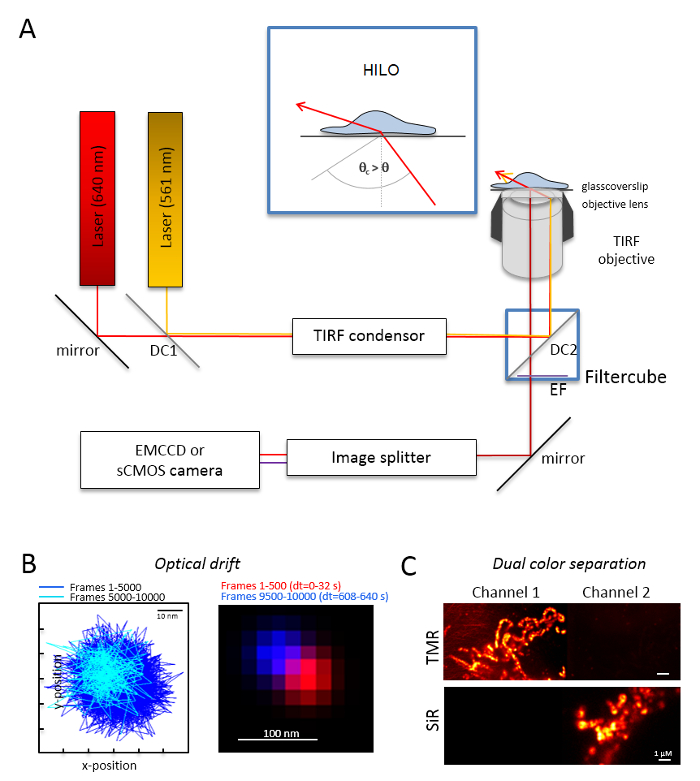
図 1: マルチカラー追跡およびローカリゼーション顕微鏡 (TALM) オレンジと赤のエミッタの光学レイアウトします。(A) 少なくとも 2 つの励起レーザー、全反射コンデンサー、全反射の適切な目的、イメージ分割高感度カメラと逆顕微鏡のセットアップ。Inset: 細胞内小器官を刺激する入射ビームの角度設定してください非常に達成するために全反射の臨界角が傾斜積層光学シート照明 (ヒロ) よりも小さい。DC1: ダイクロイック ミラー 1;DC2: ダイクロイック ミラー 2。EF: 発光フィルター。(B) 実験次の実験として同じフレーム レートで 10,000 フレーム用蛍光ビーズの位置をイメージングによる光ドリフト (ここで: 15 Hz)。最初 500 のフレームと最後 500 フレームの接続位置は、ドリフトを表示します。また、赤と青の最初と最後のフレームの位置にマージされた画像は、最小限のドリフトを表示します。ドリフトは、合計の録音時間は、ここで 125 分/s. (C) 信号、ここの TMR とサーの明確な分離にチェックで割った値信号の中心間の距離。両方のチャネル (チャネル 1 の TMR) とチャネル 2 でサー 3,000 のフレームの累積合計イメージが生成されました。サーHTLは Tom20 HaloTag と OxPhos 複雑な V HaloTag を TMRHTLに添付されました。色は、偽色です。スケール バー = 100 nm (B)、1 μ m (C)。この図の拡大版を表示するのにはここをクリックしてください。
-
生成されたイメージの物理的な配置の画像分割の
注: coverslip の準備試験片を取り付け、自作のサンプル ホルダーにできます (図 2 a) を使用します。サンプルに陥るなどほこりを避けるためには、培養皿の蓋疎上に置きます商工会議所、マウントされているとき。同じ試料ホルダーを蛍光ビーズまたはセルで coverslip のマウントに使用できます。細胞をイメージするとときに、追加 0.5-0.8 mL の培地をイメージングします。画像分割 2 つイメージに分割または詳細はスペクトル チャネルを分離し、同じカメラに投影するサイド ・ バイ ・ サイド。このプロセスは、可能性があります異なる光パスの走査によるチャンネル間の体系的な歪みを導入、直接共存分析を妨害します。したがって、まず物理的な配置の 2 番目を実行、後補正変換行列に配置。両方の配置プロセスでは、蛍光ビーズは、ビューのフィールド全体でゆく配布必要があります。- ポリテトラフルオロ エチレン (PTFE) のサンプル ホルダーに蛍光ビーズを用いた作製した試料をマウント-リングと赤いゴム リング (図 2 a)。
- 顕微鏡、すべてのハードウェア コンポーネントおよび顕微鏡検査のために必要なすべてのソフトウェアを起動します。
- 目的と、カバーガラスの下部をイソプロパノールで湿った糸くず組織ワイプときれい。新鮮な糸くずティッシュで両方の項目を乾燥します。対物レンズの瞳にイマージョン オイルの滴を配置します。
- 顕微鏡ステージ上にビード サンプルのサンプル ホルダーを配置、coverslip の下部連絡先油です。伝送ライトまたはレーザー ラインを使用してビーズに焦点を当てます。
- 2 つの蛍光チャンネルと同様の信号強度を達成するために 2 つの励起レーザーのパワーを調整します。多数の異なる蛍光信号の領域を検索します。
- カメラ コントロール ソフトウェアを使用して蛍光チャンネルのマージされたビューを生成します。手動で (図 2 b) 2 つの蛍光チャネルからの信号の最高のオーバーレイを達成するために画像分割の内部のミラーを傾ける画像スプリッターにネジを使用しています。
注:注意!カメラのダイナミック レンジを超えないようにします。
-
空間の変換を実行するソフトウェアによってスペクトル分離チャンネルの配置
注: 次の部分は、後補正配置とローカリゼーション手順、私たちのソフトウェアのプラグイン (要リクエスト) を示しています。- ソフトウェアを制御する全反射顕微鏡を起動し、ライブ ストリーム モードで個々 のチャンネルを表示するを選択します。すべてのチャネル (図 2) でスナップショット画像のエキサイティングな蛍光を取る。
- このスナップショット イメージを使用して、変換行列を生成する (図 2参照)。
メモ: 変換行列は、空間変換、通常、アフィン 1 つ (2 つのチャンネル間の単一の点光源からの信号の分岐) の翻訳を修正するために使用されます。 - ソフトウェア解析プラグインを開始 (研究室からの要求に得ることができる、図 2を参照)。
- 蛍光ビーズの以前に記録したデュアル カラー画像 (手順 2.2 参照) をソフトウェアにロードします。蛍光チャネルの使用の向きを選択します。 'はい' '画像のキャリブレーション' のメッセージが表示されたらクリックし、以前に撮影したスナップショットを選択します。
- 単位変換係数 (ピクセル サイズ、フレーム レート、光子変換係数) を定義する「単位マネージャー」を開きます。
- 「ローカリゼーション マネージャー」を開きます。最初の点広がり関数 (PSF) を決定します。ボタンを押して:「PSF 半径」。「PSF 推定」ウィンドウが開いたら、開口数と最大の排出量を定義します。開始"PSF 推定半径」をクリック。評価ボックスを得られた実験 PSF. 定義を受け入れる、デフレのループの数と、コンピューターのコアの数計算に使用します。2次元の対称ガウス関数 (図 2) による単一粒子の強度分布を近似する「ローカライズ」を押します。
- 「受け入れる」得られた実験 PSF. 定義評価ボックス、デフレのループの数と、コンピューターのコアの数計算に使用します。2次元の対称ガウス関数 (図 2) による単一粒子の強度分布を近似する「ローカライズ」を押します。
- 「キャリブレーション マネージャー」を開きます。2 つのチャネルの結合されたレンダリング イメージ、元の信号とローカライズされたセンターが表示されます。「アフィン」モードをを選択します。手動で接続線を描画することによって同じ蛍光ビーズから起源を持つ 2 つのチャネルのローカライズされたセンターの対応するペアを接続します。
- ビューのフィールドの各地に分散対応する信号を接続します。この後、「同意します」を押してください。キャリブレーションを保存します。
注: 空間の変換は各蛍光ビーズでサンプリング、間で補間されます。抽出された変換関数は、フィールドの変位 Δr(x,y) その後の定位精度内でオーバーレイするように実験的デュアル色単一分子の局在化を修正するために使用を表します。空間の変換行列は、通常翻訳、スケール、およびナノ精度でチャンネル間の回転を補正するアフィン 1 とこのマニュアルの一対一マッピング (図 2) から推論することができます。
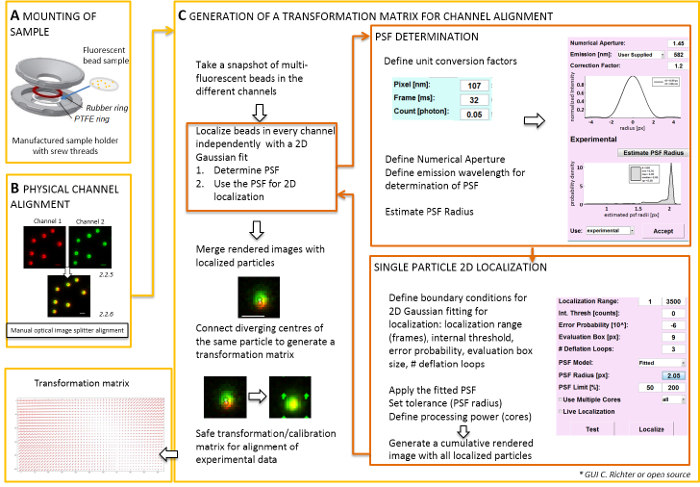
図 2: デュアル カラー配置のワークフロー 。蛍光ビーズを用いた coverslip (A) は、PTFE とゴム輪の間の試料ホルダーにマウントされています。その後、商工会議所の上部と下部の一部をボルトで連結。(B) 画像スプリッターによって生成されるチャネル ビューの物理的な配置です。2 つのチャネルにビーズ (0.1 μ m) から蛍光信号を記録 (緑と赤、偽色) マージされます。光学画像分割に対応するネジは手動で異なった信号の最高のオーバーレイを達成するまでになっている (黄色、下部のパネル)。(C) post-processive チャネル配置変換行列の生成。粒子の正確な局在に依存発光波長と対物レンズの開口数の点広がり関数 (PSF) を決定する必要は。その強度プロファイルと合わせて対称二次元ガウスによる分析によって、PSF の中心を決定ことができます。信号のピークの結果の局在し、ぼやけ、元の信号に投影されます。統合後の画像で 2 つのチャネルからの信号のローカライズ センターは実験データの post-processive の配置の後で使用されるトランス フォーム行列を生成する接続されます。スケール バー = 1 μ m (B、C)。この図の拡大版を表示するのにはここをクリックしてください。
-
ミトコンドリア膜タンパク質の 1 分子イメージング
注: すべての実験は室温で実施されています。T 細胞または非付着性のセルは、31をイメージングする前にアガロースで固定しなければなりません。- ゴムとテフロン リング (図 3 a) 間 coverslip の付着性のセルに試料をマウントします。商工会議所を詰めて 0.5-0.8 mL の培地をイメージングします。
- 2.2.2–2.2.5 の手順を繰り返します。
- TIR モード ヒロ シート32 (ヒロ モード、図 1 a) を介して関心の特定の領域を刺激する臨界角より小さい入射角度を作成するソフトウェアを制御する照明角度全反射顕微鏡を調整します。
注意: は、レーザ光を直接目に接触を避ける! - EM ゲインを設定し、フレームごとに十分な光子を収集実験用に最適露光時間を選択します。
- ノイズ (S/N) 比 (図 3 b)、定位精度が直接 S/N33 (図 3) に対応するために高い信号を達成するためのレーザー出力を設定します。
- 非重複、細長いミトコンドリアと単一分子信号 (図 3 D; 細胞周囲の領域を見つける補足動画 1)。単一分子信号が表示されてない場合は、単一分子信号 (図 3E) の外観の結果を漂白まで待ちます。
- 信号の数が小さすぎる合理的な継続 (蛍光染料、図 3Fの漂白の動作によって通常 1,000-10,000 フレーム) までを記録します。
- 画像の少なくとも 1,000 記録されたフレーム (図 3) の累計レンダリング イメージを生成することによってソフトウェアとミトコンドリアの構造のチェックを処理を開始します。
注: 最速のフレーム レートは、読み出し領域によって決まります。1 つのチャネルのための視野は、256 × 512 ピクセル、256 × 256 ピクセル クワッド色デュアル カラー画像分割 (512 × 512 ピクセル) によって減らされます。したがって、画像スプリッターを使用すると、2 つの色のため、これは 30 hz フレーム転送モードに設定最低の可能な読み出し時間を達成します。 - ソフトウェア解析プラグインとロード raw データを開始します。チャネルの方向と負荷のイメージを選択します。2.3.9「キャリブレーション イメージ」を求められたときのステップから変換行列を使用します。チャンネルが個別に表示されます。
- 各チャネルの単位変換係数を定義する前に「単位マネージャー」を開きます。各チャンネルの「ローカリゼーション マネージャー」を開きます。条件の使用、コンピューターのコアの数が計算に使用される設定の理論の PSF を追加評価ボックス、デフレのループの数を定義します。最後に、ローカライズされた単一粒子 (図 3 H; を取得する「ローカライズ」を押します補足動画 2)。
- プログラムが最後に示す累積的な超解像画像を生成することに注意してください (図 3 i) の粒子はすべてローカライズ。
- 分析、例えば、オープン ソース ソフトウェアや当社のソフトウェア リクエストを実行します。
- 両方のローカライズされたチャンネルなど複数のターゲット トレーサー10の単一の分子を追跡します。
注: ステップ 2.4.13 境界条件を正しく設定する興味の蛋白質の拡散性について (実験) の予備知識が必要です。通常、正しい境界条件を見つけることは、反復的なプロセスです。
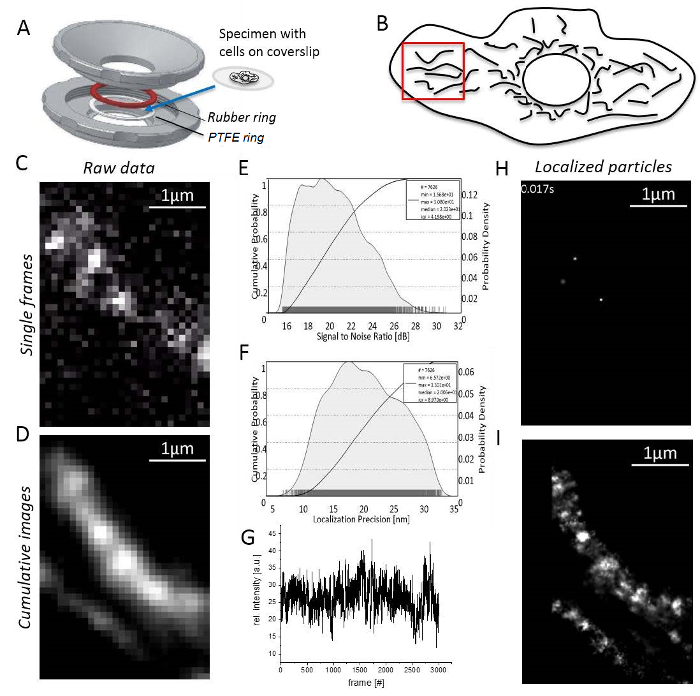
図 3: 単一分子局在顕微鏡中の手順を実行します。標本には、(A) A coverslip (j. Bereiter ・ ハーンによって設計された) 自家製のサンプル ホルダーの上部と下部部分 (グレー) 間にマウントされています。ゴム輪 (赤) と PTFE リング (ホワイト) サンプル ホルダー部分がボルトを一緒にいるとき、coverslip の下と上からシステムをシールします。(B) 信号対雑音比の TMR 信号。(C) すべてのローカライズされた粒子の局在精度ヒストグラムを計算します。(D) 合理的な地域、ここでは、明確に分離ミトコンドリア細胞周辺のイメージングのための選択。(E) 録画と画像処理: 明確な単一分子信号と 1 つのフレームが表示されます (ここでは、CV-HaloTag/TMRHTLの分子が記録された)。(F) TMR 強度記録時間をかけて。(G) 3,000 フレーム、未処理の累積合計イメージ。(H) 粒子の CV-HaloTag/TMRHTL単一のフレームから 2D ガウス関数とローカライズします。(私) 累計 3,000 フレームからすべてのローカライズされた CV-HaloTag/TMRHTL粒子を示す合計画像のレンダリング。この図の拡大版を表示するのにはここをクリックしてください。
結果
マルチカラー イメージングと共局在解析は、タンパク質のサブ核の局在を決定する助けることができます。我々 は、ゾル性細胞質ホスファターゼと張力同族体、PINK1 ミトコンドリア プロテアーゼ17での処理のための別のサブ ミトコンドリア場所を持つ前にこれを示した。PINK1 ミトコンドリア機能34,35を保...
ディスカッション
ここでは、モバイルの膜タンパク質のデュアル カラー単一分子局在法が発表されました。次のプロトコル、膜タンパク質を自己分類 TMR と彼らのそれぞれの基板に共役サー ローダミン色素と反応する蛋白質に溶けます。ローダミンは染料は明るく、あるでき繰り返し画像1。成功したパフォーマンスのいくつかの条件や重要なトピックは、留意する必要があります。
開示事項
著者が明らかに何もありません。
謝辞
著者は、生物物理学グループと継続的な支援、技術支援や、材料の準備のため Wladislaw コール用顕微鏡を提供する CellNanOs ボードにオスナブリュック大学でヤコブ Piehler に感謝したいと思います。SFB 944 によって資金が供給されたプロジェクト。
資料
| Name | Company | Catalog Number | Comments |
| (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M) (HEPES) | Biochrom | #1104E | |
| DC1: Dichroid beam splitter | Chroma | 640 dcxr | NC506031 |
| DC2: Polychroic Mirror, beamsplitter | Chroma | zt405/488/561/640rpc | discontinued |
| Dulbecco´s Phosphate-Buffered Saline (PBS) 1x (w/o Ca & Mg) | Sigma-Aldrich & Co. | #RNBF8311 | |
| Earle´s MEM without phenol red, without L-Glutamine and without NaHCO3 containing 1% FBS, 0.1% HEPES, 0.1% NEAA, 0.1% Alanyl-L-Glutamine and 34.78% sodium hydrogen carbonate (NaHCO3 0.75g/l) | Imaging medium | ||
| Earle´s minimum essential medium (MEM) with phenol red, containing 1% Fetal Bovine Serum Superior (FBS), 0.1% HEPES (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M), and 0.1% non-essential amino acids (NEAA) | Growth medium | ||
| EF: Emission filter quadbandpass | AHF analysentechnik | F72-866 | Brightline HC 446 nm/523 nm/600 nm/677 nm |
| EMCCD camera | Andor | Andor iXON 897 | EMCCD camera |
| Emission filter QuadView filter cubes, orange | AHF analysentechnik | F39-637 | bandpass 582 - 619 nm |
| Emission filter QuadView filter cubes, red | Chroma | bandpass 655 - 725 nm (HQ 690/70) | |
| FBS (Fetal bovine serum) superior | Biochrom | S0615 | |
| Fluorescent beads: TetraSpeck™ Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Thermo Fisher Scientific | T7279 | fluorescent microspheres |
| Glutamine | Biochrom | #0951C | |
| HeLa cells | DSMZ | ACC-57 | Cervical carcinoma cells from patient Henrietta Lacks |
| Hela cells CI::paGFP, stable | Muster et al., PLOSOne 2010 | ||
| Hela cells CV g::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Hela cells Tom20::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Image splitter | Photometrics | Dual-View QV2 | image splitter emission |
| Imaging processing software | ImageJ2 / Fiji | freeware | |
| Immersion Oil - ImmersolTM 518 F (ne = 1.518, ve = 45) | Carl Zeiss Jena GmbH | 444960-0000-000 | |
| Inverted epifluorescence microscope | Olympus IX-71/73/83 | ||
| Laser 561 nm, 200 mW | CrystaLaser | CL-561-200 | 561 nm emission |
| Laser 642 nm, 140 mW | Omicron | Luxx-642-140 | 642 nm emission |
| MATLAB | MathWorks | version R2013a | |
| MEM with Earle's Balanced Salt Solution 2.2 g/L NaHCO3, stable glutamine w/o PR | Biochrom | FG-0385 | |
| MEM with Earle's Balanced Salt Solution with 2.2 g/L NaHCO3, stable glutamine, Phenolred | Biochrom | FG-0325 | |
| MitoTracker® Deep Red FM | Thermo Fisher Scientific | M22426 | dye |
| MitoTracker® Green FM | Thermo Fisher Scientific | M7514 | dye |
| Multi-mode-optical polarization maintaining monomode fiber | Pointsource/Qioptiq | KineFLEX | |
| NHS-PEG-MAL, Rapp Polymer | Rapp Polymere GmbH Tübingen | coverslip coating | |
| non-essential amino acids (NEAA) | Biochrom | #0802E | |
| PEG 800 (Polyethylene glycol) 10 % | Carl Roth GmbH | Art No. 0263.1 | coverslip coating |
| Penicillin/Streptomycin | Biochrom | #0122E | |
| Plasmid for PINK1-Halo7-Tag expression | Beinlich et al., ACS Chemical Biology 2015 | ||
| Poly-L-lysine (1.2 mg/ml) | Sigma-Aldrich & Co. | Cat. No.P9155 | coverslip coating |
| RGD Peptide (Ac-CGRGDS-COOH) | Coring System Diagnostix GmbH, Gernsheim | coverslip coating / Intergrin receptor motif | |
| Silicon Rhodamine linked to HaloTag®-Ligand (SiRHTL) | personal gift from Kai Johnson | dye | |
| Software analysis plugin | self-written C. P. Richter, Biophysik Osnabrück | SLIMFAST 16g | |
| Tetramethylrhodamine / SNAP-Cell® TMR-Star linked to SNAP-Ligand (TMRstar) | New England Biolab® | S9105S | dye |
| Tetramethylrhodamine linked to HaloTag®-Ligand (TMRHTL) | Promega | G8251 | dye |
| TIRF condensor | Olympus | Cell^TIRF MITICO System | TIRF condensor |
| TIRF microscope controlling software | Olympus cellSens 1.12 | ||
| TIRF objective | Olympus | 150x oil objective (N.A. 1.45; Olympus UAPO) | |
| Trypsin/EDTA 10x | Biochrom | #0266 | |
| Water H2O 99,5 % Rotipuran® Low organic | Carl Roth GmbH | Art. No. HN57.1 |
参考文献
- Appelhans, T., Richter, C., Wilkens, V., Hess, S., Piehler, J., Busch, K. Nanoscale organization of mitochondrial microcompartments revealed by combining tracking and localization microscopy. Nano Letters. 12 (2), 610-616 (2012).
- Appelhans, T., Busch, K. Single Molecule Tracking and Localization of Mitochondrial Protein Complexes in Live Cells. Methods Mol Biol. 1567, 273-291 (2017).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3 (10), 793-795 (2006).
- Gould, T. J., Verkhusha, V. V., Hess, S. T. Imaging biological structures with fluorescence photoactivation localization microscopy. Nat Protoc. 4 (3), 291-308 (2009).
- Pennacchietti, F., Gould, T. J., Hess, S. T. The Role of Probe Photophysics in Localization-Based Superresolution Microscopy. Biophys J. 113 (9), 2037-2054 (2017).
- Wegel, E., Göhler, A., Lagerholm, B. C., Wainman, A. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific reports. , (2016).
- Pellett, P., et al. Two-color STED microscopy in living cells. Biomedical Optics Express. 2 (8), (2011).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79 (2016).
- Liss, V., Barlag, B., Nietschke, M., Hensel, M. Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy. Scientific Reports. 5, 17740 (2015).
- Sergé, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nat Methods. 5 (8), (2008).
- Appelhans, T., Busch, K. B. Dynamic imaging of mitochondrial membrane proteins in specific sub-organelle membrane locations. Biophysical reviews. 9 (4), 345-352 (2017).
- Wilmes, S., et al. Triple-color super-resolution imaging of live cells: resolving submicroscopic receptor organization in the plasma membrane. Angewandte Chemie. 51 (20), 4868-4871 (2012).
- Niewidok, B., et al. Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. J Cell Biol. , (2018).
- Wurm, C. A., Jakobs, S. Differential protein distributions define two sub-compartments of the mitochondrial inner membrane in yeast. FEBS Lett. 580 (24), 5628-5634 (2006).
- Schmidt, R., Wurm, C. A., Punge, A., Egner, A., Jakobs, S., Hell, S. W. Mitochondrial cristae revealed with focused light. Nano Lett. 9 (6), 2508-2510 (2009).
- Kukat, C., Wurm, C. A., Spahr, H., Falkenberg, M., Larsson, N. G., Jakobs, S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Beinlich, F., Drees, C., Piehler, J., Busch, K. Shuttling of PINK1 between Mitochondrial Microcompartments Resolved by Triple-Color Superresolution Microscopy. ACS chemical biology. 10 (9), 1970-1976 (2015).
- Shim, S., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. 109 (35), 13978-13983 (2012).
- Sbalzarini, I., Mezzacasa, A., Helenius, A., Koumoutsakos, P. Effects of Organelle Shape on Fluorescence Recovery after Photobleaching. Biophysical Journal. 89 (3), 1482-1492 (2005).
- Reits, E., Neefjes, J. From fixed to FRAP: measuring protein mobility and activity in living cells. Nature Cell Biology. 3 (6), E145-E147 (2001).
- Goehring, N., Chowdhury, D., Hyman, A., Grill, S. FRAP Analysis of Membrane-Associated Proteins: Lateral Diffusion and Membrane-Cytoplasmic Exchange. Biophysical Journal. 99 (8), 2443-2452 (2010).
- Bacia, K., Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: principles and applications. Cold Spring Harbor protocols. 2014 (7), 709-725 (2014).
- Sukhorukov, V., Dikov, D., Busch, K., Strecker, V., Wittig, I., Bereiter-Hahn, J. Determination of protein mobility in mitochondrial membranes of living cells. Biochimica et biophysica acta. 1798 (11), 2022-2032 (2010).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Graham, F. L., van der Eb, A. J. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52 (2), 456-467 (1973).
- Wedeking, T., et al. Spatiotemporally Controlled Reorganization of Signaling Complexes in the Plasma Membrane of Living Cells. Small. 11 (44), 5912-5918 (2015).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280 (1), 715-721 (2005).
- Poot, M., et al. Analysis of mitochondrial morphology and function with novel fixable fluorescent stains. J Histochem Cytochem. 44 (12), 1363-1372 (1996).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells (vol 5, pg 159). Nature Methods. 5 (5), 455 (2008).
- Elmokadem, A., Yu, J. Optimal Drift Correction for Superresolution Localization Microscopy with Bayesian Inference. Biophys J. 109 (9), 1772-1780 (2015).
- Barlag, B., et al. Single molecule super-resolution imaging of proteins in living Salmonella enterica using self-labelling enzymes. Sci Rep. 6, 31601 (2016).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5 (2), 159-161 (2008).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat Methods. 7 (5), 377-381 (2010).
- Jin, S., Youle, R. J. PINK1- and Parkin-Mediated Mitophagy at a Glance. Journal of Cell Science. 125, 795-799 (2013).
- Yamano, K., Youle, R. J. PINK1 is degraded through the N-end rule pathway. Autophagy. 9 (11), 1758-1758 (2013).
- Wiedemann, N., et al. Machinery for protein sorting and assembly in the mitochondrial outer membrane. Nature. 424 (6948), 565-571 (2003).
- Thompson, R., Larson, D., Webb, W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved