A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
צבע רב לוקליזציה מיקרוסקופיה של חלבוני ממברנה בודדת ב- Organelles של תאים בתרבית של חיים
In This Article
Summary
כאן, אנו מציגים עבור צבע רב לוקליזציה של חלבוני ממברנה בודדת פרוטוקול organelles של תאים חיים. כדי לצרף fluorophores, משמשים החלבונים תיוג עצמי. חלבונים, במיקום שונה ממברנות תאי האברון המשמש אותו, יכול להיות מקומי עם דיוק של ~ 18 ננומטר.
Abstract
הידע על הלוקליזציה של חלבונים ב- subcompartments סלולרי חיוני להבין את פעולתן. כאן, אנו מציגים טכניקה סופר רזולוציה המאפשרת מצפני microcompartments שהם נגישים חלבונים על ידי יצירת לוקליזציה ומעקב מפות של חלבונים אלו. יתר על כן, על ידי מיקרוסקופ צבע רב לוקליזציה, הלוקליזציה ומעקב פרופילים של חלבונים ב- subcompartments שונים מתקבלים בעת ובעונה אחת. הטכניקה ספציפית עבור תאים חיים והיא מבוססת על ההדמיה חוזרות של חלבוני ממברנה ניידים יחיד. חלבונים עניין גנטית הם התמזגו עם תגי תיוג עצמי מסוים, כביכול. תגים אלה הם אנזימים להגיב עם מצע באופן קשרי ערכיות. מצומדת כדי סובסטרטים אלה הם צבעי פלורסנט. התגובה של החלבונים האנזים מתויג עם פלורסצנטיות תוויות תוצאות מצעים בשנת חלבונים עם תוויות. כאן, Tetramethylrhodamine (TMR), סיליקון Rhodamine (SiR) משמשים כמו צבעי פלורסנט מחובר על מצעים של האנזימים. באמצעות ריכוז המצע ב רה מ למגוון ננומטר, תיוג תת stoichiometric מושגת שתוצאתו אותות ברורים. אותות אלה מותאמים עם ~ 15-27 דיוק ננומטר. הטכניקה מאפשרת הדמיה צבע רב של מולקולות יחיד, לפיה מספר הצבעים מוגבל על ידי קרום חדיר צבעים זמינים, לרפרטואר של תיוג עצמי של אנזימים. אנו מראים את הכדאיות של הטכניקה על-ידי קביעת ההתאמה של האנזים בקרת איכות (Pten)-induced קינאז 1 (PINK1) בתאים מיטוכונדריאלי שונה במהלך העיבוד שלו ביחס לחלבונים אחרים ממברנה. המבחן האמיתי הפיזי אינטראקציות בין חלבונים יחיד שכותרתו באופן שונה על ידי מולקולה בודדת סריג או מעקב משותף הוא מוגבל, אף, כי מעלות תיוג נמוך להקטין את ההסתברות שיש שני חלבונים סמוכים שכותרתו באותו זמן. בעוד הטכניקה חזקה הדמיה חלבונים בתאים ממברנה, ברוב המקרים זה לא הולם לקבוע הלוקליזציה של חלבונים מסיסים ניידים במיוחד.
Introduction
המטרה של פרוטוקול זה נועד לספק שיטת הדמיה כדי להתאים לשפה ולעקוב אחר חלבוני ממברנה בודדת בתוך תאים חיים. אנחנו קוראים בשיטה זו, מעקב ו לוקליזציה מיקרוסקופ (TALM)1,2. כמו סטוכסטי אופטי שחזור מיקרוסקופ (סערה)3 ו-4,זריחה Photoactivation לוקליזציה מיקרוסקופ ((נ) דקל)5, TALM היא טכניקה לוקליזציה פלורסצנטיות מבוסס-מולקולה בודדת. עם זאת, ברורים בדרך כי הניידות של חלבוני ממברנה בשילוב עם הדמיה חוזרות של אותו הנקרא מולקולה-מגלה עמדות שונות microcompartment הנגיש עבור החלבון ניידים. במילים אחרות, הגרסא המקומית אפשרי של החלבון נקבעים על ידי הארכיטקטורה של אברון ועל ידי את הניידות של חלבון1. השיטה זו משלימים שונים אחרים סופר רזולוציה טכניקות6,7,8 כי הוא מגלה לוקליזציה, מסלול מפות על ידי הדמיה חלבונים ניידים. תיוג מבוסס על שימוש חלבונים פיוז'ן מהונדס גנטית כי הם כשלעצמם שאינם פלורסנט. חלבונים אלה פיוז'ן הם תיוג עצמי אנזימים להגיב covalently עם מצע מצומדת כדי צבע. הליך זה יש יתרון כי מידת תיוג יכול להיות נשלט על ידי כמות המצע שנוספו. יתר על כן, היא מאפשרת לשנות את הצבע של זריחה, בהתאם לצבוע מצומדת שבחרת. מספר תיוג עצמי אנזים-תגיות הן זמינות9. יתרון נוסף של השימוש תיוג עצמי תגי אנזים זה, כי צבעים מצומדת הם בדרך כלל יותר יציב ובהיר יותר מאשר חלבונים פלורסנט1 , חלבונים בודדים ולכן ניתן להקליט עוד ועוד בדיוק עד שהם נמצאים מולבן. דבר זה מאפשר ההקלטה של מסלולים של חלבונים ניידים, החילוץ של דיפוזיה המקדמים10,11.
. הנה, נדגים את הכדאיות של TALM עם ממברנה מיטוכונדריאלי חלבונים, אך זה ניתן להחיל גם חלבונים ממברנה אינטרה - ו תוספת - cellular אחרים, כולל תאים שונים סוגי12,13. אנחנו מראים כי צבע רב TALM נוסף מאפשר ההבחנה סימולטני של חלבונים ב- subcompartments שונה ב קומפלמנטציה קיימת סופר-רזולוציה קרינה פלואורסצנטית מיקרוסקופ טכניקות14,15, 16-TALM התואמת לתא חי הדמיה17. צילום-הפיזיקה של rhodamines שבחרת Tetramethylrhodamine (TMR) וסיליקון-Rhodamien (אדון), בפרט שלהם בהירות ויציבות, מאפשרת ממברנה אחת רשומה חלבונים מסגרות מרובות ומספקת מפות לוקליזציה (ואת המסלול). TALM זאת, מוגבלת עבור ההתאמה של חלבונים מסיסים עם המקדמים של פעפוע מאז טשטוש תנועה גבוהים מדי, והפוטונים שנאספו לכל מסגרת נמוכים מדי בלוקאליזציה נאותה. חוץ מזה, TALM דורש פחות אנרגיה עירור מאשר לדוגמה סערה או דלדול פליטה מגורה (STED) מיקרוסקופיה6,7, הפחתת תופעות פוטוטוקסי. זה חשוב, מכיוון פוטוטוקסי לחץ משפיע לעיתים קרובות על מורפולוגיה אבחון18 ובכך ניידות ניתוח19. לסיכום, אנו מציגים צבע רב TALM בתאים חיים כמו טכניקה ממלאת פער בין השיטות מיקרוסקופ לוקליזציה הסערה/STED/דקל (נ) וטכניקות לנתח חלבון ניידות כגון קרינה פלואורסצנטית התאוששות לאחר photobleaching (FRAP)20 ,21קרינה פלואורסצנטית המתאם ספקטרוסקופיה (FCS)22, קרינה פלואורסצנטית לחצות המתאם ספקטרוסקופיה (FCCS)11,23.
Access restricted. Please log in or start a trial to view this content.
Protocol
להלן כללי התנהגות עוקב אחר הקווים המנחים של ועדת האתיקה של המחקר למוסד מקומי.
1. שיטות
-
תרבית תאים
- לטפח תאים, לדוגמה הלה תאים (צוואר הרחם האנושי קרצינומה), בבקבוקון T25 תא תרבות המכיל 5 מ של מדיום הגידול-CO 37 ° C ו-5%2.
הערה: עבור הדמיה, לפצל את התאים על coverslips מוכן (ראה שלבים 1.3 ו- 1.4), לשמור על הדמיה בינוני.
- לטפח תאים, לדוגמה הלה תאים (צוואר הרחם האנושי קרצינומה), בבקבוקון T25 תא תרבות המכיל 5 מ של מדיום הגידול-CO 37 ° C ו-5%2.
-
תאים תקנים
הערה: השתמש שורות תאים stably לבטא את החלבונים מתויג במידת האפשר24 כדי למנוע ביטוי חזק. עבור תקנים ארעי, להתאים את כמות פלסמיד DNA משמש תרביות תאים. לדוגמה, בעת Ca2 + פוספט תרביות תאים25 , transfect תאים (80-90% confluency) בצלחת תרבות תא 3.5 ס"מ עם 2.5 – 5 µg של פלסמיד ה-DNA. בעת ביצוע תרביות תאים זוגיים, להשתמש µg 2.5 לכל לבנות כל פלסמיד.- לניסויים צבע כפול, קו תא עם ביטוי יציב של חלבון תיוג עצמי אחד ולהשתמש transiently transfect עם פלסמיד קידוד ה אחרים תיוג עצמי חלבון-17.
הערה: כאן, לניסויים צבע כפול, הלה תאים שימשו stably לידי ביטוי החלבונים תיוג עצמי PINK1-הילה-תג ותג Tom20-fSNAP.
- לניסויים צבע כפול, קו תא עם ביטוי יציב של חלבון תיוג עצמי אחד ולהשתמש transiently transfect עם פלסמיד קידוד ה אחרים תיוג עצמי חלבון-17.
-
ניקוי של coverslips
- מקם את coverslips גביע. להוסיף 30 מ של H2O כשהספל המכיל את coverslips ומנערים בעדינות כדי להסיר אבק פני השטח שלהם.
- לאסוף את coverslips עם פינצטה, לייבש אותם עם זרם של חנקן.
- הסר כל זיהום אורגני על פני השטח של coverslips, למשלעל-ידי ניקוי פלזמה.
הערה: כדי למנוע זיהום של החומר זכוכית, יש ללבוש כפפות במהלך הטיפול coverslips.
התראה: בעת coverslips מנוקות על ידי פלזמה ניקוי, רק בחלק העליון של coverslips ינוקו; השתמש הצד הזה עבור ציפוי עם פולי-L-ליזין-פוליאתילן גליקול-ארגינין-גליצין-אספרטט (PLL-פג-RGD) (סעיף 1.4) ותא זריעה (סעיף 1.5).
-
ציפוי Coverslip עם PLL-פג-RGD
הערה: PLL-פג-RGD היא נגזרת (PLL) פולי-L-ליזין שמצורפת של פוליאתילן גליקול (3,000 Da) ופפטיד (CGRGDS) cysteine-glycine-arginine-glycine-aspartate-serine. PLL נקשר אל פני השטח זכוכית טעונים שלילית, צורות מברשת פג. זה מפחית במידה רבה איגוד לא ספציפי של צבעי פלורסנט טעונה. בנוסף, מוטיב RGD מחקה את האות פפטיד של הקולטן אינטגרין ומקדם ובכך בתיווך אינטגרין הדבקות של תאים אחרת בקלות תואם.- להכין PLL-פג-RGD כפי שתואר לעיל26. בקיצור, להמיס 0.8 מ ג של PLL-פג-RGD, ב- 1 מ"ל ל- PBS. להוסיף 10 µL של הפתרון PLL-פג-RGD בחלק העליון של coverslip נקי.
- לקחת את coverslip השני ומניחים אותו עם משטח נקי במהופך על גבי coverslip הראשון (שיש לו יתרון PLL-פג-RGD למעלה); התוצאה sandwiching הפתרון PLL-פג-RGD בין שתי coverslips.
- בזהירות מניחים על coverslips sandwiched גביע, תקופת דגירה של h 1 בטמפרטורת החדר בסביבה נטולת אבק יבש.
- לאחר 1 h, להוסיף 30 מ של H2O כשהספל כדי כיסוי מלא על coverslips עם מים.
- יש לנער את הספל בעדינות עד coverslips ניתוק אחד מהשני.
- השתמש פינצטה כדי לאסוף את coverslips מהמים, לייבש אותם תחת זרם של גז חנקן.
הערה: coverslips מצופה יכול להיות מאוחסן כוס יבש, עקר פטרי עם מכסה למשך כמה ימים.
-
הכנת הדגימה עבור הדמיה
- להעביר את coverslips מצופה יחיד לתוך תבשיל תרבות תא 35 מ מ, עם משטח מצופה PLL-פג-RGD פונה כלפי מעלה, להוסיף 2 מ של הדמיה בינוני עליון.
- הוסף ~ 500,000 trypsinized תאים (200-500 µL) המבטאים את התגים תיוג עצמי-החלבונים ממברנה בהתאמה ל- mL 2 הדמיה בינוני בצלחת התרבות תאים עם coverslip מצופה. לנער בעדינות ביד כדי להבטיח התפלגות הומוגנית של התאים כדי לקבל שכבת תאים בצורה אחידה.
- דגירה תאים ב- 37 מעלות צלזיוס ו 5% CO2 עד 80% confluency.
הערה: דגימות תאים צריך להיות נזרע 3 ימים לפני הדמיה, יום אחד לפני תרביות תאים. תאים, אשר stably אקספרס החלבון עניין, יכול להיות נזרע 2 ימים לפני הדמיה. מאוחר יותר, רק התאים גדל על coverslip של עם תמונה.
-
תיוג של חלבונים מתויג
הערה: מצעים פלורסנט ביותר חייב להיות מומס דימתיל סולפוקסיד ללא מים. אנו ממליצים להשתמש פתרונות מניות של 1 מיקרומטר מצע פלורסנט כאשר הריכוז תיוג הסופי הוא 0.2 – 30 ננומטר17. הדמיה קרום חלבונים בתוך תאים, השתמש קרום חדיר סובסטרטים פלורסנט.- המדיום הדמיה עד 37 ° C באמבט מים חמים.
- פיפטה 1 מ"ל של המדיום הדמיה ומחוממת מראש לתוך צינור 2 מ עם מכסה. הוספת 0.2 – 30 µL של סובסטרטים פלורסנט מפתרונות מניות 1 מיקרומטר להכין תיוג הפתרון הסופי (הריכוז הסופי: 0.2 – 30 ננומטר).
- מערבולת הפתרון תיוג עבור 10 s.
- מחליף המדיום בצלחת תרבות 35 מ מ עם התאים על coverslip (ראה שלב 1.5) על ידי 1 מ"ל של מוכן תיוג פתרון.
- דגירה התאים הפתרון תיוג-37 מעלות צלזיוס ו-5% CO2 למשך 20-30 דקות.
- לשטוף את התאים עם 2 מ"ל של PBS פעם אחת ולאחר מכן עם 2 מ של הדמיה בינוני פעמיים. לבסוף פיפטה 1 מ"ל של המדיום הדמיה טריים למנה תא, תחזיר את המדגם לתוך החממה-CO 37 ° C ו-5%2 לפחות שעה. לפני הדמיה, חילופי המדיום הדמיה פעם נוספת.
הערה: בעת הפעלת הניסוי בפעם הראשונה, אשר מיקוד נכון של חלבונים עצמית שכותרתו לממברנות אבחון על ידי מכתימה את organelles עם אברון זמינים מסחרית צבע ספציפי27,28. במקרה זה, גם להשתמש 200-100 ננומטר של מצע עבור תיוג עצמי האנזימים כדי להפיק אותות חזקים.
-
הכנת דגימה חרוז פלורסנט
הערה: על מנת לקבוע את הסחף אופטי וכדי ליישר תמונות של הערוצים השונים, צבע רב חרוזים פלורסנט (0.1 מיקרומטר) משמשים. עם תמונות מוקלטות, ייווצר על מטריצת מעבר affine עבור הערוצים פליטה שני.- לדלל את הפתרון של חרוזים 1% עם H טהור2O.
- מקום 5 טיפות של הפתרון מוכן עם החרוזים פלורסצנטיות לעבר חמש עמדות שונות על coverslip נקי (ראה שלב 1.3).
- תן את הדגימה חרוז פלורסנט להתייבש על הספסל נקי.
הערה: הדגימה מחדש ניתן; לכן, לכסות את הדגימה ברדיד אלומיניום, כדי למנוע זיהום לשמור את זה 4 מעלות צלזיוס.
2. מיקרוסקופ
-
הגדרת הניסוי
הערה: מערכת מיקרוסקופיה בסיסית עבור הדמיה מולקולה בודדת כפול-צבע מבוסס על מיקרוסקופ הפוך: הוא מצויד בשני לייזרים מצמידים ויה קיטוב מולטי-mode-אופטי שמירה על monomode סיב לתוך השתקפות פנימית הכוללת יחיד (טיר) מעבה, אובייקטיבית טבילה שמן תוכנן עבור TIRF, מסננים פליטה של polyband, מפצל תמונה של מצלמה מאוד רגיש (איור 1). הקבל טיר נדרש המאפשר עבור כוונון מתמשך של זווית האירוע כדי לעבור בין ה epi-, מאוד נוטה וממוטב בגיליון אופטי למינציה (תאורה דק מאוד נוטה (חילו)29), את מצב עירור TIRF עומק החדירה. תמונות נרכשים עם מערכת גלאי מקורר מאוד רגישים, למשל, גב מואר אלקטרון הכפלת טעונה המצלמה בשילוב מכשיר (EMCCD) (נצילות קוונטית QE > 90%) או מצלמה sCMOS (QE > 80-90%).- לקבוע את הסחף האופטי על ידי הדמיה חרוזים פלורסנט (ראה שלב 2.2) תחת באותם התנאים כמו אלה ייעשה שימוש מאוחר יותר בשביל הניסוי, למשל, כאשר מסגרות 10,000 נרשמים הניסוי, להקליט גם 10,000 מסגרות עם הדגימה חרוז. מצפני נסחפים אופטי, להשוות את המיקום של החרוזים המסגרת הראשונה ואת המסגרת רכשה האחרונה (איור 1B). במידת הצורך, מאוחר יותר לתקן את סדרת תמונות עבור סחיפה אופטי30 ו/או להשתמש סביבות יציב סחיפה.
- לצייד את הקוביה פילטר עם המפצל קרן ודיקרואיק זוהר מתאים, למשל, כתום ואדום פלורסצנטיות בתוספת המסננים נאותה פליטת קרינה פלואורסצנטית תפוזים ו פלואורסצנטי אדום. לצייד את הפיצול תמונה עם המסננים המתאימים. איתור דליפה אפשרית של אותות מערוץ אחד לתוך הערוץ השני בהקלטת דגימות צבע אחד בשני ערוצים (איור 1C).
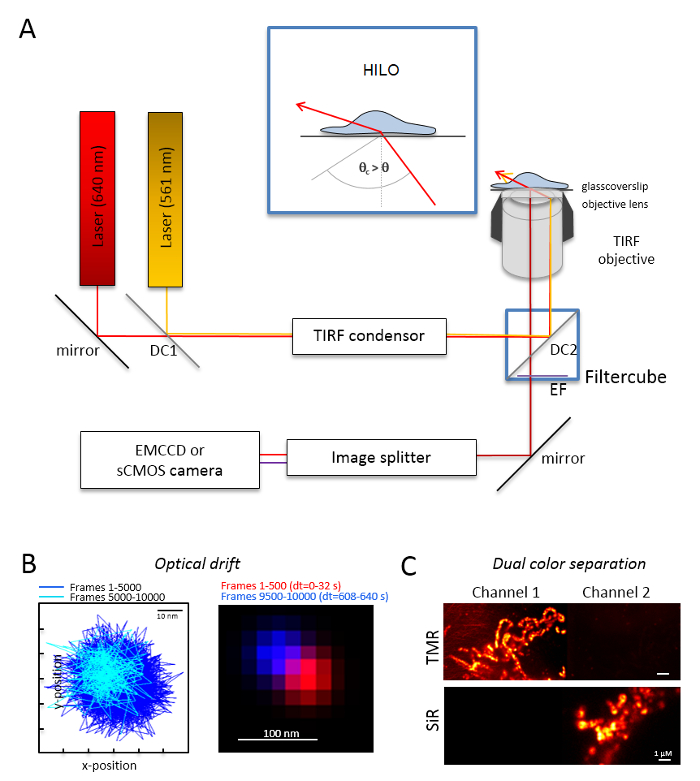
איור 1 : אופטי פריסה עבור צבע רב מעקב ולוקליזציה מיקרוסקופ (TALM) עם כתום ואדום פולטי. (א) Inverted ההתקנה מיקרוסקופ לפחות שתי עירור לייזרים, הקבל TIRF, מטרה מתאימה TIRF, מפצל תמונה של מצלמה רגישה. שיבוץ: כדי לעורר organelles בתוך תאים, הזווית של קרן האירוע חייב להיות מוגדר קטן יותר הזווית הקריטית עבור TIRF להשיג מאוד נוטה, למינציה גיליון אופטי תאורה (חילו). DC1: המראה ודיקרואיק זוהר 1; DC2: המראה ודיקרואיק זוהר 2. EF: מסנן פליטה. (B) הבדיקה על הסחף האופטי על ידי הדמיה עמדות של חרוז פלורסנט למסגרות 10,000 עם מסגרת באותו הקצב כמו הניסויים הבאים (כאן: הרץ 15). עמדות המחוברות של המסגרות הראשונה 500 ומסגרות אחרונה 500 להראות את הסחף. גם, תמונה הממוזג עם העמדה הראשונה ואת המסגרת האחרונה אדום וכחול מראים של סחיפה מינימלי. והרשע הוא שהמרחק בין המרכז של האותות לחלק זמן ההקלטה הכולל, כאן pm 125/ס (ג) הסימון על הפרדה ברורה של אותות, TMR כאן, אדוני. עבור שני ערוצי, נוצרו תמונות סכום מצטבר מ- 3,000 מסגרות (TMR ערוץ 1), אדוני ערוץ 2. אדונישהותכם היה מחובר Tom20-HaloTag ו- TMRשהותכם כדי OxPhos מורכבים V-HaloTag. הצבעים הם צבעים כוזבים. גודל ברים = 100 ננומטר (B) ו 1 מיקרומטר (C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
היישור הפיזי של התמונה הפיצול שנוצר תמונות
הערה: עבור הרכבה הדגימה שהוכנו על coverslip, בעל מדגם מתוצרת עצמית ניתן להשתמש (איור 2 א). כדי למנוע אבק, וכו נופל לתוך הדגימה, מקם את המכסה של המנה תרבות באופן רופף על החדר, כשהוא רכוב. לדוגמה-המחזיק אותו יכול לשמש כדי לטעון את coverslip עם חרוזים פלורסנט או תאים; כאשר תאים הם עם תמונה, להוסיף 0.5-0.8 מ של הדמיה בינוני. המפצל התמונה מתפצל לשניים את התמונה או יותר spectrally מופרדים ערוצים ו פרויקטים אותם side-by-side על גבי אותה מצלמה. תהליך זה פוטנציאל מציג את העיוותים שיטתית בין הערוצים עקב ברורים נתיבים אופטי חצה, מונעת ניתוח colocalization ישירה. לכן, תחילה לבצע יישור הפיזי, השני, שלאחר תיקון יישור עם מטריצה טרנספורמציה. עבור שני התהליכים יישור, חרוזים פלורסנט יופצו למשל לאורך שדה הראיה.- הר המדגם מוכן עם החרוזים פלורסנט בלדוגמה-המחזיק בין טפלון (PTFE)-הטבעת של הטבעת גומי אדום (איור 2 א).
- התחל המיקרוסקופ, כל רכיבי חומרה ותוכנות כל צורך מיקרוסקופ.
- לנקות את המטרה והחלק התחתון של coverslip עם מגבון רקמות נטולת שנרטבו עם אלכוהול איזופרופיל. אז יבש שני פריטים עם טישו נטולת טריים. במקום droplet של טבילה שמן על האישון של העדשה אובייקטיבי.
- המקום בעל מדגם עם הדגימה חרוז לבמה מיקרוסקופ כך התחתון של coverslip הקשר השמן. מתמקדים חרוזים באמצעות שידור אור או קו לייזר.
- להתאים את הכוח של לייזרים עירור שני כדי להשיג את עוצמת האות דומה ידי קרינה פלואורסצנטית בשני ערוצים. חיפוש עבור אזור עם הרבה אותות פלואורסצנט ברורים.
- ליצור תצוגה הממוזג של הערוצים פלורסנט באמצעות התוכנה בקרת מצלמה. לאחר מכן להשתמש את הברגים על המפצל התמונה כדי להטות באופן ידני את המראות הפנימיים של המפצל התמונה כדי להשיג את הכיסוי הטוב ביותר של אותות בין שני הערוצים פלורסנט (איור 2B).
הערה: לב! לא יעלה על הטווח הדינמי של המצלמה.
-
יישור של ערוצי spectrally מופרדים על-ידי תוכנת ביצוע שינוי מרחבי
הערה: החלק הבא מציגה את היישור שלאחר תיקון נוהל לוקליזציה עם תוסף התוכנה שלנו (זמין על פי בקשה).- המיקרוסקופ TIRF שליטה תוכנה ומתחילים לבחור להציג ערוצים בודדים במצב חיים בזרם. לקחת תמונה תמונה פלורסצנטיות מרגש כל הערוצים (איור 2C).
- להשתמש בתמונה זו תמונה כדי לייצר את מטריצת מעבר (ראה איור 2).
הערה: מטריצת מעבר משמש לשינוי צורה מרחבית, בדרך כלל אדם affine, המתקנת לתרגום (סטייה של אותות ממקור נקודת יחיד בין שני ערוצים). - הפעל את התוסף ניתוח תוכנה (ניתן לקבל על פי בקשה מהמעבדה שלנו, ראה איור 2C).
- לטעון את התמונות צבע כפול שהוקלט בעבר (ראה שלב 2.2) של חרוזים פלורסנט לתוך התוכנה. לבחור את הכיוון בשימוש של הערוצים פלורסנט. לאחר מכן לחץ על 'כן' כאשר ביקש 'לכייל התמונות', בחר את התמונה שהתקבלו קודם לכן.
- פתח את 'מנהל יחידת"להגדרת פקטורים של המרה יחידת (גודל הפיקסל, קצב מסגרות, פקטור המרה פוטון).
- פתח את ' מנהל לוקליזציה ". לקבוע שנקודת להפיץ את הפונקציה (PSF) קודם. לחצו על הכפתור: "רדיוס לכוחות הביטחון הפלסטיניים". בחלון "PSF משערך" שנפתח, להגדיר את מספרי הצמצם ואת הפליטה המרבי. להתחיל "הערכה PSF רדיוס" על ידי לחיצה. לקבל שהושג ניסיוני PSF. להגדיר תיבת הערכה, מספר לולאות דפלציה ולאחר כמה ליבות של המחשב משמשים לחישוב. הקש "בתרגום" כדי להתחיל להתאים את ההתפלגות בעוצמה של חלקיקים בודדים באמצעות פונקציה גאוסיאנית סימטרי 2D (איור 2C).
- "מקבל" שהושג ניסיוני PSF. להגדיר תיבת הערכה, מספר לולאות דפלציה ולאחר כמה ליבות של המחשב משמשים לחישוב. הקש "בתרגום" כדי להתחיל להתאים את ההתפלגות בעוצמה של חלקיקים בודדים באמצעות פונקציה גאוסיאנית סימטרי 2D (איור 2C).
- פתח את ' מנהל כיול ". בתמונה הממוזג המעובדת של בין שני הערוצים, את האותות המקורי מרכזי המותאמות לשפות אחרות של מוצגים. בחר את "'-. עידון" '. התחברות ידנית זוגות המקביל של מרכזי לימוד בין שני הערוצים שמקורה המותאמות לשפות אחרות של החרוז פלורסנט אותו על ידי ציור קו החיבור.
- לחבר את האותות המתאים מופץ בכל רחבי שדה הראייה. לאחר מכן, הקש על "מקבל". שמור את הכיול.
הערה: שינוי הצורה המרחבית לטעום-כל חרוז פלורסנט, אינטרפולציה בין לבין. הפונקציה טרנספורמציה שחולצו מייצג של Δr(x,y) שדה הזחה המשמש לתיקון לאחר מכן את הגרסא המקומית של מולקולה בודדת ניסיוני כפול-צבע כך הם כיסוי בתוך דיוק לוקליזציה שלהם. מטריצת מעבר המרחבי הוא בדרך כלל באזורים affine המתקנת עבור תרגום, שינוי קנה מידה, סיבוב בין ערוצים עם דיוק ננומטר, שניתן להסיק מן מיפוי ליחיד ידנית זה (איור 2C).
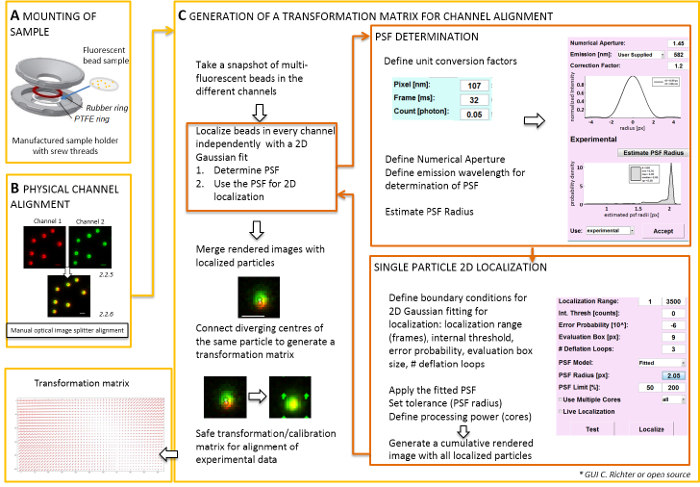
איור 2 : זרימת עבודה עבור יישור צבע כפול. (א) coverslip עם החרוזים פלורסנט נטענה בעל מדגם בין PTFE טבעת גומי. ואז החלק העליון והתחתון של התא הם ברחו יחד. (B) היישור הפיזי של הדעות ערוץ הנוצרים על-ידי המפצל התמונה. הוקלט אותות פלואורסצנט חרוזים (0.1 מיקרומטר) בשני ערוצים (ירוק ואדום, צבעים שווא) ימוזגו. הברגים המתאימים על המפצל תמונה אופטי מופעלים באופן ידני עד הכיסוי הטוב ביותר של האותות שונים מושגת (צבע צהוב, החלונית התחתונה). (ג) מהדור מטריצת מעבר ליישור ערוץ post-processive. בלוקאליזציה מדויק של חלקיק, זה הכרחי לקבוע שנקודת להפיץ את הפונקציה (PSF) התלות על הגל פליטה, את מספרי הצמצם של המטרה. במרכז PSF יכול להיקבע על ידי פרופיל האינטנסיביות שלה נותחו על ידי Gaussian מימדי סימטרית להתאים. לוקליזציה וכתוצאה מכך של הפסגה אות ואז מוקרן על האותות המקורי, מטושטשת. בתמונת הממוזג, המרכזים המותאמות לשפות אחרות של אותות בין שני הערוצים מחוברים כדי להפיק את מטריצת מעבר זה משמש לאחר מכן היישור post-processive של המידע מהניסוי. גודל ברים = 1 מיקרומטר (B, C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
מולקולה בודדת הדמיה של חלבוני ממברנה מיטוכונדריאלי
הערה: כל ניסויים מבוצעים בטמפרטורת החדר. תאי-T או תאים שאינם מחסידי חייב להיות מרותק למיטה בטיפול agarose לפני הדמיה31.- הר הדגימה עם תאים חסיד-coverslip בין גומי טבעות PTFE (איור 3 א). למלא את החדר עם 0.5-0.8 מ ל הדמיה בינוני.
- חזור על שלבים 2.2.2–2.2.5.
- להתאים את המיקרוסקופ זווית תאורה TIRF לשליטה תוכנה ליצירת זווית באירועים קטנים יותר זווית קריטית עבור מצב טיר לגרות את אזור מסוים עניין דרך חילו גיליון32 (מצב חילו, איור 1A).
זהירות: הימנעו קשר עין ישיר עם קרן לייזר! - הגדר את רווח EM ובחרו זמן חשיפה בלתי מתאימים לניסוי שאוסף פוטונים מספיקות לכל מסגרת.
- להגדיר את עוצמת הלייזר כדי להשיג קליטה גבוהה לרעש (S/N) יחס (איור 3B), מאז הדיוק לוקליזציה ישירות מקביל S/N33 (איור 3C).
- למצוא שטח בפריפריה תא עם המיטוכונדריה שאינם חופפים, מוארך, אותות מולקולה בודדת (איור תלת-ממד; משלים וידאו 1). אם אין אותות מולקולה בודדת גלויים, לחכות הלבנת תוצאות במראה של אותות מולקולה בודדת (איור 3E).
- להקליט עד מספר אותות הוא נמוך מדי עבור המשך הגיוני (בדרך כלל מסגרות 1,000 – 10,000 בהתאם התנהגות הלבנה הפלורסנט, איור 3F).
- התחל ההדמיה עיבוד תוכנה וחפש מיטוכונדריאלי מבנים על ידי יצירת תמונת שניתנו סכום מצטבר של מסגרות לפחות 1,000 מוקלטות (איור 3G).
הערה: קצב המסגרות אפשרי המהירה מוכתב על-ידי האזור readout. בתחום התצוגה עבור ערוץ אחד הוא מופחת על ידי מפצל תמונה כפול-צבע (512 x 512 פיקסלים) 256 x 512 פיקסלים, ובשביל Quad-צבע כדי 256x256 פיקסלים. לפיכך, עבור משתמש של מפצל תמונה עבור שני צבעים, זו 30 הרץ. קבע מצב ההעברה מסגרת כדי להשיג את הזמן readout אפשרי הנמוך. - הפעל תוכנת ניתוח תוסף ו'טען נתונים גולמיים. בחר את התמונות הכיוון ואת עומס של ערוץ. השתמש את מטריצת מעבר משלב 2.3.9 כאשר ביקש "כיול תמונות". ערוצי יוצג בנפרד.
- פתח את ' מנהל יחידת "כמו קודם להגדרת פקטורים של המרה יחידת לכל ערוץ. פתח את ' מנהל לוקליזציה "לכל ערוץ. לאחר מכן הגדר את תיבת הערכה, מספר לולאות דפלציה, להוסיף PSF תיאורטי עבור התנאים בשימוש ולהגדיר כמה ליבות של המחשב משמשים לחישוב. לבסוף, הקש "בתרגום" כדי לקבל מקומי יחיד חלקיקים (איור 3 H; וידאו משלים 2).
- שים לב כי התוכנית סוף סוף יפיק תמונה superresolution המצטבר מראה כל מקומי חלקיקים (איור 3עכשיו).
- לבצע ניתוח, למשל, על ידי תוכנת קוד פתוח או את התוכנה שלנו זמינים על פי בקשה.
- מעקב אחר המולקולות יחיד של שני ערוצי המותאמות לשפות אחרות, למשל, עם מספר מטרות מעקב10
הערה: שלב 2.4.13 זקוק ראשוני (ניסיוני) ידע על diffusibility של החלבונים עניין להציב את התנאים גבול כראוי. בדרך כלל, מציאת התנאים הגבול הנכון הוא תהליך איטרטיבי.
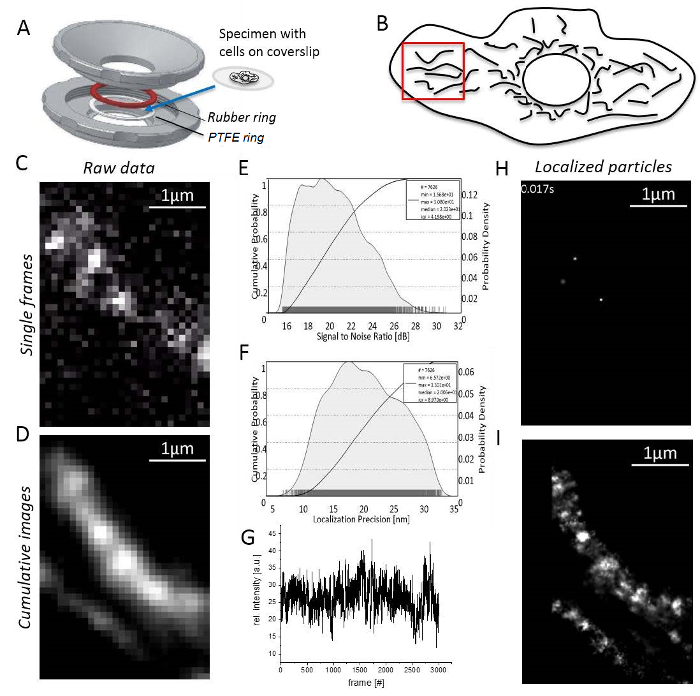
איור 3 : שלבים במהלך מולקולה בודדת לוקליזציה מיקרוסקופ. (א) א coverslip עם הדגימה הוא רכוב בין עליונים ותחתונים החלק (אפור) של בעל מדגם תוצרת בית (תוכנן על ידי ג'יי Bereiter-האן). טבעת גומי (אדום) וטבעת PTFE (לבן) חותם את המערכת מלמעלה ומלמטה את coverslip, כאשר החלקים בעל מדגם בולט יחד. (B) אות יחס לרעש של האות TMR. (ג) מחושב היסטוגרמה דיוק לוקליזציה עבור חלקיקים כל לשפות אחרות. (ד) בחירת אזור סביר עבור הדמיה, כאן, הפריפריה תא עם המיטוכונדריה מופרדים בצורה ברורה. (E) הקלטה ועיבוד תמונה: מסגרת אחת עם אותות ברורים מולקולה בודדת מוצג (כאן, מולקולות יחיד של קורות חיים-HaloTag/TMRשהותכם נרשמו). (F) בעוצמה של TMR מעל זמן ההקלטה. (G) תמונה סכום מצטבר של מסגרות 3,000, לא עובדה. (H) חלקיקים של קורות חיים-HaloTag/TMRשהותכם מקומי עם פונקציה גאוסיאנית 2D של מסגרת אחת. (אני) מצטבר, רינדור התמונה סכום מציג כל החלקיקים CV-HaloTag/TMRשהותכם מקומי ממסגרות 3,000. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הדמיית צבע רב וניתוח colocalization יכול לעזור לקבוע לוקליזציה תת-אבחון של חלבונים. להדגים זאת מוקדם יותר עם cytosolic פוספטאז, homologue tensin, PINK1, הכולל סאב-מיטוכונדריאלי במקומות שונים בשל העיבוד שלו על-ידי פרוטאזות מיטוכונדריאלי17. PINK1 הוא גורם חשוב המבטיח פונקציונליות מיט?...
Access restricted. Please log in or start a trial to view this content.
Discussion
. הנה, הוצגה טכניקה עבור צבע כפול לוקליזציה מולקולה בודדת של חלבוני ממברנה ניידים. בעקבות את הפרוטוקול, קרום חלבונים הם התמזגו כדי תיוג עצמי חלבונים כי מגיבים עם צבעים rhodamine TMR ואדוני מצומדת כדי מצעים המתאימים שלהם. Rhodamine צבעים בהירים, photostable, ובכך לאפשר הדמיה חוזרות1. לביצועים מ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות ביופיזיקה קבוצה של יעקב Piehler ב אוניברסיטה של אוסנברוק תמיכה שוטפת, ולדיסלאו קוהל לקבלת סיוע טכני והכנת חומר של הלוח CellNanOs למתן מיקרוסקופים לשימוש. הפרויקט מומן על ידי 944 SFB.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M) (HEPES) | Biochrom | #1104E | |
| DC1: Dichroid beam splitter | Chroma | 640 dcxr | NC506031 |
| DC2: Polychroic Mirror, beamsplitter | Chroma | zt405/488/561/640rpc | discontinued |
| Dulbecco´s Phosphate-Buffered Saline (PBS) 1x (w/o Ca & Mg) | Sigma-Aldrich & Co. | #RNBF8311 | |
| Earle´s MEM without phenol red, without L-Glutamine and without NaHCO3 containing 1% FBS, 0.1% HEPES, 0.1% NEAA, 0.1% Alanyl-L-Glutamine and 34.78% sodium hydrogen carbonate (NaHCO3 0.75g/l) | Imaging medium | ||
| Earle´s minimum essential medium (MEM) with phenol red, containing 1% Fetal Bovine Serum Superior (FBS), 0.1% HEPES (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M), and 0.1% non-essential amino acids (NEAA) | Growth medium | ||
| EF: Emission filter quadbandpass | AHF analysentechnik | F72-866 | Brightline HC 446 nm/523 nm/600 nm/677 nm |
| EMCCD camera | Andor | Andor iXON 897 | EMCCD camera |
| Emission filter QuadView filter cubes, orange | AHF analysentechnik | F39-637 | bandpass 582 - 619 nm |
| Emission filter QuadView filter cubes, red | Chroma | bandpass 655 - 725 nm (HQ 690/70) | |
| FBS (Fetal bovine serum) superior | Biochrom | S0615 | |
| Fluorescent beads: TetraSpeck™ Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Thermo Fisher Scientific | T7279 | fluorescent microspheres |
| Glutamine | Biochrom | #0951C | |
| HeLa cells | DSMZ | ACC-57 | Cervical carcinoma cells from patient Henrietta Lacks |
| Hela cells CI::paGFP, stable | Muster et al., PLOSOne 2010 | ||
| Hela cells CV g::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Hela cells Tom20::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Image splitter | Photometrics | Dual-View QV2 | image splitter emission |
| Imaging processing software | ImageJ2 / Fiji | freeware | |
| Immersion Oil - ImmersolTM 518 F (ne = 1.518, ve = 45) | Carl Zeiss Jena GmbH | 444960-0000-000 | |
| Inverted epifluorescence microscope | Olympus IX-71/73/83 | ||
| Laser 561 nm, 200 mW | CrystaLaser | CL-561-200 | 561 nm emission |
| Laser 642 nm, 140 mW | Omicron | Luxx-642-140 | 642 nm emission |
| MATLAB | MathWorks | version R2013a | |
| MEM with Earle's Balanced Salt Solution 2.2 g/L NaHCO3, stable glutamine w/o PR | Biochrom | FG-0385 | |
| MEM with Earle's Balanced Salt Solution with 2.2 g/L NaHCO3, stable glutamine, Phenolred | Biochrom | FG-0325 | |
| MitoTracker® Deep Red FM | Thermo Fisher Scientific | M22426 | dye |
| MitoTracker® Green FM | Thermo Fisher Scientific | M7514 | dye |
| Multi-mode-optical polarization maintaining monomode fiber | Pointsource/Qioptiq | KineFLEX | |
| NHS-PEG-MAL, Rapp Polymer | Rapp Polymere GmbH Tübingen | coverslip coating | |
| non-essential amino acids (NEAA) | Biochrom | #0802E | |
| PEG 800 (Polyethylene glycol) 10 % | Carl Roth GmbH | Art No. 0263.1 | coverslip coating |
| Penicillin/Streptomycin | Biochrom | #0122E | |
| Plasmid for PINK1-Halo7-Tag expression | Beinlich et al., ACS Chemical Biology 2015 | ||
| Poly-L-lysine (1.2 mg/ml) | Sigma-Aldrich & Co. | Cat. No.P9155 | coverslip coating |
| RGD Peptide (Ac-CGRGDS-COOH) | Coring System Diagnostix GmbH, Gernsheim | coverslip coating / Intergrin receptor motif | |
| Silicon Rhodamine linked to HaloTag®-Ligand (SiRHTL) | personal gift from Kai Johnson | dye | |
| Software analysis plugin | self-written C. P. Richter, Biophysik Osnabrück | SLIMFAST 16g | |
| Tetramethylrhodamine / SNAP-Cell® TMR-Star linked to SNAP-Ligand (TMRstar) | New England Biolab® | S9105S | dye |
| Tetramethylrhodamine linked to HaloTag®-Ligand (TMRHTL) | Promega | G8251 | dye |
| TIRF condensor | Olympus | Cell^TIRF MITICO System | TIRF condensor |
| TIRF microscope controlling software | Olympus cellSens 1.12 | ||
| TIRF objective | Olympus | 150x oil objective (N.A. 1.45; Olympus UAPO) | |
| Trypsin/EDTA 10x | Biochrom | #0266 | |
| Water H2O 99,5 % Rotipuran® Low organic | Carl Roth GmbH | Art. No. HN57.1 |
References
- Appelhans, T., Richter, C., Wilkens, V., Hess, S., Piehler, J., Busch, K. Nanoscale organization of mitochondrial microcompartments revealed by combining tracking and localization microscopy. Nano Letters. 12 (2), 610-616 (2012).
- Appelhans, T., Busch, K. Single Molecule Tracking and Localization of Mitochondrial Protein Complexes in Live Cells. Methods Mol Biol. 1567, 273-291 (2017).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3 (10), 793-795 (2006).
- Gould, T. J., Verkhusha, V. V., Hess, S. T. Imaging biological structures with fluorescence photoactivation localization microscopy. Nat Protoc. 4 (3), 291-308 (2009).
- Pennacchietti, F., Gould, T. J., Hess, S. T. The Role of Probe Photophysics in Localization-Based Superresolution Microscopy. Biophys J. 113 (9), 2037-2054 (2017).
- Wegel, E., Göhler, A., Lagerholm, B. C., Wainman, A. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific reports. , Available from: https://www.nature.com/articles/srep27290?WT.feed_name=subjects_physical-sciences (2016).
- Pellett, P., et al. Two-color STED microscopy in living cells. Biomedical Optics Express. 2 (8), (2011).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79(2016).
- Liss, V., Barlag, B., Nietschke, M., Hensel, M. Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy. Scientific Reports. 5, 17740(2015).
- Sergé, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nat Methods. 5 (8), (2008).
- Appelhans, T., Busch, K. B. Dynamic imaging of mitochondrial membrane proteins in specific sub-organelle membrane locations. Biophysical reviews. 9 (4), 345-352 (2017).
- Wilmes, S., et al. Triple-color super-resolution imaging of live cells: resolving submicroscopic receptor organization in the plasma membrane. Angewandte Chemie. 51 (20), 4868-4871 (2012).
- Niewidok, B., et al. Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. J Cell Biol. , (2018).
- Wurm, C. A., Jakobs, S. Differential protein distributions define two sub-compartments of the mitochondrial inner membrane in yeast. FEBS Lett. 580 (24), 5628-5634 (2006).
- Schmidt, R., Wurm, C. A., Punge, A., Egner, A., Jakobs, S., Hell, S. W. Mitochondrial cristae revealed with focused light. Nano Lett. 9 (6), 2508-2510 (2009).
- Kukat, C., Wurm, C. A., Spahr, H., Falkenberg, M., Larsson, N. G., Jakobs, S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Beinlich, F., Drees, C., Piehler, J., Busch, K. Shuttling of PINK1 between Mitochondrial Microcompartments Resolved by Triple-Color Superresolution Microscopy. ACS chemical biology. 10 (9), 1970-1976 (2015).
- Shim, S., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. 109 (35), 13978-13983 (2012).
- Sbalzarini, I., Mezzacasa, A., Helenius, A., Koumoutsakos, P. Effects of Organelle Shape on Fluorescence Recovery after Photobleaching. Biophysical Journal. 89 (3), 1482-1492 (2005).
- Reits, E., Neefjes, J. From fixed to FRAP: measuring protein mobility and activity in living cells. Nature Cell Biology. 3 (6), E145-E147 (2001).
- Goehring, N., Chowdhury, D., Hyman, A., Grill, S. FRAP Analysis of Membrane-Associated Proteins: Lateral Diffusion and Membrane-Cytoplasmic Exchange. Biophysical Journal. 99 (8), 2443-2452 (2010).
- Bacia, K., Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: principles and applications. Cold Spring Harbor protocols. 2014 (7), 709-725 (2014).
- Sukhorukov, V., Dikov, D., Busch, K., Strecker, V., Wittig, I., Bereiter-Hahn, J. Determination of protein mobility in mitochondrial membranes of living cells. Biochimica et biophysica acta. 1798 (11), 2022-2032 (2010).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Graham, F. L., van der Eb, A. J. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52 (2), 456-467 (1973).
- Wedeking, T., et al. Spatiotemporally Controlled Reorganization of Signaling Complexes in the Plasma Membrane of Living Cells. Small. 11 (44), 5912-5918 (2015).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280 (1), 715-721 (2005).
- Poot, M., et al. Analysis of mitochondrial morphology and function with novel fixable fluorescent stains. J Histochem Cytochem. 44 (12), 1363-1372 (1996).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells (vol 5, pg 159). Nature Methods. 5 (5), 455(2008).
- Elmokadem, A., Yu, J. Optimal Drift Correction for Superresolution Localization Microscopy with Bayesian Inference. Biophys J. 109 (9), 1772-1780 (2015).
- Barlag, B., et al. Single molecule super-resolution imaging of proteins in living Salmonella enterica using self-labelling enzymes. Sci Rep. 6, 31601(2016).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5 (2), 159-161 (2008).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat Methods. 7 (5), 377-381 (2010).
- Jin, S., Youle, R. J. PINK1- and Parkin-Mediated Mitophagy at a Glance. Journal of Cell Science. 125, 795-799 (2013).
- Yamano, K., Youle, R. J. PINK1 is degraded through the N-end rule pathway. Autophagy. 9 (11), 1758-1758 (2013).
- Wiedemann, N., et al. Machinery for protein sorting and assembly in the mitochondrial outer membrane. Nature. 424 (6948), 565-571 (2003).
- Thompson, R., Larson, D., Webb, W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved