Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Многоцветные локализации микроскопия одного мембранных белков в органеллами живой Mammalian клеток
В этой статье
Резюме
Здесь мы представляем протокол для локализации многоцветные одного мембранных белков в органеллы живых клеток. Чтобы прикрепить флуорофоров, используются самомаркируемыми белки. Белки, расположенных в различных оболочек отсеков же органеллы, могут быть локализованы с точностью ~ 18 Нм.
Аннотация
Знания о локализации белков в клеточном subcompartments важно понять их конкретные функции. Здесь мы представляем супер резолюции технику, которая позволяет для определения microcompartments, которые доступны для белков, генерируя локализации и отслеживания карты этих белков. Кроме того при локализации многоцветные микроскопии, локализации и отслеживания профили белков в разных subcompartments получаются одновременно. Техника для живых клеток и основан на повторяющихся изображений одного мобильного мембранных белков. Протеинов интереса генетически сливается с конкретными, так называемые самомаркируемыми Теги. Эти теги являются ферменты, которые реагируют с субстрат на основе ковалентных. Конъюгированных эти субстраты являются флуоресцентных красителей. Реакции Энзим тегами белков с флуоресценцией помечены субстратов результаты в обозначенные протеины. Здесь тетраметилродамина (ПМР) и родамин кремния (сэр) используются в качестве Краски люминесцентные, флуоресцентные, придает субстраты ферментов. С помощью концентрации субстрата в личку к Нм, югу стехиометрическим маркировки достигается, что приводит к различных сигналов. Эти сигналы локализованы с ~ 15 – 27 Нм точность. Техника позволяет многоцветные изображения одного молекул, согласно которой количество цветов ограничивается доступных проницаемой мембраны красителей и репертуар самомаркируемыми ферментов. Мы покажем возможности техники путем определения локализации контроля качества фермента (Pten)-индуцированной киназы 1 (PINK1) в различных отсеках митохондриальной во время его обработки в отношении других мембранных белков. Тест на истинный физических взаимодействий между по-разному помечены одной белки одной молекулы лад или совместное отслеживание ограничен, хотя, потому что низкий маркировка степени уменьшить вероятность для имеющих двух прилегающих белки, помечены в то же время. В то время как техника является сильным для визуализации белков в отсеках мембраны, в большинстве случаев это не целесообразно определить локализация мобильных растворимые белки.
Введение
Целью настоящего Протокола является предоставить метод обработки изображений для локализации и отслеживания одного мембранных белков внутри живых клеток. Мы называем этот метод отслеживания и локализации микроскопии (TALM)1,2. Как стохастические оптической микроскопии реконструкции (шторм)3 и микроскопии флуоресцирования Photoactivation локализации ((F PALM))4,5TALM это способ локализации одной молекулы основе флуоресценции. Однако она отличается в том, что мобильность мембранных белков в сочетании с повторяющихся изображений одного и того же надписью молекулы в разных позициях показывает microcompartment, который доступен для мобильных белка. Другими словами возможности локализации протеина устанавливаются архитектура органелл и мобильность белок1. Метод является дополнением к различных других суперразрешением методы6,7,8 , потому что она показывает, локализации и траектории карты визуализации мобильных белков. Маркировки основана на использовании генетически синтез белков, которые per se не флуоресцентные. Эти протеины сплавливания являются самомаркируемыми ферменты, которые реагируют ковалентно с подложкой, конъюгированных с красителем. Эта процедура имеет то преимущество, что маркировка степени может быть под контролем количество добавлен субстрата. Кроме того она позволяет изменять цвет флуоресценции, в зависимости от выбранной конъюгированных красителя. Несколько самомаркируемыми фермента теги являются доступны9. Еще одно преимущество использования самомаркируемыми фермента теги, что конъюгированных красители обычно являются более стабильными и ярче, чем флуоресцентные белки1 индивидуальных белков и поэтому может быть записано больше и более точно до тех пор, пока они являются беленой. Это позволяет для записи траекторий мобильных белков и извлечения коэффициенты диффузии10,11.
Здесь мы продемонстрировать возможности TALM с митохондриальных мембранных белков, но он также может применяться для других интра - и загородный cellular мембранных белков, включая различных клеточных типов12,13. Мы показываем, что многоцветные TALM далее позволяет одновременное различия белков в различных subcompartments в дополнения существующих суперразрешением флуоресцентной микроскопии методы14,15, 16. TALM совместим с живой клетки изображений17. Фото физика выбранной rhodamines тетраметилродамина (ПМР) и кремний-Rhodamien (SiR), в частности их яркость и стабильности, позволяет записывать один мембранных белков через несколько кадров, предоставление карт локализации (и траектории). Однако TALM ограничен для локализации растворимые белки с высокой диффузионной коэффициентами, поскольку размытие движения является слишком высоким и собранных фотонов в кадре, являются слишком низкими для правильной локализации. Кроме того TALM требует меньше энергии возбуждения, чем например шторм или стимулировали выбросов истощения (интереса) микроскопия6,7, уменьшая фототоксических эффекты. Это важно, поскольку фототоксических стресс часто влияет на organellar морфология18 и, таким образом, мобильность анализа19. В целом, мы представляем многоцветные TALM в живых клетках как технику, которая заполняет пробел между методами микроскопии локализации шторм/интереса/PALM (F) и методов, которые анализируют белка мобильности как флуоресценции восстановления после Фотообесцвечивание (FRAP)20 ,21, флуоресценции корреляции спектроскопии (FCS)22и флуоресценции крест корреляция спектроскопии (FCCS)11,23.
Access restricted. Please log in or start a trial to view this content.
протокол
Следующий протокол следует принципам местное учреждение Комитета по этике исследований.
1. методы
-
Культура клеток
- Культивируйте клетки, например НеЬа клетки (карцинома шейки матки человека), в колбу культуры T25 ячейки, содержащие 5 мл среднего роста при 37 ° C и 5% CO2.
Примечание: Для изображений, разбить ячейки на подготовленный coverslips (см. шаги 1.3 и 1.4) и держать в imaging среднего.
- Культивируйте клетки, например НеЬа клетки (карцинома шейки матки человека), в колбу культуры T25 ячейки, содержащие 5 мл среднего роста при 37 ° C и 5% CO2.
-
Transfection клетки
Примечание: Используйте клеточных линий, которые стабильно Экспресс тегами белки возможности24 чтобы избежать сильного гиперэкспрессия. Для переходных трансфекции адаптировать количество плазмидной ДНК для transfection. Например когда используется Ca2 + фосфат трансфекции25 , transfect клетки (80 – 90% confluency) в 3,5 см клетки культуры блюдо с 2,5 – 5 мкг плазмидной ДНК. При выполнении двойной трансфекции, используйте 2,5 мкг на каждой плазмидные конструкции.- Для двойной цвет экспериментов используйте линии клетки с стабильной выражение одного самомаркируемыми белка и временно transfect с плазмида кодирования другие самомаркируемыми белка17.
Примечание: Здесь, для двойной цвет экспериментов, клетки НеЬа были использованы стабильно выраженные самомаркируемыми белков PINK1-Halo-Tag и Tom20-fSNAP-Tag.
- Для двойной цвет экспериментов используйте линии клетки с стабильной выражение одного самомаркируемыми белка и временно transfect с плазмида кодирования другие самомаркируемыми белка17.
-
Очистка coverslips
- Место coverslips в стакан. Добавьте 30 мл H2O в стакан, содержащие coverslips и осторожно встряхнуть, чтобы удалить пыль с их поверхности.
- Соберите coverslips с помощью пинцета и высушить их с потоком азота.
- Удалите любые органические загрязнения на поверхности coverslips, например, путем очистки плазмы.
Примечание: Во избежание дальнейшего загрязнения материала стекла, надевайте перчатки во время обработки coverslips.
Предупреждение: При coverslips уборка, плазменной очистки, очищается только верхней части coverslips; Используйте эту сторону для покрытия с поли L-лизин полиэтилен гликоль аргинин глицин аспартат (PLL-PEG-РСЗ) (раздел 1.4) и клеток, посев (раздел 1.5).
-
Coverslip покрытие с PLL-PEG-РСЗ
Примечание: PLL-PEG-РГД является производным (PLL) поли L-лизин с полиэтиленгликоля (3000 Da) и cysteine-glycine-arginine-glycine-aspartate-serine (CGRGDS) пептида прилагается. PLL привязывается к отрицательно заряженных стеклянной поверхности и формы кисти КОЛЫШЕК. Это резко сокращает неспецифических привязки заряженных флуоресцентных красителей. Кроме того РГД мотив имитирует сигнала пептид Интегрин рецептора и тем самым содействует соблюдению при посредничестве Интегрин клеток, которые в противном случае не придерживаются легко.- Подготовьте PLL-PEG-РГД как описано26. Короче говоря Растворите 0,8 мг PLL-PEG-РГД в 1 мл ФСБ. Добавьте 10 мкл раствора PLL-PEG-РГД на верхней стороне чистой coverslip.
- Возьмите второй coverslip и поместите его с чистой поверхностью вниз на первый coverslip (что имеет PLL-PEG-РГД падение на верхней части); Это приводит к сэндвич PLL-PEG-РГД решения между двумя coverslips.
- Осторожно поместите слоеное coverslips в стакан и инкубировать 1 час при комнатной температуре в пыли сухой среде.
- После 1 h добавьте 30 мл H2O в стакан, чтобы полностью покрыть coverslips с водой.
- Осторожно встряхните стакан до тех пор, пока coverslips отделить друг от друга.
- Используйте щипчики для сбора coverslips из воды и высушите их под струей газа азота.
Примечание: С покрытием coverslips может храниться в сухих, стерильные стеклянные Петри блюдо с крышкой на пару дней.
-
Подготовка образца для изображений
- Передача одного с покрытием coverslips в 35 мм ячейку культуры блюдо, с покрытием поверхности PLL-PEG-РГД вверх и добавить 2 мл изображений среднего на вершине.
- Добавьте соты trypsinized ~ 500 000 (200 – 500 мкл), которые выражают самомаркируемыми Теги на соответствующих мембранных белков до 2 мл, изображений среднего в ячейку культуры блюдо с покрытием coverslip. Встряхнуть рукой осторожно обеспечить равномерное распределение ячеек для получения равномерно слоя клеток.
- Инкубируйте клетки при 37 ° C и 5% CO2 , пока не будет достигнут 80% confluency.
Примечание: Образцы клетки должна быть заполнена 3 дней до изображений и 1 день до transfection. Клетки, которые стабильно выражают протеин интереса, может быть заполнена за 2 дня до изображений. Позже отражаются только те ячейки, которые выросли на coverslip.
-
Маркировка тегами белков
Примечание: Наиболее флуоресцентные субстратов должны растворяться в воде бесплатно ДМСО. Мы советуем использовать акций решения 1 мкм флуоресцентные субстрата, когда окончательный маркировки концентрация составляет 0,2 – 30 Нм17. Для визуализации мембранных белков внутри клетки, используйте мембраны проницаемых флуоресцентные субстратов.- Разминка изображений среднего до 37 ° C на водяной бане.
- Пипетка 1 мл подогретым изображений среды в 2-мл пробирку с крышкой. Мкл 0,2 – 30 флуоресцентный субстратов от 1 мкм запасов решений для подготовки окончательного решения маркировки (конечная концентрация: 0,2 – 30 Нм).
- Вихревой маркировки решение для 10 s.
- Заменить средний в 35 мм культуры блюдо с клетки на coverslip (см. шаг 1.5) по 1 мл подготовленных маркировки решения.
- Инкубируйте клетки в маркировке раствор при 37 ° C и 5% CO2 на 20 – 30 мин.
- Вымойте клетки с 2 мл PBS один раз, а затем с 2 мл изображений среднего дважды. Наконец Пипетка 1 мл свежих изображений средних клеток блюдо и положить образец обратно в инкубатор при 37 ° C и 5% CO2 для по крайней мере 1 час. До обработки изображений, Обмен изображений среднего еще раз.
Примечание: При выполнении эксперимента в первый раз, подтверждают правильной ориентации самомаркирующимся белков organellar мембран путем пятнать органеллы с коммерчески доступных органеллы конкретных красители27,28. В этом случае также используйте 100 – 200 Нм субстрата для самомаркируемыми ферментов производить сильные сигналы.
-
Подготовка образца флуоресцентные шарик
Примечание: Чтобы определить оптических дрейфа и выровнять изображения различных каналов, используются многоцветные флуоресцентные бусины (0,1 мкм). С записанные изображения будет создаваться матрицы аффинного преобразования для выбросов двух каналов.- Разбавить раствор бусы до 1% с чистой H2O.
- Место 5 капель приготовленный раствор с бисером флуоресценции в пяти различных позициях на очищенный coverslip (см. шаг 1.3).
- Пусть флуоресцентные шарик образец сухой на лавочке чистой.
Примечание: Образец может быть повторно использован; Таким образом охватывать образца с алюминиевой фольгой, чтобы избежать загрязнения и держать его на 4 ° C.
2. микроскопия
-
Экспериментальные установки
Примечание: Система базовых микроскопии для одной молекулы двойной цвет изображений основана на инвертированным микроскопом: он оснащен двумя лазерами, сочетании через mode-оптической поляризации, поддержание фибероптический волокна в одного полного внутреннего отражения (МДП) конденсатор, объективной погружения нефти, предназначенные для TIRF, фильтры выбросов polyband, изображения разделителя и высокочувствительный камеры (рис. 1). Конденсатор МДП необходимо, для непрерывной настройке инцидента угол позволяет переключаться между Эпи-, весьма склонны и ламинированные оптических листа (весьма склонен тонкие освещения (ХИЛО)29) и в режиме TIRF возбуждения с оптимизированы Глубина проникновения. Изображения получены с системой высокочувствительных охлаждаемый детектор, например, задней подсветкой электрона умножения взимается камеры спаренные устройства (EMCCD) (Квантовая эффективность количественного Смягчения > 90%) или sCMOS камеры (QE > 80 – 90%).- Определите оптических смещения изображения флуоресцентных бусины (см. шаг 2.2) на тех же условиях, как те, которые будут впоследствии использоваться для эксперимента, например, когда 10000 кадры записываются в эксперименте, записывать также 10 000 кадров с образцом шарик. Для определения оптической дрейф Сравните положение бисер в первый и последний приобретенные кадром (рис. 1B). При необходимости позже исправить изображения серии для оптических дрейф30 или использовать дрейф стабильной среды.
- Оборудовать фильтр куб с соответствующей дихроичных пучка сплиттер, например, оранжевый и красный флуоресценции плюс адекватного выбросов фильтры для оранжевый флуоресценции и красной флуоресценцией. Оборудовать подходящие фильтры изображения разделителя. Проверьте возможные утечки сигналы из одного канала в другой канал путем записи одного цвета образцов в обоих каналах (рис. 1 c).
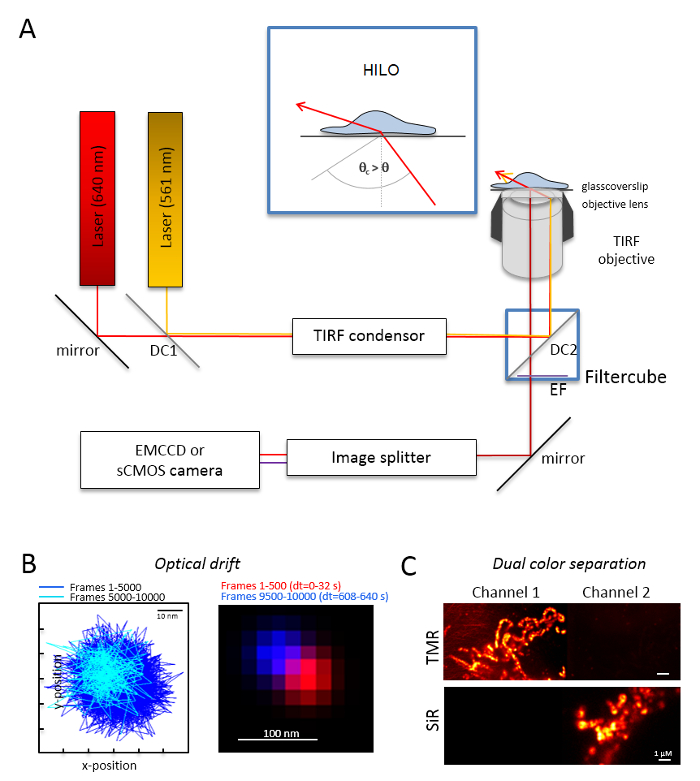
Рисунок 1 : Оптические макет для отслеживания и локализации микроскопии многоцветные (TALM) с оранжевой и красной излучателей. (A) Установка инвертированный микроскоп с по крайней мере двух лазеров возбуждения, TIRF конденсатора, TIRF подходит цели, изображения разделителя и чувствительной камеры. Врезные: возбудить органеллы внутри клетки, угол луча инцидента необходимо задать меньше, чем критический угол для TIRF для достижения весьма склонны и ламинированные оптических листа освещения (ХИЛО). DC1: Дихроичное зеркало 1; DC2: Дихроичное зеркало 2. EF: фильтр выбросов. (B) тест на оптических дрейф изображения позиции флуоресцентный шарик для 10 000 кадров с же частота кадров по состоянию на следующие эксперименты (здесь: 15 Гц). Связанные должности первых 500 кадров и последних 500 кадров показывают дрейфа. Кроме того объединенное изображение с позицией первый и последний кадр в красный и синий показывают минимальный дрейф. Дрейф является расстояние между центром сигналов, деленному на время записи, здесь 125 м/s. (C) проверка на четкое разделение сигналов, здесь ПМР и сэр. Для обоих каналов созданных нарастающая сумма изображения из 3000 кадров (ПМР в канал 1) и сэр в канал 2. СэрHTL был прикреплен к Tom20-HaloTag и ПМРHTL для OxPhos комплекса V-HaloTag. Цвета являются ложными цветами. Масштаб баров = 100 Нм (B) и 1 мкм (C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Физические выравнивание изображения разделителя созданных изображений
Примечание: Для установки образца, подготовленный на coverslip, самодельный держатель образца могут быть использованы (рис. 2A). Чтобы избежать пыли и т.д. попадания образца, место крышку культуры блюдо слабо верхней палаты, при монтаже. Же-держателя образца может использоваться для подключения coverslip с флуоресцентные бусы или клетки; когда клетки отражаются, добавить 0,5 – 0,8 мл изображений среднего. Изображения разделителя разбивает изображение на два или более спектрально разделены каналами и проецирует их бок о бок на тот же камеры. Этот процесс потенциально вводит систематические искажения между каналами из-за различных оптических пути прошёл и препятствует прямой colocalization анализа. Поэтому, сначала выполняют физические выравнивание и второй, после коррекции выравнивание с матрицей преобразования. Для обоих процессов, выравнивание флуоресцентный бусины должны распределяться содержанием однородно во всем поле зрения.- Смонтировать подготовленного образца с бусами Флюоресцентная в держателе образца между политетрафторэтилена (ПТФЭ)-кольцо и красный резиновое кольцо (рис. 2A).
- Запустите Микроскоп, все аппаратные компоненты и все программное обеспечение, необходимое для микроскопии.
- Очистите цель и в нижней части coverslip салфеткой безворсовой ткани, пропитанные изопропиловый спирт. Затем высушите обоих элементов свежие безворсовой салфеткой. Место капельку масла погружения на зрачок объектива.
- Место держателя образца с образцом шарик на сцену Микроскоп, так что в нижней части coverslip Контакты нефть. Сосредоточиться на бусы с помощью передачи света или лазерной линии.
- Отрегулируйте мощность двух лазеров возбуждения для достижения аналогичных интенсивности сигнала на двух каналах флуоресценции. Поиск по области с многих различных флуоресцентные сигналов.
- Генерировать объединенное представление флуоресцентные каналов с помощью программного обеспечения управления камерой. Затем используйте винты на изображение разделителя вручную наклона внутреннего зеркала изображения разделителя для достижения лучших наложение сигналов от двух люминесцентных каналов (рис. 2B).
Примечание: внимание! Не превышать динамический диапазон камеры.
-
Выравнивание спектрально разлученных каналов путем пространственного преобразования программного обеспечения
Примечание: Следующая часть показывает после коррекции выравнивание и процедура локализации с нашего программного обеспечения плагин (доступно по запросу).- Запустите TIRF Микроскоп контроль программного обеспечения и выбрать для отображения отдельных каналов в режиме живой эфир. Взять снимок изображения захватывающие флуоресценции во всех каналах (рис. 2 c).
- Используйте этот снимок изображения для создания матрицы преобразования (см. Рисунок 2).
Примечание: Матрица преобразования используется для пространственного преобразования, обычно аффинной один, который исправляет для перевода (дивергенция сигналов от одного точечного источника между двумя каналами). - Запустите модуль анализа программного обеспечения (могут быть получены по запросу от нашей лаборатории, см. рис. 2 c).
- Загрузите записанные ранее двойной цвет изображения (см. шаг 2.2) флуоресцентных бисера в программное обеспечение. Выбор используемых ориентации флуоресцентные каналов. Затем нажмите кнопку «Да» когда попросил «калибровки изображения» и выберите ранее принятые моментального снимка.
- Откройте «Единица менеджер» для определения единицы коэффициентов (размер пикселей, частота кадров, коэффициент пересчета Фотон).
- Откройте диспетчер «локализации». Определите, что точка распространения функция (PSF) сначала. Нажмите на кнопку: «ПСФ радиус». В открывшемся окне «ПСФ оценщик» определите числовой апертуры и максимальная выбросов. Начало «Оценка ПСФ радиус», нажав кнопку. Примите полученный экспериментально определить PSF. поле оценки, Количество петель дефляции, и сколько ядер компьютера используются для вычисления. Нажмите «локализовать», чтобы начать установку распределение интенсивности одного частиц по 2D симметричная Гауссова функция (рис. 2 c).
- «Принять» полученные экспериментально определить PSF. поле оценки, Количество петель дефляции и сколько ядер компьютера используются для вычисления. Нажмите «локализовать», чтобы начать установку распределение интенсивности одного частиц по 2D симметричная Гауссова функция (рис. 2 c).
- Откройте диспетчер «калибровка». В визуализированном изображении слияния двух каналов отображаются исходные сигналы и локализованных центров. Выбор режима «аффинных». Вручную соединяют соответствующие пары локализованных центров в двух каналах, которые возникли из же флуоресцентные шарик, создав линию связи.
- Подключите соответствующие сигналы распределены все поле зрения. После этого нажмите кнопку «принять». Сохраните калибровки.
Примечание: Пространственное преобразование пробы на каждом флуоресцентные шарик и интерполяцией между ними. Функция преобразования извлечения представляет смещение поля Δr(x,y), которая используется впоследствии исправить экспериментальной двойной цвет одной молекулы локализации, таким образом, чтобы они наложения точностью их локализации. Матрица пространственные преобразования обычно является аффинной тот, который исправляет перевод, масштабирование и вращение между каналами с нанометровой точностью, и он может быть выведен из этого ручной однозначное соответствие (рис. 2 c).
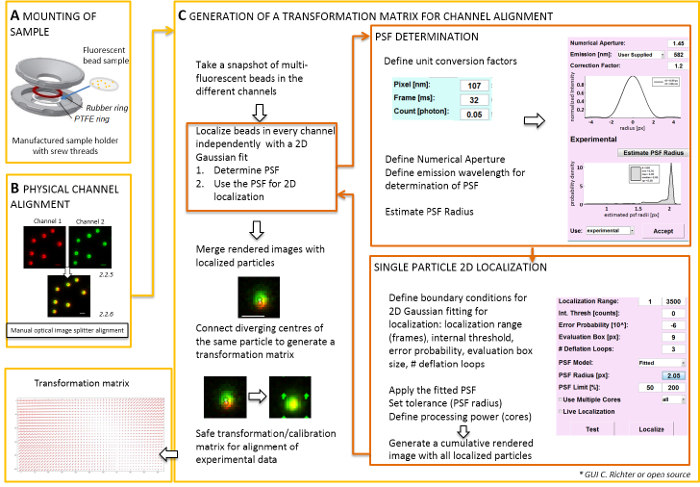
Рисунок 2 : Рабочий процесс для двойной цвет выравнивания. (A) coverslip с бусами Флюоресцентная устанавливается в держатель образца PTFE и резиновое кольцо. Тогда верхняя и Нижняя часть камеры болтами вместе. (B) физические выравнивание просмотров канала, которые создаются изображения разделителя. Записан флуоресцентные сигналы из бисера (0,1 мкм) в двух каналов (зеленый и красный, ложных цветов) объединяются. Соответствующие винты на оптическое изображение разделителя вручную включены, пока не будет достигнуто лучшее наложение различных сигналов (желтый цвет, Нижняя панель). (C) поколение матрицу преобразования для выравнивания post-processive канала. Для точной локализации частицы необходимо определить, что точка распространения функция (PSF) в зависимость от длины волны выбросов и числовой апертуры цели. В центре ПСФ может определяться ее интенсивность профиля анализируемой симметричный двумерных Гаусса подходят. Результате локализацией сигнал пик затем проецируется на оригинальный, размыты сигналов. В объединенного изображения локализованных очагов сигналов от двух каналов связаны сформировать матрицу преобразования, которая позднее используется для post-processive выравнивание экспериментальных данных. Масштаб баров = 1 мкм (B, C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Визуализация одной молекулы белков митохондриальных мембран
Примечание: Все эксперименты проводятся при комнатной температуре. T-клетки или клетки не сторонник должны быть иммобилизованным в агарозном перед изображений31.- Смонтируйте образца с адэрентных клеток на coverslip между резиной и кольца ПТФЭ (рис. 3A). Заполнить камеры с 0,5 – 0,8 мл изображений среднего.
- Повторите шаги 2.2.2–2.2.5.
- Отрегулируйте освещение угол TIRF Микроскоп контроль программного обеспечения для создания инцидента угол меньше, чем критический угол для режима МДП для возбуждения конкретные области интереса через HILO лист32 (HILO режим, рис. 1A).
Предостережение: Избегайте прямого контакта глаз с лазерный луч! - Установите получить EM и выбрать время экспозиции, подходит для эксперимента, который собирает достаточно фотонов в кадре.
- Установите мощность лазера для достижения высокий сигнал/шум (S/N) соотношение (рис. 3B), так как точность локализации непосредственно соответствует S/N33 (рис. 3 c).
- Найти область в периферии клетки с non перекроя, удлиненные митохондрий и одной молекулы сигналов (Рисунок 3D; Дополнительные видео 1). Если без одной молекулы сигналы видимы, дождитесь отбеливания результаты в виде одной молекулы сигналов (Рисунок 3E).
- Запись до тех пор, пока количество сигналов, слишком мал для продолжения разумного (обычно 1000-10000 кадров в зависимости от обесцвечивания поведение Люминесцентную краску, Рисунок 3F).
- Запуск визуализации, обработки программного обеспечения и проверки для митохондриального структур, создавая нарастающая сумма визуализированного изображения по меньшей мере 1000 записанных кадров (Рисунок 3 g).
Примечание: Быстрый возможную частоту кадров диктуется области индикации. Поле зрения для одного канала уменьшается двойной цвет изображения разделителя (512 x 512 пикселей) до 256 x 512 пикселей, а для Quad цвет до 256 x 256 пикселей. Таким образом для использования изображения разделителя для двух цветов, это 30 Гц. Установите режим передачи кадра для достижения низкой возможная индикация времени. - Запустите программное обеспечение анализа плагин и загрузки необработанных данных. Выберите канал ориентации и загрузки изображения. Используйте матрицу преобразования из шага 2.3.9 при попросила «Калибровка изображения». Каналы будут отображаться отдельно.
- Откройте «менеджер подразделения» как раньше определить подразделение коэффициентов для каждого канала. Откройте «локализация менеджер» для каждого канала. Затем определить поле оценки, Количество петель дефляции, добавьте теоретические ПСФ для условий использования и установить, сколько ядер компьютера используются для вычисления. Наконец нажмите кнопку «локализовать» для получения локализованных одной частицы (рис. 3 H; Дополнительные видео 2).
- Обратите внимание, что программа наконец будет генерировать совокупный сверхразрешение изображения показаны все локализованные частицы (Рисунок 3I).
- Выполните анализ, например, с открытым исходным кодом или наше программное обеспечение, предоставляются по запросу.
- Отслеживать одной молекулы в обоих локализованных каналов, например, с несколькими целевой трассирующими10
Примечание: Шаг 2.4.13 требует предварительных (экспериментальная) знаний о diffusibility протеинов интереса для правильно установить граничные условия. Как правило найти правильный граничных условий это итеративный процесс.
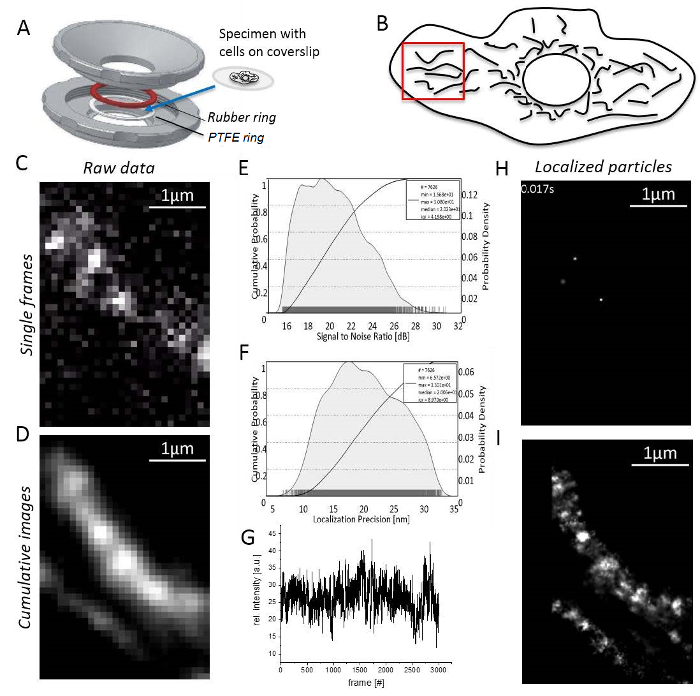
Рисунок 3 : Шаги во время одной молекулы локализации микроскопии. (A) A coverslip, с образец монтируется между верхней и нижней частью (серый) держателя домашнее образца (разработан J. Bereiter-Хан). Резиновое кольцо (красный) и кольцо PTFE (белый) печать системы от выше и ниже coverslip, когда держатель образца частей болт вместе. (B) отношение сигнал-шум сигнала ПМР. (C) вычисляется гистограмма точность локализации для всех локализованных частиц. (D) выбор разумного региона для обработки изображений, здесь, на периферии клетки с четко отделены митохондрий. (E) запись и обработка изображений: показан один кадр с одной молекулы различных сигналов (здесь, были зарегистрированы одной молекулы CV-HaloTag/TMRHTL ). (F) интенсивность ПМР за время записи. Нарастающая сумма изображения (G) 3000 фреймов, необработанные. (H) частицы из CV-HaloTag/TMRHTL локализованы с 2D Гауссова функция от одного кадра. (я) кумулятивным, рендеринг сумма изображения показаны все локализованные частицы CV-HaloTag/TMRHTL из 3000 кадров. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Многоцветные изображения и colocalization анализ может помочь определить суб organellar Локализация белков. Мы продемонстрировали это раньше с цитозольной фосфатазы и натяжение гомолог, PINK1, имеющий митохондриальной протеаз17различных суб митохондриальной местах в...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь был представлен метод двойной цвет одной молекулы локализация мобильных мембранных белков. После протокол, мембранные белки сплавлены к самомаркируемыми белки, которые реагируют с красителями родамин ПМР и сэр, сопряженных с их соответствующих субстратов. Родамин краски яркие ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить группу биофизики и Jacob Piehler в университете Оснабрюка для постоянной поддержки, Владислав Kohl для оказания технической помощи и подготовке материала и Правление CellNanOs для предоставления микроскопы для использования. Проект финансировался SFB 944.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M) (HEPES) | Biochrom | #1104E | |
| DC1: Dichroid beam splitter | Chroma | 640 dcxr | NC506031 |
| DC2: Polychroic Mirror, beamsplitter | Chroma | zt405/488/561/640rpc | discontinued |
| Dulbecco´s Phosphate-Buffered Saline (PBS) 1x (w/o Ca & Mg) | Sigma-Aldrich & Co. | #RNBF8311 | |
| Earle´s MEM without phenol red, without L-Glutamine and without NaHCO3 containing 1% FBS, 0.1% HEPES, 0.1% NEAA, 0.1% Alanyl-L-Glutamine and 34.78% sodium hydrogen carbonate (NaHCO3 0.75g/l) | Imaging medium | ||
| Earle´s minimum essential medium (MEM) with phenol red, containing 1% Fetal Bovine Serum Superior (FBS), 0.1% HEPES (2-(4-(2-hydroxyethyl)-1-piperazinyl)-ethanesulfonic acid, 1 M), and 0.1% non-essential amino acids (NEAA) | Growth medium | ||
| EF: Emission filter quadbandpass | AHF analysentechnik | F72-866 | Brightline HC 446 nm/523 nm/600 nm/677 nm |
| EMCCD camera | Andor | Andor iXON 897 | EMCCD camera |
| Emission filter QuadView filter cubes, orange | AHF analysentechnik | F39-637 | bandpass 582 - 619 nm |
| Emission filter QuadView filter cubes, red | Chroma | bandpass 655 - 725 nm (HQ 690/70) | |
| FBS (Fetal bovine serum) superior | Biochrom | S0615 | |
| Fluorescent beads: TetraSpeck™ Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Thermo Fisher Scientific | T7279 | fluorescent microspheres |
| Glutamine | Biochrom | #0951C | |
| HeLa cells | DSMZ | ACC-57 | Cervical carcinoma cells from patient Henrietta Lacks |
| Hela cells CI::paGFP, stable | Muster et al., PLOSOne 2010 | ||
| Hela cells CV g::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Hela cells Tom20::Halo7-Tag, stable | Appelhans et al., NanoLett 2012 | ||
| Image splitter | Photometrics | Dual-View QV2 | image splitter emission |
| Imaging processing software | ImageJ2 / Fiji | freeware | |
| Immersion Oil - ImmersolTM 518 F (ne = 1.518, ve = 45) | Carl Zeiss Jena GmbH | 444960-0000-000 | |
| Inverted epifluorescence microscope | Olympus IX-71/73/83 | ||
| Laser 561 nm, 200 mW | CrystaLaser | CL-561-200 | 561 nm emission |
| Laser 642 nm, 140 mW | Omicron | Luxx-642-140 | 642 nm emission |
| MATLAB | MathWorks | version R2013a | |
| MEM with Earle's Balanced Salt Solution 2.2 g/L NaHCO3, stable glutamine w/o PR | Biochrom | FG-0385 | |
| MEM with Earle's Balanced Salt Solution with 2.2 g/L NaHCO3, stable glutamine, Phenolred | Biochrom | FG-0325 | |
| MitoTracker® Deep Red FM | Thermo Fisher Scientific | M22426 | dye |
| MitoTracker® Green FM | Thermo Fisher Scientific | M7514 | dye |
| Multi-mode-optical polarization maintaining monomode fiber | Pointsource/Qioptiq | KineFLEX | |
| NHS-PEG-MAL, Rapp Polymer | Rapp Polymere GmbH Tübingen | coverslip coating | |
| non-essential amino acids (NEAA) | Biochrom | #0802E | |
| PEG 800 (Polyethylene glycol) 10 % | Carl Roth GmbH | Art No. 0263.1 | coverslip coating |
| Penicillin/Streptomycin | Biochrom | #0122E | |
| Plasmid for PINK1-Halo7-Tag expression | Beinlich et al., ACS Chemical Biology 2015 | ||
| Poly-L-lysine (1.2 mg/ml) | Sigma-Aldrich & Co. | Cat. No.P9155 | coverslip coating |
| RGD Peptide (Ac-CGRGDS-COOH) | Coring System Diagnostix GmbH, Gernsheim | coverslip coating / Intergrin receptor motif | |
| Silicon Rhodamine linked to HaloTag®-Ligand (SiRHTL) | personal gift from Kai Johnson | dye | |
| Software analysis plugin | self-written C. P. Richter, Biophysik Osnabrück | SLIMFAST 16g | |
| Tetramethylrhodamine / SNAP-Cell® TMR-Star linked to SNAP-Ligand (TMRstar) | New England Biolab® | S9105S | dye |
| Tetramethylrhodamine linked to HaloTag®-Ligand (TMRHTL) | Promega | G8251 | dye |
| TIRF condensor | Olympus | Cell^TIRF MITICO System | TIRF condensor |
| TIRF microscope controlling software | Olympus cellSens 1.12 | ||
| TIRF objective | Olympus | 150x oil objective (N.A. 1.45; Olympus UAPO) | |
| Trypsin/EDTA 10x | Biochrom | #0266 | |
| Water H2O 99,5 % Rotipuran® Low organic | Carl Roth GmbH | Art. No. HN57.1 |
Ссылки
- Appelhans, T., Richter, C., Wilkens, V., Hess, S., Piehler, J., Busch, K. Nanoscale organization of mitochondrial microcompartments revealed by combining tracking and localization microscopy. Nano Letters. 12 (2), 610-616 (2012).
- Appelhans, T., Busch, K. Single Molecule Tracking and Localization of Mitochondrial Protein Complexes in Live Cells. Methods Mol Biol. 1567, 273-291 (2017).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3 (10), 793-795 (2006).
- Gould, T. J., Verkhusha, V. V., Hess, S. T. Imaging biological structures with fluorescence photoactivation localization microscopy. Nat Protoc. 4 (3), 291-308 (2009).
- Pennacchietti, F., Gould, T. J., Hess, S. T. The Role of Probe Photophysics in Localization-Based Superresolution Microscopy. Biophys J. 113 (9), 2037-2054 (2017).
- Wegel, E., Göhler, A., Lagerholm, B. C., Wainman, A. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific reports. , Available from: https://www.nature.com/articles/srep27290?WT.feed_name=subjects_physical-sciences (2016).
- Pellett, P., et al. Two-color STED microscopy in living cells. Biomedical Optics Express. 2 (8), (2011).
- Ishigaki, M., et al. STED super-resolution imaging of mitochondria labeled with TMRM in living cells. Mitochondrion. 28, 79(2016).
- Liss, V., Barlag, B., Nietschke, M., Hensel, M. Self-labelling enzymes as universal tags for fluorescence microscopy, super-resolution microscopy and electron microscopy. Scientific Reports. 5, 17740(2015).
- Sergé, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nat Methods. 5 (8), (2008).
- Appelhans, T., Busch, K. B. Dynamic imaging of mitochondrial membrane proteins in specific sub-organelle membrane locations. Biophysical reviews. 9 (4), 345-352 (2017).
- Wilmes, S., et al. Triple-color super-resolution imaging of live cells: resolving submicroscopic receptor organization in the plasma membrane. Angewandte Chemie. 51 (20), 4868-4871 (2012).
- Niewidok, B., et al. Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. J Cell Biol. , (2018).
- Wurm, C. A., Jakobs, S. Differential protein distributions define two sub-compartments of the mitochondrial inner membrane in yeast. FEBS Lett. 580 (24), 5628-5634 (2006).
- Schmidt, R., Wurm, C. A., Punge, A., Egner, A., Jakobs, S., Hell, S. W. Mitochondrial cristae revealed with focused light. Nano Lett. 9 (6), 2508-2510 (2009).
- Kukat, C., Wurm, C. A., Spahr, H., Falkenberg, M., Larsson, N. G., Jakobs, S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13534-13539 (2011).
- Beinlich, F., Drees, C., Piehler, J., Busch, K. Shuttling of PINK1 between Mitochondrial Microcompartments Resolved by Triple-Color Superresolution Microscopy. ACS chemical biology. 10 (9), 1970-1976 (2015).
- Shim, S., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. 109 (35), 13978-13983 (2012).
- Sbalzarini, I., Mezzacasa, A., Helenius, A., Koumoutsakos, P. Effects of Organelle Shape on Fluorescence Recovery after Photobleaching. Biophysical Journal. 89 (3), 1482-1492 (2005).
- Reits, E., Neefjes, J. From fixed to FRAP: measuring protein mobility and activity in living cells. Nature Cell Biology. 3 (6), E145-E147 (2001).
- Goehring, N., Chowdhury, D., Hyman, A., Grill, S. FRAP Analysis of Membrane-Associated Proteins: Lateral Diffusion and Membrane-Cytoplasmic Exchange. Biophysical Journal. 99 (8), 2443-2452 (2010).
- Bacia, K., Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: principles and applications. Cold Spring Harbor protocols. 2014 (7), 709-725 (2014).
- Sukhorukov, V., Dikov, D., Busch, K., Strecker, V., Wittig, I., Bereiter-Hahn, J. Determination of protein mobility in mitochondrial membranes of living cells. Biochimica et biophysica acta. 1798 (11), 2022-2032 (2010).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Graham, F. L., van der Eb, A. J. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52 (2), 456-467 (1973).
- Wedeking, T., et al. Spatiotemporally Controlled Reorganization of Signaling Complexes in the Plasma Membrane of Living Cells. Small. 11 (44), 5912-5918 (2015).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280 (1), 715-721 (2005).
- Poot, M., et al. Analysis of mitochondrial morphology and function with novel fixable fluorescent stains. J Histochem Cytochem. 44 (12), 1363-1372 (1996).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells (vol 5, pg 159). Nature Methods. 5 (5), 455(2008).
- Elmokadem, A., Yu, J. Optimal Drift Correction for Superresolution Localization Microscopy with Bayesian Inference. Biophys J. 109 (9), 1772-1780 (2015).
- Barlag, B., et al. Single molecule super-resolution imaging of proteins in living Salmonella enterica using self-labelling enzymes. Sci Rep. 6, 31601(2016).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5 (2), 159-161 (2008).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat Methods. 7 (5), 377-381 (2010).
- Jin, S., Youle, R. J. PINK1- and Parkin-Mediated Mitophagy at a Glance. Journal of Cell Science. 125, 795-799 (2013).
- Yamano, K., Youle, R. J. PINK1 is degraded through the N-end rule pathway. Autophagy. 9 (11), 1758-1758 (2013).
- Wiedemann, N., et al. Machinery for protein sorting and assembly in the mitochondrial outer membrane. Nature. 424 (6948), 565-571 (2003).
- Thompson, R., Larson, D., Webb, W. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены