Method Article
وصف جليكوبروتينس مع حظيرة الغلوبولين المناعي علم البلورات بالأشعة السينية والتقنيات الفيزيائية الحيوية
In This Article
Summary
نقدم النهج لتوصيف glycoproteins الفيزيائية-الحيوية والهيكلية مع حظيرة الغلوبولين المناعي بقياس التداخل بيولايير ومعايرة متحاور القياس وعلم البلورات بالأشعة السينية.
Abstract
جليكوبروتينس على سطح الخلايا تلعب أدواراً حاسمة في وظيفة الخلوية، بما في ذلك الإشارات، التصاق والنقل. في الكريات البيضاء، العديد من هذه جليكوبروتينس تملك طيات الغلوبولين المناعي (Ig) وهي المركزية للاعتراف بالحصانة والتنظيم. نقدم هنا، منبرا للتصميم والتعبير وتوصيف الفيزيائية الأحيائية في المجال خارج الخلية من الخلايا البشرية بمستقبﻻت CD22. ونحن نقترح أن هذه النهج قابلة للتطبيق على نطاق واسع لوصف اكتودومينس بروتين سكري الثدييات التي تحتوي على نطاقات المفتش العام. تعليق الكلي الجنينية البشرية (HEK) خلية سطرين، HEK293F و HEK293S، تستخدم للتعبير عن glycoproteins إيواء جليكانس معقدة وعالية-يطلق، على التوالي. هذه glycoproteins المؤتلف مع جليكوفورمس مختلفة تسمح للتحقيق في تأثير الحجم جليكان وتكوينها على ملزم يجند. ونحن نناقش البروتوكولات لدراسة حركية والديناميكا الحرارية لربط بروتين سكري يغاندس بيولوجيا ذات الصلة والمرشحين جسم العلاجية. Glycoproteins المؤتلف تنتج في الخلايا HEK293S قابلة للتبلور بسبب التجانس جليكان وانخفاض المرونة والقابلية للعلاج اندوجليكوسيداسي ح. نقدم أساليب لامتصاص بروتين سكري بلورات مع الذرات الثقيلة والجزيئات الصغيرة لمرحلة التصميم والتحليل ليجند ملزمة، على التوالي. البروتوكولات التجريبية وناقش هنا تبشر بتوصيف glycoproteins الثدييات تعطي فكرة عن وظيفتها والتحقيق في إليه العمل للمداواة.
Introduction
البروتينات السطحية تلعب أدواراً حاسمة في وظيفة الخلوية. من خلال هذه المجالات خارج الخلية، يمكن أن تعدل هذه البروتينات الغشاء التفاعلات خلية خلية، الالتصاق، والنقل، ويشير إلى1،2. توطين هذه البروتينات خارج الخلية يجعلها أهدافا جذابة لتطوير علاجات لعلاج مجموعة واسعة من الأمراض، بما في ذلك السرطان وأمراض المناعة الذاتية3،،من45 , 6 , 7-واحد من طيات الغشاء البشري البروتين اكتودومينس الأكثر شيوعاً هو إضعاف مثل الغلوبولين المناعي (Ig)، المكونة من سبعة أو أكثر β-خيوط ترتيبها في ورقتين β،من89. عادة، يتم glycoproteins المحتوية على المفتش العام هياكل متعددة المجالات مع المجالات Ig مرتبة تسلسلياً على الجزء خارج الخلية من غشاء بروتين10. بوستترانسلاشونال إدخال تعديلات على هذه البروتينات سطح الخلية، لا سيما glycosylation N و O مرتبطة، تبين أن تلعب أدواراً أساسية في تنظيمها، للطي، إفراز ووظيفة11. مطلوبة لتحسين فهمنا لوظيفتها والمداواة تصميم أفضل التي يمكن توجيهها، التقنيات التي تسمح لتكييفها الجزيئية المفصلة. هنا، فإننا نقدم مجموعة من التقنيات التي تسمح الفيزيائية الحيوية (بيولايير قياس التداخل (BLI) ومعايرة متحاور القياس (ITC)) ووصف الهيكلية (علم البلورات بالأشعة السينية) للمجال خارج الخلية التي تحتوي على المفتش العام غشاء جليكوبروتينس، وحدها وفي المجمع مع يغاندس بيولوجيا ذات الصلة وجزيئات علاجية (الشكل 1).
Glycosylation المرتبطة بنون واحدة من التعديلات بعد انتهاء الترجمة الأكثر شيوعاً في البروتينات الثدييات، ويحدث أثناء نضج البروتين داخل هيولى وغولجي12،13. وقد وضعت خطوط الخلايا، مثل الخلايا 293 الكلي الجنينية البشرية (HEK)، للتعبير المؤتلف لكميات كبيرة من البروتينات الثدييات الغليكوزيلاتي14،15. وقد وضعت هذا الخط الخليوي في شكل تعليق، الذي يسمح بالسهولة للارتقاء بمستوى إنتاج البروتين بكميات أكبر بالمقارنة مع خطوط الخلايا ملتصقة. هنا، فنحن نستخدم اثنين من خطوط الخلايا HEK293: HEK293F وجنت HEK293 أنا-/- (HEK293S)، التي تختلف بسبب غياب ترانسفيراز أسيتيلجلوكوسامينيل ن أنا (جنت أنا) في الحالة الثانية. وفي المقابل، ليس من الممكن إنتاج جليكانس معقدة (كما في HEK293F) وعالية بدلاً من ذلك يطلق من نوع جليكانس (غالباً الرجل5جلكناك2) يقيمون في جليكان ن ربط مواقع18،19،20 . يسمح باستخدام هذه الخطوط الخلية اثنين بالتوازي مع دراسة تأثير حجم جليكان والتعقيد على الوظيفة البيولوجية، واستهداف العلاجية. وفي الواقع، سيكون glycoproteins تنتج في الخلايا HEK293F جليكانس أكبر حجماً وأكثر تعقيداً مقارنة بروتين سكري نفس المنتج في خلايا HEK293S. جليكوبروتينس التي تنتج في خلايا HEK293S أكثر قابلية للتبلور، بسبب عدم تجانس الكيميائية و conformational انخفاض جليكانس ن مرتبطة بهم. لمواصلة تحسين كريستاليزابيليتي، glycoproteins تنتج في الخلايا HEK293S (ولكن ليس HEK293F) يمكن أن يعاملوا معاملة الإنزيم اندوجليكوسيداسي ح (ح إندو)، مما يؤدي الانقسام ومن جليكانس عالية يطلق مثل هذه إلا أن واحد ن-أسيتيلجلوكوساميني (GlcNAc) ويظل moiety في كل موقع جليكوسيليشن ن ربط21،22. يمكن أيضا استخدام أساليب أخرى للحد من المعالجة جليكان ن داخل الخلايا، مثل إضافة مثبطات جليكوسيلترانسفيراسي خلال التعبير بروتين سكري، بما في ذلك كيفونينسيني23. النهج البديلة تنطوي على التعبير عن glycoproteins الأصلية (في الخلايا HEK293F) تليها الانزيمية ديجليكوسيليشن باستخدام الببتيد و ن-جليكوسيداسي (بنجاسيف). ومع ذلك، قد تبين ديجليكوسيليشن مع بنجاسيف أقل فعالية في ظل الظروف الأصلية وتجميع زيادات في بعض البروتينات؛ في الحالات عندما لا يزال البروتين للذوبان بعد العلاج، يكتسب الاتهامات السلبية على سطحه بسبب ديميديشن بقايا الهليونين إلى24من حمض الأسبارتيك، التي قد تكون ضارة لأن تبلور. يمكن أيضا تحور تنبأ glycosylation ن المواقع، في أغلب الأحيان إلى بقايا ألانين أو الجلوتامين، لمنع جليكوسيليشن ن مرتبطة في هذه المواقع وتوليد عينات بروتين سكري من التجانس عالية. وبدلاً من ذلك، يمكن أن تنتج glycoproteins في الثقافات الخلية حقيقية النواة الأخرى، بما في ذلك الخميرة، والحشرات، والنظم النباتية، أو خطوط خلايا الثدييات الأخرى مثل الهامستر الصيني المبيض (شو) خلايا16،17.
تسمح العديد من ناقلات التعبير الثدييات، بما في ذلك فلسيك، لإفراز اكتودومينس بروتين سكري المؤتلف في خلية متوسطة25. يسمح إفراز جليكوبروتينس من الخلايا HEK293 لتنقية سريعة وسهلة دون الحاجة لتحلل الخلية. إضافة العلامات تنقية (مثلاً، صاحب العلامة، وبكتيريا-العلامة، العلم، العلامة، علامة حركة، ها-العلامة) إلى المحطة N أو ج الهدف يسمح بروتين سكري تنقية بلوني تقارب خطوة واحدة. وفي وقت لاحق، يمكن استخدام حجم الاستبعاد اللوني تسفر عن عينة مونوديسبيرسي لتحديد الخصائص الفيزيائية-الحيوية والهيكلية.
عينة بروتين سكري عالية نقية ومتجانسة تحت الظروف الملائمة يمكن أن ينتج بلورات ديفراكتينج جيدا. مجرد مجموعة كاملة من حيود الأشعة السينية الحصول من هذه البلورات، المراحل الأولية بحاجة إلى مصممين على حساب كثافة الإلكترون بروتين سكري. وبفضل عدد متزايد من أي وقت مضى من الهياكل في مصرف بيانات البروتين (PDB)، أصبح الأسلوب الأكثر شيوعاً للتخلص التدريجي حتى الآن استبدال الجزيئية (MR)، الذي يستخدم بنية بروتين ذات صلة للحصول على26من المراحل الأولية. ومع ذلك، عندما يفشل MR لحل مشكلة المرحلة، كما حدث أحياناً للمفتش العام متعدد المجال glycoproteins27،،من2829، الأساليب البديلة مطلوبة. في هذه المقالة، نحن بالتفصيل طريقة نقع بلورات مع الذرات الثقيلة (ها) للتخلص التدريجي، الذي كان يلزم لحل هيكل اكتودومين CD2228. تحديد حق ها للتخلص التدريجي هي عملية تكرارية تعتمد على مفاعليه هكتار، الذرات المتوفرة في بروتين سكري في شعرية كريستال معين، وفي بلورة حل30،31. بدلاً من ذلك، يمكن استخدام ذرات الكبريت الطبيعية في بقايا السيستين والميثيونين التدريجي إذا كان موجوداً بنسبة عالية بما يكفي لذرات أخرى في بروتين سكري، وإذا كان يمكن جمع البيانات حيود الأشعة السينية مع التكرار مرتفعة بما يكفي32، 33.
الوظيفة البيولوجية لغشاء جليكوبروتينس هو غالباً بوساطة تفاعلات البروتين البروتين أو البروتين-يجند التفاعلات، كما هو الحال مع الكربوهيدرات. عندما يجند صغيرة بما يكفي لنزع فتيل من الحل إلى موقع ربط بروتين سكري في الكريستال المشبك، يمكن مغطس تجارب ناجحة الحصول على بنية كريستال مشارك يجند بروتين سكري فهم أفضل ليجند الاعتراف.
البروتوكولات المقدمة هنا أيضا ذات صلة بفهم التفاعلات بين glycoproteins السطحية مع يغاندس العلاجية الاصطناعية34،35 وجسم المداواة36،37. عندما يتم دمجها مع المعلومات الهيكلية، ملزمة الحركية والديناميكا الحرارية يمكن قوية لفهم وتحسين آلياتها للعمل. هو أسلوب واحد الذي يسمح للتحليل الحركية للأجسام المضادة العلاجية ملزمة بروتين سكري BLI38،39. BLI يستخدم أجهزة استشعار العوامل البيولوجية مع يجند المعطل تداولها لقياس حركية الرابطة وتفكك مع شريك ملزم، في نهاية المطاف تحديد قيمة ثابتة تفكك توازن (كد). BLI نهج جذابة لأن كميات صغيرة من glycoproteins مطلوبة (< 100 ميكروغرام)، وقت التجربة بسرعة (~ 10-15 دقيقة لكل تشغيل)، وأنه يمكن أن يكون آليا. مركز التجارة الدولية أيضا مفيدة لدراسة الصلات بين glycoproteins وربط الشركاء40،41،،من4243. أن مركز التجارة الدولية مزيدا من الوقت وكاشف المكثفة، فيمكن الحصول على معلومات قيمة بخصوص الديناميكا الحرارية للتفاعل (ΔG، ΔH، ΔS، وستويتشيوميتري). مركز التجارة الدولية أيضا مفيدة جداً لدراسة التفاعلات الضعيفة التي غالباً ما ترتبط مع ربط عابر glycoproteins السطحية إلى يغاندس. وعلاوة على ذلك، يمكن استخدام هذه التقنيات بالاقتران بتقييم الربط من بنيات مختلفة وتأثير مختلف جليكوفورمس ن ربط الحصول على التعبير بروتين سكري في خطوط الخلايا مختلفة عن. يمكن أن توفر أداء BLI ومركز التجارة الدولية مع جليكوبروتينس المنتجة في HEK293F، HEK293S، وتعامل مع ح إندو نظرة متعمقة لدور جليكانس في النشاط البيولوجي والمشاركة العلاجية.
نحن طبقت بنجاح هذه البروتوكولات لوصف المجال خارج الخلية (النماء) للبشرية CD2228، عضو الأسرة lectins (سيجليكس) مثل Ig الحامض اللعابي الملزمة التي لا غنى عنها للحفاظ على التوازن ب-خلية44 بروتين سكري . نحن إجراء تصميم بنية متعمقة لتيسير بلورة ومراحل dataset بالأشعة السينية قبل ها مغطس مع الزئبق. نحن أيضا غارقة بلورات CD22 مع حمض اللعابي يجند لها (سياليلاكتوسي α2-6) الحصول على بنية مجمع المناعي مستقبلات-يجند وهكذا قدمت المخططات لتصميم هيكل تسترشد جليكان mimetics45،46. وبالإضافة إلى ذلك، أنشأنا ربط مستضد يفتت (القوات المسلحة البوروندية) ابراتوزوماب جسم العلاجية المضادة-CD22-مرشح علاجية حاليا في المرحلة الثالثة التجارب السريرية ل الأورام اللمفاوية غير هودجكين47-لتحديد تقارب ملزم واسطة BLI و مركز التجارة الدولية خلطات الغليكوزيلاتي نيات CD22 نماء الطفولة المبكرة. وكشفت هذه الدراسات دوراً حاسما جليكوسيليشن ن مرتبطة في الاشتباك ابراتوزوماب، مع الآثار المحتملة للاعتراف CD22 على اختلال ب الخلايا.
Protocol
1-بناء تصميم لبروتين سكري نماء الطفولة المبكرة
- تقييم تسلسل الأحماض الأمينية CD22 البشرية (أونيبروت) استخدام الملقمات InterPro و Phyre2 لتحديد عناصر المجال المتوقعة والحدود تقع ضمن ال48،البروتين49.
- استنساخ تسلسل CD22 البشرية، التي تفتقر إلى إشارة الببتيد، المجالات ترانسميمبراني وسيتوسوليك (بقايا 20-687، الآخرة CD22 المجال خارج الخلية، النماء CD22) في مكافحة ناقلات التعبير الثدييات فلسيك25 استخدام إنزيمات التقييد يجئ و (كبني الشكل 2 A) 50.
ملاحظة: ناقل فلسيك هو الأمثل ل overexpression البروتينات القابلة للذوبان، ويفرز في خلايا الثدييات25. يتضمن هذا ناقل إشارة إفراز للسماح لإفراز glycoproteins القابلة للذوبان خارج الخلية. فلسيك يحتوي على علامة6 x ج-طرفية (له) تيسيرا لتنقية تقارب من سوبيرناتانتس الخلية استخدام أساليب اللوني تقارب معدنية المعطل تداولها. - استنساخ ثوابت تم اقتطاعها من النماء CD22 مع الحذف المتسلسل نطاقات Ig ج-الطرفية: المجالات 1-6 (بقايا 20-687)، ومجالات 1-5 (بقايا 20-592)، المجالات 1-4 (بقايا 20-504)، والمجالات 1-3 (بقايا 20-330) (الأرقام 2 و 2 ج)50 .
- تقييم التسلسل الأساسي من النماء CD22 استخدام الملقم نيتنجليك لتحديد المواقع glycosylation المتوقعة المرتبطة بنون الحالية في بناء51.
- استخدام الطفرات توجه الموقع، البروتوكولات القياسية52 أو تداخل بكر53، تتحول كل موقع glycosylation المتوقعة المرتبطة بنون (Asn جلن و/أو Asn لعلاء) لإنشاء بنيات للنماء CD22 التي تحتوي على واحد أو عدة الطفرات جليكوسيليشن المرتبطة بنون.
- بعد التحقق من تسلسل من بنيات المستنسخة، تحويل المختصة كولاي DH5α الخلايا54 والإعدادية ماكسي الحمض النووي (وفقا لإرشادات الشركة المصنعة) للتحضير تعداء.
2-HEK293F وإنشاء خلية HEK293S
ملاحظة: يجب إجراء معالجة كافة الخلايا HEK293F أو HEK293S مع الكواشف اللازمة والمعدات في مرفق السلامة الأحيائية على مستوى 2 في مجال السلامة الأحيائية مناسبة مجلس الوزراء. يجب تعقيم السطح الخارجي لجميع البنود مع الحل الإيثانول 70% أو ما يعادل كاشف.
- الحصول على خلايا تعليق HEK293F و HEK293S (انظر الجدول للمواد) وتخزينها في-80 درجة مئوية حتى جاهزة للاستخدام.
- وسائط الحارة (انظر الجدول للمواد) على ح 1 في حمام مائي 37 درجة مئوية. نقل 24 مل من وسائل الإعلام المعالجون قارورة ثقافة الخليوي حيرة 125 مل مع سقف تنفيس.
- الحصول على خلية 1 مل الكوة عن-80 درجة مئوية ونقل إلى الجليد.
- احتضان خلايا في حمام مائي 37 درجة مئوية لمدة 1 دقيقة تقريبا، لإذابة الجليد جزئيا في الخلايا. نقل 1 مل خلايا من القنينة إلى قارورة ثقافة الخليوي حيرة 125 مل تحتوي على وسائط الإعلام.
- إغلاق قارورة ثقافة الخليوي مع سقف تنفيس ومكان قارورة في شاكر تعيين إلى 37 درجة مئوية، 130 لفة في الدقيقة والرطوبة 70% ونسبة 8% CO2.
3-HEK293 خلية الصيانة
ملاحظة: كثافة الخلية وبقاء الخلايا يجب فحص حوالي 24 ساعة بعد ذوبان الجليد. تضمن هذه الخطوة أن الخلايا تنتعش عقب التطعيم؛ ينبغي أن تكون الجدوى الأولية > 80%.
- بعناية إزالة 10 ميليلتر من الخلايا من قارورة 125 مل تحتوي على خلايا تعليق جديد وتحويلها إلى microtube معقم 1.5 مل. أغلق في قارورة وإعادته إلى الحاضنة.
- "الماصة؛" 10 ميليلتر لحل تريبان الأزرق إلى microtube 1.5 مل تحتوي على الخلايا ومزيج دقيق ونقل 10 ميليلتر للدائرة بشريحة العد.
- وضع الشريحة عد الأصوات في عداد تلقائي خلية والحصول على قيم لكثافة الخلية (بوحدات الخلايا مل-1) وبقاء الخلية (بالنسبة المئوية).
- حساب حجم الخلايا التي ستكون مطلوبة لتطعيم ثقافة جديدة 200 مل في كثافة نهائي من ~0.8 x 106 خلايا مل-1 استخدام المعادلات التالية:
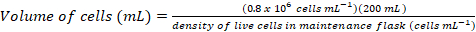 (1)
(1)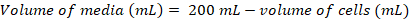 (2)
(2)
ملاحظة: قد يستغرق ~ 5 د للحصول على كثافة خلية مناسبة للتطعيم في ثقافة 200 مل. - بمجرد كافية لتلقيح ثقافة 200 مل كثافة الخلية، وسائط الاحماء ح 1 37 درجة مئوية في المياه حمام ونقل وسائل الإعلام المعالجون في السلامة الأحيائية مجلس الوزراء.
- استخدام ماصة مصلية، بعناية بتحويل وحدة التخزين المطلوب من وسائل الإعلام (المحتسب في المعادلة 2) إلى قارورة ثقافة الخليوي حيرة 500 مل مع سقف تنفيس.
- استخدام ماصة مصلية، نقل وحدة التخزين المطلوب تعليق الخلايا (محسوبة بالمعادلة 1) في قارورة ثقافة الخليوي حيرة 500 مل تحتوي على وسائط الإعلام.
- سقف جديد 200 مل صيانة المخزون وإعادته إلى الحاضنة. تنمو الخلايا بكثافة حوالي 3 × 106 خلايا مل-1. مرور الخلايا في كثافة 0.8 x 106 خلايا مل-1 كل د 2-3 الحفاظ على ثقافة مستقرة من الخلايا (كما هو موضح في القسم 3، 3، 4-7). لا تسمح للخلايا لتتجاوز كثافة ~ 4 × 106 خلايا مل-1.
4-تعداء الخلايا HEK293 للتعبير بروتين سكري
- حساب الحجم الخلايا والوسائط المطلوبة لثقافة 200 مل تعداء على 0.8 x 106 خلايا مل-1 (باستخدام المعادلات 1 و 2 من المادة 3، 4).
ملاحظة: عدد 200 مل ترانسفيكشنز التي يمكن أن يؤديها يعتمد على كثافة الخلية للمحافظة على المخزون. - تحويل وحدة التخزين المطلوبة لوسائل الإعلام وخلايا تعداء إلى قارورة ثقافة الخليوي 500 مل جديدة مع سقف تنفيس والعودة الأسهم خلية للحاضنة.
- احتضان خلايا ح 1 قبل تعداء السماح بالتأقلم بعد تقسيم الخلايا.
- نقل 50 ميكروغرام من الحمض النووي في أنبوب عقيم 50 مل مخروطية وتمييع مع 5 مل من وسائل الإعلام. الفراغ تصفية الحمض المخفف باستخدام نظام ترشيح 0.22 ميكرومتر في أنبوب معقم آخر.
- مزيج المخفف، وتصفية الحمض النووي بنسبة 1:1 كتلة: حجم مع كاشف تعداء. بلطف دوامة الحل كاشف الحمض النووي: تعداء لخلط واحتضان الحل في درجة حرارة الغرفة لمدة 10 دقائق.
- إضافة الحمض النووي: تعداء كاشف حل مباشرة إلى الخلايا. احتضان transfected الخلايا في 37 درجة مئوية، 130 لفة في الدقيقة والرطوبة 70% ونسبة 8% CO2 في شاكر لمد 5-7.
5-الاستغلال الأمثل للظروف تعداء الخلايا
ملاحظة: لتحسين شروط تعداء الخلايا بروتين سكري أقصى غلة، ترانسفيكت الخلايا في مجموعة متنوعة من كثافة الخلية الأولية وتقييم العائد البروتين على مر الزمن (الشكل 3أ). ترانسفيكت الخلايا كما هو موضح في القسم 4، كثافة الخلية الأولى تتراوح بين 0.5 × 106 إلى 2 × 106 خلايا مل-1 55. يمكن تقليصها ترانسفيكشنز المحاكمة إلى إجمالي حجم 25 مل (في قارورة ثقافة الخليوي حيرة 125 مل) مع 6 ميكروغرام للحمض النووي لإنقاذ الفضاء والمواد الكاشفة. يمكن أيضا أن تكون كمية الحمض النووي الأمثل55.
- كل يوم بعد انتهاء تعداء (الأيام 1-7)، نقل قاسمة 500 ميليلتر من ثقافة الخلية في microtube معقم 1.5 مل (في مجلس الوزراء السلامة الأحيائية).
- تدور الخلايا الكوتيد في 12,000 س ز لمدة 5 دقائق في ميكروسينتريفوجي فورا بعد جمع. نقل المادة طافية جديدة 1.5 مل microtube ومخزن في 4 درجات مئوية حتى يتم الحصول على جميع العينات.
- كوانتيتاتي يفرز بروتين سكري بقياس كثافة
- حالما يتم الحصول على جميع العينات، الكوة ميليلتر 20 لكل عينة في microtube 1.5 مل جديدة وخلط مع 6 ميليلتر للحد من غير العازلة عينة x Laemmli 4.
- يغلي عينات لمدة 5 دقائق عند 95 درجة مئوية في كتلة حرارية. تدور عينات لمدة 1 دقيقة في 12,000 س ز في ميكروسينتريفوجي.
- تحميل 20 ميليلتر لكل عينة من كل بئر في جل الحزب الديمقراطي الصربي صفحة تدرج 10-جيدا 4-15%. وتشمل حارة واحدة لعلامات حجم البروتين. قم بتشغيل جل في 250 الخامس لمدة 20 دقيقة في المخزن مؤقت تريس/جليكاين/الحزب الديمقراطي الصربي.
- بعد انتهاء تشغيل، نقل جل لأخذ وصمة عار (انظر الجدول للمواد) 20 دقيقة لإزالة وصمة عار جل في ddH2س ل 20 دقيقة جل الصورة.
- إجراء قياس كثافة مع إيماجيج، عقب البروتوكولات القياسية57،58.
- ترجمة ورسم البيانات مع 'تعداء يوما بعد انتهاء' على المحور السيني و 'قياس كثافة القيم' على المحور الصادي (الشكل 3أ).
ملاحظة: بدلاً من ذلك، إذا كان التعبير البروتين غير كاف للتصور بالحزب الديمقراطي الصربي صفحة، تقنيات مثل النشاف الغربية قد تكون تستخدم56.
- كوانتيتاتي يفرز بروتين سكري قبل BLI
- باستخدام أجهزة استشعار العوامل البيولوجية ني-جاتا، كوانتيتاتي كمية بروتين سكري يفرز استخدام BLI59.
- ترجمة ورسم البيانات مع 'تعداء يوما بعد انتهاء' على المحور السيني و 'تركيز البروتين (ميكروغرام/مل)' على المحور الصادي (الشكل 3أ).
6-تنقية بروتين سكري قابلة للذوبان من المادة طافية HEK293
- حصاد الخلايا باستخدام الطرد المركزي في 6,371 س ز لمدة 20 دقيقة في 4 درجات مئوية. الاحتفاظ بالمادة طافية تتضمن يفرز CD22 النماء والتصفية باستخدام عامل تصفية 0.22 ميكرومتر.
- تحميل المادة طافية في دقيقة مل 4-1 على قبل متوازن (20 مم تريس pH 9.0، 150 مم كلوريد الصوديوم، 5 ملم ايميدازول) ني-جاتا العمود (حجم 5 مل) باستخدام نظام الفصل لوني benchtop.
ملاحظة: تقنيات تنقية المستندة إلى تقارب أخرى يمكن، استناداً إلى العلامات تقارب المدرجة في تصميم بناء في الباب 1. - بعد تحميل طافية، أغسل العمود تقارب مع أحجام العمود 3-4 (CV) يغسل المخزن المؤقت (20 مم تريس pH 9.0، 150 مم كلوريد الصوديوم، ايميدازول 5 مم).
- الوت بروتين سكري المنقي من العمود باستخدام تدرج 4-100% (4 سيرة ذاتية) شطف المخزن المؤقت (20 مم تريس pH 9.0، 150 مم كلوريد الصوديوم، ايميدازول 500 ملم) حين جمع الكسور (الشكل 3ب).
- تجمع الكسور التي تحتوي على ذروة التيد في جهاز الطرد مركزي ترشيح مع 10 كاتشين حد الوزن الجزيئي الأسمى (نمول) وتركز سينتريفوجينج في س 4,000 ز عند 4 درجة مئوية لمدة 15 دقيقة، أو حتى يصل حجم 500 ميليلتر من العينة.
- بروتين سكري تتركز بحقن 500 ميليلتر عينة حلقة وتحميل في 0.5 مل دقيقة-1 على قبل متوازن (20 ملم تريس، pH 9.0، 150 مم كلوريد الصوديوم) عالية الأداء حجم الاستبعاد العمود (تقريبا حجم مل 24) لوني سائل في بروتين سريعة (فبلك) النظام عند 4 درجة مئوية بينما جمع الكسور (الشكل 3ج).
- تشغيل جل الحزب الديمقراطي الصربي صفحة الكسور التيد تحديد الكسور التي تحتوي على بروتين سكري في، وتجمع الكسور المقابلة. يمكن تشغيل هلام الحزب الديمقراطي الصربي صفحة كما هو موضح في القسم 560.
7-ديجليكوسيليشن لتنقية بروتين سكري
- قياس تركيز البروتين المنقي بعد حجم الاستبعاد اللوني باستخدام امتصاص في 280 nm مقسوماً على معامل الانقراض (مثلاً، م 1.418-1 سم-1 لنماء الطفولة المبكرة CD22).
ملاحظة: يمكن حساب معامل الانقراض النظرية للبروتينات لمصلحة استخدام ملقمات مثل بروتبارام اكسباسي61. - احتضان البروتين المنقي مع إندو ح ح 1 في 37 درجة مئوية، بنسبة 1 ملغ بروتين المنقي إلى 10 ميليلتر من إنزيم التجارية في المخزن المؤقت X إندو ح 1 (وفقا لإرشادات الشركة المصنعة).
ملاحظة: ح إندو كليفس جليكانس يطلق عالية تنتج في HEK293S ترك moiety جلكناك واحد في كل موقع جليكوسيليشن21. ح إندو لم تهزم جليكانس على البروتينات التي تنتج في خلايا HEK293F22، بيد أن الإنزيمات الأخرى يمكن أن تستخدم لهذا الغرض (مثلاً،بنجاسيف24). - تركز deglycosylated نماء الطفولة المبكرة إلى 500 ميليلتر وتشغيل هلام الترشيح اللوني على عمود استبعاد حجم عالية الأداء (ما يقارب حجم مل 24) في مل 0.5 دقيقة-1 في فبلك لإزالة ح إندو وفصل أي التجميعات الناتجة عن ذلك.
- تخزين البروتين ديجليكوسيلاتيد في 4 درجات مئوية حتى تستخدم في تجارب المتلقين للمعلومات.
8-بلورة Glycoproteins
ملاحظة: إجراء محاكمات تبلور استخدام الشاشات المتوفرة تجارياً ويجلس إسقاط تجارب باستخدام روبوت تبلور.
- التركيز الصرفة، ديجليكوسيلاتيد تنمية الطفولة المبكرة بملغ 10 مل-1 باستخدام جهاز الطرد مركزي ترشيح مع كاتشين 10 نمول في 4,000 س ز (4 درجة مئوية) حتى يتم الحصول على التركيز المطلوب.
- تحديد تركيز البروتين باستخدام امتصاص في 280 نانومتر وقسمة معامل الانقراض.
- عينة للطرد المركزي في 12,000 س ز لمدة 5 دقائق عند 4 درجة مئوية قبل المحاكمات التبلور لإزالة الغبار غير المرغوب فيها أو الملوثات الأخرى من عينة.
- ملء الخزان آبار لجلوس 96-جيدا إسقاط لوحات تبلور مع 80 ميليلتر لبلورة حل من شاشة بلورة تجارية.
ملاحظة: نحن نستخدم متفرق مصفوفة التجارية الشاشات التي تم تصميمها استناداً إلى شروط تبلور الأكثر نجاحا فيما يتعلق بالهياكل التي أودعت في PDB. - استخدام روبوت، وتبلور الاستغناء عن قطرات في البئر لصفيحة تبلور بحجم انخفاض إجمالي 200 nL بنسبة البروتين المنقي: بلورة حل من 1:1.
- مرة واحدة وقد تم الاستغناء عن لوحة كاملة، ختم اللوحة مع الشريط ومكان في تصوير طبق للتفتيش بالضوء المرئي والأشعة فوق البنفسجية.
- فحص لوحات تبلور بعد الإعداد مباشرة، وفي الأسابيع التالية، باستخدام الضوء المرئي والأشعة فوق البنفسجية على حد سواء لتحديد الشروط التي تعطي بروتين سكري الأولية كريستال يضرب.
- مواصلة تحسين البلورات التي تم الحصول عليها من يضرب تبلور الأولية باستخدام شاشات غرامة استناداً إلى حالة ضرب كريستال أو مصفوفة عشوائية البذر الصغرى أساليب62،63،64،65.
- حماية من البرد أي بلورات تفتقر protectant cryo كافية داخل الشرط تبلور بامتصاص البلورة في الأم الخمور الحل وتستكمل مع الحل والغليسيرول 20% (v/v) (أو ما يعادل cryo-protectant، مثل جليكول أو البولي إيثيلين جليكول 400).
- بلورات جبل في كريولوبس وفلاش تجميدها في نيتروجين سائل قبل جمع البيانات عن ديفراكتوميتير مصدر الصفحة الرئيسية أو استخدام الإشعاع السنكروتروني.
9-التدريجي لاستخدام الذرة الثقيلة Derivatization
ملاحظة: قبل أي تلاعب بمركبات هكتار، يجب مراعاة جوانب السلامة. ها المركبات المستخدمة في علم البلورات البروتين يتم تحديدها من أجل بهم صلة قوية للجزيئات البيولوجية وتشكل خطرا على صحة الإنسان من التعرض لفترة طويلة. خطوات السلامة المناسبة للمركبات هكتار كما هو مذكور في "صحائف بيانات السلامة المادية" بهم.
- لاختبار مختلف مركبات هكتار، التركيزات، وأوقات الاحتضان، إنتاج بلورات جيدا ديفراكتينج التي تم الحصول عليها في القسم 8 في صفيحة تبلور 24-جيدا باستخدام أسلوب نشر بخار معلق-انخفاض66.
- تقرر التي ستكون هكتار تستخدم لكريستال derivatization. يمكن مساعدة خوادم (نظام قاعدة البياناتمثل الذرة الثقيلة-67) بالتحديد مجمع هكتار، ضمان أنها مناسبة لشرط البروتين والتبلور.
ملاحظة: الشاشات ها أيضا متاحة تجارياً للفرز سهلة للمركبات هكتار الأكثر فعالية للتخلص التدريجي. وقد وصف مجموعة من المركبات هكتار "ماجيك سبع" سابقا إلى احتمال كبير لنجاح ها derivatization68. - إعداد محطة العمل لها مغطس (الشكل 4أ). باستخدام كريولوب، سرعة نقل بلورات إلى 0.2 إسقاط ميليلتر في كشف غطاء 22 ملم تحتوي على حل ها مخففة في حالة تبلور بتركيز ها النهائي يتراوح بين 1-20 ملم. ختم القطرة واحتضان لفترات مختلفة من الزمن (الشكل 4ب). هو نقطة انطلاق جيدة 5، 10 و 60 و 90 دقيقة وبين عشية وضحاها.
- فحص بلورات بصريا مع مجهر خفيفة للتعرف على الشقوق المحتملة أو التغييرات في الألوان، التي يمكن أن تشير إلى آثار ضارة على بروتين سكري كريستال أو كريستال derivatization.
- جبل البلورات في كريولوبس وبلورات نقع مرة أخرى لمدة 30 s في ميليلتر 0.2 على التوالي ثلاث قطرات تحتوي على حل الخمور الأم تستكمل مع 20% (v/v) الجلسرين (أو البديل cryo-protectant)69. الخلف-مغطس البلورات يزيل ها المجمع ملزمة بعدم التحديد ويقلل من الأشغال الجزئي الناجم عن ضعف ها ملزمة. فلاش بلورات التجميد في النيتروجين السائل (الشكل 4ب).
- لجمع البيانات، وتجهيز، وبنية الحل، وصقل، استخدام البروتوكولات هو موضح سابقا26،70،،من7172.
10-امتصاص بروتين سكري بلورات مع أن يجند
- استخراج بلورات جيدا ديفراكتينج التي تم الحصول عليها في القسم 8 في صفيحة تبلور 24-كذلك استخدام أسلوب نشر بخار قطره معلقة.
- إعداد حل أسهم ليجند 50 مم 20 مم تريس، pH 9.0، 150 مم كلوريد الصوديوم.
ملاحظة: ينبغي إعداد تركيز يجند وفقا للتقارب على بروتين سكري به. إذا التقارب غير معروف، قد يلزم استخدام طريقة مثل مركز التجارة الدولية (الفرع 12.2) لتحديد التقارب قبل بداية مغطس التجارب. تأكد يجند القابلة للذوبان في التركيز المطلوب في المخزن المؤقت المطلوب. - إضافة تركيزات مختلفة من يجند إلى قطره تحتوي على بلورات النماء وختم القطرة للحضانة في وقت أطوال تتراوح بين 5 دقائق إلى 5 د.
- تتبع بلورات بصريا مع مجهر ضوء لتحديد التغييرات المحتملة في التشكل.
- جبل البلورات في كريولوبس والبرد-حماية لهم في حل الخمور الأم تستكمل مع 20% (v/v) الجلسرين (أو cryo-protectant الأخرى مثل جليكول أو الوزن الجزيئي المنخفض البولي إيثيلين جليكول 400)69.
- لجمع البيانات وتجهيزها، وهيكل الحل والصقل، استخدام البروتوكولات هو موضح سابقا73،،من7475.
11-إنتاج جزء مستضد ملزمة (القوات المسلحة البوروندية)
- سوبكلون الجينات التي تتوافق مع القوات المسلحة البوروندية السلسلة الثقيلة (المفوض السامي) وتسلسل السلسلة الخفيفة (LC) الأجسام المضادة-نماء الطفولة المبكرة، مثلاً،ابراتوزوماب.
ملاحظة: بدلاً من ذلك، مفتش يمكن أن يكون المشقوق بغراء إنزيم لإنشاء القوات المسلحة البوروندية شظايا76. - ترانسفيكت الخلايا كما هو موضح في القسم 4، مع التعديلات التالية:
- استخدام كتلة إجمالية من الحمض النووي تعداء من القوات المسلحة البوروندية شظايا من 90 ميكروغرام كل 200 مل ثقافة.
- ترانسفيكت والبلازميدات HC و LC في نسبة 2:1 تقليل مقدار LC ديمر تشكيل.
- بعد 7 د الحضانة، حصاد الخلايا والاحتفاظ بالمادة طافية وتصفية مع جهاز تنقية يحركها فراغ 0.22 ميكرومتر.
- حجته مكافحة-LC (كابا أو لامدا) تقارب الأعمدة في برنامج تلفزيوني المخزن المؤقت باستخدام نظام الفصل لوني benchtop.
ملاحظة: إذا كان تشكيل ديمر LC قضية خلال تنقية، يمكن استخدام "البروتين ز" التقارب اللوني كبديل لتنقية تقارب LC كابا/أمداً. - تحميل المادة طافية على عمود النسب في مين مل 4-1. بعد تحميل عينة، أغسل العمود مع السير الذاتية 3-4 "من برنامج تلفزيوني".
- الوت البروتين من عمود باستخدام شطف isocratic مع 100 مم جليكاين، الأس الهيدروجيني 2.2، تحييد فورا الكسور التيد مع 10% (v/v) 1 م تريس، pH 9.0 في كل جزء.
ملاحظة: القوات المسلحة البوروندية التيد يمكن أن يكون كذلك تنقيته بالتبادل الأيوني اللوني و/أو حجم الاستبعاد اللوني باستخدام فبلك في 4 درجات مئوية.
12-وصف القوات المسلحة البوروندية والصغيرة جزيء ملزمة بروتين سكري
- قياس التداخل بواسطة بيولايير
- إعداد 50 مل 1 × حركية المخزن المؤقت (1 x PBS، 0.002% (v/v) توين-20، 0.01% (w/v) جيش صرب البوسنة).
- هيدرات ستة أجهزة استشعار العوامل البيولوجية ني-الإدارة الوطنية للسياحة في 200 ميكروليتر 1 x حركية من المخزن المؤقت لمدة 10 دقائق في صفيحة التبول قبل.
- تمييع النماء له معلم في مل 1 1 x حركية المخزن المؤقت بتركيز نهائي ميليلتر ng 25-1. "الماصة؛" تخفيف المسلسل لتنقية القوات المسلحة البوروندية إلى 200 ميليلتر من 1 × حركية المخزن المؤقت، مع تركيزات عالية من 500 نانومتر، وتخفيف المسلسل اللاحقة من 250 نانومتر، 125 نانومتر، و 62.5 شمال البحر الأبيض المتوسط.
- الكوة من الكواشف إلى سوداء مسطحة القاع البوليبروبيلين الميكروسكوبية 96-جيدا كما هو مبين في الشكل 5A، حيث يحتوي كل جيدا على 200 ميليلتر من الحل المشار إليه.
- جمع البيانات باستخدام "فحوصات حركية" في البرنامج "الحصول على البيانات"، كما هو موضح سابقا38،،من3977 (الشكل 5ألف).
- بإيجاز، نقل أجهزة استشعار العوامل البيولوجية في الآبار التي تحتوي على 1 × حركية المخزن المؤقت لخط الأساس بالنسبة 60 s قبل تحميل نغ 25 ميليلتر-1 من بروتين سكري ل 240 s (أو حتى حدا أدنى من 1.0 هو التوصل إلى شمال البحر الأبيض المتوسط) 1,000 لفة في الدقيقة.
- بعد أساس ثاني من 60 ثانية في 1 × حركية المخزن المؤقت، نقل أجهزة استشعار العوامل البيولوجية في الآبار التي تحتوي على إضعاف المسلسل من القوات المسلحة البوروندية. المرحلة الرابطة s 180 تبعتها بعد ذلك خطوة الانفصال s 180 1 × حركية المخزن المؤقت.
ملاحظة: هذه الأجهزة يمكن إعادة استخدامها إذا كان البروتوكول أعلاه تبعتها خطوة تجديد، الذي يتكون من ثلاث مراحل لغسل أجهزة استشعار العوامل البيولوجية في تجريد المخزن المؤقت (برنامج تلفزيوني مع ايميدازول 500 ملم) ل 5 s تليها 5 s في 1 × حركية المخزن المؤقت للإبطال. ويمكن إعادة استخدام أجهزة استشعار العوامل البيولوجية تصل إلى 20 ~ 10 مرات خلال اليوم نفسه، أو حتى ضعف البيانات النوعية هو لاحظ.
- تحليل البيانات باستخدام برنامج تحليل (الشكل 5ألف):
- ضمن علامة التبويب 1 والاستيراد وتحديد البيانات.
- ضمن علامة التبويب 2، الخطوة 1: تحديد البيانات، حدد 'التحديد استشعار' وتسليط الضوء على مرجع الآبار (الصفوف هاء وواو، الرقم 5ألف)، انقر بالزر الأيمن وتعيين مرجع جيد. ضمن الخطوة 2: الطرح، حدد 'آبار مرجع'. الخطوة 3: محاذاة المحور الصادي، حدد 'خط' من الوقت تتراوح من 0.1 إلى 59.8 s. الخطوة 4: تصحيح الخطوة بين الوكالات، حدد 'محاذاة إلى الانفصال'. الخطوة 5: عملية، وحدد 'تصفية Savitzky غولي' والصحافة "البيانات العملية".
- ضمن علامة التبويب 3، حدد 'الرابطة وتفكك' ضمن الخطوة إلى تحليل مع نموذج 1:1. حدد 'تركيب العالمية' و 'مجموعة من الألوان'. الحق فوق المنحنيات، اختر 'تغيير لون'، تعيين جميع المنحنيات باللون من اختيارك. حدد 'صالح المنحنيات'. إذا كانت البيانات مجهزة جيدا، يمكن تصدير تقرير بتحديد '"حفظ التقرير"'.
- تكرار التجربة مع بروتين سكري تنتج في الخلايا HEK293F و HEK293S (القسم 5) وبعد العلاج ح إندو (القسم 7) لتقييم الأثر، إذا وجدت، من جليكوفورمس مختلفة على الاعتراف بالقوات المسلحة البوروندية. وعلاوة على ذلك، كرر التجربة مع truncations نماء الطفولة المبكرة لتقديم نظرة ثاقبة domain (s) ملزمة بأن القوات المسلحة البوروندية.
- القياس المعايرة متحاور تفاعل القوات المسلحة البوروندية-بروتين سكري
ملاحظة: تجري تجارب المركز الموضحة هنا باستخدام أداة مركز الآلي. يتم إجراء التجارب في 1 مل جولة أسفل كتلة 96-جيدا.- دياليزي تنمية الطفولة المبكرة، والقوات المسلحة البوروندية في كوب 4 لتر واحد من عيار 20 ملم تريس، pH 8.0، 150 مم كلوريد الصوديوم في 4 درجات مئوية بين عشية وضحاها مع شريط إثارة.
- تركز دياليزيد نماء الطفولة المبكرة والقوات المسلحة البوروندية إلى 5 ميكرومتر و 50 ميكرون، على التوالي، باستخدام عامل تصفية الطرد مركزي مع كاتشين 10 نمول، ضمان لغسل الأغشية مركزات ثلاث مرات مع 5 مل من الغسيل الكلوي المخزن المؤقت في 4,000 س ز لمدة 5 دقائق في 4 درجات مئوية قبل الاستخدام.
ملاحظة: يمكن أن يسبب أي عدم تطابق في المخزن المؤقت بين العينات في الخلية وحقنه الحرارة غير مرغوب فيها أن يفرج عنها خلال تجربة المركز والنتيجة في بيانات ذات نوعية رديئة. - لتجربة 1: إضافة 400 ميليلتر لتنمية الطفولة المبكرة إلى A1 يتم تحميلها في الخلية، و 120 ميليلتر من القوات المسلحة البوروندية إلى A2 جيدا يتم تحميلها في المحاقن. كذلك تركت فارغة لإرجاع ما يلي عينة مختلطة تجربة إنجاز A3. يمكن إضافة كل التجربة اللاحقة للوحة بنفس الترتيب (أي تجربة 2: الخلية-A4، والمحاقن-A5، بئر فارغة-A6؛ الشكل 5 ب).
ملاحظة: تشمل المخزن المؤقت في المخزن المؤقت عناصر التحكم (للتأكد من الصك الذي يتصرف جيدا) في بداية ونهاية كل تشغيل، فضلا عن [ليغند] (في المحاقن) في المخزن المؤقت (في الخلية) عناصر التحكم لحساب حرارة تمييع للعينة في المحاقن. وتحسب هذه ينبغي ثم طرح الحرارة للتخفيف من البيانات التجريبية الخام أثناء تحليل البيانات (الشكل 5ب). - تشغيل ما مجموعة 16 الحقن بحجم 2.5 ميكروليتر لكل حقن. مدة الحقن هو 5 ق، مع 180 s التباعد بين الحقن. ضبط درجة حرارة الخلية إلى 25 درجة مئوية، مع سرعة إثارة من 750 دورة في الدقيقة، وفترة تصفية 5 s.
ملاحظة: استناداً إلى تقارب والديناميكا الحرارية للتفاعل ECD:Fab، قد يكون من الضروري تغيير تركيز العينة، عدد الحقن أو درجة حرارة الخلية. - تحليل البيانات مع برامج التحليل، كما هو موضح سابقا40،،من4143 (الشكل 5ب).
- تكرار التجربة على الأقل في التكرارات، حساب متوسط القيم كد والأخطاء المعيارية. تكرار التجربة مع نماء جليكوفورمس مختلفة (المادتان 5 و 6) لتقييم الأثر، إذا وجدت، من جليكوفورمس في الديناميكا الحرارية لتفاعل القوات المسلحة البوروندية: بروتين سكري.
- لمعايرة متحاور القياس ليجند-بروتين سكري التفاعلات، إعداد المركز التجربة كما هو موضح في القسم 12-2، مع إدخال التغييرات التالية:
- دياليزي النماء في 4 لتر من المخزن المؤقت للغسيل الكلوي بين عشية وضحاها. حل يجند استخدام المخزن المؤقت لغسيل الكلي بعد الانتهاء من الغسيل الكلوي.
- القيام بتجارب المركز بتركيزات أعلى بكثير لتكون قادرة على الكشف عن تفاعلات تقارب منخفضة. لتنمية الطفولة المبكرة ويجند التفاعل، القيام بتجارب المركز في تركيزات من 100 ميكرون من النماء في الخلية و 1 مم من يجند في المحاقن.
النتائج
بنجاح عدة بنيات للنماء CD22 المستنسخة في ناقلات التعبير فلسيك و overexpressed في الثدييات HEK293F و HEK293S خطوط الخلايا (الشكل 2 و 3 ألف). كافة بنيات تنقيته لتجانس الحجم حسب حجم الاستبعاد اللوني وأسفرت عن عينة نقية جداً لبلورة دراسات (الشكل 3 و 3 ج). بناء CD22 التي أدت إلى بلورات ديفراكتينج جيدا تم اقتطاع d1 d3 (بقايا 20-330)، مع خمسة من ستة مواقع glycosylation المتوقعة المرتبطة بنون تحور من Asn لعلاء (N67A، N112A، N135A، N164A و N231A)، تنتج في الخلايا HEK293S، إلا أن مثل هذه موقع جليكوسيليشن في موقف أبقى N101 (يسمى هذا بناء CD2220-330، 5 ألف). تم الحصول على بلورات في عدة شروط للشاشة متفرق مصفوفة مكسج-1، ولكن كانت بلورات أفضل من حالة التي تحتوي على 30% (w/v) البولي إيثيلين غليكول 4000 وكلوريد الليثيوم 0.2 M 0.1 M تريس، pH 8.5. هذه البلورات الأصلية ديفراكتيد 2.1 Å القرار؛ استخدام الهياكل المعروفة للمفتش العام في المجالات ذات الصلة سيجليك البروتينات لم تسفر عن أي حلول في تفتيش MR.
للحصول على معلومات التنفيذ على مراحل، ونحن غارقة البلورات الأصلية مع فريق من هكتار من المركبات التي شملت Hg، Pt، نظام التشغيل، تا، وفرع بتركيزات تتراوح بين 1-20 ملم ها مجمع لفترة حضانة من 5 دقائق إلى د 1 (الشكل 4). نحن رصد بلورات للتغييرات في التشكل، ووجدت أن بلورات غارقة مع ها المجمع في 20 مم أدى إلى تكسير السريع وتذويب البلورة. نحن جمدت ما مجموعة 63 بلورات الإبقاء على شكلها بعد الحضانة تعيين الأوقات التي كانت غارقة مع الكتلة بروميد تانتالوم، كلوريد البلاتين، خلات نيل الزئبق وكلوريد ميركوريك. بلورات غارقة مع 7 ملم كلوريد ميركوريك لمدة 30 دقيقة أظهرت الإشارات الشاذة على تفحص fluorescence في بيمليني 08-BM مصدر الضوء الكندية (CLS) (ساسكاتون، كندا) ويسمح للتشتت الشاذ متعددة الطول الموجي جمع بيانات الأشعة السينية على واحد كريستال. هذه datasets سمح لنا بحل الهيكلية الزئبق من CD2220-330، 5A، التي كشفت من ذرة واحدة من الزئبق منضمة إلى سيستين مجاناً في موقف C308 وفي نهاية المطاف سمح لنا ببناء هيكل CD225A 20-330، إلى مراحل خريطة كثافة الإلكترونات باستخدام أوتوبويلد78.
مرة واحدة تم حلها هيكل أونليجانديد، نحن مهتمون في حل هيكل CD22 ملزمة بأن يجند، سياليلاكتوسي α2-6. أولاً حسبنا تقارب CD22 نحو سياليلاكتوسي α2-6 استخدام المركز لتحديد خصائص الديناميكا الحرارية ملزم للتفاعل. أننا لاحظ تقارب ميكرومتر ~ 280 وتستخدم هذه المعلومات للتعرف تركيز أولية (~ 100 × كد) ليجند لاستخدامها لامتصاص لدينا الأصلي CD2220-330، 5A بلورات. ونحن غارقة بلورات CD2220-330، 5 ألف مع سياليلاكتوسي 25 مم لمدة 5 دقائق، ح 2، ح 14، ح 40 ود 5 ورصد التغيرات في مورفولوجيا كريستال. مجموعة بلورات ~ 75 كانت مجمدة من النقاط الزمنية المختلفة وإرسالها إلى CLS السنكروتروني بيمليني 08-المعرف (ساسكاتون، كندا) لجمع بيانات الاستشعار عن بعد. وجمعت ما مجموعة ست مجموعات بيانات الأشعة السينية من بلورات ديفراكتينج جيدا. الهيكل من كل مجموعة بيانات الأشعة السينية تم حلها بالسيد باستخدام أونليجانديد CD2220-330، 5A هيكل كنموذج بحث أولية. ثم جرى تفتيش كثافة الإلكترونات الناتجة عن ذلك لجميع مجموعات البيانات لكثافة إيجابية في خريطة Fo-إف سي أن تتوافق مع الالتزام سياليلاكتوسي α2-6 داخل الموقع الملزم ل CD22. بشكل ملحوظ، جميع مجموعات البيانات التي تم جمعها، حتى أولئك من بلورات غارقة بعد الواردة فقط 5 دقائق من وقت الحضانة، كثافة الإيجابية المقابلة ليجند في الموقع ملزم. الهياكل العامة أونليجانديد وليجانديد CD22 متشابهة جداً مع تغيرات طفيفة كونفورماشونال، الذي قد يفسر نجاح تجارب مغطس مع سياليلاكتوسي α2-6.
نحن التالية يتميز سطح مستضدي CD22 المعترف بها ابراتوزوماب جسم العلاجية في تجارب BLI ومركز التجارة الدولية (الشكل 5). كشفت التشكيلات الحركية والديناميكا الحرارية لربط ابراتوزوماب القوات المسلحة البوروندية إلى ثوابت CD22 مع مختلف جليكوفورمس تقارب متزايد إلى CD22 مع حجم انخفاض جليكان المرتبطة بنون، مع يصل إلى حدوث تحسن معدل في تقارب لأصغر جليكانس (327 نيوتن متر مقابل 24 نانومتر في BLI؛ 188 نيوتن متر مقابل 58 شمال البحر الأبيض المتوسط في مركز التجارة الدولية). وكان يحددها جليكان ن CD22 مرتبطة تقييد حصول من الجسم إلى بيفرتون في BLI استخدام طفرات نقطة واحدة من CD22 وحل ابراتوزوماب القوات المسلحة البوروندية-CD22 d1 d3 كريستال المشارك هيكل28.
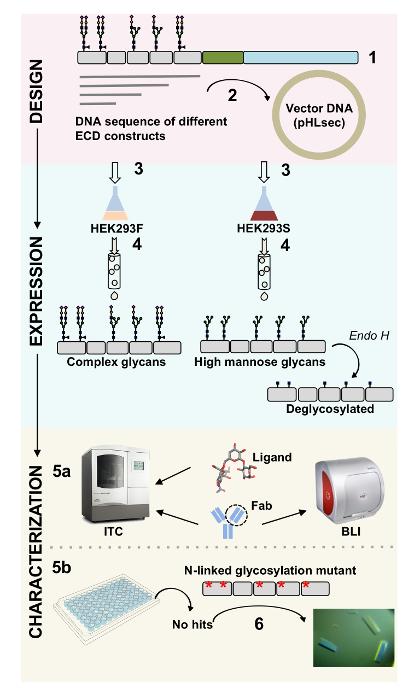
الشكل 1 . نظرة عامة على توصيف بروتين سكري من تصميم بناء على الخصائص الفيزيائية-الحيوية والهيكلية- (1) تحليل تسلسل الأولية من بروتين سكري الممثل. في الرمادي، المجال خارج الخلية (النماء)؛ باللون الأخضر، الجزء (TM) ترانسميمبراني؛ وفي الزرقاء، مجال سيتوسوليك بروتين سكري. تتم تسمية جليكانس المتوقعة المرتبطة بنون. (2) الاستنساخ من بنيات نماء الطفولة المبكرة. (3) التعبير عن نيات النماء في خلايا الثدييات. (4) تنقية بروتين سكري. في حين سوف تحتوي على البروتينات التي أعرب عنها في HEK293F جليكانس معقدة، سيكون البروتينات التي أعرب عنها في HEK293S جليكانس يطلق عالية. العلاج الأنزيمي من جليكوبروتينس المنتجة في الخلايا HEK293S مع نتائج ح إندو في جليكوبروتينس مع فقط مجموعة جلكناك في مواقع مرتبطة بنون جليكوسيليشن. اختبار جليكوبروتينس (5a) حيث تجليدها للأجسام المضادة بيولايير قياس التداخل (BLI) ومعايرة متحاور القياس (مركز التجارة الدولية). يمكن أيضا قياس النسب إلى يغاندس الصغيرة بمركز التجارة الدولية. 5 () بلورة المحاكمات من جليكوبروتينس مع جليكانس ن ربط متجانسة، مثل تلك التي عبرت في HEK293S وديجليكوسيلاتيد مع إندو حاء (6) وفي بعض الحالات، طفرة المواقع المرتبطة بنون glycosylation من الضروري الحصول على بلورات. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 . تصميم اكتودومين CD22 الحمض النووي بنيات للتعبير في خلايا الثدييات. A) تمثيل بلازميد فلسيك المستخدمة تعداء عابرة من بنيات CD22 نماء الطفولة المبكرة. يتم الإشارة إلى المواقع يجئ وكبني المستخدمة لاستنساخ مع مربعات حمراء. ب) "CD22 النماء" يحتوي على سبعة مجالات Ig (d1-d7) و 12 موقعا glycosylation المتوقعة المرتبطة بنون (باللون الأزرق). وقد صممت ثوابت أربعة من النماء CD22. ج) 1% [اغروس] هلام عرض أمبليكونس بكر من النماء CD22 بنيات للاستنساخ في ناقلات التعبير الثدييات فلسيك. لين أول يحتوي على علامة الحمض النووي 1 كيلو بايت. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
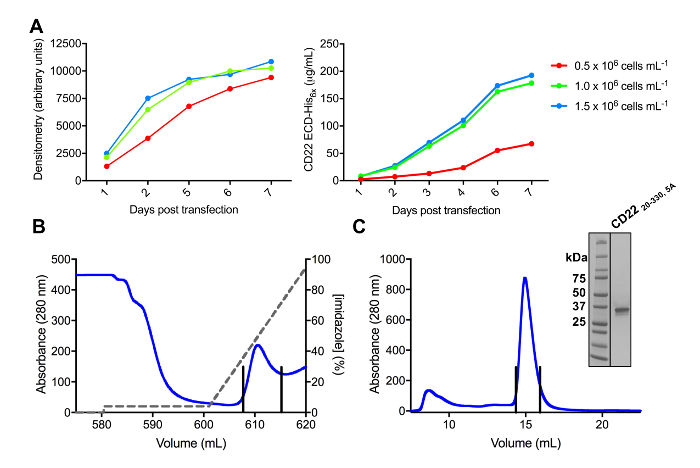
الشكل 3 . التعبير وتنقية glycoproteins. A) أثر كثافة الخلية على غلة التعبير. بروتين سكري التعبير في الثقافة الصغيرة 25 مل من خلايا تعليق HEK293F ترانسفيكتيد باستخدام ثلاثة كثافات مختلفة بدءاً من الخلايا (0.5 × 106 خلايا مل-1و 1.0 × 106 خلايا مل-1و 1.5 × 106 خلايا مل -1). إجراء القياس الكمي بقياس كثافة من الحزب الديمقراطي الصربي صفحة في اللوحة اليسرى و BLI الكمية في اللوحة اليمنى. القيم ممثل واحد بروتين سكري إعداد. ب) تشروماتوجرام لتنقية الخطوة الأولى لبناء CD2220-330، 5 ألف من 600 مل من المادة طافية باستخدام عمود النسب ني-الإدارة الوطنية للسياحة. وكان التيد بروتين سكري استخدام رج ايميدازول (خط رمادي)، حيث يتوافق 100% مع شطف المخزن المؤقت، والذي يتضمن ايميدازول 500 ملم. ويرد الكسور المجمعة مع خطوط عمودية. ج) تشروماتوجرام حجم الاستبعاد لبناء CD2220-330، 5A عالية أداء باستخدام هلام الترشيح العمود. ويرد الكسور المجمعة من ذروة شطف مع خطوط عمودية. اقحم: جل الملطخة بأخذ الحزب الديمقراطي الصربي صفحة عرض نقاء بروتين سكري. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4 . كريستال مغطس مع الذرات الثقيلة. A) محطة العمل عينة لامتصاص البلورات الأصلية مع مركبات هكتار. كافة المطلوبة يتم تسمية الأدوات. ب) الخطوات التي اتبعتها نقع بلورات من تشييد CD2220-330، 5A مع مركبات هكتار. الخطوة 1، فتح أيضا تحتوي على بلورات ونقل بلورات استخدام حلقة إلى انخفاض 0.2 ميليلتر في كشف الغطاء الذي يحتوي على حل ها مخففة في حالة تبلور بتركيز ها النهائي يتراوح بين 1-10 ملم. الخطوة 2، ختم قطره في لوحة تبلور واحتضان بلورات مع ها مجمع لفترات مختلفة من الزمن. الخطوة 3، جبل الكريستال غارقة في الحلقة ونقع مرة أخرى لمدة 30 ثانية في ثلاث متتالية 0.2 ميليلتر قطرات تحتوي على الحل الخمور الأم تستكمل مع 20% (v/v) والغليسيرول الاستغناء في كشف الغطاء. الخطوة 4، فلاش تجميد الكريستال التي شنت على حلقة مع النتروجين السائل ووضعه في عفريت لشحنها إلى بيمليني السنكروتروني. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
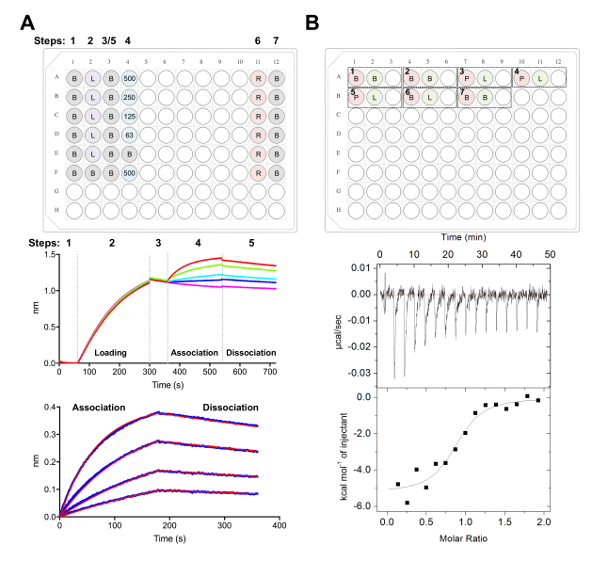
الشكل 5 . بيولايير قياس التداخل ومتحاور المعايرة القياس القياسات. A) تجربة الممثل BLI. أعلى اللوحة: مثال من لوحة الإعداد لتجربة حركية، حيث تتم تسمية التالية: المخزن المؤقت 1 x حركية (ب)، تقريرهالعاشر 6-بروتين سكري كلمات تحميل (L)، وتركيزات القوات المسلحة البوروندية الممثل (500، 250، 125، 62.5 nM)، برنامج تلفزيوني + التجديد 500 مم المخزن المؤقت (R)، و 1 × تحييد حركية المخزن المؤقت (ب). كذلك يتضمن كل 200 ميليلتر للحل. تتم الإشارة إلى عدد خطوة للتجربة الحركية في الجزء العلوي من اللوحة. الفريق الأوسط: الممثل البيانات الخام BLI تجربة إجراء باستخدام أجهزة استشعار العوامل البيولوجية ني-جاتا واللوحة الموصوفة في أعلى اللوحة. وتناظر الأرقام خطوة الأساس (1)، له بروتين سكري6 x تحميل (2)، والأساس (3)، رابطة في تمييع المسلسل من القوات المسلحة البوروندية (4) والانفصال (5). خطوات التجديد ليست ممثلة (الخطوات 6-7). اللوحة السفلية: ممثلة من البيانات تم تحليلها تبين الرابطة الخام والانفصال (الخط الأزرق) مع المناظرة 1:1 تناسب (الخط الأحمر). ب) أعلى اللوحة: تشغيل الإعداد لوحة تمثيلية لمركز مفردة على صك مركز الآلي مع سبع تجارب في 96-فضلا عن جولة كتلة أسفل. وتتألف من ثلاثة آبار كل تجربة. البئر الأولى (أحمر) يتوافق مع نموذج للخلية (400 ميليلتر)، البئر الثاني (الأخضر) يتوافق مع عينة للمحاقن (120 ميليلتر). الثالث هو ترك فارغاً، وسوف تعاد العينات المختلطة إلى هذا جيدا بعد إتمام التجربة. تجارب 1 و 2 و 7 من المخزن المؤقت إلى المخزن المؤقت لعناصر التحكم. وتمثل التجارب 3-5 ثلاث تجارب مع بروتين سكري (P) في الخلية، والقوات المسلحة البوروندية أو يجند (L) في المحاقن. التجربة 6 تمثل حرارة يجند لتخفيف السيطرة وينبغي طرح من تجارب 3-5 أثناء تحليل البيانات. اللوحة السفلية: الممثل الخام (أعلى) وبيانات المركز المجهزة (أسفل) تظهر القوات المسلحة البوروندية (ابراتوزوماب) ملزمة للنماء CD22 تنتج في الخلايا HEK293F. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
ترتكز على غشاء glycoproteins هي حاسمة بالنسبة لوظيفة الخلية والأهداف العلاجية جذابة. وهنا نقدم بروتوكولا لتوصيف الهيكلية والفيزيائية الحيوية لتنمية الطفولة المبكرة لغشاء جليكوبروتينس، سواء وحدها أو في المجمع مع يغاندس جزيء صغير والقوات المسلحة البوروندية وشظايا. لقد استخدمت بنجاح هذا البروتوكول لتحديد بنية بلورية الثلاثة مجالات Ig N-الطرفية-معظم الجزء الخاص بالخلية البشرية CD2228، مستقبل المشارك حرجة في الخلايا ب المشاركة في الحفاظ على حصانة humoral الاختيار79. ونحن أيضا يتسم موقع CD22 ملزمة مع سياليلاكتوسي α2-6 يجند الطبيعية لها، وتعريف طريقة الاعتراف بجسم العلاجية نحو CD22 البشرية. هذه النتائج ثاقبة علاقة بنية دالة عضو رئيسي في الأسرة سيجليكس التي تم تقييد التعبير على خلايا ب وجزيئية خارطة طريق نحو التنمية الجديدة CD22 جزيء الصغيرة المستهدفة والقائمة على جسم المداواة. بينما تم استخدام هذا البروتوكول بنجاح لمستقبلات خلية بالمحتويه على المفتش العام، فإننا نقترح أن يمكن تطبيق النهج الذي نتبعه لتوصيف أي بروتين سكري الغشاء مع منظمة متميزة في مجال الهيكلي والفيزيائية الحيوية. في مثل هذه الحالات، بناء التصميم واندماجي جليكان ن مرتبطة يمكن تقييمها الطفرات (أما جلن أو علاء) لإيجاد بنية مناسبة لنمو البلورات والحيود عالية الدقة.
الحصول على عينة متجانسة والصرفة بروتين سكري ذا أهمية حاسمة لنمو البلورات وحيود الأشعة السينية، وكذلك لتحديد الخصائص الفيزيائية المتلقين للمعلومات. جليكانس ن المرتبطة موجودة على جليكوبروتينس هي أصلاً غير متجانسة، ويمكن أن يسبب عدم تجانس كونفورماشونال والكيميائية داخل بروتين سكري يمكن أن تردع تشكيل الكريستال. لتقليل هذا الصغير-عدم التجانس، استراتيجيات لإدخال طفرات نقطة لإزالة بقايا Asn توقع إلى ميناء جليكانس المرتبطة بنون، أو باستخدام خطوط خلايا متحولة (مثل HEK293S) متبوعاً بالعلاج مع اندوجليكوسيداسيس (مثل اندة) يمكن إلى حد كبير تحسين تبلور نجاح15،،من2122. في هذا البروتوكول، ونحن نناقش تنقية glycoproteins القابلة للذوبان والشؤون التي هي يفرز داخل الخلية طافية. ويوفر إفراز بروتين سكري طريقا بسيطة نسبيا نحو النقاء، دون الحاجة إلى تحلل الخلية أو إضافة مواد كيميائية قاسية أو المنظفات. ثم تشغيل الخلية طافية، تحصل التالية الخلية حصاد مباشرة على عمود يحتوي على القرابة للبروتين للفائدة (مثلاً، ني-جاتا glycoproteins صاحب معلم، أو تقارب LC للقوات المسلحة البوروندية الشظايا). ومع ذلك، اعتماداً على العمود للاستخدام وظروف الخلية طافية (مثل درجة الحموضة)، يمكن أن تتأثر القدرة الملزمة من بروتين الفائدة للعمود. إذا كان هذا هو الحال، فإنه قد يكون من الضروري التركيز والمخزن المؤقت تبادل الخلية طافية لتحسين الربط للعمود. وعلاوة على ذلك، فمن المستحسن اتباع خطوات مراقبة الجودة أثناء تنقية للمساعدة في تقييم نقاوة البروتين. تشغيل الغربية وصمة عار لجميع العينات (قبل وأثناء وبعد خطوات تنقية) أو هلام الحزب الديمقراطي الصربي صفحة يمكن أن تسفر عن رؤى في ما إذا كان نظام تنقية المقترح مناسبة لبروتين الفائدة. إذا كانت العصابات تلويث مرئية على صفحة الحزب الديمقراطي الصربي، أو إذا كان يتم الحصول على العديد من الأنواع من خلال تنقية (مثلاً، عدة قمم في حجم الاستبعاد)، خطوات تنقية إضافية ينبغي النظر، مثلاً، التبادل الأيوني اللوني، للحصول على في نقاء وزيادة فرص تبلور المصب80.
لبلورة الجزيئات، المهم غالباً للحصول على غلة عالية من بروتين الفائدة للسماح لفحص عدد كبير من الشروط بلورة المحتملة بتركيزات عالية من البروتين لإيجاد يضرب الكريستال مناسبة. عموما، HEK293 خلية خطوط مناقشتها هنا (HEK293F و HEK293S) نظم التعبير قوية، ويمكن الارتقاء بسهولة لإنتاج أكثر من نموذج حسب الضرورة. ومع ذلك، من الممكن أن بروتين الاهتمام قد لا تعبر عن بما فيه الكفاية داخل هذه الخطوط الخلية. وفي هذه الحالات، وجدت لإظهار مستويات عالية من البروتين التعبير خطوط الخلايا الأخرى، مثل Expi293 الخلايا،من8182، وينبغي أن يعتبر كبديل.
إذا لم يتم الحصول على بلورات أمر جيد، ديفراكتينج عقب اختبار نيات العديد من بروتين الاهتمام على الرغم من درجة نقاء عالية، قد يكون من الضروري توسيع تقنيات التبلور لتشجيع تشكيل الكريستال. فقد ثبت أن القوات المسلحة البوروندية أجزاء من الأجسام المضادة ونانوبوديس يمكن أن تكون القدرة على بلورة ممتازة، وتعزيز أمر جيد كريستال التعبئة83،،من8485. يمكن أعربت هذه الشظايا وتنقيته للتجانس، والمستخدمة في مجمع مع البروتين لمصلحة تعزيز بلورة. الأهم من ذلك، يمكن أن يكون القوات المسلحة البوروندية الأجزاء المنتجة كما هو موضح في القسم 10 ميل إلى شكل غير وظيفية LC dimers86. Dimers هذه الملوثات وينبغي إزالتها أثناء التنقية. في تجربتنا، LC dimers غالباً ما يكون وحدة تخزين استبقاء مختلفة على حجم الاستبعاد، أو الوت كذروة متميزة على التبادل الأيوني اللوني، وبالتالي يمكن إزالتها من تطهير القوات المسلحة البوروندية-بيد أن هذا ليس هو الحال دائماً. إذا كانت هذه الأساليب غير كافية لإزالة LC dimers من تطهير القوات المسلحة البوروندية، يمكن أن تستخدم أساليب تنقية إضافية، مثل "البروتين ز" انجذاب تطهير، لتحسين نقاء.
بديل كومبليكسيشن co مع القوات المسلحة البوروندية الشظايا، تقنيات موثقة توثيقاً جيدا مثل ميكروسيدينج مصفوفة عشوائية يمكن أن تحسن فرص الحصول على بلورات أمر جيد63،70. يتضمن هذا الأسلوب إضافة كميات صغيرة من بلورات سحقت، دون المستوى الأمثل في حالة التبلور، توفير نوكليتي لتشجيع نمو البلورات كريستال. وهذا يمكن أن يؤديها باستخدام بلورات البروتين من الفائدة، أو تلك مع بنية المجال مشابه في الهندسة المعمارية، والتعليم العالي. وعلاوة على ذلك، يمكن إجراء ميكروسيدينج مصفوفة عشوائية في المحاولات الرامية إلى بلورة البروتينات وحدها أو في المجمع مع القوات المسلحة البوروندية يفتت أو جزيء صغير من الفائدة. التقدم الذي أحرز مؤخرا في الميكروسكوب الإلكتروني البرد أيضا جعل هذا الأسلوب بديلاً جذاباً لعلم البلورات بالأشعة السينية للحصول على المعلومات الهيكلية ذات الدقة العالية لجزيئات مع الميزات المناسبة87،88، 89،،من9091.
عندما يفشل التدريجي لمجموعات البيانات حيود الأشعة السينية بالسيد، يلزم هكتار مغطس لحل مشكلة المرحلة بتشتت الشاذة أو استبدال إيسومورفوس. تفتيش تسلسل الأحماض الأمينية من البروتين يمكن أن توفر أدلة حول الاستراتيجية derivatization هكتار، بما في ذلك الرقم الهيدروجيني الأمثل للربط. على وجه الخصوص، على وجه التحديد ربط سيستينيس مزاوج داخل البروتين هكتار من المركبات التي تحتوي على الزئبق. مغطس البلورات الأصلية مع مركبات ها عملية تكرارية لتحديد هوية المجمع هكتار الأمثل وتركيزه، وفترة الحضانة المطلوبة. إذا كانت لا تؤدي المحاولات الأولية مغطس بلورات جيدا ديفراكتينج التي تحتوي على ها مناسبة للتخلص التدريجي، قد يكون ضروريا لإدخال بدائل من الأحماض الأمينية لتحسين احتمالات ربط هكتار وتحسين الإشارات الشاذة. أمثلة الطفرات تشمل بقايا سيستين مجاناً لكفاءة ربط زئبق، والاتحاد الأفريقي، وحزب العمال أو Pb. التعبير عن البروتينات التدريجي الشاذة في وسائل الإعلام سيلينو-ميثيونين تستكمل في كولاي يستخدم على نطاق واسع للتخلص التدريجي الشاذة، ولكن نظام يعادل موثوق يتضمن سيلينو-الميثيونين ليست متاحة بسهولة لخلايا الثدييات في تعليق92،93، وهو مجال للتنمية في المستقبل.
حالما يتم الحصول على هيكل أونليجانديد بروتين سكري للفائدة، يمكن إجراء مغطس البلورات مع جزيء صغير يغاندس الحصول على بنية المجمع يجند مستقبلات محصنة. هذه البيانات توفر مخططا لتصميم يغاندس أكثر تحديداً والنسب العالية التي يمكن استخدامها كالمداواة جزيء صغير، فضلا عن توفر أفكاراً عالية الدقة في الوظيفة البيولوجية لبروتين سكري عقلانية. فحص بنية بلورية أونليجانديد عند محاولة نقع بلورات بروتين سكري مع يغاندس جزيء صغير من الفائدة، يمكن أن تشير إلى سواء مغطس ينبغي أن يكون من الممكن. في حالة إغلاق كريستال-التعبئة جهات الاتصال التي وجدت في جميع أنحاء الموقع ملزم يجند أو حول المناطق التي من المتوقع أن يخضع لتغييرات كونفورماشونال عند يجند ملزمة، مغطس من المرجح أن يكون مشكلة. وفي هذه الحالة، ينبغي القيام بطرق أخرى مثل بلورة المشارك من البروتين-يجند المجمع.
Disclosures
الكتاب يعلن لا تضارب المصالح.
Acknowledgements
أجريت تجارب حيود الأشعة السينية المبينة في هذه الورقة باستخدام بيملينيس 08-معرف و 08-BM في "مصدر الضوء الكندية"، التي تدعمها "مؤسسة كندا" للابتكار والعلوم الطبيعية ومجلس البحوث الهندسية في كندا، جامعة ساسكاتشوان، حكومة ساسكاتشوان، كندا التنويع الاقتصادي الغربي، كندا المجلس القومي للبحوث، والمعاهد الكندية للبحوث الصحية. نود أن نعترف الهيكلية والفيزيائية الأساسية مرفق، في مستشفى "الأطفال المرضى"، للوصول إلى أدوات مركز التجارة الدولية و BLI. وأيد J.E.O. قبل بانتنغ بعد الدكتوراه زمالة BPF-144483 من "المعاهد الكندية للبحوث الصحية". ت. س. هو أحد المستلمين من كندا خريج منحة الماجستير جائزة ومنحة Vanier خريج كندا من "المعاهد الكندية للبحوث الصحية". وأيد هذا العمل يعمل بمنحه PJT-148811 (ج. ب. ج.) من "المعاهد الكندية للبحوث الصحية". وأجرى هذا البحث، في جزء منه، بفضل التمويل المقدم من برنامج "كراسي البحث كندا" (ج. ب. ج.).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
References
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved