Method Article
Caracterização de Glicoproteínas com Dobra da Imunoglobulina por Cristalografia de Raios-X e Técnicas Biofísicas
Neste Artigo
Resumo
Apresentamos abordagens para a caracterização estrutural e biofísica das glicoproteínas com a dobra de imunoglobulina por cristalografia de raios x, Calorimetria de Titulação Isotérmica e interferometria de biolayer.
Resumo
Glicoproteínas na superfície das células desempenham um papel crítico na função celular, incluindo a sinalização, adesão e transporte. Em leucócitos, vários destas glicoproteínas possuem dobras de imunoglobulinas (Ig) e são centrais para a regulamentação e reconhecimento imune. Aqui, apresentamos uma plataforma para o projeto, expressão e caracterização biofísica do domínio extracelular do receptor de célula B humana CD22. Propomos que essas abordagens são amplamente aplicáveis para a caracterização dos mamíferos glicoproteína ectodomains contendo domínios Ig. Dois suspensão rim embrionário humano (HEK) linhas celulares, HEK293F e HEK293S, são utilizadas para expressar glicoproteínas abrigar os glicanos complexos e alta-manose, respectivamente. Estas glicoproteínas recombinantes com glycoforms diferentes permitem investigar o efeito de glicano tamanho e composição na ligação do ligante. Podemos discutir protocolos para o estudo da cinética e termodinâmica de ligação de glicoproteína a candidatos de anticorpo terapêutico e ligantes biologicamente relevantes. Glicoproteínas recombinantes produzidas em células HEK293S são passíveis de cristalização, devido à homogeneidade de glicano, flexibilidade reduzida e susceptibilidade ao tratamento endoglycosidase H. Apresentamos métodos para embeber cristais de glicoproteína, com pesado átomos e pequenas moléculas para determinação de fase e a análise de ligação do ligante, respectivamente. Os protocolos experimentais discutidos aqui segura promessa para a caracterização das glicoproteínas mamíferos dar insights sobre sua função e investigar o mecanismo de ação da terapêutica.
Introdução
Proteínas de superfície desempenham um papel crítico na função celular. Através de seus domínios extracelulares, estas proteínas de membrana podem modular interações célula-célula, adesão, transporte e sinalização1,2. A localização extracelular destas proteínas torna-los alvos atraentes para o desenvolvimento de terapêuticas para o tratamento de uma ampla gama de doenças, incluindo câncer e doenças auto-imunes3,4,5 , 6 , 7. uma das dobras de ectodomains de proteína de membrana humana mais comuns é a dobra como imunoglobulinas (Ig), que é formada por sete ou mais β-costas organizadas em duas β-folhas8,9. Normalmente, Ig-contendo glicoproteínas são estruturas de vários domínios com domínios Ig dispostos sequencialmente na porção extracelular da membrana proteína10. Modificações pós-tradução destas proteínas da pilha-superfície, particularmente glycosylation N - e O-ligados, foram mostradas para desempenhar um papel essencial no seu regulamento, dobradura, secreção e função11. Para melhorar a nossa compreensão de sua função e a melhor terapêutica de projeto que pode orientá-las, as técnicas são necessárias que permitem a sua caracterização molecular detalhada. Aqui, apresentamos uma combinação de técnicas que permitem a biofísica (biolayer interferometria (BLI) e calorimetria de titulação isotérmica (ITC)) e caracterização estrutural (cristalografia de raios x) do domínio extracelular do Ig, contendo glicoproteínas de membrana, sozinhos e em complexo com seus ligantes biologicamente relevantes e moléculas terapêuticas (Figura 1).
Glycosylation N-lig é uma das modificações pós-tradução mais comuns em proteínas de mamíferos e ocorre durante a maturação da proteína dentro do retículo endoplasmático e Golgi12,13. Linhas de células, como células de rim humano embrionário (HEK) 293, foram desenvolvidas para a expressão recombinante de grandes quantidades de glicosilados proteínas de mamíferos14,15. Esta linha de celular foi desenvolvida em um formato de suspensão, que permite a facilidade de ampliação de produção de proteína para quantidades maiores em comparação com linhas de células aderentes. Aqui, nós utilizamos duas linhas de células HEK293: HEK293F e HEK293 Gnt eu- / - (HEK293S), que diferem entre si pela ausência de N-acetylglucosaminyl transferase eu (Gnt eu) no último. Por sua vez, produção dos glicanos complexas (como visto em HEK293F) não é possível, e em vez disso alta manose-tipo os. glicanos (predominantemente homem5GlcNAc2) residem no N-lig glicano sites18,19,20 . Com estas linhas de duas células em paralelo permite estudar o efeito de glicano tamanho e complexidade na função biológica e direcionamento terapêutico. Com efeito, glicoproteínas produzidas nas células HEK293F terá maiores, mais complexos os glicanos em comparação com a mesma glicoproteína produzida nas células HEK293S. Glicoproteínas produzidas nas células HEK293S são mais receptivos a cristalização, por causa da heterogeneidade química e conformacional reduzida de seus os glicanos N-ligados. Para melhorar ainda mais crystallizability, glicoproteínas produzidas nas células HEK293S (mas não HEK293F) podem ser tratadas com a enzima endoglycosidase H (Endo H), que resulta no decote de manose alta os glicanos tais que apenas um único N-acetilglicosamina (GlcNAc) moiety permanece em cada local de glicosilação ligados N21,22. Outros métodos também podem ser usados para limitar a N-glicano processamento dentro das células, tais como a adição de inibidores de glycosyltransferase durante a expressão da glicoproteína, incluindo kifunensine23. Abordagens alternativas envolvem a expressão de glicoproteínas nativas (em células HEK293F) seguida por deglycosylation enzimático usando peptídeo N-glicosidase F (PNGaseF). No entanto, deglycosylation com PNGaseF foi mostrado para ser menos eficaz em condições nativas e agregação de aumentos em algumas proteínas; em casos quando a proteína permanece solúvel após tratamento, adquire cargas negativas em sua superfície, devido a deamidation do resíduo asparagina, ácido aspártico,24, o que pode ser prejudicial para sua cristalização. Previsto N-glicosilação sites podem também ser uma mutação, mais frequentemente a resíduos de alanina ou glutamina, para impedir o glycosylation N-ligados nesses locais e gerar amostras de glicoproteína de alta homogeneidade. Alternativamente, glicoproteínas podem ser produzidas em outras culturas de células eucarióticas, incluindo leveduras, inseto e sistemas de planta ou outras linhas de células de mamíferos, como o hamster chinês (CHO) ovarianos células16,17.
Muitos vetores de expressão de mamíferos, incluindo pHLsec, permitem a secreção de glicoproteína recombinante ectodomains na célula média25. Secreção de glicoproteínas de células HEK293 permite a purificação rápida e fácil, sem necessidade de lise celular. Adição de tags de purificação (por exemplo, sua marca, Strep-tag, tag da bandeira, Myc-marca, HA-marca) para N ou C terminus do alvo glicoproteína permite a purificação por uma cromatografia de afinidade de etapa única. Posteriormente, a cromatografia de exclusão pode ser usada para produzir uma amostra monodisperso para caracterização biofísica e estrutural.
Uma amostra de glicoproteína altamente puro e homogêneo sob condições adequadas pode resultar em cristais bem diffracting. Uma vez que foi obtido um conjunto de dados de difração de raio-x completo de tais cristais, fases iniciais necessita de ser determinado para calcular a densidade de elétrons da glicoproteína. Graças a um número cada vez maior de estruturas em banco de dados da proteína (PDB), o método mais comumente usado para eliminação gradual de longe tornou substituição molecular (MR), que usa uma estrutura de proteínas relacionadas para obter fases iniciais26. No entanto, quando o senhor não consegue resolver o problema da fase, como ocasionalmente tem sido o caso de multi-Ig domínio glicoproteínas27,28,29, métodos alternativos são necessários. Neste artigo, detalhamos um método para embeber cristais com átomos pesados (HA) para eliminação gradual, que era necessário para resolver a estrutura do CD22 ectodomínio28. Identificar o direito HA para eliminação gradual é um processo iterativo que depende HA reatividade, átomos disponíveis em glicoproteína em um lattice de cristal dado e a cristalização solução30,31. Alternativamente, os átomos de enxofre natural em resíduos de cisteína e a metionina podem ser usados para eliminação gradual se presente em uma proporção bastante alta para outros átomos na glicoproteína e dados de difração de raios x podem ser coletados com redundância suficiente32, 33.
A função biológica de glicoproteínas de membrana é muitas vezes mediada por interações da proteína-proteína ou interações da proteína-ligante, como com os hidratos de carbono. Quando o ligante é pequeno o suficiente para difundir a partir da solução para o sítio de ligação de glicoproteína na estrutura cristalina, experiências de imersão pode ser bem sucedido para obter uma estrutura de cristal Co glicoproteína-ligante para entender melhor reconhecimento ligante.
Os protocolos aqui apresentados também são relevantes para a compreensão das interacções de glicoproteínas de superfície com ligantes sintéticos de terapêutica34,35 e anticorpo terapêutica36,37. Quando combinado com informações estruturais, vinculação cinética e termodinâmica pode ser poderosa para compreender e melhorar seus mecanismos de ação. Uma técnica que permite a análise cinética dos anticorpos terapêuticos, vinculando a uma glicoproteína é BLI38,39. BLI usa biosensores com um ligante imobilizado para medir a cinética de associação e dissociação com um parceiro de vinculação, em última análise, determinando uma constante de dissociação de equilíbrio (KD). BLI é uma abordagem atraente porque pequenas quantidades de glicoproteínas são necessárias (< 100 µ g), tempo de experiência é rápido (~ 10-15 min por execução), e isso pode ser automatizado. ITC também é útil para estudar as afinidades entre glicoproteínas e vinculação parceiros40,41,42,43. Enquanto o ITC é mais tempo e reagente intensivo, informações valiosas podem ser obtidas sobre a termodinâmica da interação (ΔG, ΔH, ΔS e estequiometria). ITC também é muito útil para o estudo de interações fracas que são frequentemente associadas com a ligação transitória de glicoproteínas de superfície de ligantes. Além disso, essas técnicas podem ser usadas em conjunto para avaliar a vinculação de várias construções e avaliar o efeito de diferentes glycoforms de N-ligadas obtidas expressando a glicoproteína em linhagens celulares diferentes. Realizar BLI e ITC com glicoproteínas produzido em HEK293F, HEK293S e tratados com Endo H pode fornecer uma visão aprofundada do papel dos glicanos em atividade biológica e compromisso terapêutico.
Aplicamos com sucesso esses protocolos para caracterizar o domínio extracelular (ECD) do humano CD2228, um membro de glicoproteína da família ácido siálico-ligação Ig-como lectinas (Siglecs) que é essencial para manter a homeostase de células B44 . Realizamos o projeto de construção em profundidade para facilitar a cristalização e progressivamente o dataset de raios-x por HA de imersão com Hg. Que também embebido CD22 cristais com seu ácido siálico ligante (α2-6 sialyllactose) para obter uma estrutura do complexo imune do receptor-ligante e assim, desde as plantas para a concepção de estrutura interativa de glicano mimetics45,46. Além disso, geramos a ligação de antígeno de fragmento (Fab) do epratuzumab de terapêutica anticorpo anti-CD22 - um candidato terapêutico atualmente em ensaios clínicos de fase III para de linfoma não-Hodgkin47- para determinar sua afinidade de ligação por BLI e ITC para diferencialmente glicosilados ECD CD22 constrói. Estes estudos revelaram um papel crucial para glycosylation N-ligados em noivado epratuzumab, com implicações potenciais para reconhecimento de CD22 disfuncional células B.
Protocolo
1. construir o projeto para a glicoproteína ECD
- Avaliar a sequência de aminoácidos de CD22 humana (Uniprot) usando os servidores InterPro e Phyre2 para identificar elementos de domínio previsto e limites localizada dentro da proteína48,49.
- Clonar a sequência de CD22 humano, falta o peptídeo sinal, domínios transmembranares e citosólico (resíduos 20-687, doravante CD22 domínio extracelular, CD22 ECD) na pHLsec mamíferos expressão vetorial25 usando enzimas de restrição AgeI e KpnI ( Figura 2 ) 50.
Nota: O vetor de pHLsec é otimizado para a superexpressão de proteínas solúveis, secretadas em células de mamíferos,25. Este vetor contém um sinal de secreção para permitir a secreção extracelular de glicoproteínas solúveis. pHLsec contém uma marca de6 x C-terminal (dele) para facilitar a purificação da afinidade de sobrenadantes de células usando os métodos de cromatografia de afinidade de metal imobilizado. - Clonar construções truncadas de CD22 ECD com exclusões sequenciais dos domínios C-terminal Ig: 1-6 (20-687 resíduos) de domínios, domínios 1-5 (resíduos 20-592), domínios 1-4 (resíduos 20-504) e domínios 1-3 (resíduos 20-330) (figuras 2B e 2C)50 .
- Avalie a sequência primária de ECD CD22 usando o servidor de NetNGlyc para identificar sites de glicosilação previsto N-ligadas presentes na construção de51.
- Usando o mutagenesis local-dirigido, por protocolos padrão52 ou por sobreposição PCR53, mutar cada site previsto glycosylation N-ligadas (Asn para Gln e/ou Asn para Ala) para criar construções de ECD CD22 que contêm um único ou vários Mutações de N-ligadas glicosilação.
- Após verificação de sequência de construções clonadas, transformar em competentes de Escherichia coli DH5α células54 e maxipreparação do DNA (conforme as instruções do fabricante) para se preparar para transfeccao.
2. HEK293F e estabelecimento de célula HEK293S
Nota: Toda a manipulação de células HEK293F ou HEK293S com os reagentes necessários e o equipamento devem ser realizado em uma instalação de nível 2 de biossegurança em uma armário de biossegurança adequada. A superfície externa de todos os itens deve ser esterilizada com uma solução de etanol 70% ou reagente equivalente.
- Obter células de suspensão de HEK293F e HEK293S (ver Tabela de materiais) e armazenar a-80 ° C até que esteja pronto para uso.
- Mídia quente (ver Tabela de materiais) por 1h em banho maria a 37 ° C. 24 mL de mídia aquecida de transferência para um balão de cultura celular perplexo 125 mL com tampa exalada.
- Obter célula 1ml alíquota de-80 ° C e transferência para o gelo.
- Incube as células em um banho de água de 37 ° C por cerca de 1 min, para descongelar parcialmente as células. Transferi 1 mL de células do frasco para o frasco de cultura de célula perplexo 125 mL contendo os meios de comunicação.
- Feche o frasco de cultura celular com a tampa exalada e lugar de balão em um shaker definido como 130 rpm, 37 ° C, umidade de 70% e 8% CO2.
3. HEK293 Cell manutenção
Nota: A densidade celular e a viabilidade das células devem ser verificado aproximadamente 24 h após o descongelamento. Esta etapa garante que as células estão se recuperando após inoculação; viabilidade inicial deve ser > 80%.
- Cuidadosamente remova o frasco de 125 mL contendo as células frescas suspensão 10 µ l de células e transferi-lo para um microtubo estéril 1,5 mL. Feche o frasco e devolvê-lo para a incubadora.
- Pipetar 10 µ l de solução de azul de Trypan o microtubo de 1,5 mL contendo as células, homogeneizar e transferir 10 µ l para a câmara do slide contando.
- Coloque o slide contando em um contador automático de células e obter valores de densidade de pilha (em unidades de células mL-1) e viabilidade celular (em percentagem).
- Calcule o volume das células, o que seria necessário para inocular uma cultura fresca 200ml em uma densidade final de ~0.8 x 106 células mL-1 usando as seguintes equações:
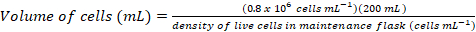 (1)
(1)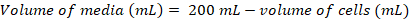 (2)
(2)
Nota: Pode levar ~ 5D para obter uma densidade celular adequada para inoculação de uma cultura de 200 mL. - Uma vez que a densidade de células é suficiente para a inoculação de uma cultura de 200 mL, warm-up mídia por 1h em uma 37 ° C banho de água e transferir mídia aquecida para a armário de biossegurança.
- Usando uma pipeta sorológica, transferi com cuidado o volume necessário de mídia (como calculado na equação 2) para um balão de cultura de célula perplexo de 500 mL com tampa exalada.
- Usando uma pipeta sorológica, transferi o volume necessário de células de suspensão (calculado na equação 1) para o frasco de cultura de célula perplexo 500 mL contendo os meios de comunicação.
- O novo estoque de manutenção de 200 mL do tampão e devolvê-lo para a incubadora. Desenvolvem-se células para uma densidade de aproximadamente 3 x 106 células mL-1. Passagem de células em uma densidade de 0,8 x 106 células mL-1 cada 2-3 d para manter uma cultura estável de células (conforme descrito na seção 3.4-3.7). Não permita que as células exceder uma densidade de ~ 4 x 106 células mL-1.
4. transfecção de células HEK293 para expressão da glicoproteína
- Calcular o volume das células e a mídia que é necessária para uma cultura de 200ml para transfeccao em 0,8 x 106 células mL-1 (usando equações 1 e 2 da seção 3.4).
Nota: O número de transfections de 200ml que podem ser executadas depende da densidade de células da unidade populacional de manutenção. - Transferir o volume necessário de mídia e células para transfeccao para um novo balão de cultura celular de 500 mL, com uma tampa exalada e retornar o estoque de célula para a incubadora.
- Incube células por 1h antes de Transfeccao para permitir que células se adapte dividindo a seguir.
- Transferir 50 µ g de DNA em um tubo cônico estéril 50 mL e diluir com 5 mL de mídia. O DNA diluído, usando um sistema de filtragem de 0,22 µm em outro tubo estéril de filtro de vácuo.
- Mistura diluída, filtrado DNA em uma relação de massa: volume 1:1 com reagente de transfeccao. Agite suavemente a solução reagente de Transfeccao de DNA: para misturar e incubar a solução à temperatura ambiente por 10 min.
- Adicione solução de reagente de transfeccao: DNA diretamente para as células. Incube as células transfectadas em 130 rpm, 37 ° C, umidade de 70% e 8% CO2 em uma coqueteleira para 5-7 d.
5. otimização das condições de transfecção celular
Nota: Para otimizar as condições de transfecção celular para rendimento máximo glicoproteína, transfect células em uma variedade de densidades de pilha inicial e avaliar o rendimento de proteína ao longo do tempo(Figura 3). Transfect células conforme descrito na seção 4, em densidades de pilha inicial variando de 0,5 x 106 a 2 x 106 células mL-1 55. Transfections julgamento podem ser escalados para baixo para o volume total de 25 mL (no frasco de cultura de células perplexo 125 mL) com 6 µ g de DNA para economizar espaço e reagentes. A quantidade de DNA também pode ser otimizado55.
- Cada pós-transfeccao dia (dias 1-7), transferir uma alíquota de 500 µ l de cultura de pilha em um microtubo estéril 1,5 mL (no gabinete de segurança biológica).
- Gire as células aliquotadas a 12.000 x g por 5 min numa microcentrifuga imediatamente após a colheita. Transferi o sobrenadante para um novo microtubo de 1,5 mL e loja a 4 ° C, até que todas as amostras são obtidas.
- Dosar a glicoproteína secretada por densitometria
- Uma vez que todas as amostras são obtidas, alíquota 20 µ l de cada amostra para um novo microtubo de 1,5 mL e misture com 6 µ l de não-redução 4 x Laemmli amortecedor da amostra.
- Ferva amostras por 5 min a 95 ° C, em um bloco de thermo. Amostras para 1 min a 12.000 x g numa microcentrifuga de girar.
- Carrega a 20 µ l de cada amostra por bem em um gel de SDS-PAGE 10-poço 4-15% gradiente. Inclua uma pista para os marcadores de tamanho da proteína. Funcione o gel em 250 V por 20 min em um tampão Tris/glicina/SDS.
- Após conclusão de execução, transferir gel de Coomassie mancha (ver Tabela de materiais) por 20 min. de manchar o gel em ddH2O por 20 min. gel de imagem.
- Realize densitometria com ImageJ, seguindo protocolos padrão57,58.
- Compilar e plotar dados com 'do pós-transfection dias' no eixo x e 'densitometria valores' no eixo y(Figura 3).
Nota: Como alternativa, se a expressão de proteínas é insuficiente para visualização por SDS-PAGE, técnicas como a mancha ocidental podem ser usado56.
- Dosar a glicoproteína secretada por BLI
- Usando biosensores Ni-NTA, dose a quantidade de glicoproteína secretada usando BLI59.
- Compilar e plotar dados com 'do pós-transfection dias' no eixo x e 'proteína concentração (µ g/mL)' no eixo y(Figura 3).
6. purificação de glicoproteína solúvel de sobrenadante HEK293
- Colheita de células por centrifugação a 6.371 x g por 20 min a 4 ° C. Reter o sobrenadante contendo secretada CD22 ECD e filtrar usando um filtro de 0,22 µm.
- Carregar o sobrenadante em 4 mL min-1 em um pre-equilibrada coluna do Ni-NTA de (20 mM Tris pH 9.0, 150 mM NaCl, imidazol 5mm) (volume de 5 mL) usando um sistema de cromatografia de bancada.
Nota: Outras técnicas de purificação baseada na afinidade podem ser utilizadas, com base a afinidade Tags incluído no projeto de construção na secção 1. - Após o carregamento do sobrenadante, lavar a coluna de afinidade com 3-4 volumes de coluna (CV) de tampão de lavagem (20 mM Tris pH 9.0, 150 mM NaCl, imidazol 5 mM).
- Eluir glicoproteína purificada da coluna usando um gradiente de 4-100% (4 CVs) do tampão de eluição (20 mM Tris pH 9.0, 150 mM NaCl, imidazol 500mm) ao coletar frações (Figura 3B).
- Fracções de piscina contendo o pico eluted em um dispositivo de filtragem centrífuga com um limite de peso molecular nominal kDa (NMWL) 10 e concentrado por centrifugação a 4.000 x g a 4 ° C por 15 min ou até que a amostra atinja um volume de 500 µ l.
- Injetar glicoproteína concentrada em um 500 µ l amostra loop e carga em 0,5 mL min-1 para uma pre-equilibrada (20 mM Tris, pH 9.0, 150 mM NaCl) coluna de exclusão de alto desempenho tamanho (aproximadamente o volume de 24 mL) em uma cromatografia líquida de proteína rápida (FPLC) sistema a 4 ° C, enquanto que coletando frações (Figura 3C).
- Funcione o gel de SDS-PAGE de frações eluted para identificar frações que contêm a glicoproteína e piscina fracções correspondentes. O gel de SDS-PAGE pode ser executado como descrito na seção 560.
7. Deglycosylation da glicoproteína purificada
- Medir a concentração de proteína purificada após cromatografia de exclusão por meio de absorbância em 280 nm dividido pelo coeficiente de extinção (por exemplo, 1,418 M-1 cm-1 para CD22 ECD).
Nota: O coeficiente de extinção teórica das proteínas de interesse pode ser calculado usando servidores como ExPASy ProtParam61. - Incube a proteína purificada com Endo H para 1 h a 37 ° C, na proporção de 1 mg de proteína purificada a 10 µ l da enzima comercial em 1 buffer X Endo H (conforme as instruções do fabricante).
Nota: Endo H cliva manose alta os glicanos produzidos em HEK293S, deixando um único GlcNAc moiety em cada local de glicosilação21. Endo H não decompor os glicanos em proteínas produzidas em células de HEK293F22, porém outras enzimas podem ser usadas para esta finalidade (por exemplo,PNGaseF,24). - Concentre-se deglycosylated ECD a 500 µ l e executar cromatografia de gel filtração em uma coluna de exclusão de alto desempenho tamanho (aproximadamente o volume de 24 mL) em 0,5 mL min-1 em um FPLC remover Endo H e separar qualquer agregados resultantes.
- Armazene a proteína de deglycosylated a 4 ° C até o uso em experimentos a jusante.
8. a cristalização de glicoproteínas
Nota: Realizar ensaios de cristalização usando telas disponíveis comercialmente e configurar sentado gota experimentos usando um robô de cristalização.
- Concentrado puro, deglycosylated ECD para 10 mg mL-1 , usando um dispositivo de filtragem centrífuga com kDa 10 NMWL a 4.000 x g (4 ° C) até a concentração desejada é obtida.
- Determinar a concentração de proteínas por meio de absorbância em 280 nm e dividindo pelo coeficiente de extinção.
- Amostra de centrifugação a 12.000 x g por 5 min a 4 ° C antes de ensaios de cristalização para remover indesejados de poeira ou outros contaminantes da amostra.
- Encha o reservatório de poços da sessão de 96 poços soltar placas de cristalização com 80 µ l de solução de cristalização de uma tela de cristalização comercial.
Nota: Usamos a matriz esparsa telas comerciais que foram projetadas baseadas sobre as condições de cristalização mais bem sucedidas no que diz respeito a estruturas depositadas no PDB. - Usando um robô de cristalização, dispense gotas dentro do poço da placa de cristalização, com um volume total de gota de 200 nL em uma proporção de solução de proteína purificada: cristalização de 1:1.
- Uma vez que o prato inteiro tem sido dispensado, sele a placa com fita e coloque em um tonalizador de placa para inspeção por luz visível e ultravioleta.
- Inspecione placas de cristalização imediatamente após a instalação e nas semanas seguintes, usando a luz visível e ultravioleta para identificar condições que deu glicoproteína inicial cristal hits.
- Otimize ainda mais os cristais obtidos de sucessos iniciais cristalização usando telas finas, baseadas na condição do sucesso de cristal ou aleatório matriz microsemeadura métodos62,63,64,65.
- Cryo-proteger os cristais falta cryo-protetor suficiente dentro da condição de cristalização embebendo o cristal em mãe licor suplementada com solução de glicerol 20% (v/v) de solução (ou equivalente de cryo-protetor, tais como o glicol de etileno ou polietileno glicol 400).
- Cristais de montagem em cryoloops e flash congelá-los em nitrogênio líquido antes da coleta de dados em um fonte em casa difratômetro ou usando radiação síncrotron.
9. eliminação usando o átomo pesado derivatização
Nota: Antes de qualquer manipulação de compostos HA, aspectos de segurança devem ser considerados. HA compostos usados em cristalografia de proteínas são selecionados pela sua forte afinidade de moléculas biológicas e representam riscos para a saúde humana da exposição prolongada. Tome medidas de segurança adequadas para compostos HA como mencionado em seu Material Safety Data Sheets.
- Para testar diferentes compostos HA, concentrações e tempos de incubação, reproduzem bem diffracting cristais obtidos na secção 8 em uma placa de 24 poços cristalização usando o enforcamento soltar vapor difusão método66.
- Decidir qual HA será usado para derivatização de cristal. Servidores (por exemplo, o átomo pesado sistema de banco de dados67) podem ajudar com seleção composta HA, assegurando que são adequados para a condição de proteína e cristalização.
Nota: HA telas também são comercialmente disponíveis para a seleção fácil de compostos HA mais eficazes para a eliminação. Um conjunto de "magia sete" HA compostos têm sido descritos anteriormente para ter alta probabilidade de sucesso para HA derivatização68. - Configurar a estação de trabalho para HA imersão(Figura 4). Usando um cryoloop, transferência rápida cristais para um 0,2 µ l cair sobre uma lamela de 22 mm, contendo HA solução diluída na condição de cristalização, tal que a concentração final de HA varia de 1 a 20 mM. A entrega do selo e incubar durante diferentes períodos de tempo (Figura 4B). Um bom ponto de partida é a 5, 10, 60 e 90 min e durante a noite.
- Inspecione visualmente os cristais com um microscópio de luz para identificar possíveis fissuras ou alterações na cor, que pode indicar os efeitos adversos para a glicoproteína cristal ou derivatização de cristal.
- Montagem de cristais em cryoloops e cristais de banho de costas por 30 s em µ l de 0.2 consecutivos três gotas contendo solução de licor mãe suplementada com 20% (v/v) glicerol (ou alternativo cryo-protetor)69. Imersão de volta os cristais remove HA composto que foi vinculado não especìfica e reduz a ocupação parcial, causada pela fraca ligação de HA. Flash cristais de congelamento em nitrogênio líquido (Figura 4B).
- Para a coleta de dados, processamento, solução de estrutura e requinte, use protocolos descrito anteriormente26,70,,71,72.
10. glicoproteína cristais com seu ligante de imersão
- Se reproduzem bem diffracting cristais obtidos na secção 8 em uma placa de cristalização 24-bem usando o método de difusão de vapor de enforcamento-gota.
- Prepare uma solução stock de ligante de 50mm em 20 mM Tris, pH 9.0, 150 mM de NaCl.
Nota: A concentração do ligante deve ser preparada de acordo com a afinidade de sua glicoproteína. Se a afinidade é desconhecida, talvez seja necessário usar um método como ITC (seção 12.2) para determinar a afinidade antes do início de experiências de imersão. Certifique-se que o ligante é solúvel na concentração desejada no buffer necessário. - Adicionar diferentes concentrações do ligante para os gota contendo cristais ECD e selar a gota para incubação em comprimentos de tempo que variam entre 5 min para 5D.
- Controle visualmente cristais com um microscópio de luz para identificar possíveis alterações na morfologia.
- Montagem de cristais em cryoloops e crio-protegê-los em solução de licor mãe suplementada com 20% (v/v) glicerol (ou outro cryo-protetor como glicol de etileno ou de baixo peso molecular polietileno glicol 400)69.
- Para coleta de dados, processamento, solução de estrutura e requinte, use protocolos descrito anteriormente73,,74,75.
11. produção de fragmento do antígeno (Fab) de vinculação
- Subclone genes que correspondem a sequências de cadeia leve (LC) de anticorpos anti-ECD, por exemplo,o epratuzumab e Fab cadeia pesada (HC).
Nota: Como alternativa, IgG pode ser clivada pela papaína enzima para gerar fragmentos Fab76. - Transfect células conforme descrito na seção 4, com as seguintes modificações:
- Use uma massa total de DNA para transfeccao de fragmentos Fab de 90 µ g / 200 mL de cultura.
- Transfect HC e LC plasmídeos na proporção de 2:1 para reduzir a quantidade de formação de dímero de LC.
- Após 7 d de incubação, colher células, reter o sobrenadante e filtrar com um dispositivo de vácuo controlado por filtração de 0,22 µm.
- Equilibrar colunas de afinidade (kappa ou lambda) anti-LC em tampão PBS, usando um sistema de cromatografia de bancada.
Nota: Se a formação do dímero de LC é um problema durante a purificação, a cromatografia de afinidade da proteína G pode ser usada como uma alternativa para a purificação da afinidade do kappa/lambda LC. - Carregar o sobrenadante na coluna de afinidade em 4 mL min-1. Após o carregamento de amostra, lave a coluna com 3-4 CVs de PBS.
- Eluir a proteína da coluna usando uma eluição isocrática com glicina de 100 mM, pH 2.2, imediatamente, neutralizando as frações eluted com 10% (v/v) 1 M Tris, pH 9.0 em cada fração.
Nota: O Fab eluted pode ser mais purificado por cromatografia de troca iônica e/ou cromatografia de exclusão usando um FPLC a 4 ° C.
12. Caracterização da Fab e pequena molécula vinculativos para a glicoproteína
- Interferometria de Biolayer
- Prepare 50 mL de tampão de cinética (1X PBS, 0,002% (v/v) Tween-20, 0,01% (p/v) BSA) 1x.
- Hidrate seis biosensores Ni-NTA em 200 µ l de debuffer 1 x cinética durante 10 minutos em um prato de pre-umectante.
- Dilua com sua tag ECD em 1 mL de tampão de cinética 1 x em uma concentração final de 25 µ l de ng-1. Pipetar diluições em série de Fab purificada em 200 µ l de tampão de cinética, 1x com uma alta concentração de 500 nM e as diluições de série subsequentes de 250 nM, 125 nM e 62.5 nM.
- Alíquotas reagentes em polipropileno microplacas de 96 poços fundo plano preto como mostrado na Figura 5A, onde cada um bem contém 200 µ l da solução indicada.
- Colete dados usando a ensaios de cinética do software de aquisição de dados, conforme descrito anteriormente,38,39,77 (Figura 5A).
- Brevemente, transferir os biossensores para poços contendo tampão de cinética de linha de base para 60 1x s antes de carregar 25 ng µ l-1 de glicoproteína para 240 s (ou até um limite de 1.0 nm é alcançado) a 1.000 rpm.
- Depois de uma segunda linha de base de 60 s em tampão de cinética, 1x transferir os biossensores para poços contendo a diluição serial de Fab. A fase de associação 180 s é posteriormente seguido por uma etapa de dissociação s 180 em cinética tampão 1x.
Nota: Biossensores podem ser reutilizados se o protocolo acima é seguido por uma etapa de regeneração, que consiste em três ciclos de lavagem as biosensores no descascamento tampão (PBS com imidazol 500 mM) para 5 s seguido por 5 s no buffer de cinética para neutralização de 1x. Biosensores podem ser reutilizados até ~ 10-20 vezes durante o mesmo dia, ou até dados pobres qualidade é observada.
- Analise os dados usando o software de análise (Figura 5A):
- Sob a aba 1, importação e selecionados dados.
- Sob a aba 2, etapa 1: Seleção de dados, selecione 'Seleção de Sensor' e poços de referência de destaque (linhas E e F, Figura 5A), clique direito e conjunto para referenciar o bem. Em etapa 2: Subtração, selecione 'referência Wells'. Em etapa 3: Alinhar o eixo y, selecione 'Base' do intervalo de tempo de 0.1 a 59,8 s. Em etapa 4: Etapa inter correção, selecione '' Alinhar à dissociação'. Em etapa 5: Processo, selecione 'Savitzky-Golay filtragem' e imprensa dados de processo.
- Em 3 de guia, selecione 'Associação e dissociação' sob passo a analisar com um modelo de 1:1. Selecione 'Global adequado' e 'Grupo de cor'. Curvas com o botão direito, selecione 'Mudar de cor', defina todas as curvas para a cor de sua escolha. Selecione 'Ajustar curvas'. Se os dados estão bem equipados, um relatório pode ser exportado, selecionando "Salvar relatório".
- Repita a experiência com glicoproteína produzida em células HEK293F e HEK293S (seção 5) e após o tratamento Endo H (secção 7) para avaliar o efeito, se for o caso, de diferentes glycoforms na Fab reconhecimento. Além disso, repeti o experimento com truncamentos de ECD de fornecer informações sobre o domínio (s) vinculado o Fab.
- Calorimetria de titulação isotérmica de interação de Fab-glicoproteína
Nota: Experiências ITC descritas aqui são executadas usando um instrumento automatizado de ITC. Experimentos são realizados em um 1ml por bloco de 96 poços de fundo.- Dialize o ECD e Fab num único copo 4L de 20 mM Tris, pH 8.0, 150 mM NaCl a 4 ° C durante a noite com uma barra de agitação.
- Concentre-se dializados ECD e Fab 5 µM e 50 µM, respectivamente, usando um filtro centrífugo com kDa 10 NMWL, garantindo para lavar três vezes com 5 mL de diálise, as membranas do concentrador de buffer a 4.000 x g durante 5 min à 4 ° C antes de usar.
Nota: Qualquer incompatibilidade em buffer entre amostras na célula e seringa pode causar calor indesejado ser lançado durante o experimento ITC e resultam em dados de má qualidade. - Para o experimento 1: adicionar 400 µ l de ECD para A1 para ser carregado na célula e 120 µ l do Fab para A2 bem para ser carregado na seringa. Bem A3 é deixado vazio para retornar a seguinte amostra mista experimentar a conclusão. Cada experimento subsequente pode ser adicionado ao prato na mesma ordem (ou seja, experimento 2: bem vazia de celular - A4, seringa - A5 - A6; Figura 5 B).
Nota: Incluir o buffer em controles de reserva (para confirmar que o instrumento está se comportando bem) no início e no final de cada corrida, bem como ligante (na seringa) em controles de buffer (no celular) para calcular o calor de diluição para a amostra na seringa. Este calculado calor de diluição deve então ser subtraída dados experimentais brutos durante a análise de dados (Figura 5B). - Execute um total de 16 injeções com um volume de 2,5 μL de cada injeção. A duração da injeção é 5 s, com espaçamento de s 180 entre as injeções. Definir a temperatura de célula de 25 ° C, com uma velocidade de agita de 750 rpm e um período de filtro de 5 s.
Nota: Com base na afinidade e termodinâmica da interação ECD:Fab, pode ser necessário alterar a concentração de amostra, o número de injeções ou temperatura da célula. - Analise os dados com o software de análise, conforme descrito anteriormente,40,41,43 (Figura 5B).
- Repeti a experiência, pelo menos em duplicatas, calcular valores de KD e erros-padrão. Repeti a experiência com ECD de diferentes glycoforms (seções 5 e 6) para avaliar o efeito, se for o caso, de glycoforms sobre a termodinâmica da interação Fab: glicoproteína.
- Por calorimetria de titulação isotérmica de interações ligante-glicoproteína, configure o experimento ITC, conforme descrito na seção 12.2, com as seguintes alterações:
- Dialize ECD em 4 L de tampão de diálise durante a noite. Dissolva o ligante usando buffer de diálise após a conclusão da diálise.
- Realize experimentos ITC em concentrações significativamente maiores para ser capaz de detectar interações de baixa afinidade. Para a interação ECD e ligante, realizar experiências ITC em concentrações de 100 µM do ECD na célula e 1 mM de ligante na seringa.
Resultados
Várias construções de ECD CD22 com êxito foram clonadas para o vetor de expressão pHLsec e overexpressed em mamíferos HEK293F e HEK293S linhas de célula (Figura 2 e 3A). Todas as construções foram purificadas a homogeneidade de tamanho por cromatografia de exclusão e rendeu uma amostra altamente pura para estudos de cristalização (Figura 3B e 3C). A construção de CD22 que levou a cristais bem diffracting era o truncamento de d1-d3 (resíduos 20-330), com cinco dos seis sites previsto glycosylation N-ligadas uma mutação de Asn para Ala (N67A, N112A, N135A, N164A e N231A), produzido em células HEK293S, tal que só o site de glicosilação em posição N101 foi mantida (essa construção é chamada CD2220-330, 5A). Cristais foram obtidos em várias condições de tela de matriz esparsa MCSG-1, mas os melhores cristais eram de uma condição que contém 30% (p/v) de polietilenoglicol 4000, cloreto de lítio 0,2 M e 0,1 M Tris, pH 8,5. Estes cristais nativos difratados para 2.1 resolução Å; usar estruturas conhecidas de domínios do Ig de proteínas relacionadas de Siglec não deu quaisquer soluções em pesquisas de senhor.
Para adquirir informações progressiva, nós embebido nativos cristais com um painel de compostos HA que incluía Hg, Pt, sistema operacional, Ta e Br em concentrações que variam de 1 a 20 mM de HA composto por um tempo de incubação de 5 min para 1D (Figura 4). Temos monitorado cristais para alterações na morfologia e encontrado que cristais embebido com HA composto em 20mm resultou no rachamento rápido e dissolução do cristal. Nós congelamos um total de 63 cristais que manteve sua forma seguindo incubações conjunto que foram embebidas com cluster de tântalo brometo, cloreto de platina, acetato de mercúrio e cloreto de mercúrio. Cristais embebido com 7 mM de cloreto de mercúrio para 30 min mostrado sinal anômalo em um exame de fluorescência para a fonte de luz canadense (CLS) 08-BM beamline (Saskatoon, Canadá) e permitiu a múltiplos do comprimento de onda dispersão anômala coleta de dados de raio-x em um único cristal. Esses conjuntos de dados nos permitiram resolver a subestrutura de mercúrio de CD2220-330, 5A, que revelou um átomo de mercúrio único ligado a uma cisteína livre na posição C308 e, finalmente, permitiu-nos construir a estrutura de CD2220-330, 5A para o faseada mapa de densidade do elétron usando AutoBuild78.
Uma vez que a estrutura de unliganded foi resolvida, estávamos interessados em resolver a estrutura de CD22 acoplado a seu ligante, α2-6 siallylactose. Primeiro calculamos a afinidade de CD22 para α2-6 sialyllactose usando ITC para caracterizar a termodinâmica de vinculação da interação. Temos observado uma afinidade de ~ 280 µM e usou esta informação para identificar uma concentração inicial (~ 100 x KD) do ligante a ser usado para imersão de nossos cristais de20-330, 5A CD22 nativos. Nós embebido CD2220-330, 5A cristais com siallylactose de 25 mM para 5 min, 2 h, 14 h, 40 h e 5D e monitorados para alterações na morfologia do cristal. Um total de 75 ~ cristais de vários pontos de tempo e congelado enviado ao CLS síncrotron beamline 08-identificação (Saskatoon, Canadá) para coleta de dados remoto. Um total de seis raios-x de conjuntos de dados foram coletados de cristais bem diffracting. A estrutura de cada conjunto de dados de raio-x foi resolvida pelo senhor usando o unliganded CD2220-330, 5A estrutura como um modelo de pesquisa inicial. A densidade de elétrons resultante para todos os conjuntos de dados então foi inspecionada para densidade positiva no mapa de Fo-Fc que corresponderia para vinculados α2-6 sialyllactose dentro do sítio de ligação de CD22. Notavelmente, todos os conjuntos de dados coletados, mesmo aqueles provenientes de cristais encharcados depois de apenas 5 minutos de tempo de incubação, continha densidade positiva correspondente para o ligante no sítio de ligação. Globais estruturas do unliganded e CD22 liganded foram altamente semelhantes com mínimas alterações conformacionais, que podem explicar o sucesso de experiências de imersão com α2-6 sialyllactose.
Nós próximos caracterizada a superfície antigênica de CD22 reconhecido pelo anticorpo terapêutico epratuzumab em experimentos BLI e ITC (Figura 5). Perfis de cinética e termodinâmica de epratuzumab Fab ligação a CD22 construções com diferentes glycoforms revelam uma crescente afinidade para CD22 com tamanho reduzido glicano N-ligados, com até 14-fold melhoria na afinidade para os glicanos menores (327 nM vs 24 nM em BLI; 188 nM vs 58 nM em ITC). O glicano CD22 N-lig restringir o acesso do anticorpo para o epítopo foi identificado por BLI usando ponto único mutantes de CD22 e resolvendo o epratuzumab Fab-CD22 d1-d3 co cristal estrutura28.
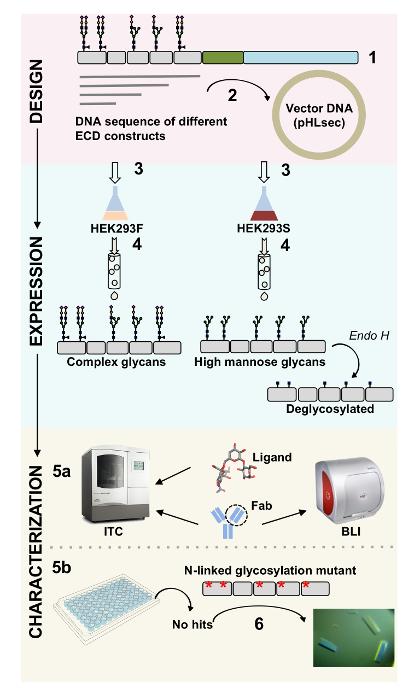
Figura 1 . Visão geral de caracterização de glicoproteína do projeto de construção para caracterização estrutural e Biofísica. (1) análise de sequências primária da glicoproteína representativa. Em cinza, o domínio extracelular (ECD); em verde, segmento transmembrana (TM); e em azul, o domínio citosólico da glicoproteína. Previsto os glicanos N-ligados são rotulados. (2) clonagem das construções de ECD. (3) expressão de ECD constrói em células de mamíferos. (4) purificação de glicoproteína. Enquanto as proteínas expressas em HEK293F conterá os glicanos complexos, proteínas expressas em HEK293S terá os glicanos manose alta. Tratamento enzimático de glicoproteínas produzidas nas células HEK293S com Endo H resultados em glicoproteínas com apenas um moiety GlcNAc em sítios de glicosilação N-ligados. (5a) glicoproteínas são testadas para a sua ligação com os anticorpos por interferometria biolayer (BLI) e calorimetria de titulação isotérmica (ITC). Afinidade com ligantes pequenos também pode ser medida pela ITC. ensaios de cristalização (5b) de glicoproteínas com homogênea N-ligados os glicanos, tais como aqueles expressos em HEK293S e deglycosylated, com H. Endo (6), em alguns casos, a mutação dos sítios de glicosilação N-ligados é necessária obter cristais. Clique aqui para ver uma versão maior desta figura.

Figura 2 . Projeto de CD22 ectodomínio DNA constrói para expressão em células de mamíferos. A) representação do plasmídeo pHLsec usado para transfecção transiente de ECD CD22 construções. Sites AgeI e KpnI usados para clonagem são indicados com caixas vermelhas. B) The CD22 ECD contém sete domínios Ig (d1-d7) e 12 sítios de glicosilação previsto N-ligados (em azul). Quatro construções foram projetadas desde o ECD CD22. C) gel de agarose 1% mostrando PCR amplicons de ECD CD22 constrói para clonagem em vetor de expressão mamíferos o pHLsec. Primeira pista contém marcador de DNA de 1 kb. Clique aqui para ver uma versão maior desta figura.
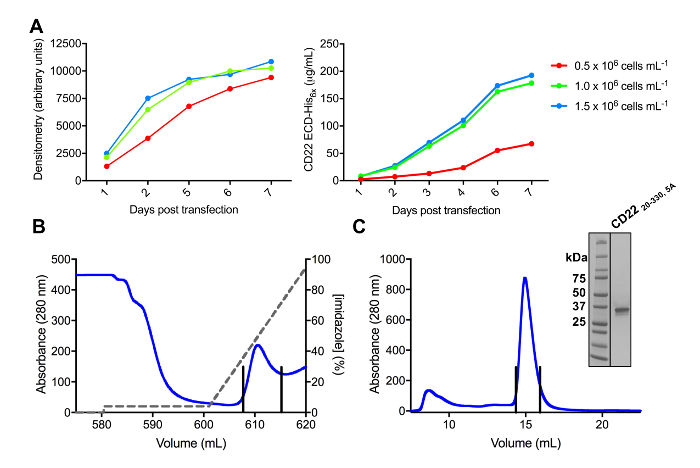
Figura 3 . Expressão e purificação de glicoproteínas. A) efeito de densidade celular em rendimentos de expressão. Expressão da glicoproteína na cultura de pequena escala 25 mL de suspensão de HEK293F células transfectadas utilizando três diferentes densidades inicial das células (0,5 x 106 células mL-1, 1,0 x 106 células mL-1e 1,5 x 106 células mL -1). Quantificação realizada por densitometria de SDS-PAGE no painel esquerdo e BLI quantitativo no painel à direita. Valores são representativos de uma preparação de glicoproteína. B) cromatograma da primeira etapa da purificação para construir CD2220-330, 5A de 600 mL do sobrenadante usando uma coluna de afinidade Ni-NTA. A glicoproteína foi eluída usando um gradiente de imidazol (linha cinza), onde 100% corresponde ao buffer de eluição, que contém o imidazol 500 mM. Frações em pool são representadas com linhas verticais. C) cromatograma tamanho-exclusão para construir CD2220-330, 5A usando de alta performance do gel coluna de filtração. Frações em pool do pico eluição são representadas com linhas verticais. Inserir: Gel de SDS-PAGE manchadas de Coomassie mostrando a pureza da glicoproteína. Clique aqui para ver uma versão maior desta figura.

Figura 4 . Cristal de imersão com átomos pesados. A) a estação de trabalho-amostra para embeber nativos cristais com compostos HA. Todas as ferramentas são rotuladas. B) as etapas seguidas para absorver os cristais de construir CD2220-330, 5A com compostos HA. Etapa 1, abra bem contendo cristais e cristais de transferência usando um loop para uma queda de 0,2 µ l sobre uma lamela contendo HA solução diluída na condição de cristalização, tal que a concentração final de HA varia de 1-10 mM. Etapa 2, a queda da placa de cristalização do selo e incube cristais com o HA composto por diferentes períodos de tempo. Etapa 3, montar o cristal embebido no loop e volta-embeber por 30 s em três consecutivos 0,2 µ l gotas contendo a solução de licor mãe suplementada com 20% (v/v) glicerol dispensada sobre uma lamela. Etapa 4, flash congelar o cristal montado em um loop com nitrogênio líquido e colocá-lo em um disco para a expedição para a trajetória de síncrotron. Clique aqui para ver uma versão maior desta figura.
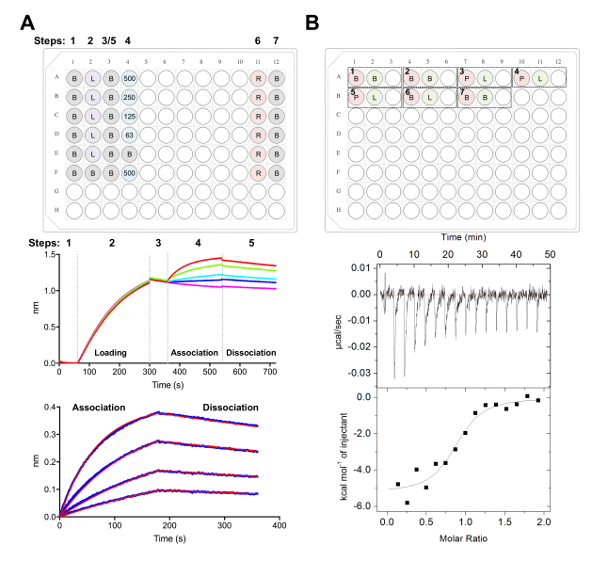
Figura 5 . Biolayer interferometria e isothermal titulação calorimetria medições. A) experimento representante BLI. Painel superior: exemplo de configuração da placa para um experimento de cinética, onde a seguir é rotulada: 1 cinética x buffer (B), ax 6-glicoproteína marcado carregando (L), concentrações de Fab representativas (500, 250, 125, 62.5 nM), PBS + regeneração de 500 mM tampão (R) e 1 x neutralização de cinética de buffer (B). Bem, cada um contém 200 µ l de solução. Passo número para o experimento de cinética é indicado na parte superior da placa. Painel médio: Dados brutos representativos do experimento BLI executada usando biosensores Ni-NTA e o prato descrito no painel superior. Passo números correspondem à linha de base (1) sua glicoproteína6 x (2) a carregar, da linha de base (3), associação em série diluição da Fab (4) e dissociação (5). Etapas de regeneração não são representados (passos 6-7). Painel inferior: Dados analisados representativos mostrando cru associação e dissociação (linha azul), com a correspondente a 1:1 se encaixam (linha vermelha). B) painel superior: instalação placa representativa para um único ITC executar em um instrumento automatizado de ITC com sete experimentos em 96-poço redondo cadernal. Cada experimento é composto de três poços. O primeiro poço (vermelho) corresponde a amostra para a célula (400 µ l), o segundo poço (verde) corresponde a amostra para a seringa (120 µ l). O terceiro bem é deixado vazio, e as amostras mistas serão devolvidas a este bem após a conclusão do experimento. Experimentos 1, 2 e 7 são reserva nos controles de buffer. Experimentos de 3-5 representam experimentos triplicados com glicoproteína (P) na célula e Fab ou ligante (L) na seringa. Experimento 6 representa um calor de ligante de controle de diluição e deve ser subtraído de experimentos 3-5 durante a análise de dados. Painel inferior: Representante cru (topo) e processados (inferior) ITC dados mostrando Fab (epratuzumab), vinculando a ECD CD22 produziram nas células HEK293F. Clique aqui para ver uma versão maior desta figura.
Discussão
Glicoproteínas de membrana-ancorados são críticas para a função celular e atraentes alvos terapêuticos. Aqui, apresentamos um protocolo para a caracterização estrutural e biofísico do ECD de glicoproteínas de membrana, em paz e em complexos com ligantes de pequenas moléculas e fragmentos de Fab. Usamos com sucesso este protocolo para determinar a estrutura de cristal dos três domínios Ig N-terminal-maioria da porção extracelular do humano CD2228, um crítico co receptor nas células B envolvidos em manter a imunidade humoral na seleção79. Temos também caracteriza-se o sítio de ligação de CD22 com seu ligante natural α2-6 sialyllactose e definido o modo de reconhecimento de um anticorpo terapêutico no sentido humano CD22. Estes resultados fornecem insights sobre a relação estrutura-função de um membro chave da família Siglecs que restringiu a expressão em células B e um roteiro molecular para o desenvolvimento da molécula pequena nova CD22 direcionada e baseados em anticorpos terapêutica. Enquanto este protocolo foi utilizado com sucesso para um receptor de célula B Ig-contendo, propomos que a nossa abordagem pode ser aplicada para a caracterização estrutural e Biofísica de qualquer glicoproteína de membrana com uma organização de domínio distinto. Em tais casos, construa o projeto e combinatório glicano N-lig mutações (ou Gln ou Ala) podem ser avaliadas para encontrar uma construção apropriada para o crescimento de cristais e difração de alta resolução.
Obtenção de uma amostra homogênea e puro glicoproteína é de importância crítica para o crescimento de cristal e difração de raios x, bem como para caracterização biofísica a jusante. N-ligados os glicanos presentes em glicoproteínas são inerentemente heterogêneos e podem causar a heterogeneidade conformacional e química dentro da glicoproteína que pode impedir a formação de cristais. Para reduzir este micro-heterogeneidade, estratégias que introduzem mutações pontuais para remover os resíduos de Asn, previstos para abrigar os glicanos N-ligados, ou usando linhas de células mutantes (como HEK293S) seguido de um tratamento com endoglycosidases (como EndoH) podem consideravelmente Melhore a cristalização sucesso15,21,22. Neste protocolo, discutimos a purificação de glicoproteínas solúveis e Fabs que são secretados na célula do sobrenadante. Secreção de glicoproteína fornece uma rota relativamente simples no sentido de pureza, sem a necessidade de lise celular ou a adição de produtos químicos ou detergentes. A célula sobrenadante, obtido seguinte célula colheita então é executada diretamente sobre uma coluna que tenha afinidade da proteína de interesse (por exemplo, Ni-NTA por glicoproteínas com sua tag ou afinidade de LC para fragmentos Fab). No entanto, dependendo da coluna de utilização e as condições da célula sobrenadante (por exemplo, pH), a capacidade de ligação da proteína de interesse para a coluna pode ser afetada. Se este for o caso, pode ser necessário para se concentrar e troca a célula sobrenadante para melhorar a ligação à coluna de buffer. Além disso, é altamente recomendável que os passos de controle de qualidade durante a purificação ser empregado para ajudar a avaliar a pureza da proteína. Executando um gel de SDS-PAGE ou borrão ocidental de todas as amostras (antes, durante e após as etapas de purificação) pode gerar insights sobre se o esquema proposto de purificação é apropriado para a proteína de interesse. Se o contaminantes bandas são visíveis em SDS-PAGE, ou se várias espécies são obtidos durante a purificação (por exemplo, vários picos na exclusão de tamanho), etapas de purificação adicional deve ser considerada, por exemplo, cromatografia de troca iónica, a ganhar em pureza e aumentar as chances de cristalização a jusante80.
Para cristalização macromolecular, muitas vezes é fundamental para obter rendimentos elevados da proteína de interesse para permitir a seleção de um grande número de potenciais condições de cristalização em concentrações elevadas da proteína encontrar sucessos de cristal apropriado. Geralmente, as linhas de células HEK293 discutidas aqui (HEK293F e HEK293S) são sistemas robustos de expressão e podem ser facilmente dimensionadas para produzir mais amostra, se necessário. No entanto, é possível que a proteína de interesse não pode exprimir suficientemente dentro destas linhas de célula. Nestes casos, outras linhas celulares, tais como Expi293 células81,82, foram encontradas para mostrar níveis superiores de expressão de proteínas em devem ser consideradas como uma alternativa.
Se bem ordenadas, diffracting cristais não são obtidos após o teste de várias construções da proteína de interesse, apesar de alta pureza, pode ser necessário expandir as técnicas de cristalização para promover a formação de cristais. Tem sido demonstrado que Fab fragmentos de anticorpos e nanobodies podem ser potenciadores de cristalização excelente e promover bem-ordenado cristal embalagem83,84,85. Estes fragmentos podem ser expressas purificados a homogeneidade e usados em um complexo com a proteína de interesse para promover a cristalização. Importante, fragmentos Fab produzidos conforme descrito na seção 10 podem ter uma tendência para formar de dímeros não-funcional LC86. Esses dímeros são contaminantes e devem ser removidos durante a purificação. Em nossa experiência, dímeros LC muitas vezes têm um volume de retenção diferentes na exclusão de tamanho, ou eluir como um pico distinto em cromatografia de troca iônica, em assim podem ser removidos da purificação Fab - porém este não é sempre o caso. Se estas técnicas são insuficientes para retirar a purificação Fab dímeros de LC, métodos de purificação adicionais, tais como a purificação da afinidade da proteína G, podem ser empregados para melhorar a pureza.
Alternativa para co-complexação com fragmentos Fab, técnicas bem documentadas como microseeding matriz aleatória podem melhorar as chances de obter cristais bem-ordenado63,70. Este método envolve a adição de pequenas quantidades de cristais esmagados, ideais para a condição de cristalização, fornecendo uma nucleada para promover o crescimento de cristal de cristal. Isso pode ser realizada usando cristais da proteína de interesse, ou aqueles com estrutura de arquitetura e terciário de domínio semelhante. Além disso, microseeding matriz aleatória pode ser executada em tentativas para cristalizar a proteína sozinha, ou em complexo com um fragmento Fab ou pequenas moléculas de interesse. Recentes avanços na microscopia cryo-elétron também fazem desta técnica uma alternativa atraente para cristalografia de raios x para a obtenção de informações estruturais de alta resolução para moléculas com características adequadas87,88, 89,90,91.
Quando a eliminação de conjuntos de dados de difração de raios x falha pelo senhor, HA de imersão pode ser necessária para resolver o problema da fase por dispersão anômala ou substituição isomórfica. Inspeção da sequência de aminoácidos da proteína pode fornecer pistas sobre a estratégia para derivatização HA, incluindo o pH ótimo para vinculação. Em particular, não pareadas cisteínas dentro da proteína especificamente podem vincular HA compostos que contêm mercúrio. Cristais nativos com HA compostos de imersão é um processo iterativo para determinar a identidade do ideal HA composto, sua concentração e o tempo de incubação necessário. Se as tentativas iniciais de imersão não render bem diffracting cristais contendo um HA apropriado para eliminação, pode ser necessário introduzir substituições de aminoácidos para melhorar a probabilidade de ligação HA e melhorar o sinal anômalo. Exemplos incluem mutações para incluir um resíduo de cisteína livre para vincular eficientemente Hg, Au, Pt ou Pb. expressão de proteínas para eliminação anômala em uma mídia de seleno-metionina completada em e. coli é usada extensivamente para eliminação anômalo, no entanto um sistema equivalente que incorpora confiantemente seleno-metionina não está prontamente disponível para células de mamíferos em suspensão92,93e é uma área de desenvolvimento futuro.
Uma vez obtida a estrutura unliganded da glicoproteína de interesse, os cristais com ligantes pequena molécula de imersão pode ser realizada para obter uma estrutura do complexo imune do receptor-ligante. Estes dados fornecem um modelo para o projeto racional de ligantes mais específicos e de alta afinidade que pode ser usado como pequeno-molécula terapêutica, bem como fornece insights de alta resolução sobre a função biológica da glicoproteína. Ao tentar absorver os cristais de glicoproteína com ligantes de pequenas moléculas de interesse, inspeção da estrutura de cristal de unliganded pode indicar se a imersão deve ser possível. Se fechar cristal-embalagem contatos encontram-se em torno do local da ligação de ligante ou ao redor de regiões deverá sofrer mudanças conformacionais sobre vinculação de ligante, imersão provavelmente vai ser problemático. Neste caso, outros métodos, como cristalização co do complexo proteína-ligante devem ser executados.
Divulgações
Os autores declaram não interesses concorrentes.
Agradecimentos
Foram realizados experimentos de difração de raios x descritos neste trabalho usando de luz síncroton 08-ID e 08-BM na fonte de luz canadense, que é apoiado pela Fundação de Canadá para inovação, ciências naturais e engenharia Conselho de pesquisa do Canadá, o Universidade de Saskatchewan, o governo de Saskatchewan, Canadá ocidental diversificação económica, o Conselho de pesquisa nacional do Canadá e os institutos canadenses de pesquisa em saúde. Nós gostaríamos de reconhecer o estrutural & biofísicos facilidade do núcleo, o Hospital para crianças doentes, para o acesso aos instrumentos ITC e BLI. J.E.O. foi apoiado por Banting Postdoctoral Fellowship BPF-144483 dos institutos canadenses de pesquisa em saúde. T.S. é um destinatário de Canadá graduação bolsa de Mestrado o prêmio e uma bolsa de pós-graduação Canadá Vanier dos institutos canadenses de pesquisa em saúde. Este trabalho foi apoiado pela operação grant PJT-148811 (J.-p. j) dos institutos canadenses de pesquisa em saúde. Esta pesquisa foi desenvolvida, em parte, graças ao financiamento do programa de cadeiras de pesquisa do Canadá (J.-p. j).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
Referências
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88 (2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764 (2017).
- Yu, X. -. L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659 (2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796 (2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601 (2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. . NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91 (2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- . Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015)
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- . Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018)
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548 (2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285 (2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022 (2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383 (2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11 (2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984 (2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -. P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a., Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados