Method Article
Caratterizzazione delle glicoproteine con la piega di immunoglobulina mediante cristallografia a raggi x e tecniche biofisiche
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo gli approcci per la caratterizzazione biofisica e strutturale delle glicoproteine con la piega di immunoglobulina biolayer interferometria, calorimetria isotermica di titolazione e cristallografia a raggi x.
Abstract
Glicoproteine sulla superficie delle cellule giocano un ruolo critico nella funzione cellulare, compresi segnalazione, adesione e trasporto. Sui leucociti, diverse di queste glicoproteine possiedono pieghe dell'immunoglobulina (Ig) e sono al centrali di regolazione e riconoscimento immune. Qui, presentiamo una piattaforma per la progettazione, l'espressione e la caratterizzazione biofisica del dominio extracellulare del recettore umano delle cellule di B CD22. Proponiamo che questi approcci sono ampiamente applicabili alla caratterizzazione della glicoproteina mammiferi extracellulari contenenti domini Ig. Due sospensione linee cellulari embrionali umane del rene (HEK), HEK293F e HEK293S, sono usati per esprimere le glicoproteine che harbouring glicani complessi e ad alta-mannosio, rispettivamente. Queste glicoproteine ricombinanti con differenti glicoforme consentono lo studio dell'effetto di glycan dimensioni e composizione il grippaggio del ligand. Discutiamo i protocolli per lo studio della cinetica e termodinamica dell'associazione glicoproteina da ligandi biologicamente rilevanti e anticorpo terapeutico candidati. Glicoproteine ricombinanti prodotte nelle cellule HEK293S sono suscettibili di cristallizzazione a causa di omogeneità glycan, ridotta flessibilità e suscettibilità al trattamento endoglycosidase H. Vi presentiamo metodi per ammollo cristalli glicoproteina con atomi pesanti e piccole molecole per fase determinazione e analisi del grippaggio del ligand, rispettivamente. I protocolli sperimentali discussi qui tengono la promessa per la caratterizzazione delle glicoproteine mammiferi per dare loro funzione: spaccato e studiare il meccanismo di azione di terapeutica.
Introduzione
Proteine di superficie svolgono un ruolo critico nella funzione cellulare. Queste proteine di membrana, attraverso i loro domini extracellulari, è in grado di modulare interazioni cellula-cellula, adesione, i trasporti e segnalazione1,2. La localizzazione extracellulare di queste proteine che li rende attraenti bersagli per lo sviluppo di terapie per il trattamento di una vasta gamma di malattie, compreso cancro e malattie autoimmuni3,4,5 , 6 , 7. uno dei più comuni pieghe della membrana umana proteine extracellulari è la piega di immunoglobulina-come (Ig), che è formata da sette o più β-fili disposti in due β-fogli8,9. In genere, Ig-contenenti glicoproteine sono strutture multidominio con domini Ig disposti in sequenza sulla porzione extracellulare della proteina della membrana10. Modificazioni post-traduzionali di queste proteine di superficie delle cellule, in particolare N - e O-collegata della glicosilazione, hanno dimostrate di svolgono un ruolo essenziale nella loro regolazione, pieghevole, secrezione e funzione11. Per migliorare la nostra comprensione della loro funzione e per meglio terapeutica di progettazione che possa usarli come destinazione, sono necessarie tecniche che consentono per la loro caratterizzazione molecolare dettagliata. Qui, presentiamo una combinazione di tecniche che consentano la biofisica (interferometria biolayer (BLI) e calorimetria isotermica di titolazione (ITC)) e caratterizzazione strutturale (cristallografia a raggi x) del dominio extracellulare di Ig-contenenti glicoproteine di membrana, da solo e in complesso con i loro ligandi biologicamente rilevanti e molecole terapeutiche (Figura 1).
N-collegata della glicosilazione è uno della più comuni modificazioni post-traduzionali delle proteine di mammifero e si verifica durante la maturazione della proteina all'interno del reticolo endoplasmatico e Golgi12,13. Linee cellulari, quali 293 cellule embrionali umane del rene (HEK), sono stati sviluppati per l'espressione ricombinante di grandi quantità di proteine di mammiferi glicosilata14,15. Questa linea cellulare è stata sviluppata in un formato di sospensione, che permette per la facilità di produzione di proteine in quantità maggiori rispetto alle linee cellulari aderenti la scalabilità. Qui, utilizziamo due linee di cellule HEK293: HEK293F e Gnt HEK293 io- / - (HEK293S), che si differenziano per l'assenza di N-acetilglucosaminil transferasi I (Gnt io) in quest'ultimo. A sua volta, produzione di glicani complessi (come visto in HEK293F) non è possibile e invece alta mannosio-tipo glicani (principalmente Man5GlcNAc2) risiedono a N-collegati glycan siti18,19,20 . Utilizzo di queste linee due cellulari in parallelo permette di studiare l'effetto di glycan dimensione e complessità sulla funzione biologica e targeting terapeutico. Infatti, glicoproteine prodotte nelle cellule HEK293F avrà glicani più grandi, più complesse rispetto alla stessa glicoproteina prodotta in cellule di HEK293S. Glicoproteine prodotte nelle cellule HEK293S sono più suscettibili di cristallizzazione, a causa della ridotta eterogeneità chimica e conformazionale di loro glycans N-collegati. Per migliorare ulteriormente crystallizability, glicoproteine prodotte nelle cellule HEK293S (ma non HEK293F) possono essere trattate con l'enzima endoglycosidase H (Endo H), che provoca la scissione dei glicani alta mannosio tale che solo un singolo N-acetilglucosamina (GlcNAc) frazione rimane a ogni N-collegata della glicosilazione sito21,22. Altri metodi è utilizzabile anche per limitare l'elaborazione di N-glycan all'interno delle cellule, come l'aggiunta di inibitori di glycosyltransferase durante l'espressione della glicoproteina, tra cui kifunensine23. Approcci alternativi implicano l'espressione delle glicoproteine nativi (nelle cellule HEK293F) seguita da deglycosylation enzimatica utilizzando il peptide N-glycosidase F (PNGaseF). Tuttavia, deglycosylation con PNGaseF ha dimostrato di essere meno efficace nelle circostanze natali e aumenta l'aggregazione in alcune proteine; nei casi quando la proteina rimane solubile dopo il trattamento, esso acquisisce cariche negative sulla sua superficie a causa la deamidazione del residuo dell'asparagina in acido aspartico24, che potrebbe essere dannosa per la sua cristallizzazione. Predetto N-glicosilazione siti possono anche essere mutati, più spesso ai residui di alanina o glutamina, per impedire la glicosilazione N-collegati a questi siti e per generare i campioni della glicoproteina di alta omogeneità. In alternativa, glicoproteine possono essere prodotti in altre culture di cellula eucariotica, inclusi lievito, insetto e sistemi di impianto o altre linee di cellule di mammifero come criceto cinese ovarico (CHO) cellule16,17.
Molti vettori di espressione dei mammiferi, tra cui pHLsec, consentono per la secrezione della glicoproteina ricombinante extracellulari in cella media25. Secrezione di glicoproteine da cellule HEK293 consente di rapida e facile purificazione senza la necessità di lisi delle cellule. Aggiunta di tag di purificazione (ad es., His-tag, Strep-tag, bandiera-tag, Myc-il tag, HA-tag) fino al capolinea N o C della destinazione della glicoproteina permette la purificazione di una cromatografia di affinità passo singolo. Successivamente, la cromatografia di esclusione di formato può essere utilizzata per produrre un campione monodisperso per la caratterizzazione biofisica e strutturali.
Un campione di glicoproteina altamente puro e omogeneo in condizioni adeguate può causare cristalli ben diffrangano. Una volta che un set di dati di diffrazione di raggi x completo è stato ottenuto da tali cristalli, fasi iniziali devono essere determinate per calcolare la densità dell'elettrone della glicoproteina. Grazie a un numero sempre crescente di strutture in Protein Data Bank (PDB), il metodo più comunemente utilizzato per l'eliminazione è diventato di gran lunga sostituzione molecolare (MR), che utilizza una struttura di proteina correlata per ottenere fasi iniziali26. Tuttavia, quando MR non riesce a risolvere il problema di fase, come occasionalmente è stato il caso per multi-Ig dominio glicoproteine27,28,29, metodi alternativi sono necessari. In questo articolo, abbiamo un metodo in ammollo cristalli con atomi pesanti (HA) per fasatura, che era necessario per risolvere la struttura del CD22 ectodomain28in dettaglio. Identificare il diritto HA graduale è un processo iterativo che dipende dalla reattività HA, atomi disponibili nella glicoproteina in una determinato grata di cristallo e la cristallizzazione soluzione30,31. In alternativa, gli atomi di zolfo naturale nei residui di cisteina e metionina possono essere utilizzati per l'eliminazione se presenti un rapporto abbastanza alto per altri atomi nella glicoproteina e dati di diffrazione di raggi x possono essere raccolti con ridondanza abbastanza alto32, 33.
La funzione biologica di glicoproteine della membrana è spesso mediata da interazioni proteina-proteina o interazioni proteina-ligando, come con i carboidrati. Quando il ligando è abbastanza piccolo per diffondere dalla soluzione per il sito di legame della glicoproteina nella grata di cristallo, ammollo esperimenti può avere successo per ottenere una struttura di co-cristallo glicoproteina-ligando per comprendere meglio il riconoscimento del ligando.
I protocolli presentati qui sono anche rilevanti per la comprensione delle interazioni di glicoproteine di superficie con ligandi sintetici terapeutico34,35 e anticorpo terapeutica36,37. Quando combinato con informazioni strutturali, associazione cinetica e termodinamica può essere potente per capire e migliorare i loro meccanismi di azione. Una tecnica che permette l'analisi cinetica di anticorpi terapeutici in associazione a una glicoproteina è BLI38,39. BLI utilizza biosensori con un ligando immobilizzato per misurare la cinetica di associazione e dissociazione con un partner di associazione, in definitiva determinare una costante di dissociazione di equilibrio (KD). BLI è un approccio attraente poiché piccole quantità di glicoproteine sono necessari (< 100 µ g), tempo di esperimento è veloce (~ 10-15 min per corsa), e può essere automatizzato. ITC è inoltre utile per lo studio delle affinità tra glicoproteine e associazione partner40,41,42,43. Mentre ITC è più tempo e reagente intensivo, preziose informazioni sono ottenibili per quanto riguarda la termodinamica dell'interazione (ΔG, ΔH, ΔS e stechiometria). ITC è anche molto utile per lo studio delle interazioni deboli che sono spesso associati con l'associazione transitoria di glicoproteine di superficie di ligandi. Inoltre, queste tecniche possono essere utilizzate in combinazione per valutare l'associazione di diversi costrutti e valutare l'effetto di differenti glicoforme N-collegati ottenuti dall'esprimere la glicoproteina in differenti linee cellulari. Esecuzione di BLI e ITC con glicoproteine prodotte in HEK293F, HEK293S e trattati con Endo H può fornire una visione approfondita del ruolo dei glicani attività biologica ed impegno terapeutico.
Abbiamo applicato con successo questi protocolli per caratterizzare il dominio extracellulare (ECD) di umano CD2228, un membro della glicoproteina della famiglia di lectine (Siglecs) per acido sialico-associazione Ig-like che è essenziale per il mantenimento dell'omeostasi delle cellule di B44 . Abbiamo effettuato approfondite costrutto design per facilitare la cristallizzazione e gradualmente il dataset di raggi x da HA ammollo con Hg. Abbiamo anche bagnato CD22 cristalli con suo acido sialico di ligando (α2-6 sialyllactose) per ottenere una struttura del complesso recettore-ligando immuni e così forniti i progetti per la progettazione della struttura-Guida di glycan mimetics45,46. Inoltre, abbiamo generato l'associazione di antigene di frammento (Fab) dell'epratuzumab anticorpo terapeutico anti-CD22 - un candidato terapeutico attualmente in studi clinici di fase III per non-Hodgkin linfoma47- per determinare la sua affinità di legame di BLI e ITC a differenzialmente glicosilata CD22 ECD costruisce. Questi studi hanno rivelato un ruolo critico per N-collegata della glicosilazione nel fidanzamento epratuzumab, con potenziali implicazioni per CD22 riconoscimento sulle cellule B disfunzionale.
Protocollo
1. costruire il Design per la glicoproteina ECD
- Valutare la sequenza dell'amminoacido di umano CD22 (Uniprot) utilizzando i server di InterPro e Phyre2 per identificare gli elementi del predetto dominio e confini si trova all'interno della proteina48,49.
- Clonare la sequenza di umano CD22, manca il peptide segnale, domini transmembrane e citosoliche (residui 20-687, d'ora in poi dominio extracellulare di CD22, CD22 ECD) in pHLsec mammiferi espressione vettoriale25 utilizzando enzimi di restrizione AgeI e KpnI ( Figura 2 A) 50.
Nota: Il vettore di pHLsec è ottimizzato per la sovraespressione di proteine solubili, secrete in cellule di mammifero25. Questo vettore contiene un segnale di secrezione per consentire la secrezione extracellulare di glicoproteine solubili. pHLsec contiene un tag di6 x C-terminale (sua) per facilitare la purificazione di affinità da surnatanti delle cellule, utilizzando metodi di cromatografia di affinità metallo immobilizzato. - Clonare costrutti troncati di CD22 ECD con le omissioni sequenziale dei domini Ig C-terminale: domini 1-6 (residui 20-687), domini 1-5 (residui 20-592), domini 1-4 (residui 20-504) e domini 1-3 (residui 20-330) (figure 2B e 2C)50 .
- Valutare la sequenza primaria di ECD CD22 utilizzando il server NetNGlyc per identificare il predetto N-collegata della glicosilazione siti presenti nel costrutto51.
- Mediante mutagenesi sito-diretta, di protocolli standard52 o sovrapponendo PCR53, mutare ogni sito previsto N-collegata della glicosilazione (Asn a Gln e/o Asn a Ala) per creare costrutti di CD22 ECD che contengono uno o più N-collegata della glicosilazione mutazioni.
- Dopo la verifica di sequenza di costrutti clonati, trasformare in competente Escherichia coli cellule DH5α54 e maxi-prep il DNA (come da istruzioni del produttore) per preparare per la transfezione.
2. HEK293F e HEK293S delle cellule istituzione
Nota: Tutte le manipolazione delle cellule HEK293F o HEK293S con i reagenti necessari e attrezzatura deve essere eseguita in una struttura di livello 2 di biosicurezza in un'adatto di biosicurezza. La superficie esterna di tutti gli elementi dovrà essere sterilizzata con una soluzione di etanolo 70% o reagente equivalente.
- HEK293F e HEK293S cellule in sospensione (Vedi Tabella materiali) di ottenere e conservare a-80 ° C fino a che pronto per l'uso.
- Caldo media (Vedi Tabella materiali) per 1 h a bagnomaria a 37 ° C. Trasferire 24 mL di supporti riscaldati in un matraccio di cultura cellulare sconcertato 125 mL con un tappo di sfiato.
- Ottenere cella 1ml aliquota da-80 ° C e trasferimento al ghiaccio.
- Incubare le cellule in bagnomaria a 37 ° C per circa 1 min, per scongelare parzialmente le cellule. Trasferire 1 mL di cellule dalla fiala nel matraccio di cultura cellulare sconcertato 125 mL contenente il supporto.
- Chiudere il matraccio di cultura delle cellule con il tappo di sfiato e immergere la muffola in uno shaker impostato a 37 ° C, 130 giri/min, umidità del 70% e 8% CO2.
3. HEK293 Mantenimento delle cellule
Nota: Densità cellulare e attuabilità delle cellule deve essere controllato circa 24 h dopo lo scongelamento. Questo passaggio garantisce che le cellule sono in ripresa a seguito di inoculazione; vitalità iniziale dovrebbe essere > 80%.
- Con attenzione rimuovere 10 µ l di cellule dalla beuta 125 mL contenente le cellule in sospensione fresca e trasferirlo in una microprovette sterili da 1,5 mL. Chiudere la beuta e restituirlo nell'incubatore.
- Pipettare 10 µ l di soluzione di blu di Trypan nella microprovetta 1,5 mL contenente le celle, mescolare accuratamente e trasferire 10 µ l all'alloggiamento di conteggio diapositiva.
- Mettere il vetrino di conteggio in un contatore di cellule automatico e ottenere i valori di densità delle cellule (in unità di cellule mL-1) e attuabilità delle cellule (in percentuale).
- Calcolare il volume delle cellule che sarebbe richiesto per inoculare una cultura fresca 200 mL ad una densità finale di ~0.8 x 106 cellule mL-1 utilizzando le seguenti equazioni:
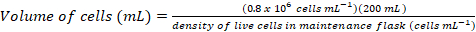 (1)
(1)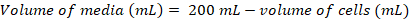 (2)
(2)
Nota: Potrebbe richiedere ~ 5D per ottenere una densità cellulare adeguata per inoculazione in una cultura di 200 mL. - Una volta che la densità cellulare è sufficiente per l'inoculazione di una cultura di 200 mL, warm-up media per 1 h a 37 ° C bagno d'acqua e trasferisce i supporti riscaldati nella cappa di biosicurezza.
- Utilizzando una pipetta sierologica, trasferire con cautela il volume richiesto di media (come calcolato nell'equazione 2) in un matraccio di cultura cellulare sconcertato 500 mL con un tappo di sfiato.
- Utilizzando una pipetta sierologica, trasferire il volume richiesto di cellule in sospensione (calcolato in equazione 1) nel matraccio di cultura cellulare sconcertato 500 mL contenente il supporto.
- Il nuovo 200 mL di brodo di manutenzione di Cap e restituirlo nell'incubatore. Crescere le cellule ad una densità di circa 3 x 106 cellule mL-1. Passaggio le cellule ad una densità di 0,8 x 106 cellule mL-1 ogni 2-3 d per mantenere una stabile cultura delle cellule (come descritto nella sezione 3.4-3.7). Non permettono alle cellule di superare una densità di ~ 4 x 106 cellule mL-1.
4. la transfezione di cellule HEK293 per espressione della glicoproteina
- Calcolare il volume delle cellule e media che è richiesto per una cultura di 200 mL per la transfezione a 0,8 x 106 celle mL-1 (utilizzando equazioni 1 e 2 sezione 3.4).
Nota: Il numero di transfezioni 200 mL che può essere eseguita dipende dalla densità cellulare dello stock di manutenzione. - Trasferire il volume richiesto di media e celle per la transfezione in un matraccio da nuova cultura cellulare di 500 mL con un tappo di sfiato e restituire il cellula stock nell'incubatore.
- Incubare le cellule per 1 h prima di transfezione per consentire alle cellule di acclimatare seguendo spaccare.
- Trasferire 50 µ g di DNA in una provetta conica sterile 50 mL e diluire con 5 mL di media. Aspirapolvere filtro DNA diluito utilizzando un sistema di filtrazione da 0,22 µm in un'altra provetta sterile.
- Mix diluito, filtrato del DNA in rapporto 1:1 in massa: volume con reagente di transfezione. Agitare delicatamente la soluzione di reagente di transfezione del DNA: per miscelare e incubare la soluzione a temperatura ambiente per 10 min.
- Aggiungere la soluzione di reagente di transfezione del DNA: direttamente alle cellule. Incubare le cellule trasfettate a 37 ° C, 130 rpm, 70% di umidità e 8% CO2 in uno shaker per 5-7 gg.
5. ottimizzazione delle condizioni di transfezione delle cellule
Nota: Per ottimizzare le condizioni di transfezione delle cellule per rendimento massimo della glicoproteina, transfect cellule in una varietà di densità iniziale delle cellule e valutare il rendimento di proteina nel corso del tempo (Figura 3A). Transfect cellule come descritto nella sezione 4, a densità iniziale delle cellule che vanno da 0,5 x 106 a 2 x 106 cellule mL-1 55. Prova transfezioni possono essere scalate verso il basso il volume totale 25 mL (nel matraccio di cultura cellulare sconcertato 125ml) con 6 µ g di DNA per risparmiare spazio e reagenti. La quantità di DNA può anche essere ottimizzato55.
- La post-transfezione ogni giorno (giorni 1-7), trasferire un'aliquota di 500 µ l dalla coltura delle cellule in una microprovette sterili da 1,5 mL (nel governo di biosicurezza).
- Spin aliquotate cellule a 12.000 x g per 5 min in una microcentrifuga immediatamente dopo la raccolta. Trasferire il surnatante in una nuova microprovetta 1,5 mL e conservare a 4 ° C fino a quando tutti i campioni sono ottenuti.
- Quantitate glicoproteina secernuta da densitometria
- Una volta ottenuti tutti i campioni, aliquota 20 µ l di ciascun campione in una nuova microprovetta 1,5 mL e mescolare con 6 µ l di tampone non riducenti 4 x Laemmli.
- Bollire i campioni per 5 min a 95 ° C in un blocco di thermo. Girare i campioni per 1 min a 12.000 x g in una microcentrifuga.
- Carico 20 µ l di ogni campione per pozzetto in un gel di SDS-PAGE 10-Pozzo 4-15% pendenza. Includere una corsia per gli indicatori di dimensione di proteina. Esegua il gel a 250 V per 20 min in un buffer di Tris/glicina/SDS.
- A seguito di completamento esecuzione, trasferire gel Coomassie macchia (Vedi Tabella materiali) per 20 min. de-macchia gel in ddH2O per 20 min. immagine gel.
- Eseguire densitometria con ImageJ, seguendo protocolli standard57,58.
- Compilare e stampare dati con post-' 'transfezione giorni sull'asse x e 'densitometria valori' sull'asse y (Figura 3A).
Nota: In alternativa, se l'espressione della proteina è insufficiente per la visualizzazione da SDS-PAGE, tecniche come macchiarsi occidentale possono essere usato56.
- Quantitate glicoproteina secernuta da BLI
- Utilizzo di biosensori Ni-NTA, quantificare l'importo della glicoproteina secernuta utilizzando BLI59.
- Compilare e stampare dati con post-' 'transfezione giorni sull'asse x e 'concentrazione (µ g/mL) nella proteina' sull'asse y (Figura 3A).
6. purificazione della glicoproteina solubile da HEK293 surnatante
- Raccogliere le cellule mediante centrifugazione a 6.371 x g per 20 min a 4 ° C. Conservare il supernatante contenente secernuto CD22 ECD e filtrare usando un filtro da 0,22 µm.
- Caricare il supernatante a 4 mL min-1 su un pre-equilibrato colonna di Ni-NTA (20 mM Tris-HCl pH 9.0, 150 mM NaCl, imidazolo 5mm) (volume di 5 mL) utilizzando un sistema di cromatografia di benchtop.
Nota: Altre tecniche di purificazione di affinità possono essere utilizzati, sulla base dei tag di affinità inclusi nel costrutto design nella sezione 1. - Dopo caricamento surnatante, lavare la colonna di affinità con volumi di colonna 3-4 (CV) del tampone di lavaggio (20 mM Tris-HCl pH 9.0, 150 mM NaCl, imidazolo 5 mM).
- Eluire glicoproteina purificata dalla colonna utilizzando un gradiente 4-100% (4 CVs) di tampone di eluizione (20 mM Tris-HCl pH 9.0, 150 mM NaCl, imidazolo 500 mM) mentre la raccolta frazioni (Figura 3B).
- Frazioni di piscina contenente il picco eluito in un dispositivo di filtraggio centrifugo con un 10 kDa peso molecolare nominale limite (NMWL) e concentrato mediante centrifugazione a 4.000 x g a 4 ° C per 15 minuti o fino a quando il campione raggiunge un volume di 500 µ l.
- Iniettare glicoproteina concentrata in una 500 µ l del campione loop e carico a 0,5 mL min-1 su un pre-equilibrato (20 mM Tris, pH 9.0, 150 mM NaCl) colonna di esclusione di dimensione ad alte prestazioni (circa 24 mL di volume) su una cromatografia liquida della proteina veloce (FPLC) sistema a 4 ° C, mentre la raccolta frazioni (Figura 3C).
- Eseguire gel di SDS-PAGE delle frazioni eluite per identificare le frazioni contenenti la glicoproteina e frazioni corrispondenti della piscina. Il gel di SDS-PAGE può essere eseguito come descritto nella sezione 560.
7. Deglycosylation della glicoproteina purificata
- Misurare la concentrazione di proteina purificata seguendo la cromatografia di esclusione di formato utilizzando assorbanza a 280 nm diviso per il coefficiente di estinzione (ad es., 1,418 M-1 cm-1 per CD22 ECD).
Nota: Il coefficiente di estinzione teorica di proteine di interesse può essere calcolato utilizzando server ad esempio ExPASy ProtParam61. - Incubare la proteina purificata con Endo H per 1h a 37 ° C, con un rapporto di 1 mg di proteina purificata a 10 µ l di enzima commerciale in 1 tampone X Endo H (come da istruzioni del produttore).
Nota: H Endo fende glicani alta mannosio prodotta in HEK293S lasciando una singola frazione di GlcNAc presso ogni sito di glicosilazione21. Endo H non fendere glicani su proteine prodotte in HEK293F cellule22, tuttavia altri enzimi possono essere utilizzati per questo scopo (ad es.,PNGaseF24). - Deglicosilata ECD a 500 µ l di concentrato ed eseguire cromatografia di gel filtrazione su una colonna di esclusione di dimensioni ad alte prestazioni (circa 24 mL di volume) a 0,5 mL min-1 su un FPLC per rimuovere Endo H e separare qualsiasi aggregazione risultante.
- Memorizzare le proteine deglicosilate a 4 ° C fino all'utilizzo negli esperimenti a valle.
8. la cristallizzazione delle glicoproteine
Nota: Eseguire prove di cristallizzazione utilizzando schermate commercialmente disponibili e impostare seduta goccia esperimenti usando un robot di cristallizzazione.
- Concentrato puro, deglicosilata ECD a mg 10 mL-1 utilizza un dispositivo di filtraggio centrifugo con 10 kDa NMWL a 4.000 x g (4 ° C) fino ad ottenuta la concentrazione desiderata.
- Determinare la concentrazione di proteina tramite assorbanza a 280 nm e dividendo per il coefficiente di estinzione.
- Campione di centrifuga a 12.000 x g per 5 min a 4 ° C prima delle prove di cristallizzazione per rimuovere polvere indesiderati o altri contaminanti da campione.
- Riempire il serbatoio pozzi di 96 pozzetti seduta drop piastre di cristallizzazione con 80 µ l di soluzione di cristallizzazione da uno schermo di cristallizzazione delle imprese.
Nota: Usiamo matrice sparsa commerciali schermi che sono stati progettati sulla base delle condizioni di cristallizzazione maggior successo rispetto alle strutture depositati nel PPB. - Usando un robot di cristallizzazione, dispensare gocce nel pozzo della piastra cristallizzazione con un volume totale di goccia di 200 nL con un rapporto di soluzione di proteina purificata: cristallizzazione di 1:1.
- Una volta che è stata erogata l'intera piastra, sigillare la piastra con nastro e posto in un imager piastra per ispezione di luce visibile e ultravioletta.
- Ispezionare piastre di cristallizzazione immediatamente dopo l'installazione e nelle settimane successive, utilizzando la luce ultravioletta e visibile per identificare condizioni che dare colpi di cristallo della glicoproteina iniziale.
- Ottimizzare ulteriormente i cristalli ottenuti dai colpi di cristallizzazione iniziale utilizzando schermi fine sulla base della condizione del successo di cristallo o matrici random micro-semina metodi62,63,64,65.
- Cryo-proteggere eventuali cristalli mancano sufficienti cryo-protectant nella condizione di cristallizzazione impregnando il cristallo in madre liquore soluzione integrata con soluzione 20% (v/v) glicerolo (o equivalente cryo-protectant, come il glicol etilenico o glicole polietilenico 400).
- Cristalli di Monte in cryoloops e flash congelarli in azoto liquido, prima della raccolta di dati su un diffrattometro di origine domestica o utilizzando la radiazione di sincrotrone.
9. graduale mediante derivatizzazione di atomi pesanti
Nota: Prima di qualsiasi manipolazione di composti HA, gli aspetti di sicurezza devono essere considerati. HA composti utilizzati in cristallografia di proteine sono selezionati per la loro forte affinità per le molecole biologiche e pongono rischi per la salute umana da una prolungata esposizione. Adottare misure di sicurezza appropriate per composti HA come indicato nelle loro schede di sicurezza materiale.
- Per testare diversi ettari composti, concentrazioni e tempi di incubazione, riproducono ben generano cristalli ottenuti in sezione 8 in una piastra di cristallizzazione 24 pozzetti utilizzando il vapore appendere-goccia diffusione metodo66.
- Decidere quale HA sarà utilizzato per la derivatizzazione di cristallo. Server (ad esempio, l'atomo di pesante sistema di Database67) sarà lieto di assistervi HA composto selezione, garantendo che siano appropriate per la condizione di proteina e cristallizzazione.
Nota: HA schermi sono anche disponibili in commercio per facile screening di composti HA più efficaci per l'eliminazione. Un insieme di "magia sette" HA composti precedentemente sono stati descritti per avere alta probabilità di successo per HA derivatizzazione68. - Allestire la postazione di lavoro per HA ammollo (Figura 4A). Utilizzando un cryoloop, trasferire rapidamente i cristalli a una 0.2 µ l drop su un vetrino coprioggetto 22 mm contenente soluzione HA diluito nella condizione di cristallizzazione in modo tale che la concentrazione finale di HA varia da 1-20 mM. La goccia ed incubare per diverse lunghezze di tempo (Figura 4B). Un buon punto di partenza è di 5, 10, 60 e 90 min e pernottamento.
- Ispezionare visivamente i cristalli con un microscopio ottico per identificare eventuali crepe o cambiamenti di colore, che può indicare gli effetti negativi per la glicoproteina cristallo o la derivatizzazione di cristallo.
- Montare i cristalli in cryoloops e retro-ammollo cristalli per 30 s in tre consecutivi 0.2 µ l gocce contenente soluzione di liquore madre completati con 20% (v/v) glicerolo (o alternativo cryo-protectant)69. Retro-ammollo i cristalli rimuove HA composto che è stato associato non specifico e riduce l'occupazione parziale causata da debole HA associazione. Flash cristalli di congelamento in azoto liquido (Figura 4B).
- Per la raccolta dati, elaborazione, soluzione strutturale e raffinatezza, utilizzare protocolli precedentemente descritti26,70,71,72.
10. ammollo cristalli glicoproteina con il suo ligando
- Riprodurre ben generano cristalli ottenuti in sezione 8 in una piastra di cristallizzazione 24 pozzetti utilizzando il metodo di diffusione del vapore appendere-goccia.
- Preparare una soluzione stock di ligando di 50 mM a 20 mM Tris, pH 9.0, 150 mM NaCl.
Nota: La concentrazione del ligando dovrebbe essere preparata secondo l'affinità alla sua glicoproteina. Se l'affinità è sconosciuto, si potrebbe essere necessario utilizzare un metodo come ITC (sezione 12.2) per determinare l'affinità prima inizio ammollo esperimenti. Assicurarsi che il ligando è solubile alla concentrazione desiderata nel buffer richiesto. - Aggiungere diverse concentrazioni del ligando al goccia contenenti cristalli ECD e sigillare la goccia per incubazione a lunghezze di tempo che varia tra 5 min per 5D.
- Tracciare graficamente cristalli con un microscopio ottico per identificare i possibili cambiamenti nella morfologia.
- Montare i cristalli in cryoloops e cryo-proteggerli in soluzione di liquore madre completati con 20% (v/v) glicerolo (o altri cryo-protectant quali glicol etilenico o basso peso molecolare polietilene glicole 400)69.
- Per raccolta dati, elaborazione, soluzione strutturale e raffinatezza, utilizzare protocolli precedentemente descritti73,74,75.
11. produzione di Fragment Antigen Binding (Fab)
- Subclone geni che corrispondono a sequenze di catena leggera (LC) di anticorpi anti-ECD, ad es.,epratuzumab e Fab catena pesante (HC).
Nota: In alternativa, IgG può essere clivata dalla Papaina enzima per generare frammenti Fab76. - Transfect cellule come descritto nella sezione 4, con le seguenti modifiche:
- Utilizzare una massa totale di DNA per la transfezione di frammenti Fab di 90 µ g / mL 200 della cultura.
- Transfect plasmidi HC e LC in un rapporto di 2:1 per ridurre la quantità di formazione dimerica LC.
- Dopo 7 giorni di incubazione, raccogliere le cellule, conservare il surnatante e filtrare con un dispositivo di filtrazione sottovuoto-guidato da 0,22 µm.
- Equilibrare le colonne di affinità (kappa o lambda) di anti-LC in tampone PBS utilizzando un sistema di cromatografia di benchtop.
Nota: Se formazione dimerica LC è un problema durante la purificazione, cromatografia di affinità della proteina G può essere utilizzata come alternativa alla purificazione di affinità LC kappa/lambda. - Caricare il surnatante su colonna di affinità alle 4 mL min-1. A seguito di caricamento del campione, lavare la colonna con 3-4 CVs di PBS.
- Eluire la proteina da colonna utilizzando un'eluizione isocratica con glicina di 100 mM, pH 2.2, neutralizzare immediatamente le frazioni eluite con 10% (v/v) 1 M Tris, pH 9.0 in ogni frazione.
Nota: Il Fab eluito può essere ulteriormente purificato per cromatografia a scambio ionico e/o cromatografia di esclusione di dimensione utilizzando un FPLC a 4 ° C.
12. caratterizzazione della favolosa e piccola molecola vincolanti per la glicoproteina
- Biolayer interferometria
- Preparare 50 mL di tampone di cinetica (1x PBS, 0,002% (v/v) di Tween-20, 0,01% (p/v) BSA) 1x.
- Idrato sei biosensori Ni-NTA a 200 µ l di tampone cinetica 1x per 10 min in un piatto pre-bagnatura.
- Diluire la sua etichetta ECD in 1 mL di tampone di cinetica di 1x ad una concentrazione finale di 25 ng µ l-1. Pipettare diluizioni seriali del Fab purificati in 200 µ l di tampone di cinetica, 1x con un'alta concentrazione di 500 nM e successive diluizioni seriali di 250 nM, 125 nM e 62,5 nM.
- Aliquotare reagenti in micropiastra a 96 pozzetti in polipropilene nero fondo piatto come mostrato in Figura 5A, dove ciascun pozzetto contiene 200 µ l della soluzione indicata.
- Raccogliere i dati utilizzando le analisi cinetica del software di acquisizione dati, come descritto in precedenza38,39,77 (Figura 5A).
- Brevemente, trasferire i biosensori in pozzetti contenenti 1x buffer di cinetica alla linea di base per 60 s prima di caricare 25 ng µ l-1 della glicoproteina per 240 s (o fino a una soglia di 1.0 nm viene raggiunto) a 1.000 giri/min.
- Dopo una seconda linea di base di 60 s in 1x buffer di cinetica, trasferire i biosensori in pozzetti contenenti la diluizione seriale di Fab. La fase di associazione s 180 successivamente è seguita da una fase di dissociazione di s 180 in 1x buffer di cinetica.
Nota: Biosensori possono essere riutilizzati se il protocollo di cui sopra è seguito da una fase di rigenerazione, che consiste di tre cicli di lavaggio i biosensori in stripping buffer (PBS con imidazolo 500 mM) per 5 s seguita da 5 s in 1x buffer cinetica per neutralizzazione. Biosensori possono essere riutilizzati fino a ~ 10-20 volte durante il giorno stesso o fino a dati di scarso qualità è osservato.
- Analizzare i dati utilizzando il software di analisi (Figura 5A):
- Sotto la scheda 1, l'importazione e selezionare i dati.
- Nella scheda 2, passaggio 1: Selezione dei dati, selezionare 'selezione sensore' e punto culminante riferimento wells (righe E e F, Figura 5A), fare clic destro e impostata per fare riferimento a ben. In passaggio 2: Sottrazione, selezionare 'pozzi di riferimento'. In passaggio 3: Allineare l'asse y, selezionare 'Baseline' dall'intervallo di tempo di 0,1 a 59,8 s. In passaggio 4: Correzione del Inter-passaggio, selezionare 'Allinea alla dissociazione'. In passaggio 5: Processo, selezionare 'Savitzky Golay filtering' e stampa dei dati di processo.
- In Tab 3, selezionare 'Associazione e dissociazione' Step to Analyze con un modello 1:1. Selezionare 'Raccordo globale' e 'Gruppo di colore'. Fare clic destro curve, selezionare 'Cambia colore', impostare tutte le curve al colore della vostra scelta. Selezionare 'Fit Curve'. Se i dati sono ben attrezzati, un report può essere esportato selezionando 'Salva Report'.
- Ripetere l'esperimento con glicoproteina prodotta in cellule di HEK293F e HEK293S (sezione 5) e dopo il trattamento Endo H (sezione 7) per valutare l'effetto, se del caso, delle diverse glicoforme sul riconoscimento Fab. Inoltre, di ripetere l'esperimento con troncamenti ECD per fornire la comprensione nei domini vincolato il Fab.
- Calorimetria isotermica di titolazione di interazione Fab-glicoproteina
Nota: Esperimenti ITC qui descritti vengono eseguiti utilizzando uno strumento automatizzato di ITC. Gli esperimenti sono effettuati in un mL 1 blocco inferiore 96 pozzetti.- Dializzare l'ECD e Fab in un becher da 4 L unico di 20 mM Tris, pH 8.0, 150 mM NaCl a 4 ° C durante la notte con un'ancoretta.
- Concentrare i dializzati ECD e Fab 5 µM e 50 µM, rispettivamente, con un filtro centrifugo con 10 kDa NMWL, garantendo per lavare le membrane di concentratore tre volte con 5 mL di dialisi buffer a 4.000 x g per 5 min a 4 ° C prima dell'uso.
Nota: Eventuali disallineamenti nel buffer tra i campioni in cella e siringa possono causare calore indesiderato essere rilasciato durante l'esperimento di ITC e risultato nei dati di scarsa qualità. - Per esperimento 1: aggiungere 400 µ l di ECD a A1 da caricare nella cella e 120 µ l della Fab a pozzetto A2 deve essere caricato nella siringa. Beh A3 viene lasciata vuota per restituire il seguente campione miscelato sperimentare completamento. Ogni successivo esperimento possa essere aggiunti alla piastra nello stesso ordine (cioè, esperimento 2: pozzo vuoto di cella - A4, siringa - A5 - A6; Figura 5 B).
Nota: Includono buffer nei controlli di buffer (per confermare lo strumento si sta comportando bene) all'inizio e alla fine di ogni esecuzione, come pure il ligando (in siringa) nei controlli di buffer (nella cella) per calcolare il calore di diluizione per il campione nella siringa. Questo calcolato il calore di diluizione dovrebbe poi essere sottratti dai dati sperimentali grezzi durante l'analisi dei dati (Figura 5B). - Eseguire un totale di 16 iniezioni con un volume di 2,5 µ l per ogni iniezione. La durata dell'iniezione è di 5 s, con spaziatura di s 180 tra le iniezioni. Impostare la temperatura della cella 25 ° C, con una velocità dell'agitatore di 750 giri/min e un periodo di filtro di 5 s.
Nota: Basata sull'affinità e termodinamica dell'interazione ECD:Fab, può essere necessario cambiare la concentrazione del campione, numero di iniezioni o temperatura cella. - Analizzare i dati con il software di analisi, come descritto in precedenza40,41,43 (Figura 5B).
- Ripetere l'esperimento almeno in duplicati, calcolo media valori KD e gli errori standard. Ripetere esperimento con ECD di differenti glicoforme (sezioni 5 e 6) per valutare l'effetto, se del caso, di glicoforme sulla termodinamica dell'interazione Fab: glicoproteina.
- Per calorimetria isotermica di titolazione delle interazioni ligando-glicoproteina, impostare l'esperimento ITC come descritto in sezione 12.2, con le seguenti modifiche:
- Dializzare ECD in 4 L di tampone di dialisi durante la notte. Sciogliere il ligando utilizzando buffer di dialisi dopo il completamento di dialisi.
- Esperimenti di ITC alle concentrazioni significativamente più alte di essere in grado di rilevare interazioni bassa affinità. Per l'interazione di ECD e ligando, eseguire esperimenti ITC alle concentrazioni di 100 µM di ECD nella cella e 1 mM di ligand nella siringa.
Risultati
Diversi costrutti di CD22 ECD sono stati con successo clonati nel vettore di espressione pHLsec e overexpressed in mammiferi linee di cellulari HEK293F e HEK293S (Figura 2 e 3A). Tutti i costrutti sono stati purificati per omogeneità di dimensioni di cromatografia di esclusione di formato e ha reso un campione altamente puro per gli studi di cristallizzazione (Figura 3B e 3C). Il costrutto di CD22 che ha portato a ben generano cristalli era il troncamento d1-d3 (residui 20-330), con cinque dei sei siti previsti N-collegata della glicosilazione mutati da Asn a Ala (N67A, N112A, N135A, N164A e N231A), prodotta nelle cellule HEK293S, tali che solo il sito di glicosilazione posizione N101 è stato mantenuto (questo costrutto è denominato CD2220-330, 5A). Cristalli sono stati ottenuti in diverse condizioni dello schermo matrice sparsa MCSG-1, ma i migliori cristalli erano da una condizione contenente 30% (p/v) di polietilenglicole 4000, 0,2 M di cloruro di litio e 0,1 M Tris, pH 8.5. Questi cristalli nativi diffratte 2.1 risoluzione Å; utilizzando strutture conosciute di domini Ig delle proteine relative Siglec non ha dato alcun soluzioni nelle ricerche di MR.
Per acquisire informazioni phasing, ci siamo immersi cristalli nativi con un pannello di composti HA incluso Hg, Pt, Os, Ta e Br alle concentrazioni che variano da 1 a 20 mM di HA composto per un periodo di incubazione da 5 min di 1 d (Figura 4). Abbiamo monitorato i cristalli per i cambiamenti nella morfologia e abbiamo trovato che cristalli imbevuto con composto a 20mm HA provocato la fessurazione rapida e la dissoluzione del cristallo. Abbiamo congelato un totale di 63 cristalli che conservava la loro forma seguendo i tempi di incubazione indicati che sono stati impregnati con cluster di tantalio bromuro, cloruro di platino, acetato mercurico e cloruro mercurico. Cristalli imbevuto con 7 mM di cloruro mercurico per 30 min ha mostrato il segnale anomalo su un'esplorazione di fluorescenza presso la sorgente di luce canadese (CLS) 08-BM beamline (Saskatoon, Canada) e ammessi per dispersione anomala di multi-lunghezza d'onda raggi x raccolta dati su un singolo cristallo. Questi set di dati ha permesso di risolvere la sottostruttura di mercurio di CD2220-330, 5A, che ha rivelato un atomo di mercurio singolo associato a una cisteina libera alla posizione C308 e in ultima analisi ci ha permesso di costruire la struttura del CD225A 20-330, nella graduale Mappa di densità dell'elettrone utilizzando AutoBuild78.
Una volta che la struttura unliganded è stato risolto, eravamo interessati a risolvere la struttura del CD22 associato a suo ligando, α2-6 siallylactose. In primo luogo abbiamo calcolato l'affinità del CD22 verso α2-6 sialyllactose usando ITC per caratterizzare la termodinamica di associazione dell'interazione. Abbiamo osservato un'affinità di ~ 280 µM e utilizzato queste informazioni per identificare una concentrazione iniziale (~ 100 x KD) del ligando da utilizzare per l'ammollo dei nostri cristalli di20-330, 5A CD22 nativi. Abbiamo imbevuto i CD2220-330, 5A cristalli con 25 mM siallylactose per 5 min, 2 h, 14 h, 40h e 5D e monitorato per i cambiamenti nella morfologia di cristallo. Un totale di ~ 75 cristalli furono congelati da vari momenti e CLS sincrotrone beamline 08-ID (Saskatoon, Canada) per la raccolta dei dati remota. Un totale di sei raggi x DataSet sono stati raccolti da cristalli ben diffrangano. La struttura di ogni set di dati di raggi x è stato risolto da MR utilizzando il legame CD2220-330, 5A struttura come un modello di ricerca iniziale. La densità risultante dell'elettrone per tutti i DataSet è stato poi ispezionata per densità positiva nella mappa Fo-Fc che corrisponderebbe per associato α2-6 sialyllactose all'interno del sito di associazione di CD22. Notevolmente, tutti i set di dati raccolti, anche quelli da cristalli imbevuti dopo soli 5 minuti del tempo di incubazione, contenuta densità positiva corrispondente ligando nel sito di legame. Strutture complessive del legame e CD22 liganded erano altamente simili con minimi cambiamenti conformazionali, che potrebbero spiegare il successo degli esperimenti a immersione totale con α2-6 sialyllactose.
Successivamente abbiamo caratterizzato la superficie antigenica del CD22 riconosciuto da anticorpo terapeutico epratuzumab in esperimenti BLI e ITC (Figura 5). Cinetica e termodinamica profili di epratuzumab associazione Fab per CD22 costrutti con differenti glicoforme ha rivelato un'affinità crescente per CD22 con dimensione ridotta glycan N-collegati, con fino a un 14-fold miglioramento nell'affinità per piccoli glicani (327 nM vs 24 nM in BLI; 188 nM nM di vs 58 in ITC). Il CD22 N-collegati glycan che limitano l'accesso dell'anticorpo a suo epitopo è stato identificato da BLI usando mutanti di singolo punto di CD22 e risolvendo l'epratuzumab Fab-CD22 d1-d3 co-cristallo struttura28.
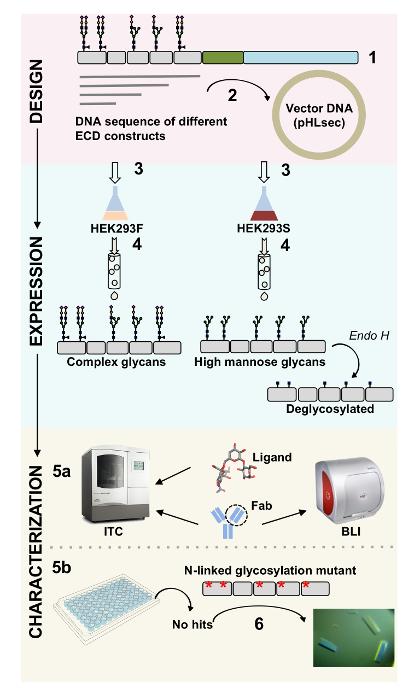
Figura 1 . Panoramica di caratterizzazione della glicoproteina dal costrutto design alla caratterizzazione strutturale e biofisiche. (1) analisi di sequenza primario della glicoproteina rappresentativa. In grigio, il dominio extracellulare (ECD); in verde, il segmento transmembrana (TM); e in blu, il dominio citosolico della glicoproteina. Predetto glycans N-collegati sono etichettati. (2) clonazione dei costrutti di ECD. (3) espressione di costrutti di ECD in cellule di mammifero. (4) purificazione della glicoproteina. Mentre proteine espresse in HEK293F conterrà glicani complessi, proteine espresse in HEK293S avrà alta mannosio glicani. Trattamento enzimatico delle glicoproteine prodotte nelle cellule HEK293S con Endo H risultati in glicoproteine con solo una frazione di GlcNAc presso siti di glicosilazione N-collegati. (5a) glicoproteine sono testati per il loro legame degli anticorpi da interferometria biolayer (BLI) e calorimetria isotermica di titolazione (ITC). Affinità per i ligandi del piccoli può anche essere misurata da ITC. (5b) prove di cristallizzazione delle glicoproteine con omogeneo glycans N-collegati, come quelli espressi in HEK293S e deglicosilata con Endo H. (6) In alcuni casi, la mutazione di N-collegata della glicosilazione siti è necessario ottenere cristalli. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 . Progettazione di CD22 ectodomain DNA costruisce per l'espressione in cellule di mammifero. A) rappresentazione del plasmide pHLsec utilizzato per trasfezione transiente di costrutti CD22 ECD. AgeI e KpnI siti utilizzati per la clonazione sono indicati con caselle rosse. B) The CD22 ECD contiene sette domini Ig (d1-d7) e 12 previsto N-collegata della glicosilazione siti (in blu). Quattro costrutti sono stati progettati da DCE CD22. C) gel di agarosio 1% risultati amplificati PCR di ECD CD22 costruisce per clonazione nel vettore di espressione di pHLsec. Prima corsia contiene 1 kb DNA marker. Clicca qui per visualizzare una versione più grande di questa figura.
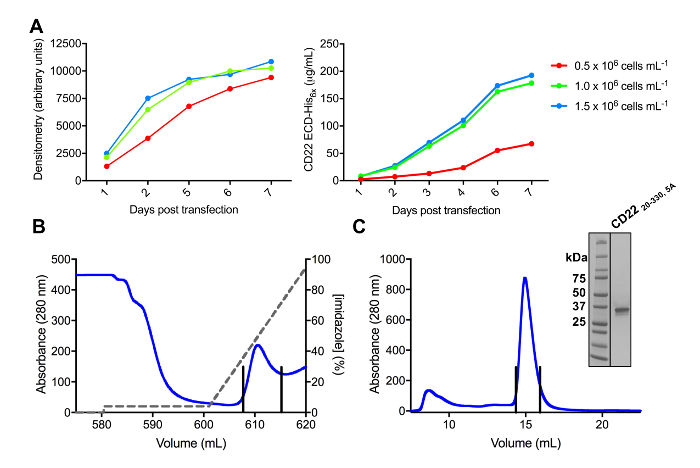
Figura 3 . Espressione e purificazione delle glicoproteine. A) effetto della densità delle cellule sui rendimenti di espressione. Espressione della glicoproteina in cultura su piccola scala 25 mL di HEK293F sospensione cellule trasfettate utilizzando tre differenti densità iniziale delle cellule (0,5 x 106 cellule mL-1, 1,0 x 106 cellule mL-1e 1,5 x 106 cellule mL -1). Quantificazione effettuata da densitometria da SDS-PAGE nel pannello di sinistra e di BLI quantitativa nel pannello di destra. Valori sono rappresentativi di una preparazione di glicoproteina. B) cromatogramma del primo passaggio di purificazione per costruire CD2220-330, 5A da 600 mL di surnatante utilizzando una colonna di affinità Ni-NTA. La glicoproteina è stata eluita utilizzando un gradiente di imidazolo (linea grigia), dove 100% corrisponde al buffer di eluizione, che contiene imidazolo di 500 mM. Frazioni raccolte vengono rappresentate con linee verticali. C) cromatogramma di esclusione dimensionale per costruire CD2220-330, 5A utilizza un alto rendimento del gel colonna di filtrazione. Frazioni raccolte dal picco di eluizione sono rappresentate con linee verticali. Inserto: Macchiato di Coomassie SDS-PAGE gel mostrando la purezza della glicoproteina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 . Cristallo con atomi pesanti ammollo. A) workstation campione per ammollo cristalli nativi con composti HA. Tutti i necessari strumenti sono etichettati. B) i passi seguiti ammollo cristalli di costruire CD2220-330, 5A con composti HA. Passaggio 1, aprire bene contenente cristalli e cristalli di trasferimento utilizzando un ciclo ad un calo di 0.2 µ l su un vetrino coprioggetto contenente soluzione HA diluito nella condizione di cristallizzazione in modo tale che la concentrazione finale di HA varia da 1-10 mM. Passaggio 2, la goccia nella piastra di cristallizzazione ed incubare cristalli con l'HA composto per diversi periodi di tempo. Passaggio 3, montare il cristallo imbevuto nel ciclo e retro in ammollo per 30 s in tre consecutivi 0,2 µ l gocce contenente la soluzione di liquore madre completata con 20% (v/v) glicerolo erogata su un vetrino coprioggetto. Passaggio 4, flash congelare il cristallo montato su un ciclo con azoto liquido e posizionarlo in un disco di gomma per la spedizione per la linea di luce di sincrotrone. Clicca qui per visualizzare una versione più grande di questa figura.
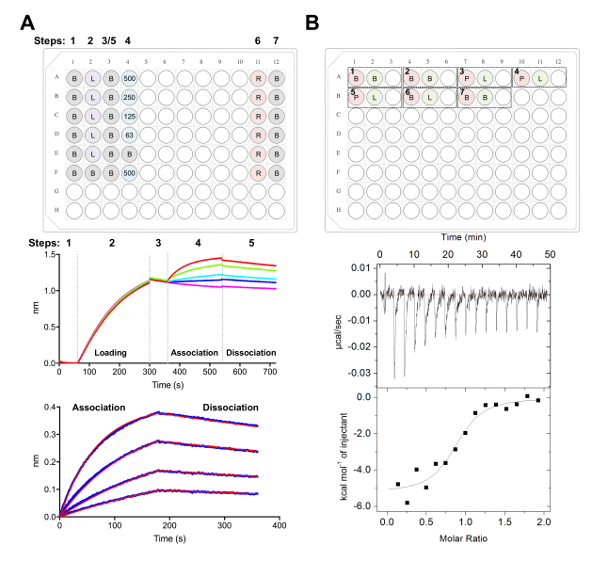
Figura 5 . Biolayer interferometria e isotermici misure di calorimetria titolazione. A) esperimento rappresentante BLI. Pannello superiore: esempio di piastra di supporto per un esperimento di cinetica, dove vengono etichettati i seguenti: 1 cinetica x buffer (B), sua6x-tagged glicoproteina caricamento (L), rappresentante Fab concentrazioni (500, 250, 125, 62.5 nM), PBS + 500 mM rigenerazione buffer (R) e neutralizzazione di cinetica: 1x tampone (B). Ciascun pozzetto contiene 200 µ l di soluzione. Numero di step per l'esperimento di cinetica è indicato nella parte superiore della piastra. Pannello centrale: Dati grezzi rappresentativi di BLI esperimento eseguito utilizzando biosensori Ni-NTA e la piastra descritto nel pannello superiore. Passo numeri corrispondono alla linea di base (1), sua glicoproteina6 x caricamento (2), della linea di base (3), associazione in diluizione seriale di Fab (4) e dissociazione (5). Procedura di rigenerazione non è rappresentati (passaggi 6 e 7). Pannello di fondo: Dati analizzati rappresentativi risultati grezzi associazione e dissociazione (linea blu) con il corrispondente 1:1 in forma (linea rossa). B) Pannello superiore: installazione piatto rappresentativo per un singolo ITC eseguito su uno strumento automatizzato di ITC con sette esperimenti in un 96 pozzetti tondo blocco inferiore. Ogni esperimento è composto da tre pozzi. Il primo pozzo (rosso) corrisponde al campione per la cella (400 µ l), il secondo pozzo (verde) corrisponde al campione per la siringa (120 µ l). Il terzo bene viene lasciato vuoto, e i campioni misti verranno restituiti a questo bene dopo il completamento di esperimento. Esperimenti di 1, 2 e 7 sono buffer nei controlli di buffer. Esperimenti di 3-5 rappresentano la triplice copia esperimenti con glicoproteina (P) nella cella e Fab o ligando (L) nella siringa. Esperimento 6 rappresenta un calore di ligando di controllo di diluizione e dovrebbe essere sottratto da esperimenti 3-5 durante l'analisi dei dati. Pannello di fondo: Rappresentanza crudo (in alto) e trasformati (in basso) ITC dati risultati Fab (epratuzumab) vincolanti per CD22 ECD prodotta nelle cellule HEK293F. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Ancorata alla membrana glicoproteine sono critici per la funzione cellulare e attraente bersagli terapeutici. Qui, presentiamo un protocollo per la caratterizzazione strutturale e biofisica di ECD di glicoproteine di membrana, sia da solo che in complesso con ligandi di piccole molecole e frammenti favolosi. Abbiamo utilizzato con successo questo protocollo per determinare la struttura di cristallo dei tre domini Ig N-terminale-la maggior parte della porzione extracellulare dell'umano CD2228, un critico co-recettore sulle cellule B coinvolti nel mantenere l'immunità umorale nel controllo79. Abbiamo anche caratterizzato il sito di legame del CD22 con suo ligando naturale α2-6 sialyllactose e definito le modalità di riconoscimento di un anticorpo terapeutico verso umano CD22. Questi risultati forniscono le comprensioni il rapporto struttura-funzione di membro chiave della famiglia Siglecs che ha limitato l'espressione sulle cellule B e una tabella di marcia molecolare verso lo sviluppo di nuovo CD22 mirati piccola molecola e base di anticorpi terapeutica. Mentre questo protocollo è stato usato con successo per un recettore delle cellule B Ig-contenente, proponiamo che il nostro approccio può essere applicato per la caratterizzazione strutturale e biofisica di qualsiasi glicoproteina di membrana con un'organizzazione di dominio distinti. In tali casi, costruire design e combinatoria glycan N-collegati mutazioni (sia a Gln o Ala) possono essere valutate per trovare un costrutto adatto per la crescita del cristallo e diffrazione ad alta risoluzione.
Ottenere un campione omogeneo e puro della glicoproteina è di importanza critica per la crescita dei cristalli e diffrazione di raggi x, così come per la caratterizzazione biofisica a valle. Glycans N-collegati presenti sulle glicoproteine sono intrinsecamente eterogenee e possono causare eterogeneità conformazionale e chimici all'interno la glicoproteina che può scoraggiare la formazione di cristalli. Per ridurre questa micro-eterogeneità, strategie che introducono mutazioni puntiformi per rimuovere residui di Asn prevedute per harbor glycans N-collegati, o utilizzando linee cellulari mutanti (ad esempio HEK293S) seguita da trattamento con punti (ad esempio EndoH) possono notevolmente migliorare la cristallizzazione successo15,21,22. In questo protocollo, discutiamo la purificazione delle glicoproteine solubili e Fabs che sono secreti nella cella surnatante. Secrezione di glicoproteina fornisce un percorso relativamente semplice verso la purezza, senza la necessità di lisi delle cellule o l'aggiunta di prodotti chimici o detergenti. La cella surnatante, ottenuta seguente cella raccolta è quindi eseguire direttamente sopra una colonna che ha affinità per la proteina di interesse (ad es., Ni-NTA per glicoproteine His-tag, o affinità di LC per frammenti Fab). Tuttavia, in base alla colonna di utilizzo e le condizioni della cella surnatante (ad es., pH), la capacità di legame della proteina di interesse per la colonna può essere influenzata. Se questo è il caso, può essere necessario concentrare e cambio la cella surnatante per migliorare l'associazione alla colonna del buffer. Inoltre, si raccomanda vivamente che passi di controllo di qualità durante la purificazione impiegata per aiutare a valutare la purezza della proteina. In esecuzione di un gel di SDS-PAGE o Western blot di tutti i campioni (prima, durante e dopo le fasi di purificazione) può produrre intuizioni che lo schema proposto purificazione sia adatto alla proteina di interesse. Se bande di contaminanti sono visibili su SDS-PAGE, o se alcune specie sono ottenuti durante la purificazione (per esempio, parecchi picchi sull'esclusione di dimensione), fasi di purificazione supplementare dovrebbe essere considerato, per esempio, cromatografia a scambio ionico, per ottenere in purezza e aumentare le probabilità di cristallizzazione a valle80.
Per cristallizzazione macromolecolare, è spesso critico per ottenere rendimenti elevati della proteina di interesse per consentire la proiezione di un gran numero di potenziali condizioni di cristallizzazione a concentrazioni ad alta percentuale proteica per trovare adatto cristallo hits. Generalmente, le linee di cellule HEK293 discusse qui (HEK293F e HEK293S) sono sistemi di espressione robusta e possono essere facilmente scalate per produrre altro campione come necessario. Tuttavia, è possibile che la proteina di interesse non può esprimere sufficientemente all'interno di queste linee cellulari. In questi casi, altre linee cellulari, quali Expi293 cellule81,82, sono stati trovati per mostrare i livelli superiori di espressione della proteina e dovrebbero essere considerati come un'alternativa.
Se ben ordinati, generano cristalli non si ottengono seguendo la sperimentazione di diversi costrutti della proteina di interesse nonostante l'elevata purezza, può essere necessario ampliare le tecniche di cristallizzazione per promuovere la formazione di cristalli. Esso ha dimostrato che frammenti Fab di anticorpi e nanobodies possono essere esaltatori di cristallizzazione eccellente e promuovere ben ordinato cristallo imballaggio83,84,85. Questi frammenti possono essere espresse e purificati ad omogeneità e utilizzati in un complesso con la proteina di interesse per favoriscono la cristallizzazione. D'importanza, frammenti Fab prodotti come descritto nella sezione 10 possono avere una tendenza a formare non funzionali LC dimeri86. Questi dimeri sono contaminanti e dovrebbero essere rimosso durante la purificazione. Nella nostra esperienza, spesso LC dimeri hanno un volume di conservazione diversi sull'esclusione di dimensione, o eluire come un picco distinto su cromatografia a scambio ionico e quindi possono essere rimosso dalla purificazione Fab - tuttavia questo non è sempre il caso. Se queste tecniche non sono sufficienti per rimuovere dimeri di LC da purificazione Fab, metodi di purificazione supplementare, come la purificazione di affinità della proteina G, possono essere impiegati per migliorare la purezza.
In alternativa alla co-complessazione con frammenti Fab, tecniche ben documentate come matrici random microseeding possono migliorare le probabilità di ottenere cristalli ben ordinati63,70. Questo metodo prevede l'aggiunta di piccole quantità di cristalli schiacciati, non ottimali nella condizione di cristallizzazione, fornendo un cristallo mononucleato per promuovere la crescita dei cristalli. Questa operazione può essere eseguita utilizzando cristalli della proteina di interesse, o quelli con struttura simile di architettura e terziario del dominio. Inoltre, matrici random microseeding può essere eseguita nei tentativi di cristallizzare la proteina da solo, o in complesso con un frammento Fab o piccola molecola di interesse. Gli avanzamenti recenti nella crio-microscopia elettronica anche fare questa tecnica alternativa alla cristallografia a raggi x per ottenere informazioni strutturali ad alta risoluzione per molecole con caratteristiche appropriate87,88, 89,90,91.
Quando graduale dei set di dati di diffrazione di raggi x non riesce dal sig, HA ammollo è necessario per risolvere il problema di fase di dispersione anomala o sostituzione isomorfa. Ispezione della sequenza dell'amminoacido della proteina può fornire indizi circa la strategia per derivatizzazione ettari, tra cui pH ottimale per l'associazione. In particolare, spaiati cisteine all'interno della proteina possono legano specificamente HA composti che contengono mercurio. Ammollo cristalli nativi con composti HA è un processo iterativo per determinare l'identità del ottimale HA composto, la sua concentrazione e il tempo di incubazione richiesto. Se tentativi iniziali di immersione totale non danno ben generano cristalli contenente un HA adatto per l'eliminazione, può essere necessario introdurre sostituzioni dell'amminoacido per migliorare la probabilità di associazione HA e migliorare segnale anomalo. Gli esempi includono mutazioni per includere un residuo di cisteina libera per associare in modo efficiente Hg, Au, Pt o Pb. espressione di proteine per graduale anomali in un media di seleno-metionina completato in e. coli è ampiamente usato per fasatura anomala, tuttavia un sistema equivalente che incorpora in modo affidabile seleno-metionina non è prontamente disponibile per cellule di mammifero in sospensione92,93ed è un'area di sviluppo futuro.
Una volta ottenuta la struttura di legame della glicoproteina di interesse, ammollo cristalli con ligandi di piccola molecola può essere eseguita per ottenere una struttura del complesso recettore-ligando immuni. Questi dati forniscono un modello per la progettazione razionale di ligandi ad alta affinità e più specifici che può essere utilizzato come piccolo-molecola terapeutica, nonché fornisce approfondimenti ad alta risoluzione la funzione biologica della glicoproteina. Quando si tenta di ammollo cristalli glicoproteina con ligandi di piccola molecola di interesse, ispezione della struttura cristallina unliganded possibile indicare se ammollo dovrebbe essere possibile. Se nelle vicinanze cristallo-imballaggio contatti si trovano in tutto il sito di ligand-legantesi o nei dintorni di regioni prevede a subire cambiamenti conformazionali su ligando vincolanti, ammollo sarà probabilmente essere problematico. In questo caso, devono essere eseguite altri metodi quali co-cristallizzazione del complesso proteina-ligando.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Esperimenti di diffrazione di raggi x descritti in questa carta sono stati eseguiti utilizzando beamlines 08-ID e 08-BM alla fonte di luce canadese, che è sostenuto dalla Fondazione Canada per innovazione, scienze naturali e ingegneria Research Council of Canada, il Università di Saskatchewan, il governo di Saskatchewan, Canada di diversificazione economica occidentale, il Canada del Consiglio nazionale delle ricerche e istituti canadesi di ricerca sanitaria. Vorremmo riconoscere la strutturale & biofisica Core Facility, The Hospital for Sick Children, per l'accesso agli strumenti telematici e BLI. J.E.O. è stato sostenuto da Banting Postdoctoral Fellowship BPF-144483 dall'istituti canadesi di ricerca sanitaria. T.S. è un destinatario di un Canada Graduate Scholarship Master Award e un Vanier Canada Graduate Scholarship dall'istituti canadesi di ricerca sanitaria. Questo lavoro è stato supportato da sovvenzione PJT-148811 (J.-P.J.) dall'istituti canadesi di ricerca sanitaria di funzionamento. Questa ricerca è stata intrapresa, in parte, grazie ai finanziamenti del programma Canada ricerca sedie (J.-P.J.).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
Riferimenti
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon