Method Article
用 X 射线晶体学和生物物理技术表征免疫球蛋白折叠的糖蛋白
摘要
通过 biolayer 干涉法、等温滴定量热仪和 X 射线晶体学, 我们提出了免疫球蛋白褶皱的生物物理和结构表征方法。
摘要
细胞表面的糖蛋白在细胞功能中起重要作用, 包括信号、黏附力和转运。在白细胞上, 这些糖蛋白中有几个具有免疫球蛋白 (Ig) 褶皱, 并且是免疫力识别和调节的核心。在这里, 我们提出了一个平台的设计, 表达和生物物理特性的细胞外领域的人 B 细胞受体 CD22。我们建议, 这些方法是广泛适用于哺乳动物糖蛋白 ectodomains 的特点, 其中含有的免疫球蛋白领域。两个悬浮人胚肾 (HEK) 细胞系, HEK293F 和 HEK293S, 是用来表达的糖蛋白窝藏复杂和高甘露糖多糖分别。这些重组糖蛋白与不同的 glycoforms 允许研究糖大小和组成对配体结合的影响。我们讨论了研究糖蛋白结合生物学相关配体和治疗抗体候选者的动力学和热力学的协议。HEK293S 细胞生成的重组糖蛋白, 由于糖的均一性, 降低了灵活性和 endoglycosidase H 治疗的易感性, 易于结晶。我们提出了用重原子和小分子浸泡糖蛋白晶体的方法来测定和分析配体结合。这里讨论的实验性协议对哺乳动物糖蛋白的特性有一定的把握, 可以洞察它们的功能, 并研究治疗的作用机制。
引言
表面蛋白在细胞功能中起重要作用。通过它们的胞外域, 这些膜蛋白可以调节细胞的相互作用, 黏附力, 传输和信号1,2。这些蛋白质的胞外定位使它们成为治疗多种疾病的疗法的诱人靶点, 包括癌症和自身免疫性疾病3,4,5,6,7. 人类膜蛋白 ectodomains 最常见的褶皱之一是免疫球蛋白样 (Ig) 褶皱, 由七或更多的β链组成, 排列成两个β片8,9。一般情况下, 含膜糖蛋白是多域结构, 在细胞膜蛋白10的胞外部分按顺序排列。这些细胞表面蛋白, 特别是 n-和 O 连锁糖基化的转化后的修饰, 在它们的调节、折叠、分泌和功能11中发挥了重要作用。为了提高我们对其功能的了解, 更好地设计能够针对它们的治疗方法, 需要技术, 使其具有详细的分子特征。在这里, 我们提出了技术的组合, 允许生物物理 (biolayer 干涉 (BLI) 和等温滴定量热 (贸易中心)) 和结构 (X 射线晶体学) 的细胞外域的表征膜糖蛋白, 单独和在复杂与他们的生物相关的配体和治疗分子 (图 1)。
n-链接糖基化是哺乳动物蛋白质的最常见的后翻译修改, 并发生在蛋白质成熟期间内质网和高尔基12,13。细胞系, 如人胚肾 (HEK) 293 细胞, 已开发用于重组表达大量糖化哺乳动物蛋白14,15。这一细胞系是以悬浮的形式发展的, 它允许将蛋白质的生产与粘附细胞线相比更容易地扩大到更大的数量。在这里, 我们利用两个 HEK293 细胞系: HEK293F 和 HEK293 Gnt I/- (HEK293S), 这是不同的 n-acetylglucosaminyl 转移酶 i (Gnt) 在后者。反过来, 复杂多糖的生产 (如 HEK293F 中所见) 是不可能的, 而是高甘露糖型多糖 (主要是人5GlcNAc2) 居住在 N 链接糖站点18,19,20.同时使用这两个细胞线可以研究糖大小和复杂性对生物学功能和治疗靶向的影响。事实上, HEK293F 细胞产生的糖蛋白将有更大, 更复杂的多糖相比, HEK293S 细胞生成的糖蛋白。HEK293S 细胞产生的糖蛋白更易于结晶, 因为它们的 n-链多糖的化学和构象异质性降低。为了进一步改善结晶性能, HEK293S (而不是 HEK293F) 细胞中产生的糖蛋白可以用酶 endoglycosidase h (内 h) 处理, 从而导致高甘露糖多糖的分裂, 只有一个 n-葡糖 (GlcNAc)基团仍然在每 N 链接的糖基化站点21,22。其他方法也可用于限制细胞内的 n-糖处理, 例如在糖蛋白表达过程中添加 glycosyltransferase 抑制剂, 包括 kifunensine23。替代方法包括在 HEK293F 细胞中表达原生糖蛋白 (deglycosylation), 然后使用肽 n-糖苷酶 F (PNGaseF) 的酶。然而, deglycosylation 与 PNGaseF 已被证明是不太有效的当地条件下, 增加聚集在一些蛋白质;在治疗后, 当蛋白质保持可溶性时, 由于天门冬残留物对天冬氨酸24的去酰胺, 它的表面会产生负电荷, 这可能对其结晶有害。预测的 n-糖基化部位也可以突变, 最常见的是丙氨酸或谷氨酰胺残留物, 以防止这些部位的 n-链化糖基化, 并生成高均一性的糖蛋白样品。另外, 糖蛋白也可以在其他真核细胞细胞培养, 包括酵母, 昆虫, 植物系统, 或其他哺乳动物细胞系, 如中国仓鼠卵巢 (CHO) 细胞16,17。
许多哺乳动物表达载体, 包括 pHLsec, 允许分泌重组糖蛋白 ectodomains 进入细胞培养基25。分泌糖蛋白从 HEK293 细胞允许快速和容易的纯化, 不需要细胞裂解。添加纯化标签 (例如, 他的标签, 链球菌标记, 标志标记, c-myc 标记, HA 标记) 到目标糖蛋白的 N 或 C 终点, 允许单步亲和层析纯化。随后, 尺寸排除色谱可用于产生单分散样品的生物物理和结构表征。
在适当的条件下, 高纯度和均匀的糖蛋白样品可以产生良好的衍射晶体。一旦从这种晶体中获得了完整的 X 射线衍射数据集, 就需要确定初始阶段来计算糖蛋白的电子密度。由于蛋白质数据库 (PDB) 中的结构越来越多, 目前最常用的分阶段方法已经成为分子置换 (MR), 它使用相关的蛋白质结构来获得初始阶段26。然而, 当 MR 无法解决相位问题时, 就像偶尔出现的多域糖蛋白27、28、29的情况一样, 需要其他方法。本文详细介绍了用重原子 (HA) 浸泡晶体进行分阶段处理的方法, 为解决 CD22 胞外区28的结构要求。确定分阶段的右 HA 是一个迭代过程, 它取决于 ha 反应性、给定晶格中糖蛋白中的可用原子和结晶溶液30、31。另外, 在半胱氨酸和蛋氨酸残留物中的天然硫原子, 如果存在于糖蛋白中其他原子的足够高的比例, 则可以用于分阶段, 如果 X 射线衍射数据可以收集足够高的冗余32, 33。
膜糖蛋白的生物学功能通常由蛋白质相互作用或蛋白质配体相互作用 (如碳水化合物) 介导。当配体小到可以从溶液中扩散到晶体晶格中的糖蛋白结合部位时, 浸泡实验可以成功获得一个糖蛋白-配体共晶结构, 以更好地理解配体识别。
这里提出的协议也适用于了解表面糖蛋白与合成治疗配体34,35和抗体疗法36,37之间的相互作用。结合结构信息, 结合动力学和热力学可以有力地理解和改进它们的作用机制。一种允许对糖蛋白结合的治疗性抗体进行动力学分析的技术是 BLI38,39。BLI 使用生物传感器与固定化配体测量关联和离解动力学与一个结合伙伴, 最终确定平衡离解常数 (KD)。BLI 是一个有吸引力的方法, 因为需要少量的糖蛋白 (< 100 µg), 实验时间快 (每运行10-15 分钟), 它可以自动化。贸易中心对于研究糖蛋白和结合伙伴40、41、42、43之间的亲和力也很有用。虽然贸易中心是更多的时间和试剂密集型, 有价值的信息可以获得关于热力学的相互作用 (ΔG, ΔH, ΔS 和化学计量)。贸易中心对于研究与表面糖蛋白与配体的瞬态结合通常相关的弱相互作用也非常有用。此外, 这些技术可以结合使用, 以评估各种结构的结合, 并评估不同的 n-链接 glycoforms 表达糖蛋白在不同的细胞线的效果。执行 BLI 和贸易中心的糖蛋白产生的 HEK293F, HEK293S 和治疗与内 H 可以提供一个深入的看法多糖在生物活动和治疗参与的作用。
我们成功地应用这些协议来表征人类 CD2228的胞外领域 (幼儿发展), 这是唾液酸结合的类似凝集素 (Siglecs) 家族的糖蛋白成员, 对于维持 B 细胞稳态是必不可少的44.我们进行了深入的构造设计, 以促进结晶和分阶段的 X 射线数据集浸泡汞。我们还浸泡 CD22 晶体与配体唾液酸 (α2-6 唾液乳糖), 以获得免疫受体-配体复合体的结构, 从而提供了结构导向设计的糖 mimetics45,46的蓝图。此外, 我们产生了片段抗原结合 (anti-CD22 治疗抗体 epratuzumab-一个治疗候选者目前在 III. 期临床试验的非霍奇金淋巴瘤47-以确定其结合亲和性的 BLI 和贸易中心对差异糖化 CD22 幼儿发展的构造。这些研究揭示了 n-联用糖基化在 epratuzumab 参与中的关键作用, 对功能失调的 B 细胞 CD22 识别有潜在的影响。
研究方案
1. 糖蛋白早期发育的结构设计
- 使用 InterPro 和 Phyre2 服务器评估人体 CD22 (Uniprot) 的氨基酸序列, 以确定位于蛋白质48、49内的预测域元素和边界。
- 克隆人类 CD22 序列, 缺乏信号肽, 跨膜和胞浆领域 (残留物 20-687, 此后 CD22 细胞外领域, CD22 幼儿发展) 到 pHLsec 哺乳动物表达载体25使用限制酶 AgeI 和 KpnI (图 2A)50。
注意: pHLsec 向量是为哺乳动物细胞中可溶性、分泌蛋白的过度表达而优化的.25。这个向量包含分泌信号, 允许可溶性糖蛋白的胞外分泌。pHLsec 包含一个 C 终端 (他的)6x标签, 以促进亲和纯化从细胞上清液使用固定化的金属亲和层析方法。 - CD22 的克隆截断构造与 C 终端的连续删除域: 域 1-6 (残滓 20-687), 域 1-5 (残滓 20-592), 域 1-4 (残滓 20-504) 和域 1-3 (残滓 20-330) (图2B 和 2C)50.
- 使用 NetNGlyc 服务器评估 CD22 幼儿发展的主要序列, 以确定在构造51中存在的预测 n-链化的糖基化站点。
- 使用站点定向诱变, 通过标准协议52或重叠 PCR53, 突变每个预测 n-链接的糖基化站点 (Asn 到 Gln 和/或 Asn 到阿拉巴马州), 以创建 CD22 幼儿发展的结构, 其中包括一个或几个n-连锁糖基化突变。
- 在对克隆结构进行序列验证后, 将 DNA 转化为合格的大肠杆菌DH5α细胞54和最大-准备脱氧核糖核酸 (根据制造商的指示) 准备转染。
2. HEK293F 和 HEK293S 细胞的建立
注: 所有使用必要试剂和设备操作 HEK293F 或 HEK293S 细胞必须在一个适当的生物安全柜内的生物安全等级2设施中进行。所有物料的外部表面必须用70% 乙醇溶液或等效试剂进行灭菌。
- 获得 HEK293F 和 HEK293S 悬浮细胞 (见材料表), 并存储在-80 °c, 直到准备使用。
- 温暖的媒介 (参见材料表) 在37°c 水浴1小时。将24毫升的暖化介质转移到125毫升的折流细胞培养瓶中, 排气帽。
- 获得1毫升细胞整除从-80 °c 和转移到冰。
- 孵育细胞在37°c 水浴大约1分钟, 部分解冻细胞。将1毫升细胞从瓶子转移到125毫升的折流细胞培养瓶中, 含有培养基。
- 关闭细胞培养瓶与通风帽和地方烧瓶设置为37°c, 130 rpm, 70% 湿度, 8% CO2。
3. HEK293 细胞维护
注: 解冻后必须检查细胞密度和电池的生存能力约24小时。这一步骤确保细胞在接种后恢复;初步可行性应 > 80%。
- 小心地从含有新鲜悬浮细胞的125毫升烧瓶中取出10µL 细胞, 并将其转移到不育的1.5 毫升微细。关闭烧瓶, 并返回到孵化器。
- 吸管10µL 的台盼蓝溶液进入1.5 毫升微细包含细胞, 彻底混合和转移10µL 到计数幻灯片的房间。
- 将计数滑块放入自动单元格计数器中, 获取细胞密度 (单位为-1) 和细胞活力 (百分比) 的值。
- 计算在最终密度为 0.8 x 106细胞毫升-1的情况下, 使用以下方程式接种200毫升培养的细胞数量:
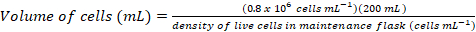 (1)
(1)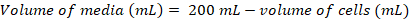 (2)
(2)
注: 在200毫升培养中获得合适的细胞密度可能需要5维。 - 一旦细胞密度足够为200毫升培养的接种, 温暖的媒介为1小时在37°c 水浴并且转移温暖的媒介入生物安全内阁。
- 使用血清吸管, 仔细转移所需的介质量 (如公式2中计算) 成一个500毫升的折流细胞培养瓶与通气帽。
- 使用血清学吸管, 将所需的悬浮细胞量 (在方程式1中计算) 转化为500毫升的折流细胞培养瓶, 其中含有培养基。
- 盖新的200毫升维修库存, 并返回到孵化器。将细胞生长到大约 3 x 106细胞毫升-1的密度。通道细胞密度为 0.8 x 106细胞毫升-1每 2-3 d 维持稳定细胞培养 (如 3.4-3.7 节所述)。不要让细胞超过 4 x 106细胞毫升-1的密度。
4. HEK293 细胞对糖蛋白表达的转染
- 计算200毫升区域性所需的单元格和介质体积, 以便在 0.8 x 106单元格 mL-1 (使用1和2节中的公式) 进行转染。
注: 可执行的200毫升 transfections 的数量取决于维护库存的细胞密度。 - 转移所需的介质和细胞, 以转染成一个新的500毫升细胞培养瓶与通风帽, 并返回到孵化器的细胞存量。
- 在转染前孵化细胞1小时, 以使细胞在分裂后能适应。
- 将50µg 的 DNA 转移到不育的50毫升锥形管中, 稀释5毫升的介质。真空过滤器稀释后的 DNA 使用0.22 µm 过滤系统进入另一个无菌管。
- 混合稀释, 过滤 DNA 在1:1 质量: 体积比与转染试剂。轻轻旋转的 DNA: 转染试剂溶液混合和孵化溶液在室温下10分钟。
- 添加 DNA: 直接转染试剂溶液到细胞。孵育转染细胞在37°c, 130 rpm, 70% 湿度, 8% CO2在一个振动筛为 5-7 d。
5. 细胞转染条件的优化
注: 为了优化细胞转染条件, 最大糖蛋白产量, 染细胞在各种初始细胞密度和评估蛋白质产量随着时间的推移 (图 3a)。染细胞如4节所述, 初始细胞密度范围从 0.5 x 106到 2 x 106细胞 mL-1 55。试验 transfections 可以缩小到25毫升总体积 (125 毫升折流细胞培养瓶) 与6µg 的 DNA, 以节省空间和试剂。DNA 的数量也可以优化55。
- 每天转染后 (天 1-7), 转移500µL 整除从细胞培养成无菌1.5 毫升微细 (在生物安全柜)。
- 收集后立即在离心中旋转 aliquoted 细胞, 在 1.2万 x g 处为5分钟。转移上清到一个新的1.5 毫升微细和存储在4°c, 直到所有样品得到。
- 定量分泌糖蛋白的密度测定
- 一旦所有样品获得, 整除20µL 的每个样品成一个新的1.5 毫升微细和混合6µL 的不减少 4x Laemmli 样本缓冲区。
- 在热块中煮沸样品5分钟, 95 摄氏度。在离心的 1.2万 x g 处旋转样品1分钟。
- 在10井4-15% 梯度 SDS 页凝胶中, 每个样品每井20µL。包括一条用于蛋白质尺寸标记的车道。在三/甘氨酸/SDS 缓冲器中运行凝胶在250伏20分钟。
- 在运行完成后, 转移凝胶到考马斯染色 (见材料表) 为20分钟, ddH2O 的除污凝胶20分钟的图像凝胶。
- 按照标准协议57,58执行 ImageJ 密度测量。
- 用 "天后转染" 对 Y 轴上的 X 轴和 "密度值" 进行编译和绘制数据 (图 3A)。
注: 或者, 如果蛋白质表达不足以用于可视化的 SDS 页面, 技术, 如西方印迹可以使用56。
- 定量分泌糖蛋白 BLI
- 利用镍 NTA 生物传感器, 定量 BLI59的分泌糖蛋白量。
- 使用 Y 轴上的 X 轴和 ' 蛋白质浓度 (µg/毫升) ' 上的 "天后转染" 来编译和绘制数据 (图 3A)。
6. HEK293 上清液中可溶性糖蛋白的纯化
- 以 6371 x g 为20分钟, 以4摄氏度离心的方法收获细胞。保留含有分泌 CD22 的上清液, 并使用0.22 µm 过滤器进行过滤。
- 使用台式色谱系统, 在预平衡 (20 毫米三 pH 9.0, 150 毫米氯化钠, 5 毫米咪唑) 镍 NTA 柱 (5 毫升容积) 上, 载入上清4毫升最小-1 。
注: 其他基于亲和性的纯化技术可根据1节中结构设计中所包含的亲和标记使用。 - 在上清装后, 用洗涤缓冲器的3-4 柱容积 (CV) (20 毫米三 pH 9.0, 150 毫米氯化钠, 5 毫米咪唑) 洗涤亲和柱。
- 洗脱纯化糖蛋白从专栏使用4-100% 梯度 (4 CVs) 洗脱缓冲器 (20 毫米三 pH 9.0, 150 毫米氯化钠, 500 毫米咪唑), 而收集分数 (图 3B)。
- 含 10 kDa 标称分子量限制 (NMWL) 的离心过滤装置中含有洗脱峰的池馏分, 其浓缩离心在 4000 x g 4 摄氏度, 15 分钟或直到样品达到500µL 的体积。
- 将浓缩糖蛋白注入500µL 样品循环中, 并在0.5 毫升-1到前平衡 (20 毫米三, pH 9.0, 150 毫米 NaCl) 高性能尺寸排除柱 (大约24毫升体积) 上的快速蛋白质液相色谱 (FPLC)系统在收集分数4摄氏度 (图 3C)。
- 运行 SDS 页凝胶的洗脱分数, 以确定含有糖蛋白的分数, 并池相应的分数。SDS 页凝胶可以按照 560节所述运行。
7. 纯化糖蛋白的 Deglycosylation
- 用 280 nm 除以消光系数 (例如, 1.418 米-1厘米-1为 CD22 幼儿发展) 测定纯化蛋白的浓度。
注意: 感兴趣的蛋白质的理论消光系数可以使用诸如专家系统 ProtParam61这样的服务器来计算。 - 在37摄氏度的1小时内培养纯化蛋白, 在1X 内 h 缓冲液中以1毫克的纯化蛋白与10µL 的商业酶的比值 (根据制造商的指示)。
注: 在 HEK293S 中产生的高甘露糖多糖在每个糖基化部位21留下一个单一的 GlcNAc 基团。多糖对 HEK293F 细胞中产生的蛋白质不进行切割,但其他酶可用于此目的 (如PNGaseF24)。 - 集中 deglycosylated 幼儿发展到500µL 和运行凝胶过滤层析在一个高性能的尺寸排除柱 (约24毫升体积) 在0.5 毫升最低-1在 FPLC, 以消除内 H 和分离任何结果骨料。
- 将 deglycosylated 蛋白贮存在4摄氏度, 直至下游实验使用。
8. 糖蛋白的结晶
注: 使用商用屏幕进行结晶试验, 并使用结晶机器人建立静坐实验。
- 集中纯净, deglycosylated 幼儿发展到10毫克 mL-1使用一个离心过滤装置与 10 kDa NMWL 在 4000 x g (4 °c), 直到期望的浓度得到。
- 用 280 nm 光度法测定蛋白质浓度并除以消光系数。
- 离心样品在 1.2万 x g 5 分钟在4°c 在结晶试验之前去除不需要的尘土或其他污染物从样品。
- 用80µL 结晶溶液从商业结晶筛中填充96井坐滴结晶板的油藏井。
注: 我们使用的是基于在 PDB 中沉积的结构最成功的结晶条件设计的稀疏矩阵商业屏幕。 - 使用结晶机器人, 在纯化蛋白的比例下, 在 200 nL 的总滴量下滴入结晶板的井中: 结晶溶液为1:1。
- 当整个盘子被配发后, 用胶带把盘子封起来, 然后放到一个平板成像仪中, 通过可见光和紫外光进行检查。
- 在安装后立即检查结晶板, 并在接下来的几周内, 使用可见光和紫外光来确定初始糖蛋白晶体命中的条件。
- 根据晶体命中或随机基质微播种方法62、63、64、65的条件, 进一步优化从初始结晶命中中获得的晶体。
- 低温保护在结晶条件下缺乏足够的低温防护的任何晶体, 在母液溶液中浸泡结晶, 辅以 20% (v/v) 甘油溶液 (或类似的低温防护, 如乙二醇或聚乙二醇 400)。
- 在 cryoloops 和闪光中安装晶体时, 将它们冷冻在液态氮中, 然后再在主源衍射仪上或使用同步辐射进行数据收集。
9. 利用重原子衍生化的分期
注: 在对 HA 化合物进行任何操作之前, 必须考虑安全问题。在蛋白质晶体学中使用的 HA 化合物由于其对生物分子的强烈亲和力而被选择, 并对长期暴露对人体健康构成威胁。在材料安全数据表中提到的 HA 化合物采取适当的安全步骤。
- 为了测试不同的 HA 化合物、浓度和潜伏期, 在24井晶化板中, 用悬滴蒸气扩散法 (66) 复制衍射晶体。
- 决定哪些 HA 将用于晶体衍生。服务器 (例如,重原子数据库系统67) 可以帮助 HA 复合选择, 确保它们适合于蛋白质和结晶条件。
注: ha 屏幕也可用于商业上, 便于筛选最有效的 ha 化合物以进行分阶段。一组 "魔术七" ha 化合物以前被描述为有很高的成功概率, 在 ha 衍生68。 - 设置用于 HA 浸泡的工作站 (图 4A)。使用冷冻环, 迅速转移晶体到一个22毫米的盖子滑动0.2 µL 下降, 其中含有 ha 溶液稀释在结晶条件, 使 ha 的最终浓度从1-20 毫米不等。密封的下降和孵化的时间长短不同 (图 4B)。一个好的出发点是5、10、60和90分钟和一夜之间。
- 通过光学显微镜观察晶体, 以识别可能出现的裂纹或颜色变化, 这可能表明对糖蛋白晶体或晶体衍生的不利影响。
- cryoloops 和后浸泡晶体中的芒晶在三十年代连续三0.2 µL 液中含有母液溶液, 补充 20% (v/v) 甘油 (或交替冷冻-防护)69。浸泡后的晶体去除 ha 化合物, 这是非专门的约束和减少部分占用由弱 HA 绑定造成。液态氮中的闪光冷冻晶体 (图 4B)。
- 对于数据收集、处理、结构解决方案和细化, 请使用前面描述的协议26、70、71、72。
10. 用配体浸泡糖蛋白晶体
- 采用悬滴蒸气扩散法, 在24井结晶板中, 衍射8节中获得的良好的晶体。
- 准备一个50毫米配体在20毫米三, pH 9.0, 150 毫米氯化钠的股票溶液。
注: 配体的浓度应根据其糖蛋白的亲和性来制备。如果亲缘关系未知, 可能需要使用诸如国贸中心 (第12.2 节) 这样的方法来确定开始浸泡实验之前的亲和力。确保配体可溶于所需的缓冲液中所需的浓度。 - 将配体的不同浓度添加到含有幼儿早期晶体的下落中, 并在时间长度范围内封闭5分钟至5维的潜伏期。
- 视觉跟踪晶体与光显微镜, 以确定可能的变化形态学。
- 在 cryoloops 和低温下安装晶体, 保护它们在母液溶液中补充 20% (v/v) 甘油 (或其他低温防护, 如乙二醇或低分子量聚乙烯乙二醇 400)69。
- 对于数据收集、处理、结构解决方案和细化, 请使用以前描述的协议73、74、75。
11. 片段抗原结合的生产 (工厂)
- 亚克隆基因, 对应于晶圆重链 (HC) 和轻链 (LC) 序列的抗幼儿发展抗体,例如,epratuzumab。
注: 另外, 可以通过酶法木瓜蛋白酶对 IgG 进行劈裂, 以产生76。 - 染单元格, 如第4节所述, 并进行以下修改:
- 使用一个总质量的 DNA, 以转染的90µg 每200毫升文化的工厂碎片。
- 染 HC 和 lc 质粒的比例为 2:1, 减少了 lc 二聚体的形成量。
- 经过 7 d 的孵化, 收获细胞, 保留上清和过滤器与0.22 µm 真空驱动过滤装置。
- 平衡在 PBS 缓冲器中使用台式色谱系统的抗 LC (卡伯或 lambda) 亲和柱。
注: 如果 lc 二聚体的形成是一个在纯化过程中的问题, 蛋白质 G 亲和层析可作为一种替代卡伯/lambda LC 亲和纯化。 - 在亲和柱上上清液4毫升最小-1。跟随样品装载, 洗涤专栏与 3-4 CVs 的 PBS。
- 洗脱蛋白质从专栏使用等度洗脱与100毫米甘氨酸, pH 值 2.2, 立刻中和洗脱分数与 10% (v/v) 1 M 三, ph 9.0 在每个分数。
注: 洗脱可以通过离子交换色谱和/或大小排除色谱进一步纯化, 使用 FPLC 在4摄氏度。
12. 晶圆和小分子对糖蛋白结合的表征
- Biolayer 干涉测量
- 准备50毫升的1x 动力学缓冲器 (1x PBS, 0.002% (v/v) Tween-20, 0.01% (瓦特/v) BSA)。
- 水合物六镍 NTA 生物传感器在200µL 的1x 动力学缓冲器10分钟的预润湿板。
- 在1毫升的1x 动能缓冲中稀释他标记的幼儿发育, 最终浓度为 25 ng µL-1。将纯化的晶圆管串联稀释成200µL 的1x 动力学缓冲器, 高浓度 500 nM, 随后连续稀释 250 nm, 125 nm, 62.5 nm。
- 整除试剂成黑色平底聚丙烯 96-井微板块如图 5A所示, 其中每个井包含200µL 的表示的解决方案。
- 使用数据采集软件中的动力学方法收集数据, 如前所述38、39、77 (图 5A)。
- 简单地, 将生物传感器转化为含1x 动能缓冲液的井, 在六十年代加载 25 ng µL-1糖蛋白为 240s (或直到达到1.0 毫微米的门槛) 在 1000 rpm 之前。
- 在六十年代的第二个基线以后1x 动力学缓冲器, 转移生物传感器入井包含系列稀释的工厂。180s 关联相随后是1x 动力学缓冲器中的180s 离解步。
注: 如果上述协议后面有一个再生步骤, 生物传感器可以被重用, 其中包括三个循环, 用于洗涤缓冲液中的生物传感器 (PBS 与500毫米咪唑), 在1x 的动力学缓冲器中中和5秒。生物传感器可以在同一天重复使用多达10-20 次, 或者在数据质量较差之前进行。
- 使用分析软件分析数据 (图 5A):
- 在 "选项卡 1" 下, 导入并选择数据。
- 在 Tab 2, 步骤 1: 数据选择, 选择 "传感器选择" 和突出显示参考井 (E 和 F 行,图 5A), 右键单击并设置为参考。在步骤 2: 减法中, 选择 "参考井"。在 "步骤 3: 对齐 Y 轴" 下, 从0.1 到59.8 秒的时间范围中选择 "基线"。在步骤 4: 跨步更正中, 选择 "对齐到离解"。在步骤 5: 进程中, 选择 "Savitzky-Golay 筛选" 和 "按进程数据"。
- 在 "选项卡 3" 下, 选择 "关联和分解" 下的步骤来分析1:1 模型。选择 "全局管接头" 和 "按颜色分组"。右键单击曲线, 选择 "更改颜色", 将所有曲线设置为您选择的颜色。选择 "适合曲线"。如果数据安装良好, 可以通过选择 "保存报告" 导出报表。
- 重复实验中产生的糖蛋白在 HEK293F 和 HEK293S 细胞 (5 节) 和后续的 H 治疗 (第7节), 以评估的效果, 如果有的话, 不同的 glycoforms 对工厂的承认。此外, 重复的实验与幼儿发展截断, 以提供洞察的领域 (s) 绑定的。
- 晶糖相互作用的等温滴定量热法
注: 贸易中心在这里所做的实验是使用自动化的国贸仪器进行的。实验在1毫升圆底96井块进行。- 透析在一个4升烧杯20毫米三, pH 8.0, 150 毫米氯化钠在4°c 一夜间与搅拌棒的幼儿发展和晶圆。
- 用 10 kDa NMWL 的离心过滤器, 将透析和µM 浓缩成5的50µM, 确保在使用前5摄氏度用4000毫升的透析缓冲液洗涤浓缩膜三倍于5。
注意: 细胞和注射器中样本之间的任何不匹配会导致在贸易中心实验中释放不需要的热量, 并导致质量较差的数据。 - 为实验 1: 增加400µL 的幼儿发展到 A1 将被装载在细胞, 和120µL 的 A2 将被装载在注射器。以及 A3 是空的返回混合样本后, 实验完成。随后的每个实验都可以按相同的顺序添加到板中 (即实验 2: 细胞 A4、注射器 A5、空 A6;图 5B)。
注: 在每次运行的开始和结束时包括缓冲区到缓冲控制 (确认仪器表现良好), 以及配体 (在注射器中) 到缓冲 (在细胞) 控制中, 以计算注射器中样品的稀释热量。在数据分析过程中, 应从原始实验数据中减去这一计算所得的稀释热量 (图 5B)。 - 每次注射时总共运行16个注射剂, 每块 2.5 ul。注射时间为5秒, 注射180s 间隔。将单元温度设置为25摄氏度, 搅拌速度为 750 rpm, 过滤周期为5秒。
注: 根据幼儿发展的亲和性和热力学: 晶胞相互作用, 可能需要改变样品浓度, 注射次数或细胞温度。 - 使用分析软件分析数据, 如前所述40、41、43 (图 5B)。
- 重复该实验至少在重复, 计算平均 KD值和标准误差。重复实验与不同的 glycoforms (5 和6节) 的幼儿发展, 以评估的效果, 如果有的话, glycoforms 的热力学: 糖蛋白相互作用。
- 对于配体-糖蛋白相互作用的等温滴定量热, 建立贸易中心实验, 如第12.2 节所述, 并进行以下更改:
- 透析4升的透析缓冲液过夜。透析完成后, 用透析缓冲液溶解配体。
- 执行国贸中心的实验, 在显着更高的浓度, 能够检测低亲和力的相互作用。对于幼儿发展和配体相互作用, 在100µM 的细胞和1毫米的配体在注射器中, 执行国贸中心的实验。
结果
在哺乳动物 HEK293F 和 HEK293S 细胞株中成功地克隆出了 CD22 的几种结构, pHLsec 表达载体和抗原 (图 2和 3A)。通过尺寸排除色谱法纯化所有构造, 并产生高度纯净的结晶研究样品 (图 3B和 3C)。导致衍射晶体的 CD22 构造是 d1-d3 截断 (残滓 20-330), 其中六预测的 n-链化的糖基化部位从 Asn 到亚拉巴马州 (N67A、N112A、N135A、N164A 和 N231A), 在 HEK293S 细胞中产生, 只有在位置 N101 的糖基化站点被保留了 (这个结构命名 CD2220-330, 5A)。晶体是在 MCSG-1 稀疏矩阵的几个条件, 但最好的晶体是从一个条件, 包括 30% (w/v) 聚乙二醇 4000, 0.2 米氯化锂和0.1 米三, pH 8.5。这些原生晶体衍射到2.1 Å分辨率;使用已知结构的 Siglec 相关蛋白质的玻璃领域没有产生任何解决方案在 MR 搜索。
为了获得分阶段的信息, 我们用一个 ha 化合物的面板浸泡了本机晶体, 其中包括汞、Pt、Os、Ta 和 Br, 其浓度从1-20 毫米 ha 化合物到孵化时间从5分钟到 1 d 不等 (图 4)。我们监测晶体的形态学变化, 发现晶体浸泡在20毫米的 HA 化合物导致快速开裂和溶解晶体。我们冻结了63种晶体, 在设定的孵化时间后保持其形状, 它们浸泡在溴化钽簇、铂氯、醋酸汞和氯化汞中。用7毫米氯化汞浸泡的晶体30分钟在加拿大光源 (CLS) 08-BM 光束线 (加拿大萨斯卡通) 的荧光扫描中显示异常信号, 允许在单个晶体。这些数据集使我们能够解决 CD2220-330 5A的汞子结构, 它揭示了一个单一的汞原子, 它被绑定到一个自由的半胱氨酸位置 C308, 最终允许我们建立 CD2220-330, 5A的结构到分阶段电子密度图使用 AutoBuild78。
一旦 unliganded 结构得到解决, 我们就有兴趣解决 CD22 与配体、α2-6 siallylactose 的结构。我们首先计算了 CD22 对α2-6 唾液乳糖的亲和性, 利用贸易中心来表征相互作用的结合热力学。我们观察到了280µM 的亲和性, 并利用这些信息来确定配体的初始浓度 (~ 100 x KD) 用于浸泡我们的本地 CD2220-330,5A晶体。我们浸泡的 CD2220-330, 5A晶体与25毫米 siallylactose 5 分钟, 2 h, 14 h, 40 h 和 5 d 和监测的变化, 晶体形态。共75个晶体被冻结从不同的时间点, 并发送到 CLS 同步光束线 08 ID (加拿大萨斯卡通), 为远程数据收集。从衍射晶体中收集了总共六个 x 射线数据集。利用 unliganded CD2220-330 5A结构作为初始搜索模型, 解决了每个 X 射线数据集的结构。然后, 对所有数据集产生的电子密度进行检查, 以确定在α2-6 地图中的正密度, 该映射对应于 CD22 绑定站点内的绑定唾液乳糖。值得注意的是, 所有收集到的数据集, 即使是在5分钟的潜伏期内浸泡的晶体, 也含有与结合部位对应的配体的正密度。unliganded 和 liganded CD22 的整体结构与最小构象变化高度相似, 这可能解释了α2-6 唾液乳糖浸泡实验的成功与否。
我们接下来的特点是在 BLI 和国贸中心的实验中承认的 CD22 抗原表面 epratuzumab (图 5)。epratuzumab 的动力学和热力学剖面结合到 CD22 构造与不同的 glycoforms 揭示了越来越亲和 CD22 与减少 N 链接糖大小, 多达14倍的改善亲和力为较小的多糖 (327 毫微米 vs 24 nm在 BLI;188毫微米 vs 58 毫微米在贸易中心)。采用 CD22 单点突变体 BLI, 通过求解 epratuzumab Fab-CD22 共晶结构28, CD22 N 联糖限制了抗体对其表位的获取。
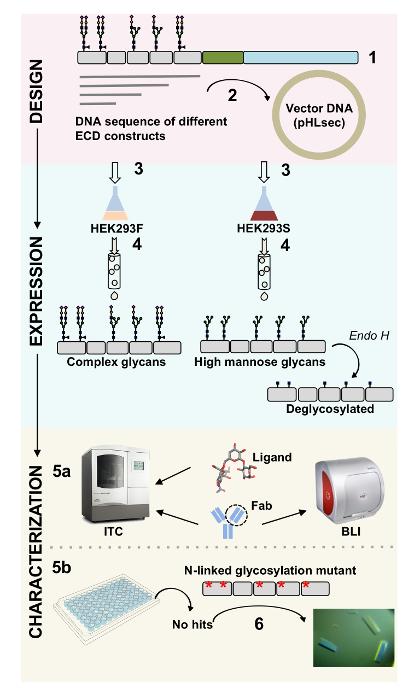
图 1.从结构设计到生物物理和结构表征的糖蛋白特征概述.(1) 代表性糖蛋白的初步序列分析。在灰色, 胞外领域 (幼儿发展);绿色, 跨膜 (TM) 段;在蓝色中, 糖蛋白的胞浆域。预测的 N 链接多糖被标记。(2) 幼儿发展的克隆。(3) 哺乳动物细胞的早期发育表达。(4) 糖蛋白纯化。在 HEK293F 中表达的蛋白质将含有复杂的多糖, HEK293S 中表达的蛋白质将有高甘露糖多糖。酶法处理 HEK293S 细胞中产生的糖蛋白, 其结果是在 n-链接糖基化部位只有一个 GlcNAc 基团的糖蛋白。(5a) 糖蛋白通过 biolayer 干涉测量 (BLI) 和等温滴定量热仪 (贸易中心) 对抗体的结合进行测试。与小配体的亲和性也可以通过贸易中心来衡量。(5b) 糖蛋白与均匀 n-链多糖的结晶试验, 如在 HEK293S 和 deglycosylated 中表达的与内 H. (6) 在某些情况下, N 链接糖基化部位的突变是获得晶体所必需的。请单击此处查看此图的较大版本.

图 2.CD22 胞外区 DNA 构建在哺乳动物细胞中表达的设计. A) pHLsec 质粒的表达, 用于瞬态转染 CD22 的早期发育。用于克隆的 AgeI 和 KpnI 站点用红色框表示。B) CD22 的幼儿发育包括七个 d1-d7 和12预测的 n-链化的糖基糖化点 (蓝色)。四构造是从 CD22 幼儿开发中设计的。C) 1% 琼脂糖凝胶显示 PCR amplicons 的 CD22 幼儿早期构建克隆成 pHLsec 哺乳动物表达载体。第一条车道包含 1 kb DNA 标记。请单击此处查看此图的较大版本.
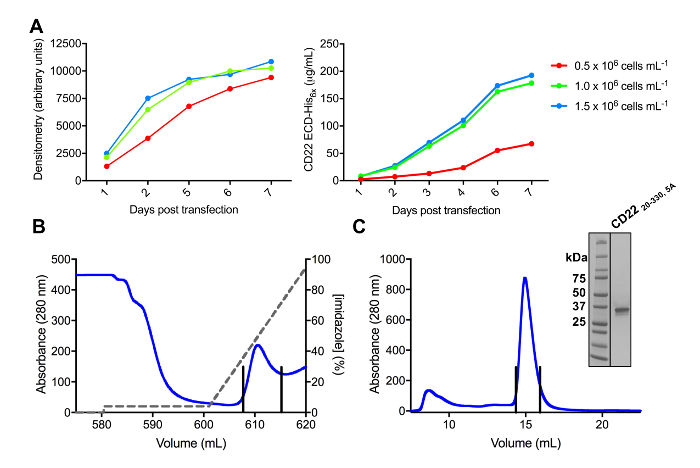
图 3.糖蛋白的表达和纯化。A)细胞密度对表达率的影响。小尺度25毫升培养的糖蛋白表达 HEK293F 悬浮细胞的三种不同起始密度细胞 (0.5 x 106细胞 ml-1, 1.0 x 106细胞 ml-1, 1.5 x 106细胞毫升-1)。从左面板中的 SDS 页和在右面板中定量 BLI 的密度测量进行量化。值代表一个糖蛋白制剂。B)第一纯化步骤的色谱, 用于构造 CD2220-330, 5A从600毫升的上清, 使用镍 NTA 亲和柱。糖蛋白被洗脱使用咪唑 (灰色线) 梯度, 其中100% 对应于洗脱缓冲, 其中包含500毫米咪唑。汇总的分数用垂直线描述。C)使用高性能凝胶过滤柱构造 CD2220-330,5A的尺寸排除色谱。从洗脱峰中汇集的分数用垂直线描述。插图: 考马斯染色的 SDS 页凝胶显示糖蛋白的纯度。请单击此处查看此图的较大版本.

图 4.用重原子浸泡的晶体.A) 用 HA 化合物浸泡本机晶体的样品工作站。所有必需的工具都被标记。B) 采取步骤, 浸泡晶体的建筑 CD2220-330, 5A与 HA 化合物。步骤 1, 打开含有良好的晶体, 并转移晶体使用一个环到0.2 µL 下降的封面滑动包含 HA 溶液稀释在结晶条件, 使 ha 的最终浓度从1-10 毫米不等。步骤 2, 密封在结晶板的下降和孵化晶体与 HA 化合物在不同的时间段。步骤 3, 在循环中装入浸泡过的水晶, 并在三连续0.2 µl 滴中浸泡三十年代, 其中含有母液溶液, 辅以 20% (v/v) 甘油, 并将其放在盖子上。步骤 4, 闪光冻结的水晶安装在一个循环与液氮, 并把它放在一个冰球运往同步辐射光束线。请单击此处查看此图的较大版本.
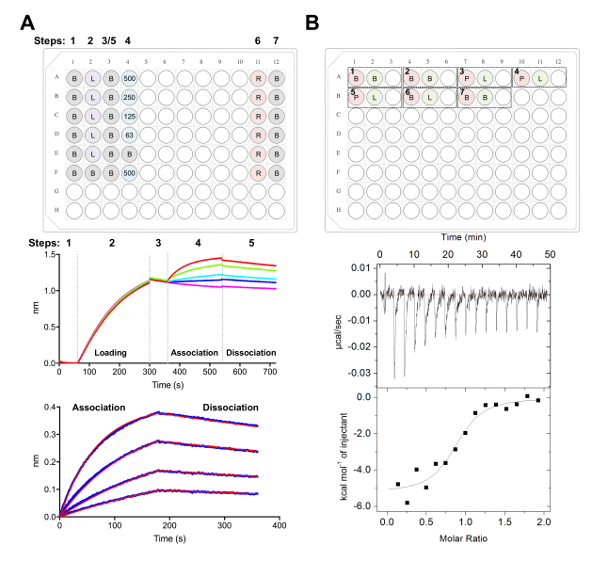
图 5.Biolayer 干涉测量和等温滴定量热测定。A)代表 BLI 实验。顶部面板:一个动力学实验的平板设置示例: 1x 动力学缓冲器 (B), 他的6x标签糖蛋白加载 (L), 代表性的晶圆浓度 (500, 250, 125, 62.5 nM), PBS + 500 毫米再生缓冲器 (R) 和1x 动能中和缓冲器 (B)。每个井包含200µL 的解决方案。动力学实验的步数在板材的顶部被表明。中间板:BLI 实验的代表性原始数据使用 Ni-NTA 生物传感器和板块描述的顶部板。步数对应于基线 (1), 他的6x糖蛋白装载 (2), 基线 (3), 协会在连续稀释的晶圆 (4) 和离解 (5)。未表示再生步骤 (步骤 6-7)。底部面板:代表分析的数据显示原始的关联和离解 (蓝线) 与相应的1:1 适合 (红线)。B) 顶部面板:一个单一的贸易中心在一个96井的圆底块上进行七次实验的自动化贸易中心仪器上运行的代表性板设置。每个实验由三口井组成。第一井 (红色) 对应于样品为细胞 (400 µL), 第二个井 (绿色) 对应于样品为注射器 (120 µL)。第三井是空的, 混合样本将返回到这个良好的实验完成后。实验1、2和7是缓冲控制的缓冲区。实验3-5 代表细胞中的糖蛋白 (P) 的三项实验和在注射器中的晶胞或配体 (L)。实验6代表稀释控制的配体热, 在数据分析过程中应从实验3-5 中减去。底部面板:代表性的原始 (顶部) 和处理 (底部) 贸易中心数据显示, epratuzumab 对 CD22 在 HEK293F 细胞中产生的发育具有约束力。请单击此处查看此图的较大版本.
讨论
膜定位糖蛋白是细胞功能的关键, 是有吸引力的治疗目标。在这里, 我们提出了一项关于膜糖蛋白的早期发育的结构和生物物理特性的协议, 这两种方法单独和复杂的小分子配体和晶圆碎片。我们已经成功地使用这个协议来确定人 CD2228的细胞外部分的三 N 末端最透明的区域的晶体结构, 一个关键的联合受体在 B 细胞参与保持体液免疫在检查79。我们还描绘了 CD22 与天然配体α2-6 唾液乳糖的结合部位, 并定义了一种治疗抗体对人类 CD22 的识别模式。这些结果提供了对 Siglecs 家族的一个关键成员的结构-功能关系的洞察力, 它限制了 B 细胞的表达, 并为发展新的 CD22 靶向小分子和抗体基础的分子路线图疗法。虽然该协议成功地用于含有 B 细胞受体, 我们建议, 我们的方法可以适用于结构和生物物理特性的任何膜糖蛋白与一个独特的领域组织。在这种情况下, 构造设计和组合 N 链接糖突变 (无论是 Gln 或亚拉巴马州) 可以评估, 以找到一个适合晶体生长和高分辨率衍射的结构。
获得一个均匀和纯糖蛋白样品是至关重要的晶体生长和 x 射线衍射, 以及下游生物物理特性。n-链多糖存在于糖蛋白本身是异构的, 并可能导致构象和化学异质性内的糖蛋白, 可以阻止晶体形成。为了减少这种微异质性, 引入点突变的策略, 以去除预测将 n-链多糖的 Asn 残留物, 或者使用突变细胞线 (如 HEK293S), 然后用 endoglycosidases (如 EndoH) 进行治疗, 可以大大改善结晶成功15,21,22。在本议定书中, 我们讨论了可溶性糖蛋白和晶圆的纯化, 分泌到细胞中清。糖蛋白分泌提供了一个相对简单的途径, 以纯度, 不需要细胞裂解或添加苛刻的化学品或洗涤剂。在细胞收获之后获得的细胞上清, 然后直接运行在一个对感兴趣的蛋白质有亲和力的专栏 (例如,镍 NTA 为他标记的糖蛋白, 或 LC 亲和为晶圆碎片)。然而, 根据使用的专栏和细胞上清的条件 (例如, pH 值), 对柱感兴趣的蛋白质的结合能力可能受到影响。如果是这种情况, 可能需要集中和缓冲交换细胞上清, 以改善绑定到该列。此外, 强烈建议使用净化过程中的质量控制步骤, 以帮助评估蛋白质纯度。运行一个 SDS 页凝胶或所有样品的西部污点 (在纯化步骤之前、过程中和之后), 可以对建议的纯化方案是否适合感兴趣的蛋白质产生洞察力。如果在 SDS 页上可见污染带, 或者在提纯过程中获得了几个物种 (例如,在大小排除上有几个峰值), 则应考虑额外的净化步骤,例如离子交换色谱, 以获得在纯净和增加机会下游结晶80。
对于大分子结晶, 通常关键是要获得高产量的蛋白质的利益, 以便筛选大量的潜在的结晶条件, 在高蛋白质浓度, 以找到合适的晶体命中。一般来说, 这里讨论的 HEK293 细胞线 (HEK293F 和 HEK293S) 是健壮的表达系统, 可以很容易地放大, 以产生更多的样本, 必要的。然而, 有可能的蛋白质的兴趣可能没有足够的表达在这些细胞系。在这些情况下, 其他细胞系, 如 Expi293 细胞81,82, 已被发现显示高水平的蛋白质表达, 应该被认为是一种替代品。
如果有良好的顺序, 衍射晶体是没有得到以下几个结构的兴趣, 尽管高纯度的蛋白质, 可能需要扩大结晶技术, 以促进晶体形成。结果表明, nanobodies 的抗体和微晶片段可以是极好的结晶增强剂, 并促进有序的晶体填料83,84,85。这些片段可以表达和纯化为同质性, 并用于一个复杂的与感兴趣的蛋白质促进结晶。重要的是, 如10节所述产生的晶圆碎片可能有形成非功能 LC 脂肪酸86的倾向。这些脂肪酸是污染物, 应在净化过程中去除。根据我们的经验, LC 脂肪酸通常有一个不同的保留量的大小排除, 或洗脱作为一个独特的峰值离子交换色谱, 从而可以从晶圆净化-但这并不总是如此。如果这些技术不足以去除脂肪酸从晶圆纯化, 额外的纯化方法, 如蛋白质 G 亲和纯化, 可用于提高纯度。
另一种方法是与晶圆碎片进行相互配合, 记录良好的技术 (如随机矩阵 microseeding) 可以提高获得有序晶体63、70的几率。该方法包括将少量粉碎的, 次优晶体加入结晶条件中, 提供晶体的核化以促进晶体的生长。这可以使用感兴趣的蛋白质晶体, 或具有类似的领域体系结构和三重结构。此外, 随机矩阵 microseeding 可以在试图单独结晶的蛋白质, 或复杂的一个晶圆或小分子的利益。最近的研究进展, 在低温电子显微镜也使这项技术成为一个有吸引力的替代 X 射线晶体学获得高分辨率结构信息的分子具有适当的特征87,88, 89,90,91。
当 X 射线衍射数据集的分阶段被 MR 所失败时, 可能需要 HA 浸泡以通过异常色散或同构替换来解决相位问题。检测蛋白质的氨基酸序列可以为 HA 衍生的策略提供线索, 包括最佳的结合 pH 值。特别是, 蛋白质内配对的半胱氨酸可以专门约束含有汞的 HA 化合物。用 ha 化合物浸泡本族晶体是一个迭代过程, 用于确定最佳 HA 化合物的特性、浓度和所需的孵化时间。如果初始浸泡尝试不产生良好的衍射晶体, 含有 ha 适合分阶段, 可能需要引入氨基酸替代, 以提高 ha 结合的可能性, 改善异常信号。例如, 含有游离半胱氨酸残留物的突变可以有效地结合汞、Au、Pt 或 Pb. 蛋白质在硒-蛋氨酸补充培养基中的异常分期的表达广泛用于异常分期, 然而硒-蛋氨酸的等效系统在悬浮92、93的哺乳动物细胞中不易获得, 是未来发展的一个领域。
一旦获得感兴趣的糖蛋白的 unliganded 结构, 就可以用小分子配体浸泡晶体来获得免疫受体-配合物的结构。这些数据为合理设计更特异和高亲和性配体提供了一个蓝图, 可以作为小分子治疗, 并提供高分辨率洞察到糖蛋白的生物学功能。当试图浸泡糖蛋白晶体与小分子配体的兴趣, 检查的 unliganded 晶体结构可以表明是否浸泡应该是可能的。如果在配体结合部位周围或周围区域发现接近的晶体填料接触, 则在配体结合时会发生构象变化, 浸泡可能会有问题。在这种情况下, 应执行其他方法, 如共结晶的蛋白质配体复合物。
披露声明
作者声明没有相互竞争的利益。
致谢
本文所描述的 X 射线衍射实验是使用同步辐射08号和 08-BM 在加拿大光源上进行的, 该试验由加拿大创新基金会、加拿大自然科学和工程研究委员会支持,萨斯喀彻温省大学、萨斯喀彻温省政府、加拿大西部经济多样化、加拿大国家研究委员会和加拿大卫生研究所。我们要感谢为患病儿童医院提供的结构 & 生物物理核心设施, 以便进入国贸中心和 BLI 仪器。J.E.O. 得到了加拿大卫生研究院班廷博士后奖学金 BPF-144483 的支持。Vanier 是加拿大大学研究生奖学金获得者, 加拿大卫生研究院的一项研究生奖学金。这项工作得到了加拿大卫生研究院的 PJT-148811 (J.-p.j) 的资助。这项研究的一部分原因是加拿大研究椅项目提供的资金(J.-p.j)。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
参考文献
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。