Method Article
X 선 결정학 및 생물 기술에 의해 면역 글로불린 겹와 Glycoproteins의 특성
요약
우리 면역 글로불린 겹 biolayer 간섭계, 등온선 적정 열 량, 및 x-선 결정학에 의해 glycoproteins의 생물 및 구조적 특성에 대 한 접근 방법 제시.
초록
Glycoproteins 세포의 표면에 접착 및 전송 신호를 포함 한 세포 기능에 중요 한 역할을 재생 합니다. 백혈구에이 glycoproteins의 여러 면역 글로불린 (Ig) 주름을 소유 하 고 면역 인식 및 규정은. 여기, 우리 디자인, 식 및 인간 B 세포 수용 체 CD22의 세포 외 도메인의 생물 특성에 대 한 플랫폼을 제시. 우리는 이러한 방식을 Ig 도메인을 포함 하는 포유 동물 당단백질 ectodomains의 특성에 광범위 하 게 적용 되는 것을 제안 합니다. 두 개의 서 스 펜 션 인간 미 발달 신장 (HEK) 셀 라인, HEK293F 및 HEK293S, glycoproteins 각각 복잡 하 고 높은-만 노 오 스 glycans를 은닉을 표현 하는 데 사용 됩니다. 다른 glycoforms와 함께 이러한 재조합 glycoproteins glycan 크기와에 ligand 바인딩 구성의 효과 조사 하 고 있습니다. 우리 토론 활동 및 생물학 관련 ligands 및 치료 항 체 후보 당단백질 바인딩의 열역학 공부에 대 한 프로토콜. HEK293S 세포에서 생산 하는 재조합 glycoproteins glycan 동질성, 감소 유연성과 민감성 endoglycosidase H 치료에 대 한 결정 의무가 있습니다. 우리는 각각 당단백질 결정 무거운 원자 및 단계 결정과 ligand 바인딩의 분석에 대 한 작은 분자를 몸을 담글에 대 한 방법을 제시. 실험 프로토콜 논의 여기 그들의 기능에 대 한 통찰력을 제공 하 고 치료의 행동의 메커니즘을 조사에 포유류 glycoproteins 특성에 대 한 약속 잡으십시오.
서문
표면 단백질 세포 기능에 중요 한 역할을 재생합니다. 그들의 세포 외 도메인을 통해이 막 단백질 세포 세포 상호 작용, 접착, 전송 및1,2신호를 조절 수 있습니다. 이 단백질의 extracellular 지역화는 그들에 게 다양 한 질병, 암 및 면역 질환3,,45 등의 치료에 대 한 치료제의 개발에 대 한 매력적인 대상 , 6 , 7. 인간의 막 단백질 ectodomains의 가장 일반적인 주름 중 하나는 7 개 이상의 β 물가 2 개의 β-시트8,9으로 배열에 의해 형성 되는 면역 글로불린 같은 (Ig) 배. 일반적으로, glycoproteins Ig를 포함 하는 세포 외 막 단백질10부분에 순차적으로 정렬 된 서 도메인 멀티 도메인 구조. 포스트 번역 상 수정이 세포 표면 단백질, 특히 N-및 O-연결 된 glycosylation의 그들의 레 귤 레이 션, 접이식, 분 비 및 기능11에 필수적인 역할을 보여왔다. 그들의 기능은 그들을 타겟팅 할 수 있습니다 더 나은 디자인 치료제를 우리의 이해를 개선, 기술 하는 필요를 그들의 상세한 분자 특성에 대 한 허용. 여기, 우리는 생물을 허용 하는 기술의 조합을 제시 (biolayer 간섭계 (BLI) 및 등온선 적정 열 량 (ITC)) 및 포함 하는 Ig의 세포 외 도메인의 구조 (x-선 결정학) 특성화 막 glycoproteins, 혼자이 고, 단지 그들의 생물학 관련 ligands와 치료 분자 (그림 1)에서
N 연결 glycosylation 포유류 단백질에서 가장 일반적인 번역 후 수정 중 이며 바인딩과 그물 및 골12,13내 단백질 성숙 하는 동안 발생 합니다. 셀 라인 (HEK) 인간 미 발달 신장 293 세포, 등 대량의 당화 포유류 단백질14,15의 재조합 형 식에 대 한 개발 되었습니다. 이 셀 라인 부착 세포 라인에 비해 대량 단백질 생산 확장의 용이성을 위해 수 있는 서 스 펜 션 형식으로 개발 되었습니다. 여기, 우리 두 HEK293 세포 라인 활용: HEK293F 및 HEK293 Gnt 나-/- (HEK293S), N-acetylglucosaminyl 전이 효소의 부재에 의해 차이가 나는 (Gnt 나) 후자에. 차례로, (에서 본된 HEK293F)으로 복잡 한 glycans의 생산은 불가능 하 고 대신 높은 노 오 스-타입 glycans (주로 남자5GlcNAc2) N 연결 glycan 사이트18,19,20에서 거주 . 동시에이 두 셀 라인을 사용 하 여 생물 학적 기능 및 치료 대상에 glycan 크기와 복잡성의 효과 공부 하 고 있습니다. 실제로, HEK293F 세포에서 생산 하는 glycoproteins HEK293S 세포에서 생산 하는 동일한 당단백질에 비해 더 크고, 더 복잡 한 glycans를 있을 것 이다. Glycoproteins HEK293S 세포에서 생산 되는 그들의 N-연결 된 glycans의 감소 된 화학 및 구조적이 더 많은 의무가 결정, 됩니다. 더욱 개선 하기 위해 crystallizability, glycoproteins HEK293S (그러나 아닙니다 HEK293F) 세포에서 생산 효소 endoglycosidase H (엔도 H), 귀착되 고만 노 오 스 glycans의 분열 등으로 치료 될 수만 있는 단일 N-acetylglucosamine (GlcNAc) moiety 각 N 연결 glycosylation 사이트21,22에 남아 있다. 다른 방법 또한 당단백질 식, kifunensine23를 포함 하 여 동안 glycosyltransferase 억제제의 추가 같은 셀 내에서 N glycan 처리를 제한 사용할 수 있습니다. 대체 방법을 효소 deglycosylation 펩 티 드 N glycosidase F (PNGaseF)를 사용 하 여 다음 기본 glycoproteins (HEK293F 세포)에 식을 포함 한다. 그러나, PNGaseF와 deglycosylation 기본 조건 및 증가 집계 어떤 단백질;에 덜 효과적인 것으로 표시 되었습니다. 경우에는 단백질 치료 후, 수용 성 유지 그것 가져옵니다 aspartic 산24, 아스파라긴 잔류물의 deamidation 때문에 표면에 음 전을 그것의 결정 화에 대 한 될 수 있습니다. 예측된 N glycosylation 사이트 수 또한 변경 될, 알라닌 또는 글루타민 잔류물,이 사이트에서 glycosylation N 연결을 방지 하 고 높은 동질성의 당단백질 샘플을 생성 하는 가장 자주. 또는, glycoproteins 효 모, 곤충, 및 공장 시스템, 또는 중국 햄스터 난소 (CHO) 세포16,17등 다른 포유류 세포 라인을 포함 하 여 다른 진 핵 세포 배양에서 생산 수 있습니다.
PHLsec를 포함 하 여 많은 포유류 식 벡터 셀 중간25에 재조합 당단백질 ectodomains의 분 비에 대 한 수 있습니다. HEK293 세포에서 glycoproteins의 분 비 세포 세포의 용 해에 대 한 필요 없이 신속 하 고 쉽게 정화 수 있습니다. 정화 태그의 추가 (예: 그의 태그, Strep 태그 플래그-태그, Myc-태그, 하-태그) 대상의 N 또는 C terminus 당단백질 단일 단계 친화성 크로마토그래피에 의해 정화 있습니다. 그 후, 크기 배제 크로마토그래피는 생물 및 구조적 특성에 대 한 단 분산 예제를 사용할 수 있습니다.
적절 한 조건 하에서 매우 순수 하 고 균질 당단백질 샘플 잘 diffracting 결정에서 발생할 수 있습니다. 전체 x 선 회절 데이터 집합 같은 결정에서 얻은 되어, 초기 단계는 당단백질의 전자 밀도 계산 하기 위해 결정을 해야 합니다. 구조 단백질 데이터 은행 (PDB)에서 이제까지 증가 수, 덕분에 단계적으로 대 한 가장 일반적으로 사용 되는 방법 지금까지 초기 단계26관련된 단백질 구조를 사용 하 여 분자 교체 (MR) 되고있다 합니다. 그러나, 때때로 멀티-Ig 도메인 glycoproteins27,,2829경우 되었습니다 미스터 위상 문제를 해결 하기 위해 실패 하면 다른 방법이 제시해 주셔야 합니다. 이 문서에서는, 우리 CD22 ectodomain28의 구조를 해결 하는 데 필요한 있던 단계적으로 조정, 무거운 원자 (HA)와 결정을 방법 선발. 단계적으로 조정 하는 권리를 식별 특정된 결정 격자와 결정 화 솔루션30,31당단백질에 사용할 수 있는 원자 하 반응에 의존 하는 반복적인 프로세스입니다. 또는, 시스테인과 메티오닌 잔류물에 자연 유황 원자 단계적으로 조정, 당단백질에 다른 원자에 충분히 높은 비율에 있는 경우 그리고 만약 충분히 높은 중복32, x 선 회절 데이터를 수집할 수 있습니다. 사용할 수 있습니다. 33.
멤브레인 glycoproteins의 생물 학적 기능은 종종 탄수화물과 같은 단백질 단백질 상호 작용 또는 상호 작용 단백질-리간드, 중재. ligand는 결정 격자에 있는 당단백질 바인딩 사이트에 솔루션에서 확산, 실험을 몸을 담글 수 있습니다 리간드 인식을 이해 하기 당단백질 ligand 공동 결정 구조를 성공.
여기에 제시 된 프로토콜 합성 치료 ligands34,35 및 항 체 치료제36,37와 표면 glycoproteins의 상호 작용을 이해 관련이 있습니다. 결합 구조 정보, 활동 및 열역학을 바인딩 이해 하 고 그들의 행동의 메커니즘을 개선 하는 강력한 될 수 있습니다. 치료 항 체는 당단백질에 바인딩의 운동 분석을 허용 하는 1 개의 기술은 씨38,39이다. 라스 고정된 ligand와 바이오 센서를 사용 하 여 바인딩 파트너, 궁극적으로 결정 하는 평형 분리 상수 (KD) 협회 및 분리 속도 측정. Glycoproteins의 적은 양이 필요 하기 때문에 씨는 매력적인 방법입니다 (< 100 µ g), 실험 시간 빠릅니다 (10 ~ 15 실행 당 분), 그리고 자동화 될 수 있다. ITC는 또한 glycoproteins와 바인딩 파트너40,41,,4243사이의 선호도 공부 하 고 유용 합니다. ITC는 더 많은 시간과 집중 시 약, (ΔG, ΔH, ΔS, 및 산출할) 상호 작용의 열역학에 관한 귀중 한 정보를 얻을 수 있습니다. ITC는 또한 수시로 ligands에 표면 glycoproteins의 과도 바인딩 연관 된다 약한 상호 작용을 공부 하 고 매우 유용 합니다. 또한, 이러한 기법을 평가의 다양 한 구문 바인딩 다른 세포에서 당단백질 표현에서 얻은 다른 N-연결 된 glycoforms의 효과 평가 하는 함께에서 사용할 수 있습니다. Glycoproteins HEK293F, HEK293S에서에서 생산 하 고도 H로 치료와 씨와 ITC 수행 생물 활동 및 치료 참여에 glycans의 역할의 깊이 보기를 제공할 수 있습니다.
우리는 성공적으로 인간의 CD2228,44 B 세포 항상성 유지 하기 위한 필수적인 sialic acid 바인딩 Ig 같은 lectins (Siglecs) 가족의 당단백질 구성원의 세포 외 도메인 (ECD)의 특성을 이러한 프로토콜 적용 . 우리는 결정 화를 촉진 하기 위하여 심층 구조 설계를 수행 하 고 Hg에 몸을 담글 하 여 x-선 데이터 집합 위상. 우리는 또한 면역 수용 체 ligand 복합물의 구조를 그것의 ligand sialic 산 (α2-6 sialyllactose) CD22 결정을 젖 었 고 따라서 glycan mimetics45,46의 구조 기반 디자인에 대 한 청사진을 제공. 또한, 우리 생성 안티 CD22 치료 항 체 epratuzumab-현재 비-Hodgkin의 림프 종47단계 III 임상 시험에서에서 치료 후보-의 단편 항 원 바인딩 (팹) 씨에 의해 그것의 바인딩 선호도 결정 하 고 차동 당화를 ITC CD22 ECD를 생성합니다. 이러한 연구는 CD22 인식 역 기능 B 세포에 대 한 잠재적인 영향으로 epratuzumab 연계, glycosylation N 연결에 대 한 중요 한 역할을 계시 했다.
프로토콜
1. 당단백질 ECD에 대 한 디자인 구성
- 인간의 CD22의 아미노산 시퀀스를 평가 (Uniprot) 단백질48,49내에 있는 예측된 도메인 요소와 경계를 식별 하는 InterPro 및 Phyre2 서버를 사용 하 여.
- 복제 인간의 CD22, 신호 펩타이드, 막 횡단 및 cytosolic 도메인 (잔류물 20-687, 여기서 부터는 CD22 extracellular 도메인, CD22 ECD) 사용 하 여 제한 효소 AgeI 및 KpnI (pHLsec 포유류 식 벡터25 에 부족의 순서 그림 2 A) 50.
참고: pHLsec 벡터25포유류 세포 있는 수용 성, 분 비 단백질의 overexpression에 최적화 되어 있습니다. 이 벡터 녹는 glycoproteins의 세포 외 분 비에 대 한 허용 하도록 분 비 신호를 포함 되어 있습니다. pHLsec에는 고정된 금속 친화성 크로마토그래피 방법을 사용 하 여 셀 supernatants에서 친 화력 정화를 촉진 하기 위하여 C-터미널 (그의)6 x 태그를 포함 되어 있습니다. - C-터미널 Ig 도메인 순차 삭제 CD22 ECD의 잘린된 구조 복제: 1-6 (잔류물 20-687), 1-5 (잔류물 20-592) 도메인, 도메인 1-4 (20-504 잔류물) 도메인과 도메인 1-3 (20-330 잔류물) (그림 2B와 2c)50 .
- NetNGlyc 서버를 사용 하 여 예측된 N 연결 glycosylation 사이트 구문51에 식별 CD22 ECD의 기본 시퀀스를 평가 합니다.
- 사용 하 여 사이트 지시 된 mutagenesis, 표준 프로토콜52 또는 PCR53, 중복 변형 각 예측된 N 연결 glycosylation 사이트 (Gln에 Asn 또는 Asn Ala) CD22 ECD의 단일 또는 몇 가지를 포함 하는 구조를 만드는 N 연결 glycosylation 돌연변이입니다.
- 유능한 대장균 변환 순서 확인 후 복제 구문, DH5α 세포54 와 맥시 prep (제조 업체의 지침)에 따라 DNA transfection에 대 한 준비.
2. HEK293F 및 HEK293S 셀 설립
참고: 필요한 시 약 및 장비를 가진 HEK293F 또는 HEK293S 세포의 모든 조작 적당 한 biosafety 캐비닛에 biosafety 수준 2 시설에서 수행 되어야 합니다. 모든 항목의 외부 표면 70% 에탄올 솔루션 또는 해당 시는 살 균 되어야 합니다.
- HEK293F 및 HEK293S 현 탁 액 셀 ( 재료의 표참조)을 얻기까지 사용 하기 위해 준비-80 ° C에서 저장.
- 미디어 따뜻한 ( 재료의 표참조)를 37 ° C 물 욕조에 1 h. 환풍구 뚜껑 125 mL 당황된 셀 문화 플라스 크를 따뜻하게 미디어의 24 mL를 전송 합니다.
- 1 mL 셀 aliquot-80 ° C 및 얼음 전송에서 얻을.
- 부분적으로 세포를 해 동 약 1 분 동안 37 ° C 물 욕조에 셀을 품 어. 셀의 1 mL 유리병에서 125 mL 당황된 셀 문화 플라스 크 포함 하는 미디어 전송.
- 발명 캡 셀 문화 플라스 크 그리고 장소 플라스 크 37 ° C, 130 rpm, 습도 70% 및 8% CO2로 설정 통에 닫습니다.
3. HEK293 세포 유지 보수
참고: 셀 밀도 세포의 생존 해야 녹고 후 약 24 시간 체크. 이 단계는 세포 접종; 다음 복구 보장 초기 생존 해야한다 > 80%.
- 신중 하 게 신선한 현 탁 액 셀을 포함 하는 125 mL 플라스 크에서 셀의 10 µ L을 제거 하 고 살 균 1.5 mL microtube에 그것을 전송. 플라스 크를 닫고 인큐베이터를 반환 합니다.
- 셀을 포함 하는 1.5 mL microtube로 Trypan 블루 솔루션의 10 µ L를 플라스틱, 철저 하 게 혼합 하 고 세 슬라이드의 약 실에 10 µ L를 전송.
- 자동 셀 카운터로 세 슬라이드를 넣고 (셀 mL-1단위로) 셀 밀도 세포 생존 능력 (비율)에 대 한 값을 얻을.
- ~0.8 x 106 셀 mL-1 다음과 같은 방정식을 사용 하 여 최종 밀도에 신선한 200 mL 문화를 예방 하는 데 필요한 것이 셀의 볼륨을 계산:
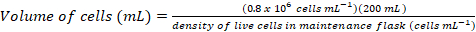 (1)
(1)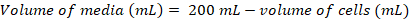 (2)
(2)
참고:이 걸릴 수 있습니다 ~ 200 mL 문화에 접종에 대 한 적합 한 세포 밀도를 5 d. - 일단 셀 밀도 200 mL 문화의 접종에 대 한 충분 한, 37 ° C에 1 시간 워밍업 미디어 목욕 물 하 고 biosafety 캐비닛으로 따뜻하게 미디어를 전송.
- 발명된 모자와 함께 500 mL 당황된 셀 문화 플라스 크에 필요한 양의 (서 방정식 2에서 계산 된) 미디어를 전송 신중 하 게 혈 청 학적인 피 펫을 사용 하 여.
- 혈 청 학적인 피 펫을 사용 하 여 미디어가 있는 500ml 당황된 셀 문화 플라스 크에 (방정식 1에서에서 계산) 현 탁 액 셀의 필요한 볼륨 전송.
- 새로운 200 mL 유지 보수 재고 모자 고 인큐베이터에 그것을 반환 합니다. 약 3 x 106 세포 mL-1의 밀도를 세포를 성장 한다. 통로 106 세포 mL-1 x 0.8의 조밀도에 셀 셀 (섹션에서에서 설명한 대로 3.4-3.7)의 안정 된 문화를 유지 하기 위해 매일 2-3 d. X 106 세포 mL-1~ 4의 밀도 초과 하는 세포를 허용 하지 않습니다.
4. 당단백질 식 HEK293 세포의 transfection
- 계산 볼륨 세포 transfection 0.8 x 10에 대 한 200 mL 문화에 필요한 미디어의6 mL-1 (섹션 3.4에서에서 식 1 및 2 사용 하 여) 세포.
참고: 수행할 수 있는 200 mL transfections 수 유지 보수의 세포 밀도에 따라 달라 집니다. - 발명된 모자와 함께 새로운 500 mL 셀 문화 플라스 크에 미디어와 transfection에 대 한 셀의 필요한 볼륨을 전송 하 고 인큐베이터에 셀 주식을 반환 합니다.
- 셀 분할에 따라 순응을 셀 수 있도록 transfection 전에 1 시간을 품 어.
- 살 균 50 mL 원뿔 튜브로 50 µ g의 DNA 전송 및 미디어의 5 mL로 희석. 진공 0.22 μ m 여과 시스템을 사용 하 여 다른 무 균 튜브에 희석된 DNA 필터링.
- 혼합 희석, transfection 시 약 질량: 볼륨 1:1 비율에 DNA 필터링. 부드럽게 혼합 하 고 10 분 동안 실내 온도에 솔루션을 품 어 DNA: transfection 시 약 해결책을 소용돌이 친다.
- 셀에 직접 DNA: transfection 시 솔루션을 추가 합니다. 37 ° C, 130 rpm, 습도 70% 및 8% CO2 5-7 d 통에 transfected 세포를 품 어.
5입니다. 세포 Transfection 조건의 최적화
참고: 최대 당단백질 수율에 대 한 세포 transfection 조건 최적화, transfect 세포 초기 셀 밀도의 다양 한에서와 시간(그림 3)에 단백질 수율을 평가. 섹션 4에서에서 설명한 대로 셀을 transfect, 초기 셀 밀도 0.5 x 10에서 배열에서 2 x 106 6 mL-1 55셀. 시험 transfections (125 mL 당황 하 고 세포 배양 플라스 크)에 25 mL 전체 볼륨을 공간 및 시 약 하기 DNA의 6 µ g으로 확장할 수 있습니다. DNA의 양을 최적화 된55를 수도 있습니다.
- 모든 하루 후 transfection (일 1-7), (biosafety 내각)에서 멸 균 1.5 mL microtube 세포 배양에서 500 µ L 약 수를 전송할.
- 컬렉션 직후는 microcentrifuge에서 5 분 12000 x g에서 aliquoted 세포를 스핀. 모든 샘플 얻을 때까지 상쾌한 새로운 1.5 mL microtube 및 4 ° C에 게 전송 합니다.
- Densitometry에 의해 분 비 당단백질을 quantitate
- 모든 샘플은 얻은 각각의 aliquot 20 µ L 새로운 1.5 mL microtube로 시음 하 고 6 µ L의 4 x Laemmli 샘플 버퍼를 비 감소와 함께 혼합.
- 샘플 온도 블록에서 95 ° C에서 5 분 동안 끓인 다. microcentrifuge에서 12000 x g에서 1 분에 대 한 샘플을 회전 합니다.
- 10 잘 4-15% 그라데이션 SDS 페이지 젤 잘 당 각 샘플의 20 µ L을 로드 합니다. 단백질 크기 마커 대 한 차선을 포함 합니다. 트리 스/글리신/SDS 버퍼에 20 분에 대 한 250 V에서 젤을 실행 합니다.
- 젤 Coomassie 전송 실행된 완료, 다음 20 분 대 ( 재료의 표참조) 얼룩 ddH2O 20 분 이미지 젤 젤 드 얼룩.
- Densitometry ImageJ, 표준 프로토콜57,58다음을 수행 합니다.
- 컴파일하고 x 축에 '일 후 transfection'와 데이터 플롯 및 y 축(그림 3)에 ' densitometry 값'.
참고: 또는, 단백질 발현 SDS 페이지 시각화에 대 한 충분 하지 않은 경우 부 럽 같은 기술을 수 있습니다 사용된56.
- 씨에 의해 분 비 당단백질을 quantitate
- 씨59를 사용 하 여 분 비 당단백질의 금액을 quantitate Ni NTA 바이오 센서를 사용 하 여.
- 컴파일하고 x 축에 '일 후 transfection'와 데이터를 플롯과 '단백질 농도 (µ g/mL)' y (그림 3A).
6. HEK293 상쾌한에서 수용 성 당단백질의 정화
- 4 ° c.에 20 분 동안 6,371 x g에서 원심 분리 하 여 세포를 수확 CD22 ECD 분 비를 포함 하는 상쾌한을 유지 하 고 0.22 μ m 필터를 사용 하 여 필터링 합니다.
- 로드에 미리 equilibrated 4 mL 분-1 에서 상쾌한 벤치탑 크로마토그래피 시스템을 사용 하 여 (20 mM Tris pH 9.0, 150 mM NaCl, 5mm 이미) Ni NTA 열 (5 mL 볼륨).
참고: 다른 선호도 기반 정화 기술은 사용할 수 있습니다, 제 1에서 구조 디자인에 포함 된 선호도 태그에 따라. - 3-4 열 량 (CV) 워시 버퍼 (20 mM Tris pH 9.0, 150 mM NaCl, 5mm 이미)의 유사성 열 세척 표면에 뜨는 로드, 다음.
- 분수 (그림 3B)를 수집 하는 동안 차입 버퍼 (20 m m Tris pH 9.0, 150 m NaCl, 500mm 이미 m)의 4-100% 그라데이션 (4 CVs)을 사용 하 여 열에서 순화 된 당단백질 elute
- 15 분 동안 또는 샘플 500 µ L의 볼륨에 도달할 때까지 4 ° C에서 4000 x g에서 centrifuging 여 10 kDa 공칭 분자 무게 제한 (NMWL)와 집중 된 원심 여과 장치에 eluted 피크를 포함 하는 풀 분수.
- 500 µ L 샘플 루프 및 미리 equilibrated (20 mM Tris, pH 9.0, 150 mM NaCl)에 0.5 mL 분-1 에 부하 집중된 당단백질 주입 고속 단백질 액체 크로마토그래피 (FPLC)에 높은-성능 크기 제외 열 (약 24 mL 볼륨) 분수 (그림 3C)를 수집 하는 동안 4 ° C에서 시스템.
- SDS 페이지 젤 eluted 분수 분수를 포함 하는 당단백질을 식별 하기 위해 실행 하 고 해당 분수 수영장. SDS 페이지 젤60섹션 5 설명 된 대로 실행할 수 있습니다.
7입니다. 정화 당단백질의 Deglycosylation
- 크기 배제 크로마토그래피 280에서 흡 광도 사용 하 여 다음 순화 된 단백질의 농도 측정 nm 소멸 계수 (예: 1.418 M-1 c m-1 CD22 ECD에 대 한)로 나눈 값.
참고: 관심사의 단백질의 이론적인 소멸 계수 계산할 수 있습니다 ExPASy ProtParam61같은 서버를 사용 하 여. - 10 µ L 1 X 엔 H 버퍼 (제조 업체의 지침)에 따라 상업 효소의 순화 된 단백질의 1 밀리 그램의 비율로 37 ° C에서 1 시간에 대 한 엔도 H로 순화 된 단백질을 품 어.
참고: 엔도 H 앞 생산 높은 노 오 스 glycans HEK293S에서 각 glycosylation 사이트21에서 단일 GlcNAc moiety를 떠나. 엔도 H는 다른 효소 (예를 들어,PNGaseF24)이이 목적을 위해 사용할 수 있습니다 HEK293F 셀22에서 생산 하는 단백질에 glycans를 쪼개 하지 않습니다. - Deglycosylated ECD 500 µ L에 집중 하 고 높은-성능 크기 제외 열 (약 24 mL 볼륨)도 H를 제거 하 고 모든 결과 집계를 분리 하는 FPLC에 0.5 mL 분-1 에 젤 여과 착 색 인쇄기를 실행.
- 다운스트림 실험에 사용 될 때까지 4 ° C에서 deglycosylated 단백질을 저장 합니다.
8입니다. Glycoproteins의 결정 화
참고: 상업적으로 사용 가능한 화면을 사용 하 여 결정 화 실험을 수행 하 고 앉아 드롭 실험 결정 화 로봇을 사용 하 여 설정 합니다.
- 집중, ECD에 10 mL-1 원하는 농도 얻을 때까지 10 kDa NMWL 4000 x g (4 ° C)에서 원심 여과 장치를 사용 하 여 deglycosylated.
- 280에서 흡 광도 사용 하 여 단백질 농도 결정 및 소멸 계수에 의해 나누어.
- 이전 샘플에서 원치 않는 먼지나 다른 오염 물질을 제거 하는 결정 화 실험 4 ° C에서 5 분 동안 12000 x g에서 원심 분리기 샘플.
- 저수지를 채우기 96 잘 앉아의 우물 상업적인 결정 화면에서 80 µ L 화 솔루션의 결정 화 접시를 드롭.
참고: 우리는 스파스 매트릭스 상업 화면 설계 된 구조는 PDB에 관하여 가장 성공적인 결정 화 조건에 따라 사용 합니다. - 200의 총 드롭 볼륨으로 결정 화 접시의 우물에 상품을 특 면 결정 화 로봇을 사용 하 여 1: 1의 순화 된 단백질: 결정 화 솔루션의 비율로 nL.
- 전체 접시는 적절 하 고, 일단 표시 및 자외선 빛 접시 영상 검사에 테이프와 장소 접시를 봉인.
- 초기 당단백질 크리스탈 안타 게 하는 조건을 식별 하기 위해 표시 하 고 자외선 빛을 사용 하 여 결정 화 접시 즉시 설치, 다음 그리고 다음 주에 검사 합니다.
- 더 크리스탈 크리스탈 히트 또는 임의의 행렬 마이크로 시드 방법62,63,,6465의 조건에 따라 좋은 스크린을 사용 하 여 초기 결정 화 안타에서 얻은 최적화.
- 곳을 알아내는 보호 어떠한 결정 라도 어머니에 크리스탈을 몸을 담글 하 여 결정 화 조건 내에서 충분 한 곳을 알아내는-막는 부족 주류 20% (v/v) 글리세롤 솔루션과 보완 솔루션 (또는 동등한 곳을 알아내는-막는, 에틸렌 글리콜 등 또는 폴 리 에틸렌 글리콜 400)입니다.
- Cryoloops 및 플래시 마운트 크리스탈 홈 소스 diffractometer 또는 싱크 로트 론 방사선을 사용 하 여 데이터 수집 전에 액체 질소에 그들을 동결.
9. 무거운 원자 Derivatization를 사용 하 여 단계적으로
참고: 전에 하 화합물의 조작, 안전 측면 고려 되어야 한다. 단백질 결정학에서 사용 되는 화합물 생물학 분자를 그들의 강한 유사성에 대 한 선택를 하 하 고 장기간된 노출에서 인간의 건강에 위험을 포즈. HA 화합물 그들의 물질 안전 데이터 시트에 언급 된에 대 한 적절 한 안전 조치를 취할.
- 테스트 하려면 다른 하 화합물, 농도 및 부 화 시간을 매달려 드롭 수증기 유포 방법66를 사용 하 여 24-잘 결정 화 접시에 8 절에서에서 얻은 잘 diffracting 크리스탈 재현 합니다.
- 결정 하 되 크리스탈 derivatization 사용. 서버 (예를 들어, 무거운 원자 데이터베이스 시스템67) 그들은 단백질 결정 화 상태에 대 한 적절 한 보장 하 복합 선택, 지원할 수 있습니다.
참고: 하 스크린 가장 효과적인 하 화합물 단계적으로 조정의 쉬운 심사에 대 한 상업적으로 사용할 수 있습니다. "매직 7" 하 화합물의 집합 이전 HA derivatization68에 대 한 성공의 높은 가능성을가지고 설명 했습니다. - HA(그림 4)를몸을 담글에 대 한 워크스테이션을 설정 합니다. 빠르게 전송는 cryoloop를 사용 하 여 0.2 µ L 하의 최종 농도가 1-20 m m에서에서 배열 되도록 결정 화 조건에 희석 HA 솔루션을 포함 하는 22 m m 커버 슬립에 드롭 크리스탈. 방울을 봉인 하 고 시간 (그림 4B)의 서로 다른 길이 대 한 품 어. 좋은 출발점은 5, 10, 60, 및 90 분와 하룻밤.
- 시각적으로 가능한 균열 또는 당단백질 크리스털 또는 크리스털 derivatization에 불리 한 효과 나타낼 수 있는 색상의 변화를 식별 하는 가벼운 현미경으로 결정을 검사 합니다.
- 마운트 cryoloops에서 결정 및 다시 담가 크리스탈 30 s 3 연속 0.2 µ L에 20% (v/v) 글리세롤 (또는 다른 곳을 알아내는-막는) 보충 포함 어머니 주류 솔루션 상품69. 결정에 다시 몸을 담근 채 하 복합 였던 비 특히 부분 인 약한 HA 바인딩에 의해 발생 감소를 제거 합니다. 플래시 동결 결정 액체 질소 (그림 4B).
- 데이터 수집, 처리, 구조 솔루션, 그리고 세련미, 앞에서 설명한 프로토콜26,70,,7172사용 합니다.
10. 몸으로 그것의 Ligand와 당단백질 결정
- 교수형-드롭 증기 확산 방법을 사용 하 여 24-잘 결정 화 접시에 8 절에서에서 얻은 잘 diffracting 결정을 재현 합니다.
- 20 mM Tris, pH 9.0, 150 m NaCl m에서에서 50 m m ligand의 재고 솔루션을 준비 합니다.
참고:는 ligand의 농도 당단백질에 선호도 따라 준비 되어야 한다. 선호도 알 수 없는 경우 메서드를 사용 하는 ITC (섹션 12.2) 등 몸으로 실험 시작 전에 선호도 결정 해야 수 있습니다. ligand 필요한 버퍼에 원하는 농도에서 수용 성 인지 확인 합니다. - 드롭 포함 ECD 결정 하는 리간드의 다양 한 농도 추가 하 고 시간 길이 5 d 5 분 사이에 부 화에 대 한 드롭 인감.
- 시각적으로 형태에 가능한 변화를 식별 하는 가벼운 현미경으로 결정을 추적 합니다.
- Cryoloops 및 곳을 알아내는 결정 탑재-어머니 주류 솔루션 20% (v/v) 글리세롤 (또는 에틸렌 글리콜 또는 저 분자 무게 폴 리 에틸렌 글리콜 400 등 다른 곳을 알아내는-막는) 보충에서 그들을 보호69.
- 앞에서 설명한 프로토콜73,,7475을 사용 하 여 데이터 수집, 처리, 구조 솔루션 및 수정, 있습니다.
11. 단편 항 원 바인딩 (팹)의 생산
- 유전자 팹 무거운 체인 (HC) 및 안티-ECD 항 체, 예를 들어,epratuzumab의 가벼운 체인 (LC) 시퀀스에 해당 하는 subclone
참고: 또는, IgG 수 수 죽 습 효소 papain Fab 조각76를 생성 하 여. - 다음 수정 섹션 4에서 설명한 대로 셀을 transfect:
- 문화의 200 mL 당 90 µ g의 팹 조각의 transfection에 대 한 DNA의 총 질량을 사용 합니다.
- HC 및 LC 플라스 미드 LC 이합체 형성의 양을 줄이기 위해 2:1 비율에 transfect
- 외피의 7d, 후 세포를 수확 하 고 상쾌한을 유지 한 0.22 μ m 진공 기반 여과 장치와 필터.
- 벤치탑 크로마토그래피 시스템을 사용 하 여 PBS 버퍼에서 안티-LC (카파 나 람다) 선호도 열 equilibrate
참고: 지금까지 이면 LC 이합체 형성 문제 정화 동안에 단백질 G 친화성 크로마토그래피 카파/람다 LC 친 화력 정화 대 안으로 사용할 수 있습니다. - 상쾌한 선호도 4 mL 분-1열에 로드 합니다. 샘플 로드, 다음 3-4 CVs PBS를 가진 열을 씻어.
- 100mm 글리신, pH 2.2, 즉시 중화 10% (v/v) 1 M eluted 분수와 isocratic 차입을 사용 하 여 열에서 단백질을 elute 트리 스, 각 분수에 pH 9.0.
참고: eluted 팹 수 더 정화 이온 교환 크로마토그래피 / 크기 배제 크로마토그래피는 FPLC를 사용 하 여 4 ° c.에 의해
12.는 당단백질에 바인딩 하는 팹 및 작은 분자의 특성
- Biolayer 간섭계
- 1x 속도 론 버퍼 (1 x PBS, 0.002% (v/v) 트윈 20, 0.01% (w/v) BSA) 50 mL를 준비 합니다.
- 6. 바이오 센서 Ni NTA 사전 일로 판에 10 분에 대 한 1 x 속도 론 버퍼의 200 µ L에서 하이드 레이트.
- 그의 태그 ECD 25 ng µ L-1의 최종 농도에 1x 속도 론 버퍼의 1 mL에 희석. 500 nM의 높은 농도와 250의 후속 직렬 희석 속도 론 버퍼, x 1의 200 µ L로 순화 팹의 직렬 희석 플라스틱 nM, 125 nM, 그리고 62.5 nM.
- Aliquot 시 약 같이 그림 5A, 블랙 플랫 바닥 폴 리 프로필 렌 96 잘 microplate에 각각 잘 표시 된 솔루션의 200 µ L을 포함.
- 38,,3977 (그림 5A) 이전에 설명 된 대로 데이터 수집 소프트웨어에 활동 분석 실험을 사용 하 여 데이터를 수집 합니다.
- 간단히, 우물 속도 론 버퍼 기준 60 x 1에 바이오 센서를 전송 s 240에 대 한 당단백질의 25 ng µ L-1 을 로드 하기 전에 s (또는 1.0의 임계값까지 nm에 도달) 1000 rpm.
- 60의 두 번째 기준 후 속도 론 버퍼, x 1에는 s에 웰 스 팹의 직렬 희석을 포함 하는 바이오 센서 전송. 180 s 협회 단계 이후에 속도 론 버퍼 x 1에서 180 s 분리 단계 뒤.
참고: 바이오 센서 다시 사용할 수 있습니다 위의 프로토콜 버퍼 (500mm 이미와 PBS) 스트립에 바이오 센서 세척의 3 주기를 이루어져 있는 재생 단계 다음 5 s 뒤 5 중화에 대 한 속도 론 버퍼 x 1에서 s. 바이오 센서는 10 ~ 20까지 다시 사용할 수 있습니다 시간 같은 날 또는 가난한 데이터까지 품질 관찰 됩니다.
- (그림 5A) 분석 소프트웨어를 사용 하 여 데이터 분석:
- 아래 탭 1, 가져오기 및 선택 데이터.
- 탭 2, 단계 1: 데이터 선택, 선택 ' 센서 선택 ' 및 하이라이트 참조 웰 스 (행 E와 F, 그림 5A), 마우스 오른쪽 단추로 클릭 하 고 잘 참조로 설정. 단계 2: 빼기, 선택 ' 참조 웰 스 '. 단계 3: y 축 정렬에서 0.1 59.8의 시간 범위에서 '베이스 라인'을 선택 s. 간 단계 보정 단계 4: '분리에 맞춤'을 선택 단계 5: 프로세스, 선택 'Savitzky Golay 필터링'과 언론 과정 데이터.
- 탭 3 선택 '협회와 분리' 분석 하는 단계는 1:1 모델. '글로벌 피팅' 및 '색상으로 그룹'을 선택 합니다. 곡선을 클릭 마우스 오른쪽, '색상 변경'을 선택, 당신의 선택의 색깔에 모든 커브를 설정. '맞는 커브'를 선택 합니다. 데이터는 잘 적합 하, 만약 ' 보고서 저장 '을 선택 하 여 보고서를 내보낼 수 있습니다.
- 팹 인식에 다른 glycoforms의 HEK293F 및 HEK293S 세포 (5)에서 생산 하 고도 H 치료 (7) 경우는 효과 평가 하기 위해 다음과 당단백질으로 실험을 반복 합니다. 또한, 팹 준수할 ECD 잘림은 도메인에 대 한 통찰력을 제공 하는 실험을 반복 합니다.
- 팹 당단백질 상호 작용의 등온선 적정 열 량
참고: 여기서 설명 하는 ITC 실험 자동된 ITC 악기를 사용 하 여 수행 됩니다. 실험은 하단 96 잘 블록 라운드 1 mL에서 수행 됩니다.- ECD와 팹 20 mM Tris, pH 8.0, 밤새 저 어 바와 4 ° C에서 150 m m NaCl의 단일 4 L 비 커에 dialyze.
- 집중 dialyzed ECD와 팹 5 µ M, 50 µ M, 각각, 사용 하기 전에 4 ° C에서 5 분 동안 4000 x g에서 버퍼 집중 막 투 석의 5 mL로 세 번 세척을 보장 10 kDa NMWL와 원심 필터를 사용 하 여.
참고: 셀에 주사기 샘플 사이의 버퍼에 어떤 불일치 ITC 실험 및 데이터에서 품질의 결과 발표를 원치 않는 열을 발생할 수 있습니다. - 에 대 한 실험 1: 400 µ L a 1 셀에 로드할 수를 ECD의 그리고 120 µ L를 주사기에 로드 잘 A2에 팹의 추가. 잘 A3 혼합된 샘플 다음 실험 완료 반환 하려면 비어입니다. 각 후속 실험 순서에서 판에 추가할 수 있습니다 (즉, 실험 2: 셀-A4, A5, 주사기-빈 잘-A6; 그림 5 B)입니다.
참고: 포함 버퍼 버퍼 컨트롤 (악기를 잘 작동 확인)에 시작 하 고 각 실행으로 주사기에 샘플에 대 한 희석의 열을 계산 하기 위해 버퍼 (에 셀) 컨트롤에 (주사기)에 ligand의 끝에. 이 희석의 열 해야 다음 뺄 원시 실험 데이터에서 데이터 분석 (그림 5B) 중 계산. - 각 주입에 대 한 2.5 μ의 볼륨으로 총 16 주사를 실행 합니다. 주사 기간은 5 s, 180 s 간격 주사. 750 rpm의 교 반 속도와 5의 필터 기간 25 ° C 셀 온도 설정 s.
참고: 선호도 및 ECD:Fab 상호 작용의 열역학에 따라, 그것은 샘플 농도, 수의 주사 또는 셀 온도 변경 하려면 필요할 수 있습니다. - 앞에서 설명한40,,4143 (그림 5B) 분석 소프트웨어를 사용 하 여 데이터를 분석 합니다.
- 중복, 말은 KD 값과 표준 오류 계산에서 적어도 실험을 반복 합니다. 팹: 당단백질 상호 작용의 열역학에 glycoforms의 다른 glycoforms (섹션 5와 6) 경우는 효과 평가 하기 위해 ECD와 실험을 반복 합니다.
- 리간드-당단백질 상호 작용의 등온선 적정 열 량, ITC 실험 다음 변경 섹션 12.2에 설명 된 대로 설정:
- Dialyze 투 버퍼의 4 L에 ECD 하룻밤. 투 석의 완료 다음 투 석 버퍼를 사용 하 여 리간드를 분해.
- 낮은 친 화력 상호 작용을 검출 수 상당히 높은 농도에서 ITC 실험을 수행 합니다. ECD와 ligand 상호 작용에 대 한 셀에는 주사기에 ligand의 1mm ECD의 100 μ M의 농도에서 ITC 실험을 수행 합니다.
결과
CD22 ECD의 여러 구문은 pHLsec 식 벡터에 복제 성공적으로 되었고 overexpressed 포유류 HEK293F 및 HEK293S 셀 라인에서 (그림 2 , 3A). 모든 구문 크기 배제 크로마토그래피에 의해 크기 동질성을 순화 되었고 결정 화 연구 (그림 3B 와 3c) 매우 순수한 예제를 굴복. CD22 구문을 잘 diffracting 결정을 주도 했다 d1 d3 잘림 (잔류물 20-330), Ala (N67A, N112A, N135A, N164A 및 N231A), Asn에서 돌연변이 6 예측된 N 연결 glycosylation 사이트의 5 등만 HEK293S 세포에서 생산 위치 N101 유지 되었다 glycosylation 사이트 (이 구문을 CD22 라는20-330, 5A). 크리스탈 MCSG 1 스파스 매트릭스 스크린의 여러 조건에서 가져온 하지만 최고의 결정 pH 8.5 30% (w/v) 폴 리 에틸렌 글리콜 4000, 0.2 M 리튬 염화 물 및 0.1 M 트리를 포함 하는 상태에서 했다. 이 기본 결정 2.1 Å 해상도; diffracted 관련된 Siglec 단백질의 Ig 도메인의 알려진된 구조를 사용 하 여 미스터 검색에 어떤 해결책 든 지 생성 하지 않았다.
위상 정보를 취득, 우리 하는 보육 시간 1 d (그림 4)을 5 분에서에 대 한 화합물의 1-20 m m에서 배열 하는 농도에서 Hg, Pt, 운영 체제, Ta, 및 Br 포함 하 화합물의 패널 기본 결정을 젖 었. 우리는 크리스탈 형태학에 있는 변화를 모니터링 하 고 발견 결정 하 20 m m 컴파운드와 배어 귀착되 었 다 급속 한 균열 및 결정의 용 해. 우리 63 탄탈 브 로마 이드 클러스터, 백 금 염화 물, mercuric 아세테이트와 mercuric 염화 젖 었 했다 설정된 부 화 시간을 다음과 같은 그들의 모양을 유지 하는의 총을 동결. 크리스탈 7 m 30 분 캐나다 빛 소스 (CLS) 08-BM beamline (새스커툰, 캐나다)에 형광 스캔에 변칙 신호를 보여준 mercuric 염화의 흠뻑 젖 고 다 파장 변칙 분산 단일 x-선 데이터 컬렉션에 대 한 허용 크리스탈입니다. 이러한 데이터 세트 허용 CD22의 수은 하위 구조를 해결 하기 위해 우리20-330, 5A, 단일 수은 원자 위치 C308 무료 시스테인에 바인딩된 및 궁극적으로 봐도 CD22의 구조를 구축 공개는 단계적으로20-330, 5A 전자 밀도 지도 사용 하 여 빌드78.
Unliganded 구조 해결 되었다, 일단 그것의 ligand, α2-6 siallylactose에 바인딩된 CD22의 구조를 해결에 관심이 있었습니다. 우리는 먼저 α2 6 sialyllactose ITC를 사용 하 여 상호 작용의 바인딩 열역학 특성으로 CD22의 선호도 계산. 우리는 ~ 280 μ M의 선호도 관찰 하 고 초기 농도 식별 하기 위해이 정보를 사용 (~ KDx 100) 우리의 네이티브 CD2220-330, 5A 결정의 적시에 사용할 ligand의. 우리 5 분, 2 시간, 14 h, 40 h 및 5 d 25 m m siallylactose와 CD2220-330, 5A 결정 젖 었 고 크리스탈 형태학에 있는 변화 모니터링. ~ 75 결정의 총 다양 한 시간 포인트에서 동결 되었고 CLS 싱크 로트 론 beamline 08-ID (새스커툰, 캐나다) 원격 데이터 수집에 대 한 전송. 6 x-선 데이터 집합의 총은 잘 diffracting 결정에서 수집 되었다. 각 x-선 데이터 집합에서 구조 unliganded CD2220-330, 5A 구조를 사용 하 여 초기 검색 모델로 서 씨에 의해 해결 되었다. 모든 데이터 집합에 대 한 결과 전자 밀도 CD22의 바인딩 사이트 내에서 α2 6 sialyllactose에 대응할 Fo Fc 지도에 긍정적인 밀도 대 한 다음 검사 했다. 놀랍게도, 모든 데이터 집합 수집, 심지어 그 후 부 화 시간, 5 분만 포함 된 ligand 바인딩 사이트에서에 해당 하는 긍정적인 밀도 젖 었 하는 결정에서. Unliganded 및 liganded CD22의 전반적인 구조 α2 6 sialyllactose와 몸을 담글 실험의 성공을 설명할 수 있는 최소한의 구조적 변화, 매우 유사 했다.
우리는 다음 CD22 치료 항 체 epratuzumab 씨 및 ITC 실험 (그림 5)에 의해 인식의 항 원 표면 특징. 다른 glycoforms와 CD22 구문에 epratuzumab 팹 바인딩의 활동 및 열역학 프로필 작은 glycans (327 nM 대 24 nM에 대 한 선호도에 14-fold 개선까지 함께 감소 N 연결 glycan 크기 증가 선호도 CD22 공개 에 라스; 188 nM 대 58 nM ITC에). CD22의 단일-지점 돌연변이 사용 하 여 씨와 epratuzumab 팹 CD22 d1 d3 공동 결정 구조28해결 glycan CD22 N 연결 제한 액세스 하는 epitope 항 체의 확인 되었다.
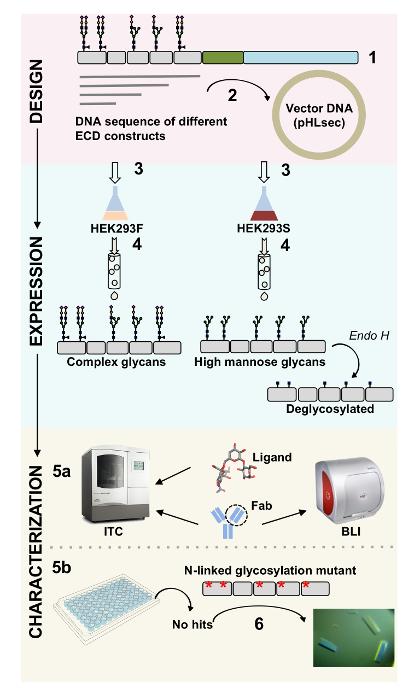
그림 1 . 생물 및 구조적 특성을 구문 디자인에서 당단백질 특성 개요. (1) 기본 시퀀스 대표 당단백질의 분석. 회색, 세포 외 도메인 (ECD); 녹색, 막 횡단 (TM) 세그먼트; 그리고 파란색으로 당단백질의 cytosolic 도메인. 예측된 N 연결 glycans로 표시 됩니다. ECD 구문 (2) 복제입니다. (ECD의 표현 3) 포유류 세포에서 생성합니다. (4) 당단백질 정화입니다. HEK293F에 표현 된 단백질 복잡 한 glycans 포함 됩니다, 하는 동안 HEK293S에 표현 된 단백질 높은 노 오 스 glycans가 있을 것 이다. Glycoproteins의 효소 처리 glycosylation N 연결 된 사이트에만 GlcNAc moiety와 glycoproteins에도 H 결과 HEK293S 세포에서 생산. (5a) Glycoproteins 항 체 바인딩을 위한 biolayer 간섭계 (BLI) 및 등온선 적정 열 량 (ITC)에 의해 테스트 됩니다. 작은 ligands 선호도 또한 ITC에 의해 측정할 수 있습니다. 어떤 경우에도 헤 (6) HEK293S와 deglycosylated에 표현 등 균질 N 연결 된 glycans와 glycoproteins의 (5b) 결정 화 실험 돌연변이 glycosylation N 연결 사이트의 결정을 얻을 필요가 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 . CD22 ectodomain DNA 포유류 세포에서 식에 대 한 구성의 디자인. A) pHLsec 플라스 미드 과도 transfection CD22 ECD 구문에 대 한 사용의 표현. 복제에 사용 되는 AgeI 및 KpnI 사이트는 빨간 상자에 표시 됩니다. B) The CD22 ECD 포함 7 Ig 도메인 (d1-d7) 및 12 예측된 N 연결 glycosylation 사이트 (파란색). 4 구조 CD22 ECD에서 설계 되었습니다. C) 1 %agarose 젤 CD22 ECD의 PCR amplicons 보여주는 pHLsec 포유류 식 벡터에 클로닝을 위한 구성. 첫 번째 레인 1 kb DNA 마커를 포함합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
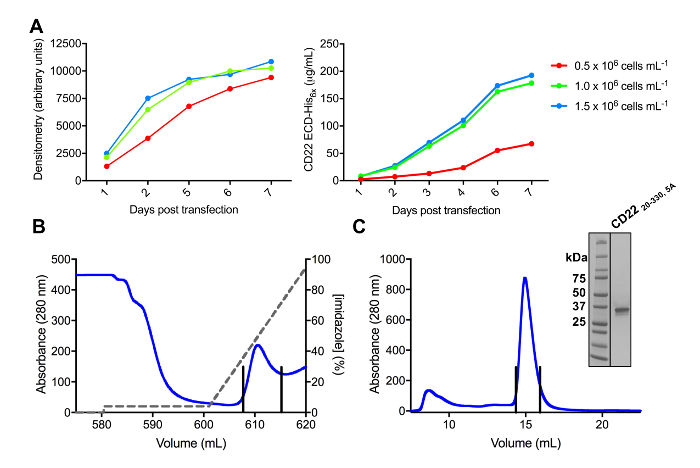
그림 3 . 식 하 고 glycoproteins의 정화입니다. A) 식 수익률에 셀 밀도의 효과. HEK293F 현 탁 액 셀의 소규모 25 mL 문화에서 당단백질 식 페 셀 (0.5 x 106 세포 mL-1, 106 세포 mL-1x 1.0 및 1.5 x 106 세포 mL 의 3 개의 다른 시작 밀도 사용 하 여 -1). 정량화와 오른쪽 패널에서 양적 라스 densitometry SDS 페이지에서 왼쪽된 패널에 의해 수행. 값은 한 당단백질 준비의 대표입니다. B) 첫 번째 정화 단계의 크로마 구성 CD2220-330, 5A에서 Ni NTA 선호도 열을 사용 하 여 상쾌한의 600 mL. 당단백질은 eluted 100 %500 m m 이미 포함 된 차입 버퍼에 해당 한 이미 (회색 선), 그라디언트를 사용 하 여. 풀링된 분수 수직 선으로 묘사 된다. C) 에 대 한 크기-배제 크로마 구성 CD2220-330, 5A는 고성능을 사용 하 여 젤 여과 열. 차입 피크에서 풀링된 분수 수직 선으로 묘사 된다. 삽입: Coomassie 스테인드 SDS 페이지 젤은 당단백질의 순도 보여주는. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 . 크리스탈 무거운 원자를 가진 몸을 담글. HA 화합물과 기본 결정을 몸을 담글의 A) 샘플 워크스테이션 모든 도구는 레이블이 필요 합니다. B)의 결정을 따른 스텝 구성 CD2220-330, 5A 하 화합물. 1 단계, 잘 결정, HA 솔루션 HA의 최종 농도 1-10 mM에서 범위는 결정 화 조건에 희석을 포함 된 커버 슬립에는 0.2 µ L 루프를 사용 하 여 전송 결정을 포함 하는 오픈. 2 단계, 결정 화 접시에 방울을 봉인 하 고 다른 기간에 대 한 복합 HA와 크리스털을 품 어. 3 단계, 루프에서 젖된 크리스탈 탑재 및 백-담가 30에서 3 연속 0.2 µ l 20% (v/v) 글리세롤 커버 슬립에 적절 하 게 보충 어머니 주류 솔루션을 포함 하는 s. 4 단계, 플래시 동결 액체 질소로 루프에 장착 된 크리스탈 하 고 싱크 로트 론 beamline에 선적을 위한 퍽에 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
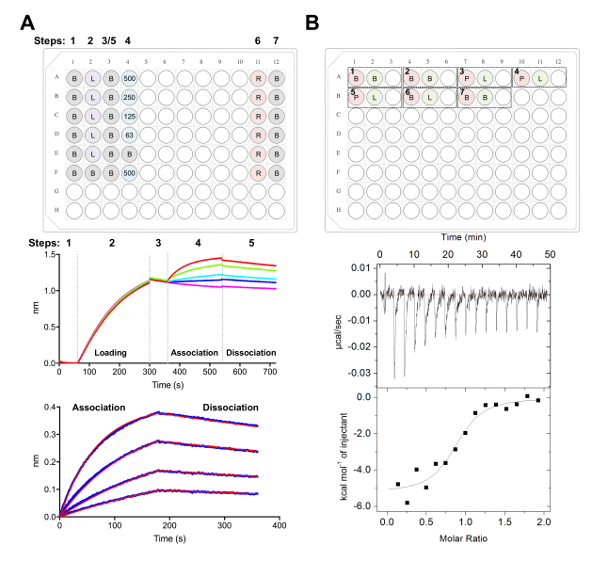
그림 5 . Biolayer 간섭계와 등온 적정 열 량 측정 측량입니다. A) 대표 씨 실험. 상단 패널: 플레이트 설치 속도 실험, 다음 표시 됩니다에 대 한의 예: 1 x 속도 론 버퍼 (B), 그의6 x-태그 당단백질 로드 (L), 대표 팹 농도 (62.5, 125, 250, 500 nM), PBS + 500 m m 재생성 버퍼 (R), 그리고 속도 론 중화 x 1 버퍼 (B). 각 잘 솔루션의 200 µ L를 포함합니다. 동역학 실험 단계 번호는 접시의 위쪽에 표시 됩니다. 중간 패널: 대표 씨 실험 Ni NTA 바이오 센서를 사용 하 여 수행 및 상단 패널에 설명 된 접시의 원시 데이터입니다. 단계 번호 기준 (1), 그의6 x 당단백질 로드 (2), 초기 (3), 팹 (4) 및 (5) 분리의 직렬 희석에서 협회에 해당 합니다. 재생 단계 표현 (6-7 단계). 하단 패널: 원시 협회 및 해당 분리 (파란 선) 1: 1을 보여주는 대표적인 분석된 데이터 (레드 라인) 적합. B) 상위 패널: 단일 ITC에 대 한 대표적인 플레이트 설치 바닥 블록 라운드 96 잘에서 7 실험 자동된 ITC 악기에서 실행. 각 실험은 3 개의 우물의 구성 되어 있습니다. 셀 (400 µ L)에 대 한 샘플에 해당 하는 첫 번째 잘 (레드), 주사기 (120 µ L)에 대 한 샘플에 해당 하는 두 번째 잘 (녹색). 3 잘 남아 빈, 그리고 혼합된 샘플 잘 실험 완료 다음이 반환 될 것입니다. 실험 1, 2 및 7 버퍼 버퍼 컨트롤에 있습니다. 실험을 3-5 셀 및 팹 또는 주사기에 ligand (L)에서 당단백질 (P)와 triplicate 실험을 나타냅니다. 실험 6 희석 제어의 ligand 열을 나타내고 데이터 분석 중 실험 3-5에서에서 공제 한다. 하단 패널: 대표적인 원료 (맨 위) 및 가공된 (아래) ITC 데이터 CD22 ECD에 바인딩 팹 (epratuzumab)을 보여주는 HEK293F 세포에서 생산. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
막 고정 glycoproteins 세포 기능에 대 한 중요 하 고 매력적인 치료 대상. 여기, 우리 모두 혼자 하 고 작은 분자 ligands 복잡 한 막 glycoproteins, ECD의 구조 및 생물 특성에 대 한 프로토콜을 제시 하 고 놀라 우 파편. 성공적으로 인간의 CD2228, B 셀 체크79에 체액 성 면역을 유지에 관련 된 중요 한 공동 수용 체의 세포 외 액의 3 개의 N-터미널-대부분 Ig 도메인의 결정 구조를 결정 하기 위해이 프로토콜을 사용 했습니다. 우리는 자연 ligand α2 6 sialyllactose CD22의 바인딩 사이트 특징 또한 있고 인간의 CD22 향해 치료 항 체의 인식 모드를 정의. B 세포 및 분자 로드맵 발전 새로운 CD22 대상된 작은 분자의 항 체 기반으로 식을 제한 했다 Siglecs 가족의 중요 한 일원의 구조-기능 관계에 대 한 통찰력을 제공 하는 이러한 결과 치료제입니다. 이 프로토콜은 Ig 포함 된 B 세포 수용 체에 대 한 성공적으로 사용 되었다, 하는 동안 우리는 별개의 도메인 조직과 어떤 막 당단백질의 구조 및 생물 특성에 대 한 우리의 접근을 적용할 수 있는 제안 합니다. 이러한 경우에 설계 및 조합 N 연결 glycan 돌연변이 (Gln 또는 중 Ala) 구문을 결정 성장 및 고해상도 회절에 적합 찾을 수 계산 수를 생성 합니다.
균질 하 고 순수한 당단백질 샘플을 얻는 것은 결정 성장 및 x 선 회절, 뿐만 아니라 류의 생물 특성에 대 한 중요 한 중요성의. N 연결 된 glycans glycoproteins에 본질적으로 다른 유형의 그리고 크리스탈 형성을 막을 수 있는 당단백질 내 구조적 및 화학이 발생할 수 있습니다. 이 마이크로-이 줄이기 위해, 전략 항구 N 연결 glycans, 또는 뒤에 endoglycosidases (EndoH) 같은 치료 돌연변이 세포 라인 (HEK293S) 등을 사용 하 여 예측 하는 Asn 잔류물을 제거 하려면 포인트 변이 소개 하는 상당히 수 있습니다. 결정 화 성공15,,2122향상. 이 프로토콜을 수용 성 glycoproteins 및 셀 표면에 뜨는에 분 비 된 팹의 정화를 다루겠습니다. 당단백질 분 비 세포 세포의 용 해에 대 한 필요성 또는 가혹한 화학 제품 또는 세제의 추가 없이 순으로 비교적 간단한 경로 제공합니다. 세포 표면에 뜨는, 얻은 다음 셀 수확 다음 열 (예를 들어, Ni NTA 태그 그의 glycoproteins 또는 Fab 조각에 대 한 LC 선호도) 관심사의 단백질에 대 한 선호도 통해 직접 실행 됩니다. 그러나, 사용 열 셀 표면에 뜨는 (예, pH)의 조건에 따라 열에 관심사의 단백질의 바인딩 기능 수 있습니다 영향을 받을. 이 경우 그것은 집중 하 고 버퍼 교환 표면에 뜨는 셀 열에 바인딩 개선 하기 위해 필요할 수 있습니다. 또한, 단백질 순도 평가할 수 있도록 정화 하는 동안 품질 관리 단계를 고용 하는 것이 좋습니다. SDS 페이지 젤 또는 (이전, 도중 및 정화 단계 후)는 모든 샘플의 서쪽 오 점 실행 제안 된 정화 계획은 관심사의 단백질에 대 한 적합 여부에 대 한 통찰력을 얻을 수 있습니다. 오염 밴드 SDS 페이지에 표시 되는 경우 또는 여러 종의 정화 하는 동안 가져온 경우 (예를 들어, 크기 배제에 여러 봉우리), 추가 정화 단계 고려해 야 합니다, 예를 들어, 이온 교환 크로마토그래피, 얻을 수 다운스트림 결정 화80의 순도 증가 기회
고분자의 결정 화에 대 한 잠재적인 결정 화 조건 높은 단백질 농도에서 다 수의 심사에 대 한 적합 한 크리스탈 안타를 찾을 수 있도록 관심사의 단백질의 높은 수익률을 얻기 위해 중요 한이. 일반적으로, HEK293 세포 라인 여기 논의 (HEK293F 및 HEK293S) 강력한 식 시스템을 필요에 따라 더 많은 샘플을 생산 하 쉽게 확장 될 수 있습니다. 그러나, 그것은 관심사의 단백질이 세포 라인 내에서 충분히 표현 하지 않을 수 있습니다. 이러한 경우에는에서 Expi293 셀81,82, 같은 다른 셀 라인, 단백질 식의 우수한 수준을 보여주 발견 되었습니다 하 고 대 안으로 고려해 야 합니다.
정돈, diffracting 크리스탈 얻지 못하면 다음의 고 순도도 불구 하 고 관심사의 단백질의 여러 구문 테스트, 크리스탈 형성을 촉진 하는 결정 화 기술을 확장 필요할 수 있습니다. 그것은 그 항 체 및 nanobodies의 팹 조각 우수한 결정 화 강화, 고 수 정돈된 크리스탈83,,8485포장 홍보 표시 되었습니다. 이 파편은 표현 고 동질성, 정화 고 결정 화를 촉진 하 관심사의 단백질을 가진 복합물에 사용 될 수 있습니다. 중요 한 것은, 제 10에 설명 된 대로 생산 팹 조각 비작동 LC 이합체86를 형성 하는 경향이 있을 수 있습니다. 이러한 이합체 오염 물질 고 정화 하는 동안 제거 한다. 그러나 우리의 경험에서 LC 이합체 종종 다른 보존 볼륨 크기 제외에 또는 이온 교환 크로마토그래피에 뚜렷한 피크로 elute 있고 따라서에서 제거할 수 있습니다 팹 정화-이것은 항상 사실이 아니다. 이러한 기술을 Fab 정화에서 LC 이합체를 제거 하기에 충분 하지 않으면, 추가 정화 방법, 단백질 G 친 화력 정화 등 순도 향상 시키기 위해 사용할 수 있습니다.
대안 공동-complexation 놀라 우 파편을, 임의의 행렬 microseeding 같은 문서화 기법 정돈된 크리스탈63,70를 얻기의 기회를 높일 수 있습니다. 이 방법은 크리스탈 크리스탈 성장을 촉진 핵 제공 결정 화 조건에 짓 눌린, 차선의 결정의 작은 금액의 추가 포함 한다. 이 관심, 또는 유사한 도메인 아키텍처 및 3 차 구조에 그들의 단백질의 결정을 사용 하 여 수행할 수 있습니다. 또한, 혼자, 단백질을 구체화 하려고 또는 Fab 조각 또는 관심의 작은 분자와 복잡 한 임의 매트릭스 microseeding은 수행할 수 있습니다. Cryo 전자 현미경 검사 법의 최근 발전 또한 게이 기술을 적절 한 기능87,88와 분자에 대 한 고해상도 구조 정보를 얻기 위해 엑스레이 결정학에 매력적인 대안 89,,9091.
X 선 회절 데이터 집합의 단계적 씨에 의해 실패, 몸을 담글 하 변칙 분산 또는 isomorphous 교체 하 여 위상 문제를 해결 하기 위해 필요할 수 있습니다. 단백질의 아미노산 시퀀스의 검사 하 derivatization, 바인딩에 대 한 최적의 pH를 포함 하 여에 대 한 전략에 대 한 단서를 제공할 수 있습니다. 특히, 단백질 내 짝이 없는 시스테인 특히 하 화합물 수은 포함 하는 바인딩할 수 있습니다. HA 화합물과 기본 결정을 몸을 담글 최적의 하 화합물의 id, 그것의 농도 및 필요한 보육 시간을 결정 하는 반복 프로세스입니다. 초기 몸을 담글 시도 단계적 적합 하 포함 잘 diffracting 결정을 양보 하지, 그것은 HA 바인딩의 확률을 개선 하 여 비정상적인 신호를 개선 아미노를 함유한 산 성 대체를 소개 해야 있습니다. 그러나 예로 돌연변이 바인딩할 효율적으로 Hg, Au, Pt 식이나 Pb. 단백질의 변칙 단계적으로 조정, 광범위 하 게 사용 되는 대장균 에서 seleno-메티오닌 보충 미디어에 변칙 단계적 무료 시스테인 잔류물을 포함 하는 해당 시스템을 안정적으로 seleno-메티오닌 정지92,93, 포유류 세포를 위해 쉽게 사용할 수 있는 이며 미래 발달의 지역 이다.
관심의 당단백질의 unliganded 구조를 얻은 작은 분자 ligands와 결정을 몸을 담글 면역 수용 체 ligand 복합물의 구조를 얻기 위해 수행할 수 있습니다. 이러한 데이터는 당단백질의 생물학적 기능에 높은 해상도 통찰력을 제공 뿐만 아니라 작은 분자 치료제로 사용 될 수 있는 더 구체적이 고 높은 선호도 ligands의 합리적인 디자인에 대 한 청사진을 제공 합니다. 관심의 작은 분자 ligands과 당단백질 결정을 할 때 unliganded 크리스탈 구조의 검사 해야 하는지 여부를 몸을 담글 수 나타낼 수 있습니다. 만약 가까운 크리스탈 포장 연락처 ligand 바인딩 사이트 발견 또는 ligand 바인딩 시 구조적 변화를 받을 것으로 예상 하는 지역, 주변 문제가 될 가능성이 몸을 담근 채. 이 경우에, 단백질-리간드 복합체의 공동 화 등 다른 방법은 수행 되어야 한다.
공개
저자 아무 경쟁 관심사를 선언합니다.
감사의 말
이 문서에서 설명 하는 x 선 회절 실험은 캐나다 재단 혁신, 자연과학 및 공학 연구 위원회 캐나다에 대 한 지원, 캐나다 광원에서 08-ID와 08-BM beamlines를 사용 하 여 수행 했다는 서스캐처원 대학, 서스캐처원 정부, 서쪽 경제 다양화 캐나다, 국가 연구 위원회 캐나다 건강 연구의 캐나다 학회. 우리는 ITC는 및 씨 계기에 대 한 액세스에 대 한 구조 및 생물 핵심 시설, 병원 아픈 어린이 위한 인정 하 고 싶습니다. J.E.O.에 의해 밴팅 박사 친목 BPF-144483 건강 연구의 캐나다 학회에서 지원 되었다. T.S.는의 캐나다 대학원 장학금 석사 받는 보너스와 건강 연구의 캐나다 학회에서 Vanier 캐나다 대학원 장학금. 이 작품은 건강 연구의 캐나다 학회에서 부여 PJT 148811 (제이-P.J.)를 운영 하 여 지원 했다. 이 연구는 캐나다 연구의 자 프로그램 (제이-P.J.)에서 자금 지원 덕분에, 부분적으로, 착수 했다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
참고문헌
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유