Method Article
糖タンパク質 x 線結晶構造解析および生物物理学的手法によって、免疫グロブリンフォールドのキャラクタリゼーション
要約
Biolayer 干渉計、等温滴定型熱量計、x 線結晶構造解析、免疫グロブリン倍で糖タンパク質の構造と特性評価のためのアプローチを提案します。
要約
細胞表面の糖タンパク質は、シグナリング、密着性と輸送を含む細胞の機能に重要な役割を果たします。白血球、免疫グロブリン (Ig) ひだを持っているこれらの糖タンパク質のいくつかと免疫認識と制御の中心であります。デザイン、表現、CD22 ヒト B 細胞受容体の細胞外ドメインの生物物理特性評価のためのプラットフォームを紹介します。これらのアプローチが広く Ig ドメインを含む哺乳類の糖タンパク質 ectodomains の評価に適用されることを提案します。2 懸濁液人間の萌芽期の腎臓 (HEK) 細胞ライン、HEK293F、HEK293S は、複雑で高マンノース糖鎖をそれぞれきょくひ糖タンパク質を表現する使用されます。異なる従ってこれら遺伝子組換え糖タンパク質糖鎖のサイズおよびリガンド結合の組成の影響を調査を許可します。動態と生体関連配位子および治療用抗体の候補者に糖タンパク質結合の熱力学的性質を研究するためのプロトコルについて述べる。HEK293S 細胞における組換えタンパク質結晶化糖鎖の均一性、減らされた柔軟性とエンドグリコシダーゼ H 治療への感受性のために適しています。重原子と小分子リガンド結合の解析と位相決定の糖タンパク質結晶をそれぞれ浸漬法を提案します。説明する実験的プロトコルはここでその機能への洞察力を与えるし、治療薬の作用のメカニズムを調査する哺乳類の糖タンパク質のキャラクタリゼーションのための約束を保持します。
概要
表面タンパク質は、細胞の機能に重要な役割を果たします。細胞外ドメインをこれら膜タンパク質は、細胞間相互作用、接着、トランスポートおよび1,2の信号を調節することが。これらの蛋白質の細胞局在化させるがんと自己免疫疾患3,4,5を含む病気の広い範囲の治療薬の開発のための魅力的なターゲット,6,7. ひと膜タンパク質 ectodomains の最も一般的なひだの 1 つは、7 つ以上の β ストランド 2 つの β シート8,9に配置によって形成される免疫グロブリン様 (Ig) 倍。通常、Ig 含有糖タンパク質、細胞外膜タンパク質10部に配置された順番に Ig ドメインとマルチ ドメイン構造です。これらの細胞表面タンパク質、特に N と O リンク糖の翻訳後修飾は、折りたたみ、分泌および機能11それらの規制に重要な役割を再生する示されています。技術が必要な機能とそれらを対象とするより良いデザイン治療に理解を改善するために、その詳細な分子特性を可能にします。今回、生物物理を可能にする技術の組み合わせ (biolayer 干渉法 (結合) と等温滴定型熱量計 (ITC)) と Ig 含有細胞外ドメインの構造 (x 線回折) の評価膜糖蛋白、だけで、複雑な生体関連配位子と治療上の分子 (図 1)。
N リンク糖鎖は哺乳類タンパク質は、最も一般的な翻訳後修飾の一つし、小胞体とゴルジ体12,13内タンパク質成熟中に発生します。人間の萌芽期の腎臓 (HEK) 293 細胞などの細胞は、糖タンパク質14,15の大量の組換え発現のため開発されています。スケール付着性のセルラインに比べて大量にタンパク質の生産アップのしやすさでは、サスペンションの形式でこの細胞ラインを開発しました。2 HEK293 細胞を利用するここでは、: HEK293F と HEK293 Gnt 私-/- (HEK293S)、私が N アセチルグルコサミニルトランスフェラーゼ トランスフェラーゼの有無によって異なる (Gnt 私) 後者で。ターンでは、(に見られる HEK293F) として複雑な糖鎖の生産は不可能であり、代わりに高マンノース型糖鎖 (主に男5GlcNAc2) 存在の N 型糖鎖のサイト18,19,20.同時にこれら 2 つのセルラインを使用して生物学的機能と治療ターゲットに及ぼす糖鎖の大きさや複雑さを勉強できます。確かに、糖タンパク質 HEK293F の細胞で生産されるだろう HEK293S 細胞で生産される同じ糖蛋白と比較して大きくより複雑な糖鎖HEK293S 細胞で生産される糖タンパク質の N 結合糖鎖の減らされた化学と構造の不均質性のため、結晶化に向いています。Crystallizability をさらに向上させるため、HEK293S (しかしない HEK293F) 細胞で生産される糖タンパク質は酵素エンドグリコシダーゼ高マンノース糖鎖の開裂の結果このような H (遠藤 H) を扱うことができるだけである、単一 n-アセチルグルコサミン (GlcNAc)部位は各糖鎖の N リンク サイト21,22のままです。他の方法は、kifunensine23を含む糖蛋白中に糖転移酵素阻害剤の添加などの細胞内の N 型糖鎖の処理を制限する使用できます。代替アプローチは、(HEK293F 細胞) のネイティブ糖タンパク質のペプチド N 各種グリコシダーゼ F (PNGaseF) を用いた酵素の糖鎖切り出し続いて式を含みます。ただし、PNGaseF と糖鎖切り出しの原産の条件およびいくつかの蛋白質の増加の集計の下でより少なく有効であること示されています。場合蛋白質のまま治療後、水溶性を取得アスパラギン酸24アスパラギン残基の脱あみどのため表面に負電荷、結晶化について有害な可能性もあります。アラニンやグルタミン残基、これらのサイトで N リンク グリコシル化反応を防ぐために、均質性の高い糖タンパク質サンプルを生成するためにほとんどの場合、N 糖鎖が予測も変異することができます。また、糖タンパク質は、酵母、昆虫、植物システム チャイニーズハム スター卵巣 (CHO) 細胞16,17など他の哺乳類セルラインなど他の真核生物細胞培養で製作できます。
PHLsec を含む多くの哺乳類発現ベクター細胞中25に組換え糖タンパク質 ectodomains の分泌を可能にします。HEK293 細胞から糖タンパク質の分泌細胞の換散を必要とせず簡便・迅速な浄化が可能です。精製タグの追加 (例えば、彼タグ、タグ、連鎖球菌フラグ-タグ、Myc タグ、HA タグ) ターゲットの N または C 末端に糖タンパク質によりシングル ステップ アフィニ ティー ・ クロマトグラフィーによって浄化。その後、サイズ排除クロマトグラフィーは、構造と生物の単分散のサンプルを生成する使用できます。
適切な条件の下で高純度、均一な糖タンパク質サンプルは、よく回折結晶で起因できます。このような結晶による x 線回折データセットを取得すると、初期段階は糖タンパク質の電子密度を計算する決定する必要があります。構造蛋白質のデータ ・ バンク (PDB) で数増え、おかげで段階的に廃止のため最もよく使用されるメソッドまで関連タンパク質の構造を使用して初期段階の26を取得する分子置換 (氏) となっています。しかし、氏は、時折マルチ Ig ドメイン糖タンパク質27,28,29のためのケースをされている位相問題を解決するために失敗した場合、別の方法が必要です。この記事は、CD22 外部ドメイン28の構造を解決するために必要でした、段階的に廃止の重い原子 (HA) と結晶を吸収する方法を詳しく説明します。段階的に廃止のため右 HA を識別するは、与えられた結晶格子と結晶化ソリューション30,31糖蛋白質で使用可能な原子 HA 反応性に依存する反復的なプロセスです。糖タンパク質は、他の原子に十分に高い比率で存在する場合と十分に高い冗長性32、x 線回折データを収集できるのシステインとメチオニン残基の自然硫黄原子を使用ことができますまた、 33。
膜糖タンパク質の生物学的機能しばしばによるタンパク質-タンパク質相互作用やタンパク質-リガンド相互作用など、炭水化物。リガンド認識を理解する糖タンパク質-リガンド共結晶構造を取得する成功はリガンドが結晶格子の糖蛋白結合部位にソリューションから拡散するには十分に小さいと、浸漬実験できます。
ここに示すプロトコルは合成治療配位子34,35 ・抗体治療36,37表面糖タンパク質の相互作用を理解することも。構造情報と組み合わせると、動力学および熱力学をバインディングは強力な理解し、それらの作用メカニズムを改善できます。抗体医薬品の糖蛋白に結合の速度論的解析では、1 つの手法は、バリ38,39です。バリは、最終的に平衡解離定数 (KD) を決定するバインドのパートナーと協会・解離動態を測定するのに固定化リガンドとバイオ センサーを使用します。糖タンパク質の少量が必要なので、バリは魅力的なアプローチ (< 100 μ g)、実験時間は高速 (10 ~ 15 分ごとに実行)、自動化できます。ITC はまた糖タンパク質と結合パートナー40,41,42,43の間の類似性を調べる場合に役立ちます。ITC は、多くの時間と集中的な試薬ですが、(ΔG、ΔH、ΔS、および化学量論) の相互作用の熱力学に関する貴重な情報を取得できます。ITC は、配位子に表面糖タンパク質の一過性のバインディングに関連付けられては、しばしば弱い相互作用を研究するため便利ですも。さらに、これらの技術は、さまざまなコンストラクトのバインディングの異なる N リンク従って細胞の糖蛋白質を表現することから得られる効果を評価すると共に使用できます。HEK293F、HEK293S で生産され、遠藤 H で治療は糖タンパク質とバリと ITC を実行する生物学的活性と治療的関与の糖鎖の役割の詳細なビューを提供できます。
我々 は正常に人間 CD22 の28、糖タンパク質ファミリのメンバー、シアル酸結合 Ig のようなレクチン (Siglecs)44 B 細胞の恒常性を維持するために不可欠な細胞外ドメイン (ECD) を特徴づけるこれらのプロトコルを適用.結晶化を容易にするために詳細な構造設計を行い段階的に Hg で浸漬 ha x 線データセット。我々 はまた CD22 結晶そのリガンドのシアル酸 (α 2-6/シアリルラクトース) 免疫受容体-リガンド複合体の構造を取得するを浸漬し、したがって糖ヒューマンミメティック最前線45,46の構造に基づく設計のための青写真を提供します。さらに、私たちはバリでの親和性を決定するため抗 CD22 抗体 epratuzumab - 非ホジキン リンパ腫47の第 III 相臨床試験で現在治療候補 - のフラグメント抗原結合 (Fab) を生成し、糖鎖特異的に ITC CD22 ECD を構築します。これらの研究では、B 細胞の機能不全 CD22 認識のための潜在的な影響と epratuzumab 婚約の N 結合糖鎖の重要な役割を明らかにしました。
プロトコル
1 糖タンパク質 ECD のデザインを構築すること
- 人間 CD22 のアミノ酸配列を評価 (Uniprot) 蛋白質48,49内にある予測ドメイン要素との境界を識別する InterPro と Phyre2 サーバーを使用します。
- 上井の制限の酵素と KpnI (を使用して pHLsec 哺乳類発現ベクター25への膜と細胞質ドメイン (20-687 の残基、以下 CD22 細胞外ドメイン、CD22 ECD)、シグナルペプチドを欠けている人間の CD22 のシーケンスを複製します。図 2A)50。
注: pHLsec ベクターは哺乳動物細胞の25の可溶性分泌蛋白質の過剰発現に最適です。このベクトルを可能にする可溶性糖タンパク質の細胞外分泌の分泌信号が含まれています。pHLsec には固定化金属親和性クロマトグラフィー法を用いた細胞培養上清からのアフィニ ティー精製を容易にする C 末端 (彼)6 xのタグが含まれます。 - C ターミナル Ig ドメインの逐次削除 CD22 ECD の切り捨てられたコンストラクトのクローンを作成: 1-6 (残 20-687) ドメイン、ドメイン 1-5 (残 20-592)、1-4 (残基 20 504) のドメインおよびドメイン 1-3 (残 20 330) (図 2 b および 2 C)50.
- CD22 ECD コンストラクト51で現在予測 N リンク糖鎖のサイトを識別するために NetNGlyc サーバーを使用しての主なシーケンスを評価します。
- サイト指示された突然変異誘発を使用すると、標準のプロトコル52または53PCR を重ね合わせることで各予測の N 結合糖鎖のサイト (Gln に Asn および/または Ala に Asn) を変異、CD22 ECD のいずれか 1 つまたは複数が含まれている構成を作成するにはN リンク糖鎖変異。
- 有能なエシェリヒア属大腸菌の変換シーケンスの検証後クローン構造、DH5α のセルの54とマキシ prep (製造元の指示) に従って DNA トランスフェクション用を準備します。
2. HEK293F ・ HEK293S セル苗
注: 必要な試薬、機器と HEK293F または HEK293S のセルのすべての操作は、適切なバイオ セーフティ キャビネットにおけるバイオ セーフティ レベル 2 の施設で実行する必要があります。すべてのアイテムの外部表面は、70% エタノール溶液または同等の試薬を滅菌する必要があります。
- HEK293F と HEK293S の懸濁細胞 (材料の表を参照) を取得し、使用する準備ができるまで-80 ° C で保存します。
- メディアの暖かい (材料の表を参照) を 37 ° C の水浴中で 1 時間。ベント キャップ付き 125 mL 困惑して細胞培養用フラスコに暖められたメディアの 24 mL を転送します。
- -80 ° C で氷に乗り換えから分注 1 mL のセルを取得します。
- セルを部分的に解凍に約 1 分の 37 ° C の水浴の細胞を孵化させなさい。転送 1 mL バイアルからのメディアを含む 125 mL 困惑して細胞培養用フラスコ細胞の。
- 細胞培養用フラスコ ベント キャップとシェーカーの 37 ° C、130 rpm、湿度 70% および 8% CO2に設定場所のフラスコを閉じます。
3. HEK293 細胞維持
注: セル密度と細胞の生存率をする必要があります解凍後約 24 時間をチェックします。この手順により、次の接種; 細胞が回復しています。初期の生存すべき > 80%。
- 慎重に新鮮な懸濁細胞を含む 125 mL フラスコからセルの 10 μ L を削除し、滅菌 1.5 mL のマイクロ チューブにそれを転送します。フラスコを閉じ、インキュベーターに戻ります。
- セルを含む 1.5 mL のマイクロ チューブにトリパン ブルー溶液 10 μ L をピペット、混和し、10 μ L をカウントのスライドの商工会議所に転送します。
- 自動細胞カウンターにカウントのスライドを入れてし、(単位セル mL-1の) セル密度と細胞生存率 (パーセンテージ) での値を取得します。
- ~0.8 x 106セル mL-1次の方程式を使用して最終的な密度で 200 mL の新鮮な文化を接種する必要がありますセルのボリュームを計算します。
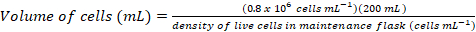 (1)
(1)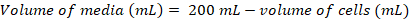 (2)
(2)
注: かかることがあります ~ 200 mL 文化に接種に適したセル密度を得るための 5 d。 - 細胞密度が 200 mL 培養の接種のために十分、37 ° C で 1 時間のウォーム アップ メディア水槽し、キャビネットのバイオ セーフティに暖められたメディアを転送します。
- ベント キャップ 500 mL 困惑して細胞培養用フラスコに (として方程式 2 で計算された) メディアの必要量を転送血清ピペットを使用して、慎重に。
- 血清ピペットを使用して、メディアを含む 500 mL 困惑して細胞培養用フラスコに懸濁細胞 (式 1 で計算された) の必要量を転送します。
- 200 mL メンテナンス新株をキャップし、インキュベーターに戻る。約 3 x 106セルの mL-1の密度に細胞を成長します。0.8 106セル mL-1倍の密度でセル (セクション 3.4 3.7 で説明) の細胞の安定した文化を維持するためにすべての 2-3 d の通路します。4 〜 106セル mL-1倍の密度を超えるセルはできません。
4. 糖タンパク質発現 HEK293 細胞のトランスフェクション
- ボリュームを計算するセルと 200 mL 文化 0.8 x 10 の transfection のために必要なメディアの6セル mL-1 (セクション 3.4 の式 1 と 2 を使用して)。
注: 実行することができます 200 mL transfections 数メンテナンス株式の細胞密度に依存します。 - ベント キャップと新しい 500 mL 細胞培養フラスコ メディアとセルの transfection のための必要量を転送し、インキュベーターに細胞の在庫を返します。
- セル セル分割を次を慣らすようにトランスフェクション前 1 時間孵化させなさい。
- 滅菌 50 mL の円錐管に 50 μ g の DNA を転送し、5 mL の培地で希釈します。真空は、別の生殖不能の管に 0.22 μ m ろ過システムを使用して希釈した DNA をフィルター処理します。
- ミックスは、希釈、DNA をトランスフェクション試薬と 1:1 質量: 容積比でフィルタ リングします。ゆっくり旋回 DNA: トランスフェクション試薬溶液をミックスし、10 分間室温でソリューションを孵化させなさい。
- セルに直接 DNA: トランスフェクション試薬溶液を追加します。37 ° C、130 rpm、湿度 70%、8% CO2 5 7 d のシェーカーに transfected セルを孵化させなさい。
5. 細胞トランスフェクション条件の最適化
注: 最大の糖収量細胞トランスフェクション条件を最適化するために transfect 初期細胞密度の様々 な細胞と (図 3A) を時間をかけてタンパク質収率を評価します。セクション 4 で説明されているように、細胞を transfect、0.5 x 10 に至る初期細胞密度で 2 x 106 6セルが mL-1 55。試用版 transfections は、スペースと試薬保存する DNA の 6 μ g と (125 mL 困惑して細胞培養用フラスコ) で 25 mL の容量を縮小することができます。DNA の量は、最適化された55も可能です。
- 毎日後トランスフェクション (日 1-7) は、(安全キャビネット) で滅菌 1.5 mL マイクロ チューブに細胞培養から 500 μ 因数を転送します。
- コレクションの直後に遠心機で 5 分間 12,000 × g 検体細胞をスピンします。上清を新しい 1.5 mL マイクロ チューブと 4 ° C でストアに転送し、すべてのサンプルが得られるまで。
- デンシトメトリーによる分泌された糖蛋白質を量的します。
- すべてのサンプルを取得した後、それぞれの 20 μ L 分注は新しい 1.5 mL マイクロ チューブにサンプルし、6 μ L 4 x Laemmli サンプル バッファーの非還元のミックスします。
- サーモ ブロック 95 ° C で 5 分間のサンプルを沸騰させます。遠心機で 12,000 × g で 1 分のサンプルをスピンします。
- 10 井戸 4-15% 勾配 SDS-PAGE ゲルの井戸あたり各サンプルの 20 μ L をロードします。タンパク質サイズ マーカーの 1 つの車線があります。トリス/グリシン/SDS バッファーで 20 分間 250 V でゲルを実行します。
- 実行完了、次ゲルを Coomassie に転送 (材料の表を参照) を染色 20 分解除 ddH2O 20 分画像ゲルのゲルを染色します。
- 次の標準的なプロトコル57,58ImageJ で密度測定を実行します。
- コンパイルし、x 軸の '日後トランスフェクション' を使用してデータをプロットと y 軸 (図 3A) に ' 密度測定値'。
注: あるいは場合蛋白質の表現が SDS-PAGE による可視化のための十分なウエスタンブロットなどのテクニックがあります使用56。
- バリによって分泌された糖蛋白質を量的に表わす
- Ni 国税庁バイオ センサーを使用すると、バリの59を使用して分泌された糖蛋白質量量的に表わします。
- コンパイルし、x 軸の '日後トランスフェクション' を使用してデータをプロットおよび y 軸 (図 3A) に ' タンパク質濃度 (μ g/mL)'。
6. HEK293 培養上清から水溶性糖タンパク質の精製
- 4 ° C で 20 分間 6,371 × g で遠心分離によって細胞を収穫します。分泌の CD22 ECD を含む上清を保持し、0.22 μ m フィルターを使用してフィルターを適用します。
- 4 mL min-1事前平衡で上清を読み込むベンチトップ クロマトグラフィー システムを使用して (20 mM Tris pH 9.0 では、150 mM の NaCl、5 mM のイミダゾール) Ni NTA 列 (5 mL ボリューム)。
注: 他の親和性に基づく浄化技術が、に基づいて使用セクション 1 の構造設計に含まれる親和性の札。 - 洗浄バッファー (20 mM Tris pH 9.0 では、150 mM の NaCl、5 mM のイミダゾール) の 3-4 列ボリューム (CV) のアフィニ ティー ・ カラムを洗って次の培養上清中の読み込み。
- 分数 (図 3B) を収集しながら溶出バッファー (20 mM Tris pH 9.0 では、150 mM, 500 mM のイミダゾールの塩化ナトリウム) の 4 100% 勾配 (4 CVs) を使用して、列から精製された糖タンパク質を溶出します。
- 4 ° C 15 分またはサンプル 500 μ L のボリュームに到達するまで、4,000 x g で遠心分離溶出ピーク 10 kDa 分子の公称重量制限 (NMWL) と濃縮・遠心ろ過デバイスを含むプールの分数。
- 500 μ L のサンプル ループと、あらかじめ平衡 (20 mM トリス、pH 9.0 では、150 mM の NaCl) に 0.5 mL min-1負荷に濃縮された糖タンパク質を注入タンパク質の高速液体クロマトグラフィー (FPLC) の高性能サイズ排除列 (約 24 mL の容積)分数 (図 3C) を収集しながら 4 ° C でのシステム。
- 分画、糖蛋白質を識別するために溶出画分の SDS ページのゲルを実行し、対応する分数をプールします。SDS ページのゲルは、60のセクション 5 で説明したように実行できます。
7. 糖鎖切り出し精製糖タンパク質の
- 280 吸光度を用いて次のサイズ排除クロマトグラフィー精製蛋白質の濃度測定 nm 吸光係数 (例えば、 1.418 M-1 cm-1 CD22 ECD) で割った。
注: 興味の蛋白質の理論の消散係数は、ExPASy ProtParam61などのサーバーを使用して計算できます。 - 遠藤 h に 10 μ L (製造元) あたり 1 X 遠藤 H バッファーの市販酵素の浄化された蛋白質の 1 mg の割合で、37 ° C で 1 時間の浄化された蛋白質を孵化させなさい。
注: 遠藤 H 切断高マンノース糖鎖生産 HEK293S で各糖サイト21で単一の GlcNAc 部分を残してします。遠藤 H が HEK293F 細胞22、生成するタンパク質の糖鎖を切断しないしかし、他の酵素を (例えば、PNGaseF24) この目的のため使用できます。 - 500 μ L に deglycosylated ECD を集中し、0.5 mL min-1遠藤 H を削除し、集計結果を別に FPLC で高性能サイズ排除列 (約 24 mL の容積) のゲル濾過クロマトグラフィーを実行します。
- 下流の実験で使用するまで 4 ° C で deglycosylated タンパク質を格納します。
8. 糖タンパク質の結晶化
注: 市販の画面を使用して結晶化試験を行うし、結晶化ロボットを使用して降下実験を座っている設定。
- 集中、純粋な deglycosylated ECD 10 mg mL-1 10 kDa NMWL 4,000 x g (4 ° C) で目的の濃度が得られるまで遠心ろ過デバイスを用いたします。
- 280 吸光度を用いたタンパク質濃度を決定する nm と消散係数で除算します。
- 結晶化試験サンプルから不要なほこりや他の汚染物質を削除する前に 4 ° C で 5 分間 12,000 × g で遠心分離機のサンプルです。
- リザーバー 96 ウェル リビングの井戸は商業結晶化画面から結晶化溶液 80 μ L で結晶化プレートをドロップします。
注: 我々 使用して疎行列商業画面設計されている PDB の構造に関して最も成功した結晶化条件に基づきます。 - 総ドロップ量 200 と結晶化プレートのウェルに滴を塗布結晶化ロボットを使用して 1:1 の精製タンパク質: 結晶化溶液の比率で nL。
- プレート全体をミックスすると、一度可視・紫外光で検査のため撮像素子板にテープと場所とプレートはシールします。
- 初期糖タンパク質結晶ヒットを与える条件を識別するために紫外・可視光を用いた結晶化プレート、セットアップ直後と次の週での検査します。
- 結晶ヒットまたはランダム行列マイクロ播種方法62,63,64,65の条件に基づいて罰金画面を使用して結晶化初期のヒット曲から得られた結晶をさらに最適化します。
- 低温保護母の結晶を浸すことによって結晶化条件の中で十分な低温保護を欠いている任意の結晶酒 20% (v/v) グリセロールの解決を補完ソリューション (または同等の低温電子顕微鏡-保護エチレング リコールなどやポリエチレング リコール 400)。
- Cryoloops とフラッシュ マウント結晶はそれらをホーム ソース回折装置や放射光を用いたデータ収集の前に液体窒素で凍結します。
9. 重原子の誘導体を使用して段階的に廃止
注: HA 化合物のいずれかの操作の前に安全面を考慮されなければなりません。HA タンパク質結晶構造解析、化合物の生体分子に強い親和性を選択し、延長された露出から人間の健康にリスクをもたらします。HA 化合物、材料の安全データ用紙で述べたように適切な安全措置を取る。
- 異なる HA の化合物をテストするため濃度とインキュベーション時間はハンギング ドロップ蒸気拡散法66を使用して 24 ウェルの結晶化プレートのセクション 8 でよく回折結晶を再現します。
- 決定 HA となる結晶の誘導に使用されます。サーバー (例えば、重原子データベース システム67) お手伝い HA 複合選択、タンパク質結晶化条件に適していることを確認します。
注: HA 画面が段階的に廃止のための最も効果的な HA 化合物の簡単なスクリーニングのため市販も。「マジック 7」HA 化合物のセットは、以前ハ誘導68のための成功の高い確率を持っているに記載されています。 - HA (図 4A) を浸漬のためのワークステーションを設定します。0.2 HA の最終濃度範囲は 1 〜 20 ミリメートルからそのような結晶化条件で希釈した HA ソリューションを含む 22 mm カバー スリップ上 μ L をドロップする結晶を転送、cryoloop を使用すると、急速に。ドロップ シールし、インキュベートする (図 4B) の時間の長さが異なる。良い出発点は、5、10、60、90 分と一晩です。
- 可能な亀裂や糖タンパク質結晶または結晶の誘導体化に悪影響を及ぼすことができる色の変化を識別するために光学顕微鏡と結晶を目視で確認します。
- Cryoloops の結晶と 30 の背面ソーク結晶マウント 3 連続 0.2 μ s 低下 20% (v/v)、グリセリン (または代替低温保護剤) を添加した含んでいる母酒ソリューション69。バックは、結晶を浸漬 HA 複合非具体的バインドされていたし、弱い HA 結合による部分の占有を減らすを削除します。(図 4B) の液体窒素凍結結晶をフラッシュします。
- データの収集、処理、構造ソリューションと洗練された、前述のプロトコル26,70,,7172を使用します。
10. そのリガンド糖タンパク質結晶を浸漬
- ハンギング ドロップ蒸気拡散法を用いた 24 ウェルの結晶化プレートのセクション 8 でよく回折結晶を再現します。
- 50 mM で 20 mM のトリス、pH 9.0 では、150 mM の NaCl リガンドの原液を準備します。
注: リガンドの濃度の糖タンパク質に親和性に従って準備されるべき。親和性が知られている場合、は、ITC (セクション 12.2) などのメソッドを使用して浸漬実験開始前に親和性を確認する必要があります。リガンドは必要なバッファーに必要な濃度で水溶性を確認します。 - 含む ECD 結晶をドロップするリガンドのさまざまな濃度を追加し、5 d を 5 分間に及ぶ時間の長さでのインキュベーションのドロップをシールします。
- 形態の変化の可能性を識別するために光学顕微鏡と結晶を視覚的に追跡します。
- Cryoloops と低温で結晶をマウント-20% (v/v) グリセロール (またはエチレング リコールまたは低分子量ポリエチレン ・ グリコール 400 など他の低温保護剤) を添加した母酒液で保護する69。
- データの収集、処理、構造解析と絞り込み、前述のプロトコル73,74,75を使用します。
11. フラグメント抗原 (Fab) を結合の生産
- Subclone Fab 重鎖 (HC) と反 ECD 抗体、epratuzumabなどの軽鎖 (LC) シーケンスに対応する遺伝子。
注: また、IgG は Fab 断片76を生成する酵素パパインによって切断することができます。 - 以下の変更のセクション 4 で説明したように、細胞を transfect:
- 文化の 200 mL あたり 90 μ g の Fab 断片の transfection のため DNA の総質量を使用します。
- LC ダイマー形成量を減らすために 2:1 の比率で HC と LC のプラスミドを transfect します。
- インキュベーションの 7 d の後細胞を採取、培養上清を保持し、フィルター 0.22 μ m ろ過の真空駆動装置と。
- 卓上型クロマトグラフィー システムを使用して PBS バッファーでアンチ LC (カッパまたはラムダ) アフィニティ列を平衡します。
注: LC ダイマー形成が問題の浄化に、G タンパク質アフィニ ティー ・ クロマトグラフィーがカッパ/ラムダ LC の親和性の浄化の代替として使用できます。 - 4 mL 分-1のアフィニ ティー ・ カラムに上澄みをロードします。次のサンプル読み込み 3 4 CVs の PBS で列を洗ってください。
- 100 mM グリシン、pH 2.2 10% (v/v) 1 M と溶出画分をすぐに中和のイソクラティック溶出を使用して列からの蛋白質を溶離するトリス、各分画の pH 9.0。
注: すてきな溶出さらにによって精製できるイオン交換クロマトグラフィーおよび/またはサイズの排除クロマトグラフィー 4 ° C で、FPLC を使用して
12 工場および低分子の糖蛋白結合の特性
- Biolayer 干渉法
- 1 x 速度バッファー (1 x PBS、0.002% (v/v) トゥイーン 20、0.01% (w/v) BSA) の 50 mL を準備します。
- 前ぬれ板の 10 分の 1 x 速度バッファーの 200 μ L で六つの Ni 国税庁バイオをメタンハイド レートします。
- 彼の付けられた ECD 25 ng μ L-1の最終的な集中で 1 x 速度バッファーの 1 mL を希釈します。500 nM の高濃度および 250 の後続のシリアル希薄 x 速度バッファー 1 の 200 μ L に精製工場のシリアル希薄をピペット 125 nM nM、および 62.5 nM。
- それぞれがよく示されているソリューションの 200 μ L を含む図 5Aに示すように、底が平らな黒いポリプロピレン 96 ウェル マイクロ プレートに分注試薬。
- 38,,3977 (図 5A) を前述のようにデータ集録ソフトウェアの速度論試金を使用してデータを収集します。
- 1 x 60 のベースラインに反応バッファーを含む井戸に、バイオ センサーを簡単に、転送 25 ng μ L-1 240 の糖蛋白質をロードする前に s s (または 1.0 のしきい値まで nm に達する) 1,000 rpm で。
- 60 の第 2 のベースライン後 x 速度バッファー 1 で s は Fab のシリアル希薄を含んでいる井戸にグルコを転送します。180 s 協会相は、その後 x 速度バッファー 1 の 180 s 解離手順が続きます。
注: バイオ センサー再利用できます上記プロトコルが続き洗浄除去バッファー (500 mM のイミダゾールと PBS) のバイオ センサーの 3 つのサイクルから成っている再生ステップの場合 5 s に続いて 5 1 中和反応バッファー x s。バイオ センサーは、10 〜 20 まで再利用できる時間、同日中にまたは貧しいデータまで品質が観察されます。
- 解析ソフトウェア (図 5A) を使用してデータを分析します。
- [タブ 1、インポートおよびデータの選択。
- タブ 2、ステップ 1: データの選択、' センサー選択 ' を選択、ハイライト参照井戸 (行の E と F、図 5A)、右クリックし、参照するように設定。[ステップ 2: 減算、選択 ' 参照井戸 '。[ステップ 3: y 軸を合わせ、0.1 に 59.8 の時間範囲から '基準' を選択 s。間ステップ補正 [ステップ 4: '解離に整列」を選択[ステップ 5: プロセス、'サビツキー ・ ゴーレイ フィルター' とプレス プロセス データを選択します。
- タブ 3 の下で [解析ステップ 1:1 モデル「協会と解離」を選択します。'グローバル フィット' と '色によってグループ' を選択します。曲線を右クリックして、「色を変更」を選択すべてカーブを選択した色に設定します。「フィット カーブ」を選択します。データがよく合うレポートがレポートを保存 ' を選択することによってエクスポートできます。
- Fab の認識の異なる従っての糖タンパク質 HEK293F と HEK293S セル (セクション 5) で生産され、遠藤 H 治療効果を評価する (セクション 7)、次の実験を繰り返します。さらに、すてきな縛られて ECD 切り捨ての生じたドメインへの洞察力を提供するために実験を繰り返します。
- Fab 糖タンパク質相互作用の等温の滴定の熱量測定
注: ITC 実験ここで説明を行った自動 ITC 装置を用いたします。1 mL の底 96 ウェル ブロック丸で実験を行った。- ECD と 20 mM トリス、pH 8.0、攪拌棒で一晩 4 ° C で 150 mM の NaCl の単一 4 L ビーカーに Fab を dialyze します。
- それぞれ 5 μ M、50 μ M に透析の ECD と Fab を集中、使用する前に 4 ° C で 5 分間 4,000 x g でバッファー 10 kDa NMWL 遠心フィルターを用いて、3 回透析の 5 mL の濃縮膜を洗浄することを確認します。
注: セルと注射器のサンプル間のバッファーに何らかの不整合は、ITC 実験とデータの質の悪い結果にリリースされる不要な熱を可能性があります。 - 実験 1: 400 μ L を読み込むときに、セル A1 に ECD のと注射器に読み込まれるも A2 に Fab の 120 μ L を追加。まあ A3 が混合サンプル次実験完了を返します空のまま。各後続の実験を同じ順序でプレートに追加できる (すなわち、実験 2: セル A4、注射器 - A5、空井戸 - A6;図 5B)。
注: バッファー コントロール (計測器動作していることを確認) するためにバッファーを含んで (注射器) での注射器のサンプルの希釈熱を計算するセルの既定のバッファー コントロールに配位子と同様に、それぞれの実行の前後で。これは、計算の希釈熱する必要があります、データ分析 (図 5B) 中に生の実験データから減算されます。 - 各注射用 2.5 μ L のボリュームを 16 注射の合計を実行します。噴射時間は 5 s、180 s 注射間隔。セル温度を攪拌回転数 750 rpm と 5 のフィルター期間の 25 ° C に設定 s。
注: は、アフィニティと ECD:Fab の相互作用の熱力学に基づく、それは注射または細胞の温度の数、サンプル濃度を変更する必要あります。 - 40,41,43 (図 5B) を前述のように解析ソフトウェアを使用してデータを分析します。
- 少なくとも重複、平均 KD値と標準誤差を計算するのに実験を繰り返します。従って工場: 糖蛋白質の相互作用の熱力学の異なる従って (セクション 5 および 6)、効果を評価するの ECD と実験を繰り返します。
- リガンド糖タンパク質相互作用の等温滴定熱量測定、ITC 実験セクション 12.2, で次の変更を説明するようを設定します。
- 4 l 透析バッファーの ECD を一晩中 dialyze します。次の透析の透析バッファーを使用してリガンドを溶解します。
- ITC 低親和性の相互作用を検出できるように大幅に高い濃度で実験を実行します。ECD とリガンドの相互作用細胞とシリンジの配位子の 1 mM で ITC ECD の 100 μ M の濃度で実験を実行します。
結果
CD22 ECD のいくつかの構造を正常に pHLsec の発現ベクターにクローン化し、哺乳類 HEK293F と HEK293S 細胞 (図 2および 3 a) で過剰に発現します。すべての構成要素はサイズ排除クロマトグラフィーによってサイズの同質性に浄化され、結晶化の研究 (図 3 b 3 C) の非常に純粋なサンプルが得られました。よく回折結晶につながった CD22 構築された HEK293S 細胞をそのようなだけで 5 つ、6 予測 N-糖鎖付加部位 (N67A、N112A、N135A、N164A、N231A)、翼に Asn から突然変異したのと d1 d3 切り捨て (残 20-330)、生産N101 が保持された位置にグリコシル化反応サイト (このコンス トラクターの名前は CD2220 330, 5 a)。結晶は MCSG 1 スパース マトリックス画面のいくつかの条件で得られたが、最高の結晶条件の 30% (w/v) ポリエチレング リコール 4000、塩化リチウム 0.2 M、0.1 M トリスを含む pH 8.5 から。これらのネイティブ結晶 2.1 Å 分解能の回折有機合成に関係するタンパク質の Ig ドメインの知られている構造を用いた MR 検索へのソリューションに至らなかった。
位相情報を取得するには、我々 は HA インキュベーション時間を 5 分から 1 d (図 4) の化合物の 1 〜 20 ミリメートルに至る濃度に Hg、Pt や Os、Ta、Br を含まれている HA 化合物のパネルとネイティブ結晶を浸した。我々 は結晶の形態の変化を監視し、発見急速な割れと結晶の溶解の結果結晶は HA 化合物 20 mM で浸漬します。第二水銀塩化水銀酢酸、塩化白金タンタル臭化クラスターでビショビショだったセット インキュベーション時間を次の形状を保持する 63 の結晶の合計を凍結しました。結晶カナダ光ソース (CLS) 08 BM ビームライン (サスカトゥーン、カナダ) 蛍光スキャンで異常信号を示した 30 分塩化第二水銀の 7 mM を浸したし、多波長異常分散単一の x 線データ収集を許可クリスタル。これらのデータセットは、CD22 の水銀部分構造を解決することができました5 a 20-330、明らかに単一の水銀原子位置 C308 無料システインにバインドされ、最終的に、CD22 の構造を構築することができました、段階的に20-330 5A電子密度マップ オートビルド78を使用しています。
リガンド非結合構造が解決された後、リガンドである α 2-6 siallylactose にバインド CD22 の構造の解決に興味を持っていた。我々 はまず、ITC を使用して相互作用の結合の熱力学を特徴付ける α 2-6/シアリルラクトースに向かって CD22 の親和性を計算されます。〜 280 μ M の親和性を観察し、初期濃度を識別するためにこの情報を使用 (~ 100 KDx) ネイティブ CD2220 330, 5 a水晶の浸漬に使用する配位子の。我々 は 5 分、2 時間、14 h、40 h と 5 d の 25 mM siallylactose で CD2220 330, 5 a水晶を浸漬し、結晶形態の変化の監視します。~ 75 結晶の合計は時間の様々 なポイントから冷凍され、CLS 放射光ビームライン 08-ID (サスカトゥーン、カナダ) リモート データ収集のために送信されます。6 x 線データセットの合計は、よく回折結晶から収集されました。各 x 線データセットの構造は、リガンド非結合型 CD2220 330, 5 aの構造を使用して最初の検索モデルとして氏によって解決されました。すべてのデータセットの結果の電子密度は、CD22 のバインディング サイト内 α 2-6/シアリルラクトースをバインドに対応する Fo Fc マップで肯定的な密度の検査された.驚くことに、すべてのデータセット、収集後インキュベーション時間の 5 分のみ含まれる結合部位でリガンドに対応する肯定的な密度を浸した結晶からであって。リガンド非結合状態とリガンド結合状態の CD22 の全体的な構造 α 2-6/シアリルラクトース浸漬実験の成功を説明するかもしれない最小限の構造変化と非常に類似していた。
我々 は次に CD22 バリと ITC の実験 (図 5) で抗体 epratuzumab によって認識される抗原の表面が特徴です。Epratuzumab 異なる従って CD22 コンストラクトする Fab バインディングの速度論と熱力学のプロファイルで小さい糖鎖 (327 nM 対 24 nM の親和性で 14-fold 改善まで N リンク糖鎖の減らされたサイズと CD22 に増加の親和性を明らかにでバリ;188 nM 対 58 nM ITC)。CD22 のシングル ポイント変異体を用いたバリと epratuzumab Fab CD22 d1 d3 共結晶構造28を解くことによってそのエピトープに対する抗体のアクセスを制限する CD22 N 型糖鎖が確認されました。
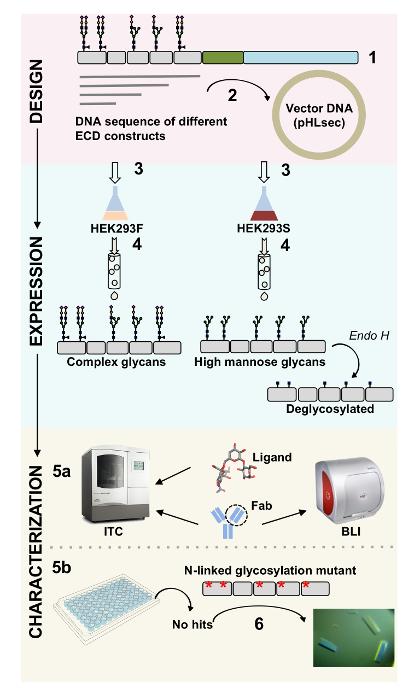
図 1.生物物理構造と構造設計から糖タンパク質特性の概要。(1) 主要な代表的な糖タンパク質の解析。グレー、細胞外ドメイン (ECD);緑で、膜貫通 (TM) セグメント;青、糖タンパク質の細胞内ドメインで。予測された N 結合糖鎖が付いています。ECD の構成要素 (2) のクローニング。(ECD の式 3) は、哺乳類細胞で構築します。(4) 糖蛋白質の浄化。HEK293F タンパク質、複合糖鎖に含まれるタンパク質 HEK293S 高マンノース糖鎖を持っています。糖タンパク質の酵素治療は糖タンパク質 N リンク糖鎖修飾部位の部位でのみ GlcNAc の遠藤 H の結果と HEK293S 細胞で生産されます。(5 a) 糖タンパク質の抗体に結合する biolayer 干渉計 (結合) と等温滴定型熱量計 (ITC) によってテストされます。小さなリガンドへの親和性は、ITC が測定できます。均一 N 結合糖、いくつかのケースで遠藤秀 (6) と HEK293S と deglycosylated で表現したものなどの糖タンパク質の (5 b) 結晶化試行 N リンク糖鎖修飾部位の変異は、結晶を取得する必要です。この図の拡大版を表示するのにはここをクリックしてください。

図 2.哺乳類細胞における発現の DNA を構築 CD22 外部ドメインの設計.A) CD22 ECD コンストラクト トランスフェクション用 pHLsec プラスミドの表現。上井、KpnI サイト クローニングに使用は、赤いボックスで示されます。B) 、CD22 ECD には 7 の Ig ドメイン (d1-d7) と (青) の 12 の予測の N 結合糖サイトが含まれています。4 つの構成要素は、CD22 ECD から設計されていた。C) pHLsec 哺乳類発現ベクターにクローニングに CD22 ECD の PCR 産物を示す 1% アガロースゲルを構築します。第 1 レーンには、1 kb の DNA マーカーが含まれています。この図の拡大版を表示するのにはここをクリックしてください。
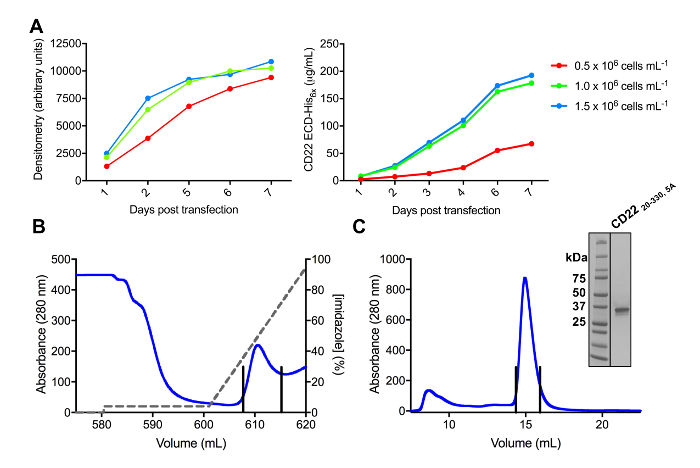
図 3.発現・精製糖タンパク質。A)式収量に及ぼす細胞密度。25 mL の小規模文化 HEK293F 懸濁細胞の糖蛋白 transfected セル (106セル mL-1x 0.5、106セル mL-1、x 1.0 および 1.5 倍の6セル 10mlの 3 つの異なる開始密度を使用して-1)。右側のパネルで定量的なバリ、SDS ページの左側のパネルのデンシトメトリーによる定量化を行った値は、1 つの糖蛋白質の準備の代表です。B)の最初の精製ステップのクロマト グラムを構築 CD2220 330, 5 aから Ni NTA のアフィニ ティー ・ カラムを使用して上清の 600 mL。糖タンパク質は、100% が 500 mM のイミダゾールを含む溶出バッファーに対応するイミダゾール (灰色の線) のグラデーションを使用して溶出しました。プールされた分数は垂直線で描かれています。C)サイズ排除クロマト グラムの構築 CD2220-330 5A高パフォーマンスを使用してゲルろ過カラム。溶出ピークからプールされた分数は垂直線で描かれています。Inset: Coomassie ステンド SDS-PAGE のゲルは、糖タンパク質の純度を示します。この図の拡大版を表示するのにはここをクリックしてください。

図 4.クリスタル重原子で浸漬.A) サンプル ワークステーション HA 化合物とネイティブ結晶を浸すため。必要なすべてのツールが表示されます。B) の結晶を吸収する手順構築 CD2220 330, 5 aと HA の化合物。ステップ 1を開くも、結晶と HA の最終濃度範囲は 1-10 の mM から、結晶化条件で希釈した HA ソリューションを含むカバー スリップ上 0.2 μ L ドロップするループを用いた転送結晶を含みます。ステップ 2、結晶化プレートでドロップをシールし、異なる期間にわたって複合 HA 結晶を孵化させなさい。ステップ 3ループでずぶぬれのクリスタルを実装し、バック-ソーク 30 カバー スリップ上分配 20% (v/v) グリセロールを添加した母酒ソリューションを含む連続 0.2 μ l 値下がりで s。ステップ 4、フラッシュ凍結液体窒素でループ マウント結晶と放射光ビームラインに出荷のためのパックにそれを置きます。この図の拡大版を表示するのにはここをクリックしてください。
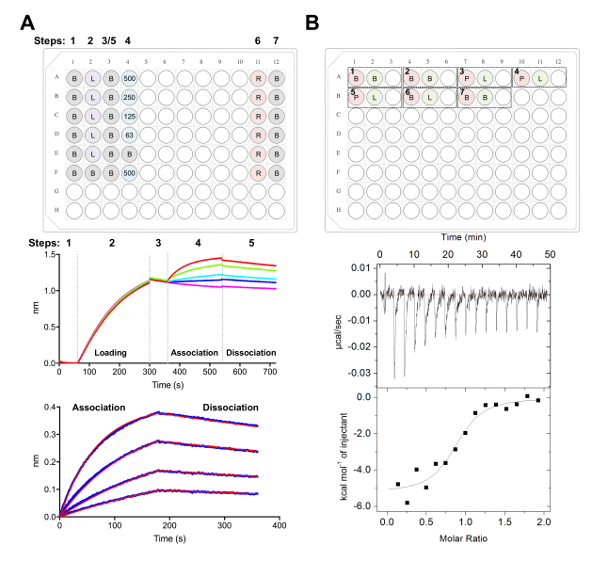
図 5.Biolayer 干渉法と等温の滴定の熱量測定測定A)代表者バリ実験。上部パネル:次が分類される動力学実験のためプレート セットアップの例: 1 x 速度バッファー (B)、彼の6 の x-タグ糖タンパク質 (L) を読み込み、代表的なファブ濃度 (500、250、125、62.5 nM)、PBS + 500 ミリメートル再生バッファー (R) と中性化速度 x 1 バッファー (B)。まあ、溶液 200 μ L が含まれています。動力学実験のステップ数は、プレートの上部に表示されます。中間パネル:Ni 国税庁バイオ センサーを用いてバリ実験と上部パネルで説明板の代表的な生データです。手順番号は、基準 (1)、彼の6 x糖タンパク質 (2) を読み込み、基準 (3)、Fab (4) と (5) 解離のシリアル希釈で協会に対応します。再生の手順 (手順 6 ~ 7) を表します。底板:生協会と解離 (青線) 対応する 1:1 を示す代表的な分析データに適合 (赤線)。B) 上部パネル: 96 ウェル底ブロック ラウンドの 7 つの実験で自動化された ITC 楽器で単一 itc 代表プレート セットアップを実行します。各実験は 3 つの井戸ので構成されます。最初の井戸 (赤) がセル (400 μ L) のサンプルに対応して、シリンジ (120 μ L) のサンプルに対応する 2 番目の井戸 (緑)。3 番目はよく空になって、混合サンプルがこれによくテストの完了の後返されます。実験 1、2、および 7 は、バッファー コントロールのバッファーです。実験 3-5 は、セルと Fab や配位子 (L) シリンジ内で糖タンパク質 (P) と帳票の実験を表しています。実験 6 配位子熱希釈コントロールを表し、データ分析中に 3-5 の実験から減算する必要があります。底板:代表的な生 (上) と Fab (epratuzumab) CD22 ECD へのバインドを示す加工 (下) ITC データは HEK293F 細胞で生産されます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
膜糖タンパク質細胞機能のために重大、魅力的な治療上のターゲット。ここで、両方単独でそして小分子リガンド複合体膜糖タンパク質の ECD の構造と特性のプロトコルを提案し、Fab フラグメントします。我々 は正常に人間 CD2228、チェック79体液性免疫を維持に関与する B 細胞の重要な共受容体の細胞外の部分の 3 つの N ターミナルほとんど Ig ドメインの結晶構造を決定するのにこのプロトコルを使用しています。またその天然リガンドの α 2-6/シアリルラクトースと CD22 の結合部位を特徴として人間 CD22 に向けて治療用抗体の認識のモードを定義します。これらの結果は、B 細胞と新しい CD22 のターゲットを絞った小分子と抗体を用いた開発に向けた分子ロードマップの表現が制限されている Siglecs 家族の主要メンバーの構造と機能の関係に洞察力を提供します。治療。このプロトコルは Ig 含有 B 細胞受容体を正常に使用されますが、異なるドメインの組織とすべての膜の糖蛋白質の構造と特性評価のためのアプローチを適用できることを提案します。このような場合は、設計とコンビナトリアル N 型糖鎖構造の結晶成長と高分解能回折に適したを見つけるため (Gln または Ala のいずれか) の突然変異を評価できるを構築します。
均一な純粋な糖タンパク質サンプルを取得下流生物物理学的特性だけでなく、結晶成長と x 線回折のため非常に重要です。N リンク糖鎖糖タンパク質の存在は本質的に不均一し、結晶の形成を抑止することができます糖内構造および化学的不均質性を引き起こすことができます。このマイクロの不均一性を減らすためには、ハーバーの N 結合糖鎖、または endoglycosidases (遠藤) などによる治療が続く突然変異細胞株 (HEK293S) などを使用して、予測した Asn 残基を削除する点変異を導入する戦略がかなり結晶化成功15,21,22を向上します。このプロトコルでは可溶性糖タンパク質・細胞培養上清中に分泌される工場の浄化をについて説明します。糖タンパク質の分泌は、セル換散の必要性や過酷な化学物質や洗剤の添加なしの純度への比較的単純なルートを提供します。細胞培養上清、得られた次セル収穫は (例えば、 Ni 国税庁彼の付けられた糖蛋白質、またはすてきなフラグメントの LC の親和性のため) の興味の蛋白質のための親和性を持つ列の上に直接実行されます。ただし、使用、細胞培養上清 (例えばpH) の条件の列によって列に興味の蛋白質のバインディング機能が影響されるかもしれない。この場合、集中し、バッファーの列へのバインドを改善するために細胞培養上清を交換する必要があります。さらに、浄化中の品質管理手順が蛋白質の純度を評価するために採用するを強くお勧めします。SDS ページのゲルまたは (の前に、中に、浄化のステップの後) すべてのサンプルの西部のしみを実行するかどうか提案された浄化方式は興味の蛋白質に洞察力を得ることができます。汚染バンドは SDS のページに表示された場合、またはいくつかの種は精製時に得られる (例えば、サイズ排除上のいくつかのピーク)、追加精製の手順を実行する必要があります考慮するを得るために、例えば、イオン交換クロマトグラフィー下流の結晶化80の純度と増加のチャンス。
高分子結晶化の結晶のヒットを見つけることができます多数の高蛋白濃度で潜在的な結晶化条件のスクリーニングのために興味の蛋白質の高収率を取得する重要です多くの場合。一般的には、HEK293 細胞株に記載 (HEK293F と HEK293S) は堅牢な表現システム、必要に応じてより多くのサンプルを生成するためのスケール アップ。ただし、興味の蛋白質可能性がありますこれらの細胞内で十分に表現できないことが可能です。これらのケースで Expi293 細胞81,82, などの他の細胞は蛋白質の表現の優れたレベルを示すことが判明し、代替手段として考慮されるべき。
整然、回折結晶が次の高純度にもかかわらず興味の蛋白質のいくつかの構造の試験を得られない場合は、結晶の形成を促進する結晶化技術を拡大する必要があります。それは、抗体と nanobodies の Fab 断片が優れた結晶化エンハンサーをするでき、よく整理されたクリスタル83,84,85を包装を促進する示されています。これらのフラグメントの表現し、同質性に浄化され、興味の蛋白質との複合体の結晶化を促進するために使用することができます。重要なは、Fab 断片セクション 10 で説明されているように生成することができます非機能的な LC ダイマー86を形成する傾向があります。これらの汚染物質をおよび精製中に削除する必要があります。我々 の経験で LC ダイマーしばしばサイズ排除に別の保存ボリュームがあるイオン交換クロマトグラフィーに明瞭なピークとして溶出や削除できるから Fab 浄化 - しかし、これは常にそうではありません。これらの技術は工場の精製から LC ダイマーを削除するための十分な G タンパク質の親和性の浄化などの他の浄化方法は、純度を向上させるために使用できます。
Fab 断片と co 錯形成する代わりに、ランダム行列 microseeding など定評の技術は、よく整理された結晶63,70を得ることのチャンスを向上できます。このメソッドは、結晶の結晶成長を促進するために核を提供する結晶化条件に粉砕、準結晶の少量の付加を含みます。これは、ドメイン アーキテクチャ及び三次構造が類似したものや、興味の蛋白質の結晶を使用して実行できます。さらに、単独で、タンパク質を結晶化しよう、Fab フラグメントまたは関心の低分子との複合体は、ランダム行列 microseeding を実行できます。クライオ電子顕微鏡の最近の進歩はまたこの手法に適切な機能87,88、分子の高分解能構造情報を取得するための x 線の結晶学への魅力的な代替手段を作る 89,90,91。
氏によって失敗すると x 線回折データセットの段階的に廃止、浸漬 HA を異常分散または同形置換による位相問題を解決するために必要かもしれない。タンパク質のアミノ酸配列の検査は、バインディングの最適 pH を含む HA の誘導体化の戦略についての手がかりを提供できます。特に、対になっていないシステイン蛋白質の内で特に水銀 HA 化合物をバインドできます。ネイティブ結晶 HA 化合物を浸漬は、最適な HA 化合物の id、その濃度および必要なインキュベーション時間を決定するための反復的なプロセスです。浸漬の初期の試みには、よく回折結晶段階に適した HA を含む譲歩しない場合、は、HA 結合確率と異常信号を改善するアミノ酸置換を導入する必要があります。などの変異体を効率的に位相の異常に使われた大腸菌セレノ メチオニン補足のメディアの異常な段階の Hg、Au、Pt や Pb タンパク質の発現をバインドする無料のシステイン残基が含まれてしかし、。セレノ メチオニンが確実に組み込まれた同等のシステムはサスペンション92,93, 哺乳類セルの容易に利用可能ではないと将来の開発の領域です。
興味の糖タンパク質のリガンド非結合構造を取得した後、小分子リガンドと結晶を沈める免疫受容体-リガンド複合体の構造を取得する実行できます。これらのデータより具体的かつ高親和性リガンド糖蛋白の生物学的機能に高解像度の洞察力を提供と同様、低分子治療薬として使用することができます合理的な設計の青写真を提供します。興味の小分子リガンド糖タンパク質結晶を吸収しようとすると、リガンド非結合状態の結晶構造の検査は浸漬で可能かどうかを指定できます。場合すぐ水晶パッキング連絡先リガンド結合部位の周りがあるまたはリガンド結合に伴う構造変化を受けると予想される地域では、問題が発生する可能性が高いを浸漬します。この場合、タンパク質-リガンド複合体の共晶析法など他の方法を実行する必要があります。
開示事項
著者は競争の興味を宣言しません。
謝辞
ビームライン 08 ID、08 BM 技術革新・自然科学・ エンジニア リング研究評議会カナダのカナダの財団によってサポートされているカナダの光源で本稿で説明した x 線回折実験を行い、カナダ保健研究機構、国立研究評議会カナダ西部経済の多様化カナダ サスカチュワンの政府サスカチュワン大学ITC とバリの商品へのアクセスの病気の子供のため構造 & 生物物理の中核施設、病院を確認したいと思います。J.E.O. は、バンティング博士研究フェローシップ BPF-144483 健康の研究のカナダの協会からサポートされていました。T. s. は受信者のカナダ大学院奨学金修士賞および健康の研究のカナダの協会からヴァニエ カナダ大学院奨学金。この仕事は、営業 PJT 148811 (j. p. j.) 健康の研究のカナダの協会からの助成金によって支えられました。一部では、カナダの研究の椅子プログラム(j. p. j.)からの資金のおかげで、この研究がうけた。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
参考文献
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved