Method Article
إعداد الأقسام الفرعية بلاستيدات الخضراء من نبات لتحليل البروتين التعريب Immunoblotting أو البروتيوميات
In This Article
Summary
هنا، يمكننا وصف أسلوب لتنقية المعايشة سليمة من أوراق نبات وعلى المقصورات الفرعية الرئيسية الثلاثة (المغلف، سدى، وثيلاكويدس)، باستخدام مزيج من سينتريفوجيشنز التفاضلية، التدرجات بركل المستمر، و تدرجات السكروز متقطع. الأسلوب قيمة بالنسبة سوببلاستيديال والترجمة سوبسيلولار للبروتينات إيمونوبلوتينج والبروتينات.
Abstract
الجبيلة هي المكونات الرئيسية للخلايا النباتية. هذه للبلاستيده الوفاء بالعديد من الوظائف الحاسمة، مثل استيعاب الكربون والكبريت والنيتروجين، فضلا عن تجميع نواتج الأيض الأساسية. وتتألف هذه العضيات من المقصورات الفرعية الرئيسية الثلاثة التالية. يحيط عضية المغلف، تتميز بالأغشية اثنين، ويتحكم تبليغ البلاستيديه مع مقصورات خلية أخرى. ستروما هي المرحلة القابلة للذوبان في بلاستيدات الخضراء والموقع الرئيسي حيث يتم تحويل ثاني أكسيد الكربون إلى الكربوهيدرات. غشاء ثايلاكويد هو الغشاء الداخلي شبكة تتألف من وجرانة (الأكياس المضغوطة شقة) و lamellae (هياكل أقل كثافة)، حيث يأخذ التمثيل الضوئي أوكسيجينيك. يصف هذا البروتوكول خطوة بالإجراءات اللازمة للتنقية، استخدام سينتريفوجيشنز التفاضلية والتدرجات بركل، من الجبيلة سليمة من نبات، وعن وجود واستخدام التدرجات السكروز، في ثلاثة الأقسام الفرعية (أي، المغلف وسدى ثيلاكويدس). هذا البروتوكول كما يوفر إرشادات حول كيفية تقييم نقاء هذه الكسور باستخدام علامات المرتبطة إلى المقصورات بلاستيدات الخضراء الفرعية المختلفة. الأسلوب الموصوفة هنا قيمة بالنسبة للتعريب سوببلاستيديال للبروتينات باستخدام إيمونوبلوتينج، ولكن أيضا سوبسيلولار والبروتينات سوببلاستيديال وغيرها من الدراسات.
Introduction
الجبيلة هي المكونات الرئيسية للخلايا النباتية. التي تجنيها من سلف سيانوباكتيريال التي مرت اندوسيمبيوسيس وتطورت في نهاية المطاف عضية أثناء تطور1،2. وتتضمن هذه العضيات المقصورات الرئيسية الثلاثة (الشكل 1). اعتماد نظام المغلف الداخلية وأغشية خارجي المحيطة في عضية. يحتوي على الإنزيمات المختلفة المشاركة في التمثيل الغذائي للدهون وأصباغ هذا النظام غشاء مزدوج وهو في الغالب المكرسة لعنصر التحكم للاتصال بين للبلاستيده وفي سيتوسول. أنه يحتوي على مختلف نظم النقل التي تسمح باستيراد البروتينات النووية المشفرة، وتبادل الأيونات ونواتج الأيض بين في سيتوسول وبلاستيدات الخضراء وبالتالي تنظيم وظائف الأيضية الأساسية النباتية الخلية3،4 . ستروما، في مرحلة قابلة للذوبان من بلاستيدات الخضراء، يحتوي على إنزيمات دورة كالفن (CO2 الاستيعاب)، تجميع نواتج الأيض المختلفة بما في ذلك الأحماض الأمينية والفيتامينات، وأجهزة النسخ والترجمة البلاستيديه. غشاء ثايلاكويد هي شبكة غشاء داخلي منظم على نطاق واسع حيث تجري المرحلة الضوء لعملية التمثيل الضوئي. وبالتالي، الجبيلة هي المكان الذي يقع فيه الأيضية الأساسية5.
من أجل فك الآليات التنظيمية الجديدة التي تتحكم في ديناميات بلاستيدات الخضراء وعلم وظائف الأعضاء، تعريف الترجمة sub بلاستيديال بلاستيدات الخضراء البروتينات وبالتالي حاسمة لدعم دراسات هادفة تهدف إلى فهم أفضل لوظائف البروتينات في نموذج الكائنات الحية6. بغية الحصول على الترجمة سوببلاستيديال الحقيقية لهذه البروتينات، من الضروري ومن ثم ابدأ من الكسور سوببلاستيديال نقية جداً (الأغشية المغلف وسدى ثيلاكويدس). وفي هذا السياق، والهدف من هذا البروتوكول هو تنقية المعايشة سليمة من أوراق نبات استخدام سينتريفوجيشنز التفاضلية والمستمر بركل التدرجات، ويجزئ لهم استخدام التدرجات السكروز متقطع، في ثلاثة الأقسام الفرعية (أي، المغلف وسدى ثيلاكويدس). الأسلوب الموصوفة هنا أيضا إرشادات لتقييم نقاء المنقي الكسور sub-أورجانيلار باستخدام علامات المرتبطة إلى المقصورات بلاستيدات الخضراء الفرعية المختلفة. هذا البروتوكول قيمة للتعريب سوببلاستيديال للبروتينات باستخدام إيمونوبلوتينج، وإجراء المزيد من التحليل للكسور المنقي استخدام الطيف الكتلي (مللي ثانية)-على أساس دراسات البروتين.
Protocol
1-إعداد المخازن المؤقتة وحلول الأسهم والتدرجات
- إعداد الحلول الأسهم التالية التي يمكن تخزين إلى 6 أشهر في 4 درجات مئوية.
- تحضير 1 لتر من تريسيني المخزن المؤقت (م 1، الرقم الهيدروجيني 8.4) وتريسيني المخزن المؤقت (1 م، درجة الحموضة 7.6). ضبط الأس الهيدروجيني بإضافة كوه الكريات.
- تحضير 1 لتر حامض الإيثيلين (الرقم الهيدروجيني يدتا، 0.5 م، 8) و 3-(N-morpholino) البروبان حمض السلفونيك (والمماسح) المخزن المؤقت (م 1، الرقم الهيدروجيني 7.8). ضبط الأس الهيدروجيني بإضافة حبيبات هيدروكسيد الصوديوم.
- إعداد 50 مل مجكل2 (م 1).
- إعداد 50 مل حوزتي الحلول مثبطات: فلوريد فينيلميثيلسولفونيل (بمسف في الايزوبروبانول، 100 ملم)، بينزاميديني هيدروكلوريد هيدرات (100 ملم)، وحمض كابرويك اليورو الأمينية (50 مم).
ملاحظة: في حين بمسف وحمض كابرويك الأمينية مستقرة في حل لأشهر عند 4 درجة مئوية، يجب تخزين بينزاميديني الحل عند-20 درجة مئوية.
- إعداد الحلول التالية في اليوم قبل التجربة وتخزين كافة الحلول في 4 درجات مئوية.
- إعداد 4 لتر لطحن المتوسطة pH 8.4 المحتوية على تريسيني--كوه (20 ملم، ودرجة الحموضة 8.4) السوربيتول (0.4 M) ويدتا (10 ملم، ودرجة الحموضة 8) ناكو3 (10 مم). ضبط الأس الهيدروجيني بإضافة حبيبات هيدروكسيد الصوديوم. إضافة ألبومين المصل البقري (BSA) 0.1% (w/v) فقط قبل الاستخدام، ومزيج جيد.
- إعداد 500 مل من غسل المتوسطة (2x) درجة الحموضة 7.6 المحتوية على تريسيني--كوه (20 ملم، ودرجة الحموضة 7.6)، السوربيتول (0.8 M) ومجكل2 (5 مم)، ويدتا (2.5 مم). ضبط الأس الهيدروجيني بإضافة حبيبات هيدروكسيد الصوديوم. تمييع هذا الحل بعد إعداد الحل التدرج بركل للحصول على الغسيل المتوسطة (س 1).
- إعداد 200 مل من محلول التدرج بركل لتنقية بلاستيدات الخضراء بخلط بركل مع الغسيل المتوسطة (2x) في وحدة تخزين متساوية للحصول على حل نهائي في 50% (v/v) بركل/السوربيتول 0.4 متر.
- إعداد 50 مل من محلول السكروز الحلول لوجود بلاستيدات الخضراء بخلط والمماسح (10 مم، الرقم الهيدروجيني 7.8)، مجكل2 (4 ملم)، وتركيزات مختلفة من السكروز (م 0.3 0.6، و 0.93 متر مربع).
- إعداد التدرجات والمخازن المؤقتة قبل البدء بالتجربة التالية.
- إعداد ست أنابيب من التدرجات بركل (كل منها تحتوي على 30 مل من نسبة 50% بركل/السوربيتول 0.4 M) بالطرد المركزي في 38,700 س ز لمدة 55 دقيقة في 4 درجات مئوية. ابتعد الفرامل لمنع مزج من التدرجات. بعد الطرد المركزي، بتخزين الأنابيب التي تحتوي على تدرجات بريفورميد في غرفة باردة حتى الاستخدام.
- إعداد أربعة أنابيب من التدرجات السكروز، مع التدرج كل تشكيل من ثلاث طبقات السكروز التالية: 3 مل من 0.93 م، 2.5 مل من 0.6 متر، و 2 مل من محلول السكروز 0.3 متر. تراكب بعناية كل طبقة، باستخدام مضخة تمعجية بدءاً م 0.93 في الجزء السفلي والانتهاء مع 0.3 متر في الجزء العلوي.
- إعداد 50 مل من ناقص التوتر المتوسط لتحلل بلاستيدات الخضراء التي تتضمن والمماسح (10 مم، الرقم الهيدروجيني 7.8)، مجكل2 (4 ملم)، بمسف (1 مم، أنشئت في الايزوبروبانول)، بينزاميديني هيدروكلوريد هيدرات (1 مم)، وحمض كابرويك اليورو الأمينية (0.5 ملم). تخزين المخزن المؤقت على الجليد حتى الاستخدام.
- إعداد 50 مل غشاء الغسيل مخزن يحتوي على والمماسح (10 مم، الرقم الهيدروجيني 7.8)، بمسف (1 ملم)، بينزاميديني هيدروكلوريد هيدرات (1 ملم)، وحمض كابرويك اليورو الأمينية (0.5 ملم). تخزين المخزن المؤقت على الجليد حتى الاستخدام.
2-النمو والحصاد من أوراق نبات
- لنمو النباتات نبات ، إعداد الأحواض البلاستيكية الكبيرة 4 (لسطح مجموع من 0.5 إلى 1 م2) من النباتات نبات ببذر 30 ملغ بذور في كل عموم. تنمو النباتات نبات لمدة 5 أسابيع في دائرة الضوء 12-ح في 23 درجة مئوية (اليوم)/18 درجة مئوية (ليلة) بكثافة ضوء من 150 ميكرومتر m-2 s-1.
- احتضان النباتات في غرفة مظلمة وباردة (4 درجات مئوية) بين عشية وضحاها قبل التجربة (خفض حجم حبيبات النشا في الجبيلة).
- قبل تزن كوب 1 لتر وثم وضعه على الجليد قبل البدء في حصاد نبات المواد.
- حصاد أوراق نبات عن طريق تجنب التربة (السماد العضوي). إعادة زن الكأس وسجل وزن الأنسجة.
ملاحظة: من 400 إلى 500 غرام مادة نبات المتوقع من الأحواض الأربعة. - تجانسه يترك في غرفة باردة مع 2 لتر من طحن المخزن المؤقت (إضافة جيش صرب البوسنة قبل الاستخدام) ثلاث مرات/2 s في كل مرة، في خلاط بسرعة عالية.
- تصفية هوموجيناتي في غرفة باردة باستخدام 4 طبقات من الشاش وطبقة واحدة من النايلون بلوت. الضغط بلطف يترك هوموجيناتي داخل بلوتيكس الشاش/النايلون لاستخراج السائل.
- استعادة الأنسجة المتبقية في كأس خلاط لاستخراج ثانية. كرر الخطوات من 2.5 و 2.6 باستخدام 2 لتر من طحن المتوسطة والجديدة 4-5 طبقات من الشاش (في غرفة باردة).
3-تنقية النفط الخام المعايشة باستخدام الطرد المركزي التفاضلي
- المثل توزيع استخراج النفط الخام الخلية إلى ستة 500 مل الزجاجات ووضع الزجاجات على الجليد قبل الطرد المركزي. أجهزة الطرد المركزي لمدة 2 دقيقة حالما يتم التوصل إلى الحد الأقصى للسرعة (2,070 س ز) (أقصى تسريع والفرامل على، 4 درجة مئوية).
- تجاهل المادة طافية بلطف.
- نضح المادة طافية المتبقية باستخدام مضخة لمياه، والحفاظ على الكريات المحتوية على المعايشة الخام تتركز على الجليد.
- ريسوسبيند الكريات بلطف بإضافة كمية ضئيلة من الغسيل المتوسطة (س 1) (الحجم النهائي لأن الإيقاف بلاستيدات الخضراء مجتمعة = مل 36) استخدام الرسام أو ملعقة بلاستيكية منحنية. استخدام بيبيت 10 مل إضافة 3 مل من غسل المتوسطة في كل زجاجة.
ملاحظة: لا تستخدم بيبيت مع نصائح جيدة جداً لتجنب كسر الجبيلة. وبدلاً من ذلك، قطع الأزرق طرف بيبيت مع شفرة حلاقة لتوليد ثقب أكبر. - جمع المعايشة ريسوسبينديد في أنبوب واحد باستخدام بيبيت 10 مل. المزيج بلطف بعكس أنبوب للحصول على تعليق متجانسة قبل تحميلها على التدرجات بركل.
4-تنقية المعايشة سليمة على استمرار بركل التدرج
- تحميل مل 6 تعليق بلاستيدات الخضراء على رأس كل من التدرجات بيركول ستة استخدام بيبيت 10 مل لتجنب كسر المعايشة ببطء.
- الطرد المركزي التدرجات لمدة 10 دقيقة في 13,300 س ز، 4 درجة مئوية باستخدام دوار يتأرجح دلو.
ملاحظة: ينبغي التعجيل ببطء، وينبغي قطع المكابح (الفرامل قبالة أو التباطؤ بطيء) لمنع مزج من التدرجات بركل. - نضح في المرحلة العليا يحتوي على كسر المعايشة وسليمة الميتوكوندريا استخدام مضخة لمياه، واسترداد ثم المعايشة سليمة في الدنيا المرحلة (أخضر داكن واسع النطاق) مع بيبيت 10 مل. كن حذراً لا نضح نوى والحطام خلية (الموجودة في الجزء السفلي من الأنبوب) مع المعايشة سليمة (الشكل 2A).
- تخفف من 3-4-إضعاف تعليق بلاستيدات الخضراء سليمة مع الغسيل المخزن المؤقت (س 1). أجهزة الطرد المركزي لمدة 2 دقيقة حالما يتم التوصل إلى الحد الأقصى للسرعة (2,070 س ز، 4 درجة مئوية) (أقصى تسريع والفرامل في).
- تجاهل المادة طافية بعناية.
- تماما نضح المادة طافية المتبقية مع مضخة لمياه، والحفاظ على بيليه للمعايشة سليمة مركزة على الجليد.
- قبل تحلل بلاستيدات الخضراء، الاحتفاظ قاسمة لكسر بلاستيدات الخضراء سليمة في حوالي 1 مل من غسل المتوسطة (س 1) لإجراء تحاليل أخرى استخدام الصوديوم دوديسيل كبريتات polyacrylamide هلام استشراد (الحزب الديمقراطي الصربي صفحة) وغرب النشاف. تبقى صغيرة الكوة من هذه المعايشة سليمة لتحديد تركيز البروتين. تخزين الكسر سليمة بلاستيدات الخضراء في النتروجين السائل لمزيد من التجارب.
5-تحلل المعايشة سليمة باستخدام المخزن المؤقت ناقص التوتر وتنقية للأقسام الفرعية بلاستيدات الخضراء في التدرجات السكروز متقطع
- المعايشة سليمة المنقي من ريسوسبيندينج بيليه في المتوسط ناقص التوتر الذي يحتوي على مثبطات البروتياز (النهائي يجب أن لا يتجاوز الحجم 12 مل).
ملاحظة: هذه الخطوة، استخدام بيبيت مع نصائح الجميلة (نصائح الأزرق) من الممكن منذ إينتاكتنيس للمعايشة ضروري لا أكثر (بيبيتينج المعايشة صعودا وهبوطاً طالما لم يتم حراكه بيليه تماما). نبات المعايشة هشة جداً (بالمقارنة مع المعايشة البازلاء، على سبيل المثال) وما تحلل فورية تقريبا بعد حضانة في وسط ناقص التوتر. - بطء تحميل 3 مل الجبيلة ليسيد على رأس كل التدرجات السكروز بريفورميد استخدام مضخة تمعجية.
- أولتراسينتريفوجي التدرجات ح 1 في (س 70,000 ز، 4 درجة مئوية). تحقيق التوازن بين أزواج من أنابيب باستخدام المخزن المؤقت المتوسطة ناقص التوتر قبل الطرد المركزي.
- استرداد البروتينات اللحمية القابلة للذوبان بعناية قبل بيبيتينج في المرحلة العليا من التدرج (3 مل من كل التدرج) (الشكل 2). تأخذ قاسمة لتحديد تركيز البروتين7. تخزين في ستروما في النتروجين السائل لمزيد من التجارب.
- نضح في المرحلة العليا المتبقية من كل متدرجة تصل إلى الفرقة الصفراء باستخدام مضخة لمياه.
- استرداد الفرقة الصفراء (المغلف) مع بيبيت (حوالي 1 مل من كل التدرج). تجمع المغلفات في أنبوب واحد.
- إزالة في المرحلة المتبقية من كل متدرجة تصل إلى بيليه ثايلاكويد استخدام مضخة لمياه.
6-الغسيل وتركيز ثايلاكويد ونظم الغشاء المغلف
- ريسوسبيند الكريات ثايلاكويد (الكريات الخضراء) في وحدة تخزين الحد أدنى (2 مل) من الغشاء الغسيل المخزن المؤقت (س 1) (مع مثبطات البروتياز).
- تمييع المعلقات المغلف وثايلاكويد تجليد-3-4 في غشاء الغسيل المتوسطة (ضبط حجم الصوت إلى 10 مل) و ultracentrifuge ح 1 في (س 110,000 ز، 4 درجة مئوية). تحقيق التوازن بين أزواج من أنابيب استخدام الغشاء الغسيل المخزن المؤقت قبل استخدام الطرد المركزي.
- نضح سوبيرناتانتس استخدام مضخة لمياه بعناية.
- إضافة حوالي 100 ميليلتر من الغشاء غسل العازلة (مع مثبطات البروتياز) إلى بيليه المغلف. تأخذ قاسمة لتحديد تركيز البروتين7. تخزين إعداد الغشاء المغلف المنقاة في نيتروجين سائل.
- ريسوسبيند بيليه ثيلاكويدس في 3 مل غشاء غسل العازلة (مع مثبطات البروتياز). تأخذ قاسمة لتحديد تركيز البروتين7. تخزين جزء غشاء ثايلاكويد في نيتروجين سائل.
النتائج
خطوات متتالية للإجراء الذي أدى إلى بلاستيدات الخضراء النقية وتلك الأقسام الفرعية استؤنفت في الشكل 2. التدرج بركل (الشكل 2A) يتيح التمييز بين المعايشة سليمة من كسر بلاستيدات الخضراء والميتوكوندريا (أعلى من التدرج) أو نوى وخلية الحطام (أسفل التدرج). بعد تمزق العضيات تنقية بركل بفضل حدوث صدمة ناضح، يتم فصل الكسور الناتجة عن تدرج سكروز (الشكل 2). ستروما (الجزء القابل للذوبان من بلاستيدات الخضراء) تطفو على سطح التدرج السكروز. يتم استرداد الحويصلات الغشاء المغلف الخفيفة كعصابة صفراء منفصلة في الواجهة السكروز M 0.6/0.93. الحويصلات الأغشية ثايلاكويد أثقل تتركز في الجزء السفلي من الأنبوب. بعد الانتعاش، والغسيل وتركيز للكسور غشاء اثنين، كمياً البروتينات ويتم تحليل تكوين كافة الكسور الأربعة على الحزب الديمقراطي الصربي صفحة (الشكل 2). يتم تحميلها في الممرات بصورة متساوية من بروتين (20 ميكروغرام لكل جزء المنقي). هذا مع العلم أن الجبيلة تتضمن فقط 1% بروتينات مغلف و 50% من البروتينات من سدى أو من ثيلاكويدس، يميل إلى المبالغة في تقدير التلوث عبر التحضيرات المنقاة المغلف مع سائر الأقسام الفرعية بلاستيدات الخضراء. ومع ذلك، يسمح هذا الأسلوب للكشف عن كميات دقيقة من البروتينات عبر تلويث جزء المغلف. علامات من كل حجرة (أي، وفرة البروتينات) مفيدة للغاية في تقييم التلوث المنتقل من الكسور. وفي الواقع، يتوقع الكسور غشاء ثايلاكويد ومغلف تحتوي على كميات منخفضة جداً من وحدة فرعية كبيرة من روبيسكو (ربكل)، البروتين الأكثر وفرة من ستروما (كاتشين 50). ويمكن بسهولة تمييز المعايشة كسر من بلاستيدات الخضراء سليمة نظراً لفقدان هذا البروتين stromal8. ضوء حصاد البروتينات المعقدة (لهكب) هي 25-كاتشين ثايلاكويد وفرة المكونات التي ينبغي بالكاد تلوث الأغشية المغلف9(أقل من 3%). أخيرا، الفوسفات-تريوسي-فوسفات ترانسلوكاتور (تي بي تي) هو بروتين 30-كاتشين مرئياً فقط في جزء المغلف المنقي بسبب تخصيب قوية (أي x 50 إلى 100) في جزء المغلف عند مقارنتها بأكملها بلاستيدات الخضراء مقتطفات. باستخدام الطريقة الموضحة هنا، الأقسام الفرعية بلاستيدات الخضراء عموما سيئة عبر الملوثة حسبما أكدت استخدام التحليلات الغربية-وصمة عار (الشكل 2D) الاعتماد على الأجسام المضادة الموجهة ضد علامات معروفة لجميع الأقسام الفرعية الثلاثة: القابلة للذوبان كيتول-حمض ريدوكتويسوميراسي (كاري) من سدى، النحاس المغلف بلاستيدات الخضراء أتباسي (HMA1)، وفي ضوء الحصاد البروتينات المعقدة (لهكب) من الأغشية ثايلاكويد. يمكن تحديده كمياً التلوث عبر من المقصورات الفرعية الثلاثة باستخدام إيمونوبلوتينج ووسائل قياس الطيف الكتلي تحليلات9. في حين ستروما عادة لا لوثها كسور المغلف أو ثايلاكويد، كسور المغلف المنقي تحتوي على 3% بروتينات ثايلاكويد وما يصل إلى 10% بروتينات من سدى. البروتينات من سدى تلويث سيئة في الأغشية ثايلاكويد (أقل من 1%) ولكن تحتوي على ثيلاكويدس تصل إلى 3 في المائة بروتينات الغشاء المغلف. عبر أكثر من بعد دوراً حاسما في تحديد موقع سوببلاستيديال حقيقية من البروتينات بلاستيدات الخضراء، والأسلوب الحالي وبالتالي يحد أيضا من استنتاجات خاطئة حول التعريب سوببلاستيديال البروتينات الناتجة عن التلوث.
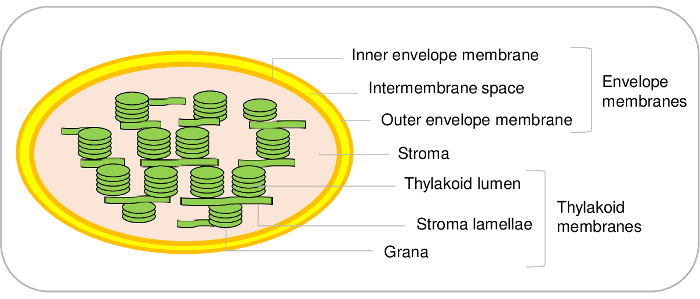
رقم 1: مخطط تمثيلي للأقسام الفرعية بلاستيدات الخضراء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
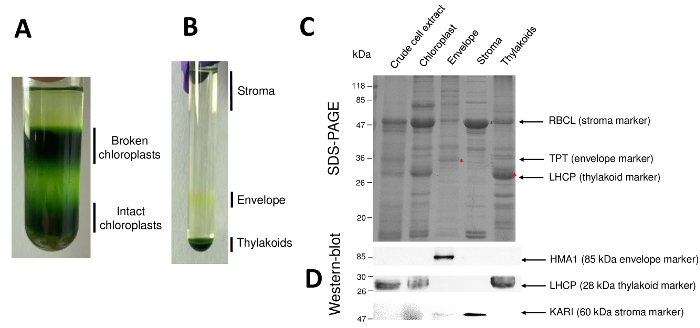
رقم 2: تنقية المعايشة سليمة والرئيسي ثلاثة الفواتير دون استخدام التدرجات بركل والسكروز. ألف بركل الانحدار السماح للفصل بين المعايشة مكسورة وسليمة. ب-التدرج السكروز مما يتيح فصل الكسور ستروما ومغلف ثايلاكويد. ج-ممثل الحزب الديمقراطي الصربي صفحة بروتينات من المعايشة سليمة وعلى المقصورات الفرعية الرئيسية الثلاثة مما يسمح بتصور علامات وفيرة من كل حجرة الفرعية. ويتضمن كل لين 10 ميكروغرام من البروتينات. علامات الوزن الجزيئي: ربكل، وحدة فرعية كبيرة من روبيسكو (العلامة ستروما)؛ تي بي تي، الفوسفات/تريوسي-فوسفات ترانسلوكاتور (العلامة للمغلف)؛ لهكب، ضوء حصاد البروتينات المعقدة (العلامة ثايلاكويد). د-التجارب وصمة عار الغربية مما يسمح للكشف عن علامات محددة (باستخدام أجسام مضادة محددة) من كل حجرة الفرعية: ATPase HMA1 المغلف النحاس بلاستيدات الخضراء10، في ضوء حصاد البروتينات المعقدة لهكب من ثايلاكويد الأغشية11، وريدوكتويسوميراسي كيتول-حمض كاري من ستروما9. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
هذه المادة يهدف إلى التفاصيل المستخدمة لتنقية المعايشة (وهذه الأقسام الفرعية) البروتوكول خطوة بخطوة من نبات التمويل. منذ توفر لها تسلسل الجينوم الكامل منذ ما يقرب من عقدين من الزمان، ومجموعات كبيرة من طفرات الإدراج متاحة للمجتمع، الآن هو نبات مقبولة على نطاق واسع كمحطة لنموذج. ومع ذلك، في حين تم تكييف هذا النبات تماما للنهج الوراثية، علماء النبات اللازمة للتكيف مع أدوات البيوكيميائية والفسيولوجية لهذا النموذج الناشئ. البروتوكولات التي تسمح لتنقية المعايشة متعددات النشطة من أوراق نماذج البيوكيميائية الراسخة مثل السبانخ12 أو البازلاء13 وبالتالي كان يجب تكييف. الطريقة الأولى تصف تنقية من نبات الجبيلة نشرت في عام 199814، قبل الإفراج عن تسلسل جينوم نبات . منذ عدة سنوات قدمت أساليب بسيطة في وقت لاحق، لعزل المعايشة نبات متوافقة مع دراسات تهدف إلى تحليل في المختبر الاستيراد من البروتينات في العضيات المنقي متاح15،16. ومع ذلك، لم تسمح هذه الأساليب الجمع بين مستوى عال من النقاء والمحافظة على النشاط الضوئي للمعايشة المنقي. في الآونة الأخيرة17، طريقة سريعة أنشئ، التي تعتمد على استخدام التدرجات بركل، ويسمح بالاحتفاظ بحوالي 90% معدل التمثيل الضوئي تقاس في البداية أوراق نبات.
يسمح البروتوكول هو موضح هنا لتنقية المعايشة نبات في مستوى ممتازا من النقاء. الواقع المناعية الكشف عن الملوثات من المقصورات الخلية الأخرى أظهرت أن العضيات المنقي تخلو من الميتوكوندريا وغشاء البلازما علامات9،10. وكان هذا البروتوكول أيضا تتسم بالكفاءة لتنقية المعايشة من عدة أعطيت اصطفاء18، مثل كولومبيا (Col) أو واسيليوسكيجا (WS)، أي اصطفاء التي كانت تستخدم للجينوم أو أعربت عن تسلسل العلامات (التكنولوجيات السليمة بيئياً) التسلسل المشاريع ولكن أيضا توليد تي-دنا الإدراج طفرات في نبات. وبعبارة أخرى، عندما يكون البروتيوميات الدراسات التي يتعين القيام بها، هذا البروتوكول متوافق مع هذه اصطفاء مرجع اثنين من نبات. وأخيراً، عائد المعايشة باستخدام هذا البروتوكول مماثلة لتلك التي تم الحصول عليها عند ابتداء من أوراق السبانخ أو البازلاء (أي 3%، مقيسا من محتوى الكلوروفيل في بلاستيدات تنقيته بركل الخضراء بالمقارنة مع العدد الإجمالي يترك كمية الكلوروفيل موجودة في البدء). العائد من البروتينات، حيث يقع بالقرب من 50 مغ بروتينات بلاستيدات الخضراء، وعندما يتم تنقيته العضيات من 500 غرام أوراق نبات عمرها 5 الأسبوع.
أن التوصل إلى مثل هذا المردود الجيد (وسلامة بلاستيدات الخضراء)، واحد لكن ينبغي إيلاء اهتمام خاص للعديد من الخطوات عند استخدام هذا البروتوكول. بلاستيدات الخضراء في نبات هي بنية هشة للغاية (وهذا ليس الحال بالنسبة للمعايشة البازلاء، على سبيل المثال). وبالتالي مطلوب اهتماما خاصا بغية تجنب تمزق واسع النطاق العضيات أثناء تنقية. عدد وحجم حبيبات النشا في الجبيلة الحاسمة للتحضير للمعايشة سليمة. وفي الواقع، المعايشة التي تحتوي على الحبوب النشا كبيرة عموما سيتم قطع خلال الخطوات الأولية سينتريفوجيشنز التفضيلية الرامية إلى تركيز الكسور بلاستيدات الخضراء الخام12. ولذلك، ينبغي أن تظل النباتات بين عشية وضحاها في غرفة مظلمة وباردة (4 درجة مئوية) قبل التجربة، الحد من كمية النشا.
يمكن أن يغري المستخدمين الجدد لهذا البروتوكول للبدء من كميات أكبر من المواد ليف (مأخذ ضخمة من النباتات نبات القديمة مع أوراق أكبر) في محاولة لتعزيز انتعاش المعايشة المنقي. ومع ذلك، في أيدينا، بدءاً من يترك الصغار (5-أسبوع) هو أفضل حل وسط الجمع بين الغلة والنقاء والنزاهة من العضيات المنقي. وفي الواقع، أوراق قديمة جداً التخصيب في المركبات الفينولية التي عرضت أن يكون له أثر سلبي على سلامة بلاستيدات الخضراء19.
وأخيراً، الخطوة الأولى استخراج (طحن الأنسجة) خطوة حاسمة أخرى. يجب أن تكون عملية مزج محدودة لبضع ثوان. كما ذكر أعلاه، قد تميل المستخدمين الجدد لاستخدام مزج أطول، وبالتالي تتوقع بشدة زيادة غلة العضيات المنقي. ومع ذلك، إذا مزج أطول فعالية إصدار المزيد من المواد من الأوراق، يبدو أن نسبة المعايشة كسر يزيد من سرعة في استخراج النفط الخام من الخلية. بسبب هذا نسبة عالية من كسر للمعايشة سليمة في الأجل المتوسط، كذلك تتأثر بشدة خطوات تنقية (فصل في التدرجات بيركول) والعائد للتنقية منخفضا بشكل غير متوقع.
توفر بروتوكولات معينة لتنقية العضيات أتاحت سلسلة من الإنتاجية العالية المستندة البروتيوميات تجارب تجري على عينات بلاستيدات الخضراء. وأتيحت هذه البيانات في عدة قواعد البيانات العامة6، مما يتيح لعلماء الأحياء في المجال التطويع اللغوي سوبسيلولار (وسوببلاستيديال) دقيقة للعديد من البروتينات بلاستيدات الخضراء. وكان هذا صحيحاً بشكل خاص للبروتينات مغلف هويته ومعظمها مجهولاً الموقع قبل هذه التحليلات، نظراً لأن الأغشية المغلف يمثلون عنصرا بلاستيدات الخضراء ثانوية (1-2 ٪ البروتينات بلاستيدات الخضراء) بينما كان يلعب دوراً رئيسيا في بلاستيدات الخضراء الأيض ونشوء حيوي5،20. باستخدام بروتوكول الموصوفة هنا، قمنا مؤخرا بتحليل تكوين المقصورات بلاستيدات الخضراء الرئيسية الثلاثة من نبات (أي سدى وثيلاكويدس النظام الغشاء المغلف)9. تستند إلى نهج البروتيوميات شبه كمي (عد الطيفية)، كنا قادرين على تقييم تقسيم مئات بروتينات في هذه الأقسام الثلاثة بلاستيدات الخضراء.
في حين يسمح هذا البروتوكول لتنقية المقصورات الرئيسية الثلاث من بلاستيدات الخضراء من نبات، من الممكن أيضا التمييز بين الأقسام الفرعية إضافية في بلاستيدات الخضراء. والواقع أن النظام الغشاء المغلف عن الداخلية والأغشية المغلف الخارجي (الشكل 1). بيد أن على حد علمنا، لا تزال طريقة لتنقية الأغشية المغلف الداخلي والخارجي من نبات الجبيلة التي ستنشأ. يمكن تنقية الأغشية المغلف الداخلي والخارجي من الجبيلة22 21 أو البازلاء السبانخ. القيد الرئيسي نبات ينتج معظمها من المبالغ المقيدة لابتداء من المواد. بدءاً من 500 غرام أوراق نبات (الذي يتطلب الفعل 1 م2 سطح في دائرة نمو) يسمح لتنقية فقط 100 ميكروغرام من البروتين المغلف. من ناحية أخرى، فمن السهل أن تبدأ مع يترك 5-10 كجم من السبانخ من السوق، وإلى تنقية كمية كبيرة من المعايشة8 وإنهاء مع عائد من 3 إلى 10 مغ بروتينات مغلف من هذه المواد.
نفس الشيء صحيح بالنسبة للأقسام الفرعية ثايلاكويد. وفي الواقع، ثيلاكويدس مصنوعة من الضوء غشاء الحويصلات (لاميلاي) وهياكل كثيفة (جرانه) (الشكل 1). تتوفر بروتوكولات معينة التمييز بين هذه المقصورات اثنين في نبات،من2324. ومرة أخرى، استناداً إلى تحليل كمي البروتيوميات، نحن مؤخرا جردها البروتينات الموجودة في هذه الأقسام الفرعية اثنين24. هذه النهج، إلى جانب تحقيق متعمق للأدب، يسمح بالتحقق من صحة، أو اقتراح فرضيات لموقع سوببلاستيديال المئات من البروتينات ثايلاكويد. ومع ذلك، من المهم ملاحظة أن ميكرودومينس الغشاء إضافية موجودة في هامش منحنى ثيلاكويدس. هذه الأقسام الفرعية بروتين دهني، أو بلاستوجلوبوليس، تقترن بشكل دائم للأغشية ثايلاكويد وتحتوي على مجموعة محددة من البروتينات25. باستخدام هذا البروتوكول، ليس مما يمكن تمييز هذه البروتينات محددة من المكونات ثايلاكويد الأخرى.
تزال تفتقر إلى بعض مكونات المغلف أو ستروما ثايلاكويد (المعروفة) حقيقية من قوائم للبروتينات المكتشفة. جنبا إلى جنب مع التحاليل الكيميائية الحيوية والمناعية المستهدفة، ستكون عونا كبيرا لإعادة النظر في محتوى بلاستيدات الخضراء نحو مرجع كامل للتكوين في الأقسام الفرعية مختلف التحسين المستمر لحساسية مرض التصلب العصبي المتعدد.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل بزمالة دكتوراه مشتركة إلى IB من معهد البيولوجيا النباتية وتربية شعبة ومن جرال لابيكس (ANR-10-لابكس-49-01). كما نود أن نعترف بالمشروع ANR ANR-15-معرض أيدكس-02، الدكتور أوليفييه بياو فالون (إيببك باريس) لأجسام مضادة ضد لهكب والدكتور رينو دوماس (لبكف، غرينوبل) للأجسام المضادة ضد كاري.
Materials
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
References
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , Chapter 3 Unit 3 30 (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. Edelman, M., Hallick, R. B., Chua, N. -H. , Elsevier Science Publishers BV. Amsterdam. 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , Oxygraphics Ltd, University of Sheffield. South Yorkshire, UK. (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved