Method Article
拟南芥叶绿体子隔层的制备及免疫印迹蛋白质组化分析
摘要
在这里, 我们描述了从拟南芥叶及其三个主要子隔间 (包络、基质和 thylakoids) 中纯化完整叶绿体的方法, 使用微分 centrifugations、连续 Percoll 梯度的组合和不连续的蔗糖梯度。该方法对蛋白质的 subplastidial 和亚细胞定位具有重要的免疫印迹和蛋白质组学意义。
摘要
叶绿体是植物细胞的主要成分。这种质体实现了许多重要的功能, 如碳、硫和氮的同化以及必需代谢物的合成。这些细胞器由以下三个关键的子隔间组成。该信封的特点是两个膜, 包围细胞器和控制质体与其他单元格的通信。基质是叶绿体的可溶性相和二氧化碳转化为碳水化合物的主要部位。类囊体膜是由 grana (扁平压缩囊) 和片晶 (不太致密结构) 组成的内部膜网络, 在那里氧光合作用发生。本议定书描述了用 centrifugations 和 Percoll 梯度纯化拟南芥的完整叶绿体及其分馏 (使用蔗糖梯度) 在三中所需的分步过程。子隔间 (即信封、基质和 thylakoids)。本协议还提供有关如何使用与各种叶绿体子隔间相关的标记评估这些分数纯度的说明。本文所描述的方法对使用免疫印迹的蛋白质的 subplastidial 定位具有重要价值, 也适用于亚细胞和 subplastidial 蛋白质组学和其他研究。
引言
叶绿体是植物细胞的主要成分。它们来源于一个蓝藻的祖先, 它经历了 endosymbiosis, 并最终在进化1,2中进化成一个细胞器。此类细胞器包含三个主隔层 (图 1)。信封系统是由内部和外部的细胞膜周围的细胞器。这双膜系统包含各种酶参与脂质和色素的新陈代谢, 主要用于控制质体和细胞质之间的交流。它包含允许进口核编码蛋白的各种运输系统, 以及细胞质和叶绿体之间的离子和代谢物的交换, 从而调节植物细胞的基本代谢功能3,4.该基质是叶绿体的可溶性相, 含有卡尔文循环 (CO2同化) 的酶, 包括氨基酸和维生素在内的各种代谢物的合成, 以及质体的转录和翻译机械。类囊体膜是一种广泛组织的内部膜网络, 光相光合作用发生。因此, 叶绿体是必要的新陈代谢途径发生的地方5。
为了破译控制叶绿体动力学和生理学的新的调控机制, 定义叶绿体蛋白的亚 plastidial 定位是至关重要的, 以支持有针对性的研究, 以更好地了解蛋白质功能在模型有机体6。为了获得这些蛋白质的真正 subplastidial 本地化, 因此必须从高度纯净的 subplastidial 馏分 (包膜、基质和 thylakoids) 开始。在这方面, 本议定书的目的是通过差异 centrifugations 和连续 Percoll 梯度纯化拟南芥叶的完整叶绿体, 并使用不连续的蔗糖梯度分级分离它们, 在三子隔间 (即信封、基质和 thylakoids)。此处描述的方法还提供了使用与各种叶绿体子隔间相关的标记来评估纯化的亚 organellar 馏分纯度的说明。本协议对使用免疫印迹的蛋白质进行 subplastidial 定位和使用基于质谱 (MS) 的蛋白质组学研究来进一步分析纯化分数有价值。
研究方案
1. 缓冲区、库存解决方案和梯度的准备
- 准备以下库存解决方案, 最多可存储6月 (4 摄氏度)。
- 准备 1 L 氯化钾缓冲器 (1 m, ph 8.4) 和氯化钾缓冲液 (1 m, ph 7.6)。通过添加 KOH 颗粒调整 pH 值。
- 准备 1 L 乙酸酸 (EDTA, 0.5 m, pH 8) 和 3-(n-吗啉代) 丙烷磺酸 (拖把) 缓冲液 (1 M, ph 7.8)。添加氢氧化钠颗粒, 调节 pH 值。
- 准备50毫升的氯化镁2 (1 米)。
- 准备50毫升蛋白酶抑制剂溶液: phenylmethylsulfonyl 氟化物 (PMSF 在异丙醇, 100 毫米), 苯甲脒盐酸盐水合物 (100 毫米), 和ε-氨基己酸 (50 毫米)。
注: 虽然 PMSF 和氨基己酸在溶液中稳定, 在4摄氏度的月份, 苯甲脒溶液应存储在-20 摄氏度。
- 在实验前一天准备以下解决方案, 并将所有解决方案存储在4摄氏度。
- 准备 4 L 研磨培养基 pH 8.4 含氯化钾 (20 mM, ph 8.4), 山梨醇 (0.4 M), EDTA (10 毫米, pH 8), 和 NaHCO3 (10 毫米)。添加氢氧化钠颗粒, 调节 pH 值。在使用前加入牛血清白蛋白 (BSA) 0.1% (w/v), 混合均匀。
- 准备500毫升洗涤培养基 (2 x) pH 7.6 含氯化钾 (20 毫米, ph 7.6), 山梨醇 (0.8 M), 氯化镁2 (5 毫米), 和 EDTA (2.5 毫米)。添加氢氧化钠颗粒, 调节 pH 值。在制备 Percoll 梯度溶液后稀释溶液以获得洗涤介质 (1 x)。
- 为叶绿体纯化准备200毫升 Percoll 梯度溶液, 方法是将 Percoll 与洗涤培养基 (2 x) 在同等体积上混合, 以获得最终溶液, 在 50% (v/v) Percoll/0.4 M 山梨醇。
- 通过混合拖把 (10 mm、pH 7.8)、氯化镁2 (4 mm) 和不同浓度的蔗糖 (0.3 m、0.6 m 和 0.93 m) 准备50毫升的叶绿体分馏的蔗糖溶液。
- 在开始实验之前准备以下渐变和缓冲区。
- 准备六管 Percoll 梯度 (每个包含30毫升 50% Percoll/0.4 M 山梨醇) 通过离心在 38700 x g 在55摄氏度的4分钟。保持刹车, 防止梯度的混合。离心后, 将含有预制梯度的管子储存在冷室中, 直至使用。
- 准备四管蔗糖梯度, 每个梯度形成三以下蔗糖层: 3 毫升0.93 米, 2.5 毫升0.6 米, 和2毫升的0.3 米蔗糖。小心地覆盖每层, 使用蠕动泵从底部0.93 米开始, 并完成0.3 米在顶部。
- 准备50毫升低渗培养基的叶绿体裂解含拖把 (10 毫米, pH 7.8), 氯化镁2 (4 毫米), PMSF (1 毫米, 建立在异丙醇), 苯甲脒盐酸盐水合物 (1 毫米), 和ε-氨基己酸 (0.5 毫米)。将缓冲区存储在冰上, 直到使用。
- 准备50毫升的膜洗涤缓冲液, 其中含有拖把 (10 mm、pH 7.8)、PMSF (1 mm)、苯甲脒盐酸盐水合物 (1 mm) 和ε氨基己酸 (0.5 mm)。将缓冲区存储在冰上, 直到使用。
2.拟南芥叶片的生长和收获
- 对于拟南芥植物的生长, 在每个平底锅中播种30毫克的种子, 准备4个大型塑料平底锅 (总表面为0.5 至 1 m2) 的拟南芥植物。在23摄氏度 (天)/18 摄氏度 (夜间) 下, 在12小时的光循环下生长拟南芥植物5周, 光强为150微米 m-2 s-1。
- 在实验前一夜间在黑暗和寒冷的房间 (4 摄氏度) 孵育植物 (减少叶绿体中的淀粉颗粒量)。
- 预先称量1升烧杯, 然后将其放在冰上, 然后开始收割叶子材料。
- 通过避免土壤 (堆肥) 收获拟南芥叶子。重新称量烧杯并记录组织重量。
注: 400 至500克的叶片材料预计从四平底锅。 - 在冷室中均匀化叶, 2 L 的研磨缓冲液 (在使用前加入 BSA) 三 times/2 每一次, 在搅拌机中的高速。
- 使用4层的薄纱和一层尼龙 blutex 在冷室中过滤匀浆。轻轻挤压薄纱/尼龙 blutex 内的匀浆叶, 提取所有液体。
- 在搅拌机杯中恢复剩余的组织, 进行第二次萃取。重复步骤2.5 和2.6 使用 2 L 研磨中和新4-5 层的薄纱 (在寒冷的房间)。
3. 利用微分离心纯化粗叶绿体
- 将粗细胞萃取物均匀分布到六500毫升瓶子中, 然后在离心前将瓶子放在冰上。当达到最大速度 (2070 x g) 时离心机2分钟 (最大加速度和刹车, 4 °c)。
- 轻轻地丢弃上清液。
- 使用水泵吸出剩余的上清液, 并将含有浓缩粗叶绿体的颗粒留在冰上。
- 使用画笔或弯曲的塑料刮刀, 通过添加最小体积的洗涤培养基 (1 x) (最终体积的叶绿体悬浮液 = 36 mL) 轻轻重悬颗粒。使用10毫升吸管在每个瓶子中添加3毫升洗涤培养基。
注意: 不要使用带极细微提示的吸管, 以避免叶绿体的破损。或者, 用剃刀刀片切割吸管的蓝色尖端, 产生较大的孔。 - 使用10毫升吸管在一根管子中收集重悬叶绿体。在 Percoll 梯度加载之前, 通过反转管子轻轻混合以获得均匀悬浮液。
4. 在连续 Percoll 梯度上纯化完整的叶绿体
- 缓慢加载6毫升的叶绿体悬浮液, 在每一个六 Percoll 梯度上使用10毫升吸管, 以避免叶绿体的破坏。
- 使用摆动铲斗转子在 13300 x g、4摄氏度离心梯度10分钟。
注: 加速度应缓慢, 制动器应断开 (刹车或减速), 以防止 Percoll 梯度的混合。 - 用水泵吸出含有破碎叶绿体和完整线粒体的上阶段, 然后用10毫升吸管在下一阶段 (宽暗绿色带) 中提取完整的叶绿体。注意不要用完整的叶绿体吸去细胞核和细胞碎片 (在管子底部发现) (图 2A)。
- 稀释3-4 倍的完整叶绿体悬浮液洗涤缓冲液 (1 x)。当达到最大速度 (2070 x g, 4 °c) (最大加速度和刹车) 时, 离心2分钟。
- 小心丢弃上清液。
- 用水泵完全吸出剩余的上清液, 并保持浓缩完好的叶绿体在冰上的颗粒。
- 在叶绿体裂解之前, 在大约1毫升的洗涤培养基 (1 x) 中保持等分的完整叶绿体分数, 以便进一步分析使用烷基硫酸盐聚丙烯酰胺凝胶电泳 (SDS 页) 和西方印迹。保留这些完整叶绿体的小等分, 以测定蛋白质浓度。将完整的叶绿体分数储存在液氮中进行进一步的实验。
5. 使用低渗缓冲液裂解完整的叶绿体, 在不连续的蔗糖梯度上纯化叶绿体子隔间
- 通过在含有蛋白酶抑制剂的低渗培养基中重悬颗粒, 裂解纯化完好的叶绿体 (最终体积不应超过12毫升)。
注意: 从这一步, 使用吸管与精细提示 (蓝色提示) 是可能的, 因为叶绿体的完整性是没有必要的 (移液叶绿体上下, 只要颗粒不是完全重悬)。拟南芥叶绿体非常脆弱 (例如与豌豆叶绿体相比), 在低渗培养基中孵育后, 它们的裂解几乎是立竿见影的。 - 使用蠕动泵在每个预制蔗糖梯度的顶部缓慢加载3毫升裂解叶绿体。
- 超速离心1小时的梯度 (7万 x g, 4 °c)。离心前使用低渗介质缓冲液对管进行平衡。
- 小心地恢复可溶性基质蛋白通过移液的梯度的上一阶段 (3 毫升从每个梯度) (图 2B)。用等分测定蛋白质浓度7。将基质储存在液氮中进行进一步的实验。
- 使用水泵将每个梯度的剩余上一阶段吸到黄色波段。
- 用吸管 (大约1毫升从每个梯度) 检索黄色波段 (信封)。将信封在一根管子中池。
- 使用水泵将每个梯度的剩余阶段移至类囊体颗粒。
6. 类囊体和包膜系统的洗涤和浓缩
- 在膜洗涤缓冲液 (1 x) 的最小容积 (2 毫升) (含蛋白酶抑制剂) 中重悬类囊体颗粒 (绿色颗粒)。
- 稀释信封和类囊体悬浮液3-4 倍在膜洗涤介质 (调整体积到10毫升) 和超速离心 1 h 在 (11万 x g, 4 °c)。离心前使用膜洗涤缓冲液对管进行平衡。
- 使用水泵仔细吸上清液。
- 将大约100µL 的膜洗涤缓冲液 (含蛋白酶抑制剂) 添加到包络颗粒中。用等分测定蛋白质浓度7。将纯化的包膜制备液储存在液氮中。
- 重悬 thylakoids 颗粒在3毫升膜洗涤缓冲液 (与蛋白酶抑制剂)。用等分测定蛋白质浓度7。在液氮中贮存类囊体膜馏分。
结果
图 2恢复了纯化叶绿体及其子隔间的过程的连续步骤。Percoll 梯度 (图 2A) 允许区分完整的叶绿体与破碎的叶绿体和线粒体 (梯度的顶部) 或细胞核和细胞碎片 (梯度的底部)。由于渗透冲击, Percoll 纯化的细胞器破裂后, 产生的馏分在蔗糖梯度上分离 (图 2B)。基质 (叶绿体的可溶性部分) 漂浮在蔗糖梯度的表面。在 0.6/0.93 米的蔗糖界面上, 光包膜囊泡被恢复为一个离散黄带。最重的类囊体膜囊泡集中在管的底部。在回收、洗涤和浓缩两个膜组分后, 将蛋白质定量化, 并在 SDS 页上分析所有四组分的组成 (图 2C)。这些车道以等量的蛋白质为基础 (每个纯化分数的20µg)。知道叶绿体只包含1% 的包络蛋白和50% 的蛋白质从基质或从 thylakoids, 这往往高估交叉污染的纯化包络制剂与其他叶绿体子隔间。然而, 这种方法允许检测微量的蛋白质交叉污染的包络分数。每个隔间 (即丰富的蛋白质) 的标记在评估分数交叉污染方面非常有用。事实上, 类囊体和信封膜的分数预计包含非常低的数量的 RuBisCO (RBCL) 的大亚基, 最丰富的蛋白质从基质 (50 kDa)。破碎的叶绿体可以很容易地区分从完整的叶绿体由于这种基质蛋白8的损失。光收集复合蛋白 (LHCP) 是 25 kDa 丰富的类囊体成分, 应勉强 (少于 3%) 污染包膜9。最后, 磷酸盐-磷酸丙糖磷酸转运体 (TPT) 是一种 30-kDa 蛋白, 仅在纯化的包络分数中可见, 这是因为与整个叶绿体萃取物相比, 包络分数中的强富集 (即50 至 100 x)。使用这里描述的方法, 叶绿体子隔间通常是很差的交叉污染被确认使用西方印迹分析 (图 2D) 依赖于针对所有三个子隔间的已知标记的抗体:可溶性缩酮酸醇酸 (卡尔) 从基质, 叶绿体包络铜 atp 酶 (HMA1) 和光采集复杂蛋白质 (LHCP) 从类囊体膜。通过免疫印迹和质谱分析9, 可以量化三个子隔间的交叉污染。虽然基质通常不受包络或类囊体组分的污染, 但纯化的包络组分含有3% 的类囊体蛋白和10% 的基质中的蛋白质。基质中的蛋白质污染类囊体膜 (小于 1%), 但 thylakoids 含有高达3% 的包膜蛋白。在确定叶绿体蛋白的真正 subplastidial 位置方面, 目前的方法除了对交叉污染所产生的蛋白质 subplastidial 定位的错误结论之外, 还有很重要的作用。
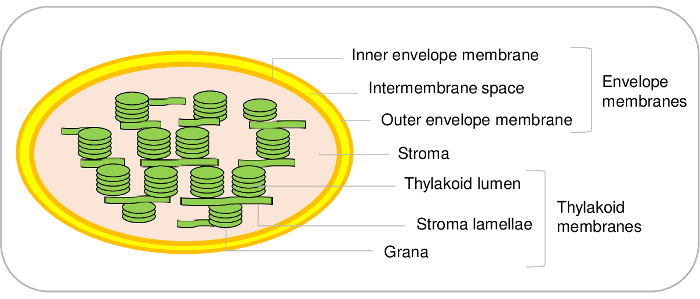
图 1: 叶绿体子隔间的代表性方案.请点击这里查看这个数字的更大版本.
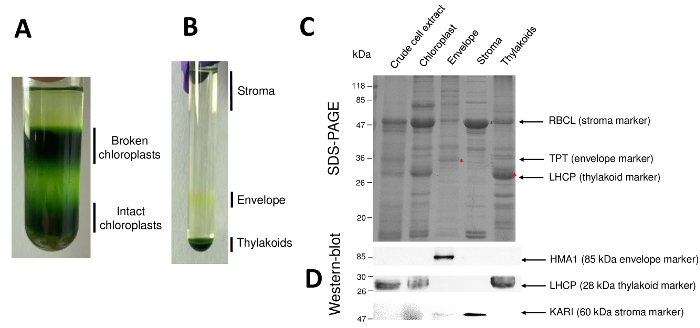
图 2: 使用 Percoll 和蔗糖梯度纯化完整的叶绿体及其三个主要子隔间. Percoll 梯度, 允许分离破碎和完整的叶绿体。B. 蔗糖梯度, 允许分离基质、包络和类囊体馏分。C. 代表性的 SDS-从完整的叶绿体和他们的三个主要子隔间的蛋白质页, 允许可视化丰富的标记从每个子隔间。每个车道包含10µg 的蛋白质。分子量标记: RBCL, RuBisCO 的大亚基 (基质的标记);磷酸丙糖磷酸转运体 (包络标记);LHCP, 光采集复杂蛋白质 (类囊体的标记)。D. 免疫印迹实验, 允许检测每个子隔间的特定标记 (使用特定抗体): 叶绿体包络铜 atp 酶 HMA110, 光采集复杂蛋白质 LHCP 从类囊体膜11, 和缩酮酸醇酸从基质9。请点击这里查看这个数字的更大版本.
讨论
本文旨在详细介绍用于纯化拟南芥叶绿体 (及其子隔间) 的分步协议。由于近两年前其完整的基因组序列的可用性, 以及为社区提供的大量插入突变体,拟南芥现在被广泛接受为模型植物。然而, 虽然这种植物是完全适应遗传方法, 植物科学家需要调整生化和生理工具, 这种新兴的模式。允许从成熟的生化模型叶子 (如菠菜12或豌豆13 ) 中纯化光合活性叶绿体的协议, 因此必须加以调整。第一种描述拟南芥叶绿体纯化的方法在 1998年14, 就在拟南芥基因组序列发布之前发表。几年后, 简单的分离拟南芥叶绿体的方法与研究旨在分析纯化的细胞器中蛋白质的体外导入有15,16。然而, 这些方法不允许将纯化的叶绿体的光合活性的高纯度和保护相结合。最近17, 建立了一个快速的方法, 它依赖于 Percoll 梯度的使用, 并允许保留近90% 的光合作用速率测量在拟南芥的起始叶。
这里描述的协议允许纯化拟南芥叶绿体在一个极好的纯度水平。事实上, 免疫检测从其他细胞舱的污染物表明纯化的细胞器缺乏线粒体和等离子膜标记9,10。该协议还有效地纯化了几个拟南芥生态型18的叶绿体, 如哥伦比亚 (Col) 或 Wassilewskija (WS),即用于基因组或表达序列标记 (无害环境) 测序的生态型。项目, 但也产生 T DNA 插入突变体在拟南芥。换言之, 当蛋白质组学研究必须执行时, 本议定书与拟南芥的这两个参考生态型是相容的。最后, 使用本协议的叶绿体的产量是类似于从菠菜或豌豆叶开始时获得的 (即3%, 从 Percoll 纯化叶绿体中的叶绿素含量计算, 与总在起始叶中存在叶绿素含量)。在蛋白质方面, 产量接近50毫克的叶绿体蛋白, 当细胞器被纯化从500克5周老拟南芥叶。
要达到这样一个良好的产量 (和叶绿体的完整性), 但是在使用本议定书时, 应特别注意几个步骤。拟南芥叶绿体是一种极其脆弱的结构 (例如, 豌豆叶绿体的情况并非如此)。因此需要特别注意, 以避免在纯化过程中的细胞器的大规模破裂。叶绿体中淀粉颗粒的数量和大小是制备完整叶绿体的关键。事实上, 含有大淀粉粒的叶绿体通常会在初始差异 centrifugations 步骤中被打破, 目的是浓缩12的粗叶绿体馏分。因此, 在试验前, 应将植物留在一个漆黑寒冷的房间 (4 摄氏度), 以减少淀粉含量。
本议定书的新用户可能会受到诱惑, 从大量的叶子材料 (大叶子的老拟南芥植物的巨大花环) 开始, 试图提高纯化叶绿体的回收率。然而, 在我们的手, 从年轻的叶子 (5 周大) 是最好的妥协, 以结合的产量, 纯度和完整性的纯化的细胞器。事实上, 太老的叶子是高度丰富的酚类化合物, 显示对叶绿体完整性19的负面影响。
最后, 初始萃取步骤 (组织的研磨) 是另一个关键步骤。混合过程必须限制为几秒钟。如上所述, 新用户可能会倾向于使用较长的混合, 因此预期会强烈提高纯化的细胞器的产量。然而, 如果较长的混合有效地释放更多的材料从叶子, 似乎破碎的叶绿体的比例迅速增加在粗细胞提取物。由于这种高比例的破碎到完整的叶绿体在培养基中, 进一步纯化步骤 (分离 Percoll 梯度) 受到强烈影响, 纯化的产量出乎意料地低。
为纯化细胞器提供了特定的协议, 允许在叶绿体样本上进行一系列高通量蛋白质组学实验。这些数据在几个公共数据库6中提供, 从而为该领域的生物学家提供了许多叶绿体蛋白的精确亚细胞 (和 subplastidial) 定位。在这些分析之前, 其身份和位置仍然主要是未知的包络蛋白尤其如此, 因为包络膜在叶绿体中扮演关键角色时, 它代表了一个次要的叶绿体成分 (1-2% 的叶绿体蛋白)新陈代谢和生物合成5,20。利用这里描述的协议, 我们最近分析了拟南芥(即基质、thylakoids 和包膜系统)9中三个主要叶绿体夹层的组成。基于半定量蛋白质组学方法 (频谱计数), 我们能够评估在这三叶绿体夹层中数以百计的蛋白质的划分。
虽然本议定书允许从拟南芥中纯化叶绿体的三个主要隔层, 但也可以区分叶绿体中的其他子隔间。事实上, 信封膜系统是由内部和外部的信封膜 (图 1)。然而, 根据我们的知识, 从拟南芥叶绿体中纯化内外包膜的方法仍有待建立。内外包膜可从菠菜21或豌豆22叶绿体中纯化。拟南芥的主要局限性主要来源于起始材料的极限量。从500克拟南芥叶 (在生长室中已经需要1米2表面) 开始纯化仅100µg 包络蛋白。另一方面, 它很容易从市场开始从5-10 公斤菠菜叶, 以净化大量的叶绿体8和结束与产量3到10毫克的包络蛋白从这种材料。
类囊体子隔间也是如此。事实上, thylakoids 是由光膜囊泡 (片晶) 和致密结构 (grana) (图 1) 组成的。在拟南芥23、24中, 可以使用特定的协议来区分这两个隔间。再次, 基于定量蛋白质组学分析, 我们最近清点了在这两个子隔间24的蛋白质。这些方法, 连同对文献的深入调查, 允许验证, 或提出假设, 数以百计的类囊体蛋白的 subplastidial 位置。然而, 重要的是要注意, 额外的膜微区存在于 thylakoids 的曲线边缘。这些脂蛋白子夹层, 或 plastoglobules, 永久耦合到类囊体膜和包含一组特定的蛋白质25。因此, 使用本协议是不可能区分这些特定的蛋白质与其他类囊体成分。
一些真正的 (众所周知的) 信封, 基质, 或类囊体组件仍然缺乏检测到的蛋白质列表。结合有针对性的生化和免疫学分析, 持续改进 MS 敏感性将有助于重新审视叶绿体的内容, 使其成为其各个子隔间的组成的完整曲目。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了自然资源研究所植物生物学和育种司和 Labex GRAL (ANR-10-LABX-49-01) 的 IB 联合博士奖学金的支持。我们还要感谢 ANR 项目 ANR-15-IDEX-02, IBPC 博士 (巴黎) 的抗体对 LHCP 和雷诺博士 (LPCV, 格勒诺布尔) 抗体对卡尔。
材料
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
参考文献
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。