Method Article
免疫ブロットやプロテオミクスによるタンパク質局在の解析シロイヌナズナから葉緑体小班の準備
要約
ここでは、シロイヌナズナの葉と 3 つメイン サブ コンパートメント (エンベロープ、質、およびチラコイド) から葉緑体を浄化する手法について述べる差動遠心、連続 Percoll の勾配の組み合わせを使用して、蔗糖不連続密度勾配。メソッドは subplastidial とイムノブロットおよびプロテオミクスによる蛋白質の細胞内局在性のため貴重です。
要約
葉緑体は、植物細胞の主要なコンポーネントです。このようなプラスチドは、炭素、硫黄、窒素の同化として不可欠な代謝産物の合成など、多くの重要な機能を果たします。これらの細胞小器官は、以下 3 つのキーのサブの区画で構成されます。エンベロープ、2 つの膜によって特徴付けられる細胞小器官を囲むし、他の細胞コンパートメントを持つ葉緑体の通信を制御します。質は、葉緑体と二酸化炭素を炭水化物に変換する、メインのサイトの水溶性相です。チラコイド膜はグラナ (フラット圧縮嚢) から成る内部膜ネットワーク、ラメラ (より少ない密な構造)、酸素の光合成がかかる場所します。存在のプロトコル記述する差動遠心 Percoll グラデーション、シロイヌナズナ、およびその分別から葉緑体を使用して、3 つのサッカロースの勾配を使用して精製に必要な手順を説明サブのコンパートメント (すなわちエンベロープ、質、およびチラコイド)。このプロトコルは、葉緑体の様々 な下位区分に関連するマーカーを使用してこれらの分数の純度を評価する方法についても説明します。ここで説明する方法は subplastidial のためだけでなく免疫ブロットを使用して蛋白質のローカリゼーションの貴重な細胞内 subplastidial プロテオミクスと他の研究。
概要
葉緑体は、植物細胞の主要なコンポーネントです。彼らは、したの細胞内共生を受けて、最終的に細胞小器官として進化1,2の間に進化したシアノ バクテリアの祖先から派生します。このような細胞小器官を含む 3 つの主要なコンパートメント (図 1)。封筒のシステムは、細胞小器官を取り巻く外膜と、内側製です。この二重膜システムは、プラスチドと細胞質間の通信の制御に捧げられる主顔料と脂質の代謝に関与するさまざまな酵素が含まれています。核符号化された蛋白質のインポートとイオンと細胞質およびこうして植物細胞報3,4 の重要な代謝機能を調節する葉緑体間代謝物の交換ができる様々 な交通システムが含まれています.実質、葉緑体の水溶性相 (CO2同化)、カルビン回路の酵素が含まれているアミノ酸やビタミン、プラスチドの転写と翻訳機械など様々 な代謝産物の合成。チラコイド膜は、光合成の光の位相が起こる広く組織内部膜ネットワークです。それによって、葉緑体重要な代謝経路が5を発生する場所であります。
葉緑体の力学と生理学を制御する新たな制御機構を解読するために葉緑体タンパク質のサブ細胞: 色素体の局在の定義は、タンパク質の機能を理解することを目指して対象の学習を支援する重要ですモデル生物6。これらの蛋白質の本物 subplastidial ローカリゼーションへのアクセスを得るために非常に純粋な subplastidial の一部分 (エンベロープ膜、実質、チラコイド) から起動に不可欠なためです。この文脈では、この議定書の目的、差動遠心と連続 Percoll の勾配、シロイヌナズナ葉の葉緑体を浄化し、それらを分別する 3 つの蔗糖不連続密度勾配を使用サブのコンパートメント (すなわちエンベロープ、質、およびチラコイド)。ここで説明する方法は、葉緑体の様々 な下位区分に関連付けられたマーカーを用いた精製サブ核分画の純度を評価するために指示を提供します。このプロトコルは、貴重な免疫ブロットを使用して蛋白質のローカリゼーションを subplastidial そしてさらに質量分析法 (MS) による精製画分の分析-ベースのプロテオーム研究。
プロトコル
1. バッファー、在庫ソリューション、およびグラデーションの準備
- 4 ° C で 6 ヶ月間に格納することができます次の貯蔵液を準備します。
- トリシン バッファー (1 M、pH 8.4) とトリシン バッファー (1 M、pH 7.6) の 1 リットルを準備します。KOH ペレットを追加することによって pH を調整します。
- エチレンジアミン四酢酸 (EDTA、0.5 M pH 8) の 1 L と 3-(N-morpholino) プロパン スルホン酸 (モップ) バッファー (1 M、pH 7.8) を準備します。NaOH ペレットを追加することによって pH を調整します。
- MgCl2 (1 M) の 50 mL を準備します。
- 50 mL のプロテアーゼの阻害剤のソリューションの準備: 特異フッ化物 (PMSF イソプロパノール、100 mM で設定)、benzamidine 塩酸塩水和物 (100 mM) と ε-アミノ-n-カプロン酸 (50 mM)。
注: PMSF とアミノ-n-カプロン酸は 4 ° C で数ヶ月のソリューションで安定しているが、benzamidine ソリューションに保存する-20 ° C
- 実験前日以下のソリューションを準備し、4 ° C ですべてのソリューションを格納
- 培地の pH 8.4 トリシン島 (20 mM、pH 8.4) を含むを研削の 4 L を準備 NaHCO3 (10 mM)、EDTA (10 mM、pH 8)、ソルビトール (0.4 M)。NaOH ペレットを追加することによって pH を調整します。ちょうど使用する前にウシ血清アルブミン (BSA) を 0.1% (w/v) を加え、よく混ぜます。
- 洗浄媒体 (2 x) pH 7.6 トリシン島 (20 mM、pH 7.6) を含む 500 mL を準備 EDTA (2.5 mM)、MgCl2 (5 mM)、ソルビトール (0.8 M)。NaOH ペレットを追加することによって pH を調整します。このようなソリューションを希釈すると、洗濯中 (1 x) を取得する Percoll グラデーション溶液の調製後。
- 50% (v/v) パーコールで最終的な解を得るに等しい容積で洗浄中 (2 x) Percoll を混合することによって葉緑体の浄化のための Percoll グラデーション溶液 200 mL を準備/0.4 M ソルビトール。
- モップ (10 mM、pH 7.8)、MgCl2 (4 mM)、および異なる濃度のショ糖 (0.3 M、0.6 M、0.93 M) を混合することによって葉緑体分別のショ糖液 50 mL を準備します。
- 次のグラデーションと実験を開始する前にバッファーを準備します。
- Percoll の勾配の六つのチューブを用意 (50 %30 mL を含む各 Percoll/0.4 M ソルビトール) 4 ° C で 55 分 38,700 × g で遠心分離によってグラデーションのブレンドを防ぐためにブレーキを控えます。遠心分離の後、使用するまで冷蔵室で前もって形成されたグラデーションを含むチューブを格納します。
- 各グラデーション 3 次ショ糖層の形成とサッカロースの勾配の 4 本のチューブを準備: 0.93 M、0.6 M と 0.3 M ショ糖の 2 mL 2.5 mL を 3 mL。慎重に始まる 0.93 M、下部と上部に 0.3 M で仕上げて蠕動性ポンプを使用して、各レイヤーをオーバーレイします。
- モップ (10 mM、pH 7.8)、MgCl2 (4 mM)、PMSF (1 mM、イソプロパノールで設定)、benzamidine 塩酸塩水和物 (1 mM)、ε-アミノ-n-カプロン酸 (0.5 mM) を含む葉緑体換散のため低張性媒体の 50 mL を準備します。氷の上に使用されるまでバッファーを格納します。
- モップ (10 mM、pH 7.8)、PMSF (1 mM)、benzamidine 塩酸塩水和物 (1 mM)、ε-アミノ-n-カプロン酸 (0.5 mM) を格納するバッファーを洗浄する膜の 50 mL を準備します。氷の上に使用されるまでバッファーを格納します。
2. 成長とシロイヌナズナの葉の収穫
- シロイヌナズナ植物の成長のために備える 4 大きいプラスチック鍋 (0.5 を 1 m2の総表面)シロイヌナズナの各鍋の種の 30 mg を播種。150 μ m-2の-1の光強度が 12 h ライト ・ サイクル 23 ° c (日)/18 ° C (夜) で 5 週間シロイヌナズナ植物を育てます。
- 暗く、冷たい部屋 (4 ° C) で植物を (葉緑体でデンプン粒の量を減らす) を実験前に一晩インキュベートします。
- 事前 1 L ビーカーの重さし、葉材の収穫を開始する前に氷の上に置きます。
- 土壌 (堆肥) を回避することによってシロイヌナズナ葉を収穫します。再ビーカーの重さし、組織重量を記録します。
注: 葉物 400 に 500 g は、4 つの鍋から期待されています。 - バッファーを研削の 2 l 冷蔵室で葉を均質化 (追加 BSA 使用前に) 3 回 2/s 高速ブレンダーのたび。
- モスリンの 4 層とナイロン blutex の 1 つの層を使用して冷蔵室で磨砕液をフィルター処理します。すべての液体を抽出するモスリン/ナイロン blutex 内側磨砕液の葉を軽く絞る。
- 2 番目の抽出のためのブレンダー カップの残りの組織を回復します。2.5 および 2.6 媒体や新しい研削の 2 L (冷蔵室) のモスリンの 4-5 層を使用して手順を繰り返します。
3. 差動遠心分離を用いた原油の葉緑体の浄化
- 同様に 6 の 500 mL のペットボトルに原油の細胞抽出液を配布し、遠心分離前に氷にボトルを配置します。(最大加速度とブレーキで、4 ° C) (2,070 x g) の最大の速度に達するとすぐに 2 分間遠心します。
- そっと上澄みを廃棄します。
- 水ポンプを使用して残りの上清を吸引し、氷の上の集中の原油葉緑体を含むペレットを保ちます。
- 優しく洗浄媒体 (1 x) の最小ボリュームを追加することでペレットを再懸濁します (結合された葉緑体の懸濁液の最終巻 36 mL を =) 湾曲したプラスチック製のヘラやブラシを使ってします。10 mL のピペットを使用して、各ボトルの中を洗浄の 3 mL を追加します。
注: は、葉緑体の破損を避けるために非常に良いヒントとピペットを使用しないでください。また、大きな穴を生成するかみそりの刃でピペットの青い先端をカットします。 - 10 mL のピペットを使用して 1 つの管で再懸濁の葉緑体を収集します。優しく Percoll グラデーションの読み込み前に均質な懸濁液を取得するチューブを反転でミックスします。
4. 連続パーコールの葉緑体の浄化
- ゆっくりと葉緑体の破損を避けるために 10 mL のピペットを使用して六つの Percoll の勾配の上に葉緑体懸濁液の 6 mL をロードします。
- 13,300 × g、スイング バケツの回転子を使用して 4 ° C で 10 分間のグラデーションを遠心します。
注: 加速が遅くなる、ことし、ブレーキを切断する必要があります (ブレーキをオフまたは減速) Percoll の勾配の混合を防ぐために。 - 壊れた葉緑体と水ポンプを使用してそのままのミトコンドリアを含む上部の段階を吸引し、無傷葉緑体下に存在を取得 (広範なダーク グリーン バンド) を 10 mL のピペットを使い、相します。葉緑体 (図 2 a) と核と細胞の残骸 (管の下部にある) を吸引しないように注意してください。
- 3-4 倍の洗浄バッファー (1 x)、無傷葉緑体懸濁液を希釈します。(最大加速度とブレーキ) (2,070 x g、4 ° C) の最高速度に達するとすぐに 2 分間遠心します。
- 上澄みを慎重に廃棄します。
- 完全に水ポンプと残りの上清を吸引し、氷の上の集中の葉緑体のペレットを保ちます。
- 葉緑体溶解前に洗浄媒体 (1 x) ナトリウム dodecyl 硫酸塩のポリアクリルアミドゲル電気泳動 (SDS-PAGE) と西部にしみが付くことを使用してそれ以上の分析のための約 1 mL で無傷葉緑体の端数の因数を維持します。蛋白質の集中の決定のためのこれらの葉緑体の因数の小さなをしてください。さらに実験のための液体窒素で無傷葉緑体の分数を格納します。
5. 蔗糖不連続密度勾配低張バッファーと葉緑体サブ コンパートメントの浄化を使用して葉緑体の換散
- (最終巻は 12 mL を超えない) プロテアーゼ阻害剤を含む低張性の中でペレットを再によって精製された葉緑体を溶解させます。
注: この手順から罰金のヒント (青のヒント) ピペットの使用可能です葉緑体のイヌイットは (ペレットは完全再停止しない限り、上下に葉緑体をピペッティング) 以上必須なので。葉緑体は (ときに例えばエンドウ葉緑体と比較して) 非常に壊れやすい、自分の換散は低張培地で培養後ほぼ即時。 - ゆっくりと蠕動ポンプを使用してそれぞれの前もって形成されたサッカロースの勾配の上に分離の葉緑体の 3 mL をロードします。
- 超遠心機 (70,000 × g、4 ° C) で 1 時間のグラデーション。遠心分離前に低張性の中間バッファーを使用してチューブのペアのバランスをとる。
- グラデーション (各グラデーションから 3 mL) の上部の段階をピペッティングによる可溶性管間質タンパク質を注意深く回復 (図 2 b)。7タンパク質濃度の定量の因数を取る。さらに実験のための液体窒素質を格納します。
- 水ポンプを使用して黄色のバンドまでの各グラデーションの残りの上部の段階を吸引します。
- ピペット (各グラデーションから約 1 mL) を使い、黄色バンド (封筒) を取得します。1 つの管の封筒をプールします。
- 水ポンプを使用してチラコイド ペレットまでの各グラデーションの残りのフェーズを削除します。
6. 洗濯とチラコイドとエンベロープ膜システムの集中
- 膜洗浄液 (1 x) (とプロテアーゼ阻害薬) の最小量 (2 mL) のチラコイド ペレット (緑ペレット) を再懸濁します。
- エンベロープとチラコイドの懸濁液を希釈膜洗浄中の 3-4 倍 (10 mL にボリューム調整) と (110,000 x g, 4 ° C) で 1 時間超。膜洗浄遠心分離前にバッファーを用いた管のペアのバランスをとる。
- 慎重に水ポンプを使用して培養上清を吸引します。
- 封筒ペレット (プロテアーゼ阻害剤) とバッファーを洗浄する膜の約 100 μ L を追加します。7タンパク質濃度の定量の因数を取る。液体窒素精製エンベロープ膜作製に格納します。
- 膜洗浄 (プロテアーゼ阻害剤) とバッファーの 3 mL でチラコイド ペレットを再懸濁します。7タンパク質濃度の定量の因数を取る。液体窒素にチラコイド膜画分を保存します。
結果
図2 精製した葉緑体とそのサブのコンパートメントの結果の連続ステップが再開されます。パーコール (図 2 a) は、壊れている葉緑体とミトコンドリア (グラデーションの上) または核と細胞の残骸 (グラデーションの下) から葉緑体を区別することができます。高浸透圧刺激のおかげで Percoll 精製オルガネラの破裂後ショ糖密度勾配 (図 2 b) 結果の分数が分けられます。間質 (葉緑体の可溶性部分) がショ糖密度勾配の表面に浮かんでいます。光エンベロープ膜小胞 0.6/0.93 M ショ糖界面離散黄色バンドとして回収しています。重いチラコイド膜小胞は、管の下部に集中しています。回復、洗濯および 2 つの膜分画の濃度後、タンパク質を定量化し、SDS ページ (図 2) のすべての 4 つの画分の組成を分析します。レーンは、同じタンパク質単位 (各精製画分の 20 μ g) で読み込まれます。葉緑体を含むエンベロープ蛋白の 1% と間質やからは、チラコイドのタンパク質の 50% だけを知っていて、これは浄化された封筒調剤他の葉緑体の小班とのクロス汚染を過大評価する傾向があります。ただし、このメソッドは、エンベロープ分数のクロス汚染蛋白質の微量を検出できます。各コンパートメント (すなわち、豊富な蛋白質) からマーカーでは分数の交差汚染の評価に非常に役立ちます。確かに、チラコイドとエンベロープの膜の一部分が大サブユニットの RuBisCO (RBCL)、質 (50 kDa) から最も豊富な蛋白質の非常に少量を含むと思われます。壊れた葉緑体は、この間質蛋白8の損失のため無傷葉緑体から簡単に区別できます。集光複合タンパク質 (LHCP) はほとんど必要があります 25 kDa 豊富なチラコイド コンポーネント (3% 未満) エンベロープ膜9を汚染します。最後に、リン酸トリオースリン酸形質 (TPT) は強力な濃縮による精製封筒分数で表示される 30 kDa タンパク質 (すなわち50 に 100 倍) 封筒分数全体の葉緑体と比較した場合で抽出します。ここで説明した方法を使用して、葉緑体サブのコンパートメントは、一般的に悪いクロス汚染されたすべての 3 つのサブのコンパートメントの既知のマーカーに対する抗体に依存する (図 2 D) ウエスタン ・ ブロット分析を使用して確認されると:水溶性 ketol 酸リダクトイソメラーゼ (仮) 間質から、葉緑体エンベロープ銅 ATPase (HMA1) と、集光性複合タンパク質 (LHCP) チラコイド膜から。イムノブロットと質量分析法分析9を使用して 3 つのサブのコンパートメントのクロス汚染を定量化することができます。封筒やチラコイドの分数によって質が汚染されない通常精製封筒分数含まれてチラコイドのタンパク質の 3%、間質から蛋白質の 10% まで。間質からの蛋白質は不十分なチラコイド膜 (1% 未満) を汚染するが、チラコイド膜のエンベロープ蛋白の 3% までを含みます。また起因の subplastidial 局在について誤った結論を制限したがって葉緑体タンパク質、本法の本物の subplastidial 場所を識別する重要な役割を持っている以上クロス汚染です。
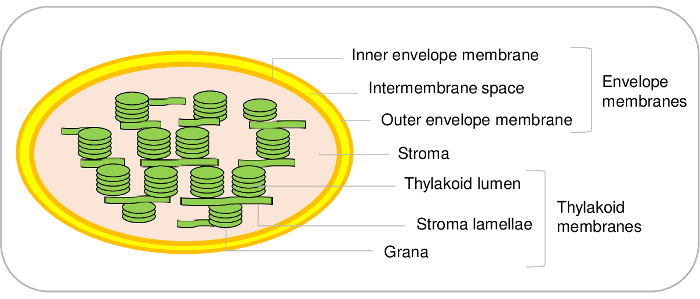
図 1: 葉緑体小班の代表的な手法です。この図の拡大版を表示するのにはここをクリックしてください。
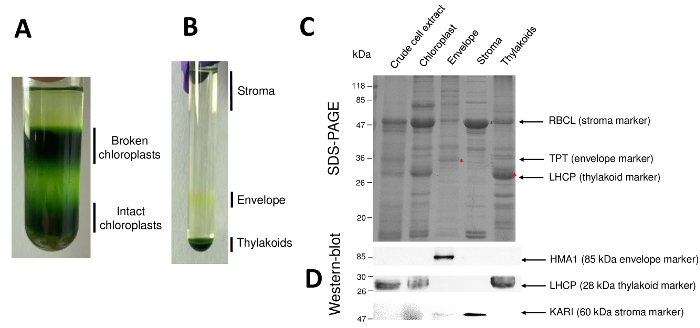
図 2: 葉緑体の精製とその 3 つの主なサブ コンパートメント Percoll およびショ糖のグラデーションを使用しています。A.パーコール壊れた、無傷葉緑体の分離を許可します。B. ショ糖密度勾配が実質、封筒とチラコイド画分の分離を許可します。C. 代表 SDS-PAGE 葉緑体と各林小班から豊富なマーカーを視覚化できるように、3 つメイン サブ コンパートメントからの蛋白質の。各レーンには 10 μ g タンパク質にはが含まれています。分子量のマーカー: rbcl 遺伝子 (マーカー間質); RuBisCO の大サブユニットTPT、リン酸/トリオースリン酸形質 (封筒のマーカー)。LHCP、光複合タンパク質 (チラコイドのマーカー) を収穫します。D. 西部のしみ方実験林小班毎から (特定の抗体を使用して) 特定のマーカーを検出することができます: 葉緑体エンベロープ銅 atp アーゼ HMA110、複雑なタンパク質 LHCP チラコイドから集光膜11と実質9から ketol 酸リダクトイソメラーゼ カリ。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿は、シロイヌナズナから葉緑体 (とそのサブ コンパートメント) を浄化するために使用されるステップ バイ ステップ プロトコルの詳細を目指しています。その完全なゲノムほぼ二十年前の挿入変異体のコミュニティに利用可能の大規模なコレクションの発売、以降シロイヌナズナは今広く受け入れられるモデル植物として。しかし、この植物は、遺伝的アプローチを完全に適応した、植物科学者この新たなモデルに生化学と生理学のツールを適応する必要です。ほうれん草12またはエンドウ豆13のような確立された生化学的モデルの葉からの光合成有効葉緑体をこうして浄化できるようにプロトコルは合わせられなければならなかった。葉緑体の精製を記述する最初の方法は、1998年14、シロイヌナズナのゲノム塩基配列のリリース直前に掲載されました。数年体外タンパク質精製した細胞内小器官のインポートを分析することを目指して研究と互換性のある葉緑体を隔離するため後で、簡単な方法は、利用可能な15,16を行われました。ただし、これらのメソッドは、純度の高いレベルと精製の葉緑体の光合成活性の保全を組み合わせることできませんでした。最近では17、迅速法設立されました、Percoll の勾配の使用に依存しているし、シロイヌナズナの開始の葉で光合成速度のほぼ 90% を保持することができます。
ここで説明されているプロトコルは、純度の優秀なレベルで葉緑体を浄化することができます。確かに、他の細胞コンパートメントからの汚染物質の免疫学的検出実証浄化された細胞小器官ミトコンドリアを欠いていると膜マーカー9,10。このプロトコルはまたいくつかシロイヌナズナ生態から18コロンビア (Col) または Wassilewskija (WS)、すなわちのような葉緑体を浄化するために効率的な表現やゲノムの使用された生態型シーケンス (Est) のタグ シーケンスまたシロイヌナズナT-DNA 挿入変異体を生成するプロジェクトします。つまり、プロテオミクス研究が実行されるが、この議定書はシロイヌナズナからこれらの 2 つの参照の生態型と互換性があります。最後に、現在のプロトコルを使用して葉緑体の収量はホウレン草やエンドウの葉 (すなわち3 %percoll 精製葉緑体の合計に比較するとクロロフィル含量から測定したから起動するときに得られるもののよう起動中のクロロフィル量の葉)。細胞小器官は 5 週齢シロイヌナズナ葉 500 g から浄化されるとき蛋白質、面で収量は葉緑体タンパク質の 50 mg に近いです。
到達するなど、良好な収率 (葉緑体整合性)、現在のプロトコルを使用する場合、1 つはしかしいくつかの手順に特別な注意を払う必要があります。シロイヌナズナの葉緑体は、(これはエンドウ豆の葉緑体の場合たとえば) 非常に壊れやすい構造です。精製中に細胞小器官の大規模な破壊を避けるために固有の注意が必要です。数および葉緑体でデンプン粒のサイズそのままの葉緑体の準備のため重要です。確かに、葉緑体大きなデンプン粒を含む一般に間に破壊される初期差動遠心手順原油葉緑体分数12を集中することを目指してします。したがって、植物はデンプンの量を減らすため、実験前に暗く、冷たい部屋 (4 ° C) で一晩保管する必要があります。
現在のプロトコルの新しいユーザー可能性があります葉材料 (大きな葉が付いている古いシロイヌナズナ植物から巨大なロゼット) の大きい量から開始する誘惑される純化クロロプ ラストのリカバリを強化しようとしています。しかし、私たちの手で若葉 (5 週齢) から始まって収量、純度、精製した細胞内小器官の整合性を結合する最良の妥協点であります。確かに、あまりにも古い葉は葉緑体整合性19に否定的な影響があることが示されたポリフェノール化合物の高度濃縮されています。
最後に、(組織の研削) 初期抽出手順は、別の重要なステップです。ブレンド処理は数秒に限定される必要があります。前述のように、新しいユーザーに誘惑されるかもしれません長いブレンドを使用して強く浄化された細胞小器官の収穫を改良するために期待しています。ただし、効果的に長くブレンド葉からより多くの材料を解放する場合、壊れた葉緑体の割合は急速に原油の細胞抽出液の増加が表示されます。葉緑体中に壊れたのこの高い比率のためさらに精製工程 (Percoll の勾配に分離) 強く影響を受けるし、浄化の収量は案外低い。
細胞内小器官を浄化するために特定のプロトコルの可用性は、高スループットのシリーズ プロテオミクスに基づく実験を葉緑体のサンプルで行うことを許可しています。これらのデータは、いくつかの公共データベースに6、従って分野の生物学者に正確な細胞内局在 (と subplastidial) 多くの葉緑体タンパク質の局在化を提供する利用可能でした。これは id のエンベロープタンパク質の特に本当だったし、エンベロープ膜は葉緑体で重要な役割を再生しながらマイナーな葉緑体のコンポーネント (葉緑体タンパク質の 1-2%) を表すので主これらの分析の前に未知の場所に残った代謝と生合成の5,20。ここで説明されているプロトコルを使用して、最近シロイヌナズナから 3 つの主要な葉緑体コンパートメントの組成を解析した (すなわち、間質、チラコイド、およびエンベロープ膜システム)9。(スペクトル カウント) 半定量プロテオミクス手法に基づいて、何百ものこれらの 3 つの葉緑体のコンパートメントにおけるタンパク質の分配を評価することができました。
議定書はシロイヌナズナから葉緑体の 3 つの主要なコンパートメントを浄化することができます、また葉緑体の追加のサブ コンパートメントを区別することが可能です。確かに、エンベロープ膜システムは内側と外側のエンベロープ膜 (図 1) 成っています。ただし、我々 の知識の限り、内側と外側のエンベロープ膜葉緑体を浄化する手法を確立する残ります。内側と外側のエンベロープ膜は、ほうれん草21またはエンドウ豆22葉緑体から精製できます。シロイヌナズナの主な制限は大抵開始材料の制限量に起因します。(これは既に必要成長チャンバ内 1 m2面)シロイヌナズナの葉 500 g から始まってのエンベロープ蛋白のだけ 100 μ g を浄化できます。その一方は簡単ですを開始 5-10 kg ほうれん草の葉市場、葉緑体8の大規模な量を浄化するために、この材料からのエンベロープ蛋白の 3 に 10 mg の収率で終了するから
チラコイド小班の場合も同じです。チラコイドが光に成っている確かに、膜小胞 (ラメラ) と密な構造 (グラナ) (図 1)。シロイヌナズナ23,24でこれらの 2 つのコンパートメントを区別するために特定のプロトコルがあります。再び、我々 は最近これらの 2 つの小班24で現在の蛋白質をインベントリ定量的プロテオミクス解析に基づき。文学の綿密な調査と、これらの方法は、検証、または、チラコイドのタンパク質の何百もの subplastidial の場所の仮説を提案を許可しました。しかし、チラコイドの曲線の余白に追加膜ミクロ ドメインが存在することに注意する重要です。これらのリポタンパク質小班、またはグラナチラコイド、チラコイド膜に永久に結合されているし、タンパク質25のセットを含みます。現在のプロトコルを使用して不可能従ってチラコイドの他のコンポーネントとこれらの特定の蛋白質を区別します。
いくつかの本物 (有名) チラコイド、ストロマ、封筒のコンポーネントが検出された蛋白質のリストから欠けています。ターゲットの生化学的および免疫学的解析とともに MS 感度の継続的な改善にその様々 な小班の構成の完全なレパートリーに向かって葉緑体内容を再検討する大きな助けとなります。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、INRA 植物生物学、繁殖部門 Labex GRAL (ANR-10-LABX-49-01) から IB に共同博士課程フェローシップによって支えられました。我々 はカリに対する抗体 ANR プロジェクト ANR-15-アイデックス-02、博士オリビエ ヴァロン (IBPC パリ) LHCP と博士ルノー デュマ (LPCV, グルノーブル) に対する抗体を認めるにも思います。
資料
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
参考文献
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved