Method Article
단백질 지 방화 Immunoblotting 또는 단백질의 분석에 대 한 애기에서 엽록체 하위 구획의 준비
요약
여기, 우리 애기 잎 (봉투, 기질, 그리고 thylakoids), 그들의 세 가지 주요 하위 구획에서 그대로 엽록체를 정화 하는 방법을 설명 차동 centrifugations, 연속 Percoll 기울기의 조합을 사용 하 고 불연속 자당 기온 변화도입니다. 메서드는 subplastidial 및 immunoblotting과 proteomics에 의해 단백질의 subcellular 지 방화에 대 한 귀중 한.
초록
엽록체는 식물 세포의 주요 구성 요소. 이러한 plastids 필수 대사 산물의 합성 탄소, 유황 및 질소의 동화 등 많은 중요 한 기능을 성취 한다. 다음 세 가지 주요 하위 구획이이 세포에 의하여 이루어져 있다. 두 막이 특징인 봉투 둘러싸는 세포 기관이 고 다른 세포 구획 plastid의 통신을 제어 합니다. 스트로 마는 엽록체와 이산화탄소 탄수화물으로 변환 되는 주요 사이트의 가용성 단계입니다. Thylakoid 막 grana (평면 압축된 sac)의 구성 된 내부 막 네트워크 이며 lamellae (더 적은 조밀한 구조), 장소 oxygenic 광합성 걸립니다. 현재 프로토콜 차동 centrifugations 및 Percoll 그라데이션, 애기및 그들의 분류에서 그대로 엽록체의 사용 하 여, 3 자당 기온 변화도 사용 하 여 정화에 필요한 단계별 절차를 설명 합니다. 하위 구획 (즉, 봉투, 기질, 및 thylakoids) 이 프로토콜은 또한 다양 한 엽록체 하위 구획을 연결 하는 마커를 사용 하 여 이러한 분수의 순도 평가 하는 방법에 지침을 제공 합니다. 여기에 설명 된 방법은 subplastidial 단백질에 대 한 뿐만 아니라 immunoblotting을 사용 하 여 지역화에 대 한 귀중 한 subcellular subplastidial 단백질 및 다른 연구.
서문
엽록체는 식물 세포의 주요 구성 요소. 그들은 한 endosymbiosis 겪고 있으며 결국 진화1,2중으로 한 세포 기관이 진화 cyanobacterial 조상에서 파생 됩니다. 이러한 세포 세 가지 주요 구획 (그림 1)를 포함합니다. 봉투 시스템 내부 및 주변 세포 기관이 외부 막의 이루어집니다. 이 이중 멤브레인 시스템 지질과 안료의 대사에 관련 된 다양 한 효소를 포함 하 고 plastids는 cytosol 간의 통신 제어 하는데 대부분 이다. 인코딩된 핵 단백질의 가져오기 및 이온 그리고 대사 산물은 cytosol와 따라서 식물 세포3,4 필수적인 대사 기능을 조절 하는 엽록체의 교환을 허용 하는 다양 한 전송 시스템 포함 . 기질, 엽록체의 용 해 단계 포함 캘빈 주기 (CO2 동화)의 효소와 비타민, 아미노산과 plastid의 전사 및 번역 기계를 포함 하 여 다양 한 대사 산물의 합성. Thylakoid 막 광합성의 빛 단계 수행 널리 조직된 내부 막 네트워크입니다. 따라서, 엽록체는 필수적인 대사 경로5발생 하는 장소입니다.
엽록체 역학 및 생리학을 제어 하는 새로운 규제 메커니즘을 해독 하려면 엽록체 단백질의 하위 plastidial 지역화를 정의 따라서 중요 하다 단백질 기능 파악을 목표로 하는 타겟된 연구를 지원 하기 위해 모델 생물6에서. 이 단백질의 정품 subplastidial 지역화에 대 한 액세스를 얻으려면, 따라서 매우 순수한 subplastidial 분수 (봉투 막, 기질, 및 thylakoids)에서 시작 필수적 이다. 이러한 맥락에서 현재 프로토콜의 목표는 애기 단풍 차동 centrifugations 및 연속 Percoll 그라디언트를 사용 하 여에서 그대로 엽록체를 정화 하 고 그들을 충분치 3 불연속 자당 기온 변화도 사용 하 여 하위 구획 (즉, 봉투, 기질, 및 thylakoids) 여기 설명 하는 방법을 다양 한 엽록체 하위 구획을 연결 하는 마커를 사용 하 여 순화 된 하위 organellar 분수의 순도 평가 하기 위해 또한 설명 합니다. 이 프로토콜은 immunoblotting를 사용 하 여 단백질의 subplastidial 지역화와 질량 분석 (MS)를 사용 하 여 순화 된 분수의 추가 분석을 위해 귀중 한-proteomic 연구를 기반으로.
프로토콜
1. 버퍼, 재고 솔루션 및 그라디언트의 준비
- 4 ° c.에 6 개월 저장 될 수 있는 다음과 같은 재고 솔루션을 준비
- Tricine 버퍼 (1 M, pH 8.4) 및 Tricine 버퍼 (1 M, pH 7.6) 1 리터를 준비 합니다. 코 펠 릿을 추가 하 여 pH를 조정 합니다.
- Ethylenediaminetetraacetic 산 (EDTA, 0.5 M, pH 8) 1 리터와 3-(N-morpholino) 프로 판 술 폰 산 (MOPS) 버퍼 (1 M, pH 7.8) 준비 합니다. NaOH 산 탄을 추가 하 여 pH를 조정 합니다.
- MgCl2 (1m) 50 mL를 준비 합니다.
- 준비 50ml protease 억제제 솔루션: phenylmethylsulfonyl 불 (PMSF 소 프로 파 놀, 100 m m에), benzamidine 염 산 염 수화물 (100 m m), 및 ε-아미노 카프 산 (50 mM).
참고: 동안 PMSF 및 아미노 카프 산 솔루션에서 안정적인 4 ° C에서 개월 동안, benzamidine 솔루션 저장 해야-20 ° c.에
- 실험 전에 하루 다음 솔루션을 준비 하 고 4 ° c.에 모든 솔루션 저장
- 보통 pH 8.4 Tricine-코 (20 m m, pH 8.4), 포함 된 연 삭의 4 L 준비 톨 (0.4 M), (10 m m, pH 8), EDTA 그리고 NaHCO3 (10 mM). NaOH 산 탄을 추가 하 여 pH를 조정 합니다. 그냥 사용 하기 전에 소 혈 청 알 부 민 (BSA) 0.1% (w/v)을 추가 하 고 잘 혼합.
- 중간 (2 배) pH 7.6 Tricine-코 (20 m m, pH 7.6), 포함 된 세척의 500 mL를 준비 톨 (0.8 M), MgCl2 (5 m m), 그리고 EDTA (2.5 m m). NaOH 산 탄을 추가 하 여 pH를 조정 합니다. Percoll 그라데이션 솔루션의 세척 매체 (1x)를 준비 후 같은 솔루션을 희석.
- 50% (v/v) Percoll에서 최종 솔루션을 동일한 볼륨에서 세척 매체 (2 배)와 Percoll를 혼합 하 여 엽록체 정화 200 mL Percoll 그라데이션 솔루션의 준비 / 0.4 M 톨.
- MOPS (10 m m, pH 7.8), MgCl2 (4 m m), 자당 (0.3 M, 0.6 M, 0.93 M)의 다른 농도 혼합 하 여 엽록체 분별에 대 한 자당 솔루션 50 mL를 준비 합니다.
- 다음 그라디언트 및 실험을 시작 하기 전에 버퍼를 준비 합니다.
- Percoll 그라데이션 6 튜브 준비 (각각 50%의 30 mL를 포함 된 Percoll / 0.4 M sorbitol) 4 ° c.에서 55 분 38,700 x g에서 원심 분리 하 여 그래디언트의 혼합을 방지 하기 위해 브레이크 계속. 원심, 후 차가운 방에 미리 형성한 그라디언트 사용까지 포함 된 튜브를 저장 합니다.
- 3 다음 자당 계층 형성 각 그라데이션으로 자당 기온 변화도의 4 개의 튜브를 준비: 0.93 M, 2.5 ml 0.6 M, 0.3 M 자당의 2 mL의 3 mL. 조심 스럽게 시작 0.93 m 아래쪽에 그리고 0.3 M로 상단에 연동 펌프를 사용 하 여 각 레이어 오버레이.
- MOPS (10 m m, pH 7.8), MgCl2 (4 m m), PMSF (1mm, 소 프로 파 놀에서 설정), benzamidine 염 산 염 수화물 (1 m m), 및 ε-아미노 카프 산 (0.5 m m)를 포함 하는 엽록체 세포에 대 한 소형 매체의 50 mL를 준비 합니다. 사용까지 얼음에 버퍼를 저장 합니다.
- 막 세척 MOPS (10 m m, pH 7.8), PMSF (1mm), benzamidine 염 산 염 수화물 (1 m m), 및 ε-아미노 카프 산 (0.5 m m)를 포함 하는 버퍼의 50 mL를 준비 합니다. 사용까지 얼음에 버퍼를 저장 합니다.
2. 성장과 애기 잎의 수확
- 애기 식물의 성장에 대 한 준비 4 큰 플라스틱 팬 (0.5 ~ 1 m2의 총 표면) 애기 식물의 각 팬에는 씨앗의 30 mg을 파 종 하 여. 150 μ M m-2의 -1의 광도와 23 ° C (일) / 18 ℃ (밤) 12-h 라이트 사이클에서 5 주 동안 애기 식물을 성장.
- (엽록체에 전 분 알갱이의 양을 줄이기 위해)을 실험 전에 하룻밤 어둡고 차가운 룸 (4 ° C)에 식물을 품 어.
- 1 리터 비 커를 미리 무게를 다음 잎 물자의 수확을 시작 하기 전에 얼음에 넣습니다.
- 토양 (퇴 비)를 피하 여 애기 잎 수확. 다시 비 커의 무게와 조직 무게 기록.
참고: 잎 물자의 400 ~ 500 g 4 개의 팬에서 예상 된다. - 버퍼를 연 삭의 2 패와 함께 추운 방에 나뭇잎 균질 (BSA 사용 하기 전에) 3 번 추가 2 / s 고속 믹서 기에 각 시간.
- 캘 리코의 4 개의 층 및 나일론 blutex의 1 개의 층을 사용 하 여 차가운 방에 homogenate를 필터링 합니다. 부드럽게 모든 액체를 추출 하는 캘 리코/나일론 blutex 내부 homogenate 잎을 짠 다.
- 두 번째 추출에 대 한 믹서 기 컵에 나머지 조직을 복구 합니다. 2.5 및 2.6 (추운 방에) 캘 리코의 4-5 레이어 매체 및 새로운 연 삭의 2 L을 사용 하 여 단계를 반복 합니다.
3. 차등 원심 분리를 사용 하 여 원유 엽록체의 정화
- 똑같이 6 500 mL 병으로 원유 세포 추출 물 고 원심 분리 전에 얼음에 병을 배치. 최대 속도 (2,070 x g) (최대 가속 및 브레이크에, 4 ° C)에 2 분 동안 원심 분리기.
- 부드럽게는 상쾌한을 삭제 합니다.
- 물 펌프를 사용 하 여 나머지 상쾌한 발음 하 고 얼음에 집중된 원유 엽록체를 포함 하는 펠 릿을 유지.
- 부드럽게 세척 매체 (1x)의 최소한의 볼륨을 추가 하 여 펠 릿을 resuspend (결합 된 엽록체 정지의 최종 볼륨 = 36 mL)를 붓 또는 곡선된 플라스틱 주걱을 사용 하 여. 10ml 피펫으로 사용 하 여 각 병에는 중간 세척 3 mL를 추가.
참고: 엽록체의 파손을 피하기 위해 아주 좋은 팁 피펫으로 사용 하지 마십시오. 또는, 더 큰 구멍을 생성 하는 면도날으로 피펫으로의 파란색 팁 잘라. - 10ml 피펫으로 사용 하 여 한 튜브에 resuspended 엽록체를 수집 합니다. Percoll 그라데이션에 로드 하기 전에 동일한 정지를 튜브를 거꾸로 하 여 부드럽게 섞는다.
4. 연속 Percoll 그라데이션에 그대로 엽록체의 정화
- 천천히 6 mL 10ml 피펫으로 엽록체의 파손을 피하기 위해 사용 하는 6 Percoll 기온 변화도의 각 위에 엽록체의 서 스 펜 션의 로드.
- 13300 x g, 진동 물통 회전자를 사용 하 여 4 ° C에서 10 분에 대 한 그라디언트 원심
참고: 가속, 그리고 브레이크를 분리 한다 (에서 브레이크 또는 느린 감속) Percoll 그라디언트의 혼합을 방지 하기 위해. - 깨진된 엽록체와 물 펌프를 사용 하 여 그대로 미토 콘 드리 아를 포함 하는 위 단계를 발음 하 고 그대로 엽록체에에서 존재를 다음 검색 (광범위 한 다크 그린 밴드) 10ml 피펫으로와 단계. 수 핵과 세포 파편 (튜브의 하단에서 찾을) 그대로 엽록체 (그림 2A)으로 발음 하지 않도록 주의 하십시오.
- 3-4-배 세척 버퍼 (1x) 그대로 엽록체 정지 희석. (2,070 x g, 4 ° C) 최대 속도 (최대 가속 및 브레이크에)에 2 분 동안 원심 분리기.
- 신중 하 게는 상쾌한을 삭제 합니다.
- 완전히 물 펌프와 나머지 상쾌한 발음 하 고 얼음에 집중된 그대로 엽록체의 펠 릿을 유지.
- 엽록체 세포의 용 해, 전에 약 1 ml의 세척 매체 (1x) 나트륨 라우릴 황산 polyacrylamide 젤 전기 영동 (SDS-PAGE)와 서 부 럽을 사용 하 여 추가 분석에 대 한 그대로 엽록체 분수의 약 수를 유지. 작은 단백질 농도의 결정에 대 한 이러한 그대로 엽록체의 aliquot 유지. 추가 실험을 위한 액체 질소에 그대로 엽록체 분수를 저장 합니다.
5. 당뇨 버퍼와 엽록체 하위 구획의 정화를 사용 하 여 불연속 자당 기온 변화도에 그대로 엽록체의 세포의 용 해
- 소형 매체 protease 억제제 (최종 볼륨 12 mL를 초과 하지 않아야 합니다)을 포함 하는 펠 릿을 resuspending에 의해 순화 그대로 엽록체를 lyse.
참고:이 단계에서 피펫으로 좋은 팁 (블루 팁) 사용 가능 하다 때문에 엽록체의 intactness는 더 이상 필수 (펠 릿은 전적으로 resuspended 하지로 아래로 엽록체 pipetting). 애기 엽록체는 (해당 되는 경우 예를 들어 완 두 엽록체에 비해) 매우 깨지기 쉬운 이며 그들의 세포의 용 해 거의 즉시 부 화 후 소형 매체에. - 연동 펌프를 사용 하 여 각 미리 형성한 자당 그라디언트 상단 lysed 엽록체의 3 mL를 천천히 로드.
- Ultracentrifuge (70000 x g, 4 ° C)에서 1 시간에 대 한 그라디언트. 원심 분리 이전 소형 중간 버퍼를 사용 하 여 튜브의 쌍을 균형.
- 신중 하 게 그라데이션 (3 mL 각 그라데이션에서)의 상위 단계를 pipetting으로 수용 성 기질 단백질을 복구 (그림 2B). 단백질 농도7의 결정에 대 한 약 수를 가져가 라. 추가 실험을 위한 액체 질소에 기질을 저장 합니다.
- 각 그라디언트의 나머지 상위 단계 발음까지 물 펌프를 사용 하 여 노란색 밴드.
- 피펫으로 (각 그라데이션에서 약 1 mL)와 노란색 밴드 (봉투)를 검색 합니다. 1 개의 관에 봉투를 풀.
- 각 그라디언트의 나머지 단계를 최대 thylakoid 펠 릿 물 펌프를 사용 하 여 제거 합니다.
6. 세척 및 Thylakoid 및 봉투 막 시스템의 농도
- 막 세척 (protease 억제제)와 버퍼 (1x)의 최소 볼륨 (2 mL) thylakoid 펠 릿 (녹색 알갱이)를 resuspend.
- 봉투와 thylakoid 정지 희석 3-4-배 막 세척 매체에서 (10 mL에 양을 맞추십시오) 및 ultracentrifuge (110000 x g, 4 ° C)에서 1 시간에 대 한. 막 세척 원심 분리 이전 버퍼를 사용 하 여 튜브의 쌍을 균형.
- 조심 스럽게 물 펌프를 사용 하 여 supernatants 발음.
- 버퍼 (protease 억제제) 봉투 펠 릿을 세척 하는 막의 약 100 µ L를 추가 합니다. 단백질 농도7의 결정에 대 한 약 수를 가져가 라. 액체 질소에 순화 된 봉투 막 준비를 저장 합니다.
- (Protease 억제제)와 버퍼를 세척 하는 멤브레인의 3 ml에서 thylakoids 펠 릿을 resuspend. 단백질 농도7의 결정에 대 한 약 수를 가져가 라. 액체 질소에 thylakoid 막 분수를 저장 합니다.
결과
순화 된 엽록체 그리고 그들의 하위 구획 인 절차의 후속 단계는 그림 2에 다시 시작 됩니다. Percoll 그라데이션 (그림 2A) 깨진된 엽록체와 미토 콘 드리 아 (그라데이션의 위) 또는 핵 세포 파편 (그라데이션 아래)에서 그대로 엽록체를 구별 수 있습니다. 삼투성 충격 덕분에 Percoll 정화 세포의 파열, 후 결과 분수 자당 기온 변화도 (그림 2B)에 분리 된다. 성 부는 엽록체의 기질 자당 기온 변화도의 표면에 부동 이다. 빛 봉투 막 소포 0.6/0.93 M 자당 인터페이스에서 개별 노란 악대로 복구 됩니다. 가장 무거운 thylakoid 막 소포는 튜브의 하단에 집중. 복구 후, 세척 두 막 분수의 농도, 단백질 정량 하 고 모든 4 개의 분수의 조성은 SDS 페이지 (그림 2C) 분석. 레인은 동등한 단백질 (각 순화 된 분수의 20 µ g)에 로드 됩니다. 엽록체 포함 봉투 단백질의 1%와 스트로 마에서 나는 thylakoids에서 단백질의 50%만 알면,이 크로스-오염 정화 봉투 준비 다른 엽록체 하위 구획의 대 평가 하는 경향이 있다. 그러나,이 방법은 수 분 양의 단백질 봉투 분수 교차 오염 감지. 각 구획 (즉, 풍부한 단백질)에서 마커는 분수의 교차 오염 평가에 매우 유용 합니다. 사실, 봉투 및 thylakoid 막 분수 큰 소 단위의 RuBisCO (RBCL), 기질 (50 kDa)에서 가장 풍부한 단백질의 매우 낮은 금액을 포함 하도록 예상 된다. 깨진된 엽록체가 기질 단백질8의 손실로 인해 그대로 엽록체에서 쉽게 구분할 수 있습니다. 복잡 한 단백질 (LHCP)를 수확 하는 빛은 거의 해야 25 kDa 풍부한 thylakoid 구성 요소 (3% 미만) 봉투 막9오염. 마지막으로, 인산 triose 인산 염 translocator (TPT) 때문에 그것의 강한 농축 정제 봉투 분수에서 볼 수만 30 kDa 단백질 이다 (즉, 50 ~ 100 x) 전체 엽록체에 비교 될 때 봉투 일부에서 추출. 여기 설명 하는 방법을 사용 하 여, 엽록체 하위 구획은 일반적으로 제대로 서쪽 오 점 분석 (그림 2D) 의존 하는 모든 3 개의 하위 구획의 알려진된 표식에 대하여 지시 하는 항 체를 사용 하 여 확인 교차 오염:는 기질에서 녹는 ketol 산 reductoisomerase (카 리), 엽록체 봉투 구리 ATPase (HMA1), 그리고 복잡 한 단백질 (LHCP) 수확 thylakoid 막에서. 3 하위 구획의 교차 오염은 immunoblotting 및 질량 분석 분석9를 사용 하 여 측정할 수 있습니다. 기질 보통 봉투 또는 thylakoid 분수에 의해 오염 되지, 하는 동안 정화 봉투 분수 포함 thylakoid 단백질의 3%와 10% 단백질의 기질에서. 단백질 기질에서 저조한 오염 thylakoid 막 (1% 미만) 하지만 봉투 막 단백질의 3%까지를 포함 하는 thylakoids. 발생 하는 단백질의 subplastidial 지역화에 대 한 잘못 된 결론을 제한 또한 따라서 엽록체 단백질, 현재 방법의 정품 subplastidial 위치 식별에 중요 한 역할을가지고 보다 더 교차 오염.
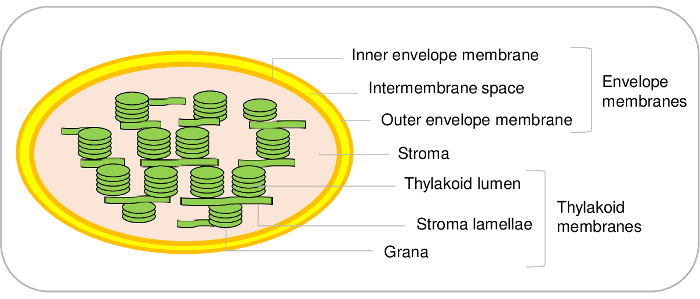
그림 1: 엽록체 하위 구획의 대표적인 제도. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
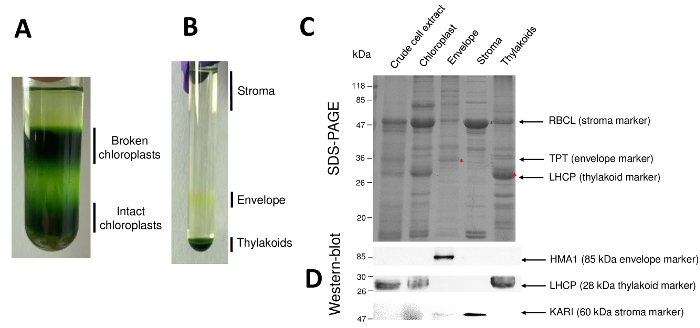
그림 2: 그대로 엽록체의 정화 및 그들의 3 개의 주요 하위 Percoll 및 자당 기온 변화도 사용 하 여 구획. A. Percoll 그라데이션 부서 지 고 그대로 엽록체의 분리 허용. B. 자당 기온 변화도 기질, 봉투, 및 thylakoid 분수의 분리 허용. C. 대표 SDS 페이지 그대로 엽록체와 각 하위 구획에서 풍부한 마커를 시각화할 수 있도록 그들의 세 가지 주요 하위 구획에서 단백질의. 각 차선에는 단백질의 10 µ g을 포함 되어 있습니다. 분자 무게 마커: RBCL, RuBisCO (기질에 대 한 마커);의 큰 소 단위 TPT, 인산 염/triose 인산 염 translocator (봉투 표식); LHCP, 수확 하는 복잡 한 단백질 (마커는 thylakoid에 대 한) 빛. D. 각 하위 구획에서 허용 (특정 항 체를 사용 하 여) 특정 마커를 감지 하는 서쪽 오 점 실험: 엽록체 봉투 구리 ATPase HMA110, 복잡 한 단백질 LHCP는 thylakoid에서 수확 하는 빛 막11, 그리고 기질9ketol 산 reductoisomerase 카 리. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
현재 문서에서 애기 thaliana엽록체 (그리고 그들의 하위 구획)를 정화 하는 데 사용 하는 단계 프로토콜 세부 목표로 합니다. 그것의 완전 한 게놈 순서 거의 2 년 전와 지역 사회에 게 제공 하는 삽입 돌연변이의 대규모 컬렉션의 가용성, 이후 애기 는 지금 널리 받아들여진다 모델 식물으로. 그러나,이 식물 유전 접근에 대 한 완벽 하 게 적응 시킨 동안, 과학자 들은 생 화 확 및 생리 적인 도구가 신흥 모델에 적응 하는 데 필요한 공장. 따라서 시금치12 또는 완두콩13 같은 잘 설립 된 생 화 학적 모델의 잎에서 photosynthetically 활성 엽록체를 정화 수 있도록 프로토콜 적응 했다. 애기 엽록체의 정화를 설명 하는 첫 번째 방법은 199814, 애기 게놈 시퀀스의 출시 직전에 간행 되었다. 몇 년 동안 애기 엽록체 순화 된 세포에 있는 단백질의 생체 외에서 수입을 분석 하는 것을 목표로 연구와 호환 하기 위한 후, 간단한 방법은 사용할 수15,16되었다. 그러나, 이러한 방법은 순도의 높은 수준 및 순화 된 엽록체의 광합성 활동의 보존을 결합 허용 하지 않았다. 최근17, 빠른 방법 설립 되었다, Percoll 그라데이션의 사용에 의존 하 고 애기의 시작 잎에서 측정 하는 광합성 속도의 거의 90%를 유지할 수 있습니다.
여기에 설명 된 프로토콜 순도의 우수한 수준 애기 엽록체 정화 수 있습니다. 실제로, 다른 세포 구획에서 오염 물질의 면역 검출 순화 된 세포는 미토 콘 드리 아 없는 시연 및 플라즈마 멤브레인 마커9,10. 이 프로토콜은 여러 애기 ecotypes18, 컬럼비아 (열) 또는 Wassilewskija (WS), 즉, 같은 엽록체 정화 효율 또한 ecotypes 게놈에 사용 되거나 표현 된 태그 (에스토니아어) 시퀀싱 시퀀싱 또한에 애기에 T-DNA 삽입 돌연변이 생성 하지만 프로젝트. 즉, proteomics 연구 수행 될 때, 현재 프로토콜 애기에서이 두 참조 ecotypes와 호환 됩니다. 마지막으로, 현재 프로토콜을 사용 하 여 엽록체의 수익률은 시금치 나 완두콩 잎 (즉, 3%, Percoll 정화 엽록체는 총에 비교 될 때에 엽록소 콘텐츠 측정에서 시작 했을 때 확인 하는 것과 유사 염 록 소 양 잎을 시작에 존재)입니다. 단백질, 측면에서 수익률 때 엽록체 단백질의 50 밀리 그램 가까이 세포 5 주 된 애기 잎 500 g에서 순화 된다.
그러나 이러한 좋은 수확량 (와 엽록체 무결성), 도달을 현재 프로토콜을 사용 하는 경우 하나 몇 가지 단계에 특별 한 주의 기울여야 한다. 애기 에 엽록체 (이건 완 두 엽록체에 대 한 경우 예를 들어) 매우 깨지기 쉬운 구조 이다. 특정 관심 따라서 정화 동안에 세포의 대규모 파열을 피하기 위해 필요 합니다. 수와 엽록체에 전 분 알갱이의 크기는 그대로 엽록체의 준비에 대 한 중요 합니다. 실제로, 큰 전 분 곡물을 포함 하는 엽록체 일반적으로 손상 됩니다 원유 엽록체 분수12집중을 목표로 초기 차동 centrifugations 단계. 따라서, 식물 전 분의 양을 줄이기 위해 실험 전에 어둡고 차가운 룸 (4 ° C)에서 하룻밤 유지 되어야 한다.
현재의 프로토콜의 새로운 사용자가 더 많은 양의 잎 소재 (큰 잎을 가진 오래 된 애기 식물에서 거 대 한 근 엽)에서 시작 하 유혹 수 정화 엽록체의 복구를 강화 하려고. 그러나, 우리의 손 안에, 수율, 순도, 고 정화 세포의 무결성을 결합 하 여 최고의 타협은 젊은 잎 (5 주 된)에서 시작. 사실, 너무 오래 된 잎은 엽록체 무결성19에 부정적인 영향을 표시 했다 페 놀 화합물에 높은 농축 된다.
마지막으로, 초기 추출 단계 (조직의 연 삭) 또 다른 중요 한 단계가입니다. 혼합 프로세스는 몇 초를 제한 해야 합니다. 위에서 설명 했 듯이, 새로운 사용자 유혹 수도 있습니다 될 더 이상 혼합 사용 하 여 따라서 강력 하 게 순화 된 세포의 수율 향상을 기대. 그러나, 더 이상 효과적으로 혼합 잎에서 더 많은 자료 출시, 그것은 깨진된 엽록체의 비율 원유 세포 추출 물에서 급속 하 게 증가 나타납니다. 깨진 매체에 그대로 엽록체의이 높은 비율 때문 추가 정화 단계 (Percoll 그라디언트에 분리) 강하게 영향을 고 정화의 수확량은 예기치 않게 낮은.
세포를 정화 하는 특정 프로토콜의 일련 높은 처리량의 proteomics 기반 실험 엽록체 샘플에 실시 될 수 있다. 이러한 데이터는 여러 공용 데이터베이스6, 따라서 생물학 분야에서 많은 엽록체 단백질에 대 한 정확한 subcellular (및 subplastidial) 지역화 제공 가능 했다. 이것은 특히 사실 봉투 단백질에 대 한 id와 위치 남아 있었다 주로 이러한 분석 하기 전에 알 수 없는 때문에 봉투 막 엽록체에서 중요 한 역할을 재생 하는 동안 사소한 엽록체 구성 요소 (엽록체 단백질의 1-2%)를 나타냅니다. 신진 대사와 속5,20. 여기 설명 된 프로토콜을 사용 하 여, 최근 분석에서 애기 3 엽록체 주요 구획의 구성 (즉, 기질, thylakoids, 및 봉투 멤브레인 시스템)9. Proteomics 반 양적 접근 (스펙트럼 계산)에 따라,이 3 개의 엽록체 구획에 있는 단백질의 수백의 분할 평가할 수 있었습니다.
현재 프로토콜 애기에서 엽록체의 세 가지 주요 구획을 정화 수 있습니다, 하는 동안 추가 하위 구획은 엽록체에서 구별 가능한 이기도 합니다. 사실, 봉투 막 시스템의 내부 및 외부 봉투 막 (그림 1) 이루어집니다. 그러나, 우리의 지식 최선을 애기 엽록체에서 내부 및 외부 봉투 막 정화 하는 방법을 설정할 수 있다. 내부 및 외부 봉투 막 시금치 완두콩 또는21 22 엽록체에서 정화 될 수 있다. 애기 의 주요 제한 시작 물자의 제한 금액에서 주로 발생 합니다. (요구 하는 이미 성장 챔버에 1 m2 표면) 애기 잎 500 g에서 시작만 100 µ g 봉투 단백질의 정화 수 있습니다. 다른 한편으로, 그것은 쉽습니다 시작으로 시금치의 5-10 k g 시장, 많은 양의 엽록체8 을 정화 하 고이 자료에서 봉투 단백질의 3 ~ 10 밀리 그램의 항복으로 끝에서 나뭇잎.
같은 thylakoid 하위 구획에 대 한 사실 이다. 실제로, thylakoids 빛의 만들어진다 막 소포 (lamellae) 및 밀도 구조 (grana) (그림 1). 특정 프로토콜 애기23,24에이 2 개의 구획을 구별할 수 있습니다. 우리 다시, 최근 이러한 두 개의 하위 구획24에 단백질을 인벤토리 양이 많은 proteomics 분석을 바탕으로. 이러한 접근 문학, 깊이 있는 조사와 검증, 또는 가설을 제안 하는 위치에 대 한, subplastidial thylakoid 단백질의 수백의 허용. 그러나, thylakoids의 곡선된 여백에 추가 막 microdomains 존재는 중요 하다. 이 지 하위 구획, 또는 plastoglobules, thylakoid 막에 영구적으로 결합 하는 고 단백질25의 특정 집합을 포함. 현재 프로토콜을 사용 하 여, 그것은 불가능 따라서 다른 thylakoid 구성 요소에서이 특정 단백질을 구별 하.
일부 정품 (잘 알려진) 봉투, 기질, 또는 thylakoid 구성 요소는 검색 된 단백질의 목록에서 아직 부족 한. 타겟된 생 화 학적 및 면역 분석, 함께 MS 감도의 지속적인 개선의 다양 한 하위 구획의 구성의 완전 한 레 퍼 토리로 엽록체 콘텐츠를 다시 하는 게 큰 도움이 될 것입니다.
공개
저자는 공개 없다.
감사의 말
이 작품 INRA 식물 생물학과 번 식 및 Labex 성배 (ANR-10-LABX-49-01) IB를 공동 박사 학위 장학금에 의해 지원 되었다. 우리 또한 싶습니다 ANR 프로젝트 ANR-15-IDEX-02, 박사 올리비에 Vallon (IBPC 파리) LHCP 박사 Renaud 뒤 마 (LPCV, 그 르노 블)에 대 한 항 체를 인정 하는 카 리에 대 한 항 체에 대 한.
자료
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
참고문헌
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유