Method Article
Kloroplast alt bölmeler Arabidopsis üzerinden hazırlanması Protein yerelleştirme Immunoblotting veya proteomik analizi için
Bu Makalede
Özet
Burada, Arabidopsis yaprakları ve onların üç ana alt bölmeler (zarf, stroma ve thylakoids) sağlam kloroplast arındırmak için bir yöntem tarif fark centrifugations, sürekli Percoll degradeler, bir arada kullanarak ve iş öğelerinin sürekli olmayan sükroz degradeler. Subplastidial ve immunoblotting ve proteomik proteinlerin hücre altı yerelleştirme için önemli bir yöntemdir.
Özet
Kloroplast bitki hücrelerinin önemli bileşenleridir. Böyle Plastitler asimilasyon karbon, kükürt ve azot gibi temel metabolitler sentezi gibi birçok önemli işlevleri yerine getirmek. Bu organelleri aşağıdaki üç anahtar alt bölmeler oluşur. İki membranlar tarafından karakterize zarf, organel çevreleyen ve diğer hücre bölmeleri ile Plastit iletişim denetler. Stroma kloroplast ve karbon dioksit karbonhidrat nerede dönüştürülür ana site çözünür aşamasıdır. Thylakoid membran grana (düz sıkıştırılmış keseleri) oluşan iç zar ağ ve lamellae (daha az yoğun yapıları), nerede temel fotosentez alır yer. Mevcut iletişim kuralı fark centrifugations ve Arabidopsisve onların ayırma sağlam kloroplast, Percoll degradeler kullanarak, sukroz degradeler, üç kullanarak arıtma gerekli adım adım yordamlar açıklanır alt bölmeler (Yani, zarf, stroma ve thylakoids). Bu iletişim kuralı da çeşitli kloroplast alt bölmeler için ilişkili işaretçileri kullanarak bu kesirler saflığı değerlendirmek izlenecek yönergeleri sağlar. Burada açıklanan yöntemi immunoblotting, ama aynı zamanda için kullanarak proteinlerin subplastidial yerelleştirme için değerlidir hücre altı ve subplastidial proteomik ve diğer çalışmalar.
Giriş
Kloroplast bitki hücrelerinin önemli bileşenleridir. Onlar bir endosymbiosis geçirmiş ve sonunda bir organel evrim1,2sırasında gelişti siyanobakteriyel bir atadan türetmek. Böyle organelleri üç ana bölmeleri (Şekil 1) içerir. Zarf sistem bir iç ve bir dış membran organel çevreleyen yapılır. Bu çift cidarlı sistem çeşitli enzimler lipidler ve pigmentler üretimiyle içerir ve çoğunlukla Plastitler sitozol arasındaki iletişimi denetlemek için ayrılmıştır. Nükleer kodlanmış proteinlerin alma ve iyonları ve metabolitleri sitozol ve böylece bitki hücre3,4 temel metabolik işlevleri düzenleyen kloroplast arasındaki değişimi izin çeşitli taşıma sistemleri içerir . Stroma, kloroplast, çözünür aşaması Calvin döngüsü (CO2 asimilasyon), enzimler içeren amino asit ve vitamin ve Plastit transkripsiyon ve translasyon makineleri de dahil olmak üzere çeşitli metabolitleri sentezi. Thylakoid membran nerede fotosentez ışık aşamasında yer alan bir yaygın olarak organize iç zar ağdır. Böylece, kloroplast temel metabolik yollar5oluştuğu yerlerdir.
Kloroplast dinamiği ve Fizyoloji kontrol yeni düzenleyici mekanizmaları çözmek için alt plastidial yerelleştirme kloroplast proteinlerin tanımlama böylece hedeflenen çalışmalar proteinler işlevleri daha iyi anlamak için amaçlayan desteklemek için önemlidir Model organizmalar6'. Bu proteinler hakiki subplastidial lokalizasyonu erişmek için bu nedenle son derece saf subplastidial kesirler (zarf membranlar, stroma ve thylakoids) başlatmak için esastır. Bu bağlamda, mevcut Protokolü Arabidopsis yaprakları fark centrifugations ve sürekli Percoll degradeler kullanarak üzerinden sağlam kloroplast arındırmak ve onları fractionate amaçtır kesintili sükroz degradeler, üç kullanma alt bölmeler (Yani, zarf, stroma ve thylakoids). Burada açıklanan yöntemi ayrıca çeşitli kloroplast alt bölmeler için ilişkili işaretçileri kullanarak arıtılmış alt organellar kesirler saflığı değerlendirmek için yönergeler sağlar. Bu iletişim kuralı subplastidial yerelleştirme immunoblotting kullanarak proteinlerin ve arıtılmış kesirler kütle spektrometresi (MS) kullanarak daha iyi inceleyebilmemiz için değerlidir-tabanlı Proteomik çalışmaları.
Protokol
1. hazırlanması arabellekleri, hisse senedi çözümleri ve gradyan
- 4 ° C'de 6 ay saklanabilir aşağıdaki hisse senedi çözümleri hazırlamak
- 1 litre Tricine tampon (1 M, pH 8.4) ve Tricine tampon (1 M, pH 7,6) hazırlayın. PH KOH granül ekleyerek ayarlayın.
- Ethylenediaminetetraacetic asit (EDTA, 0, 5 M, pH 8) 1 L ve 3-(N-morpholino) propan sülfonik asit (paspas) arabellek (1 M, pH 7.8) hazırlayın. PH NaOH Pelet ekleyerek ayarlayın.
- MgCl2 (1 M) 50 mL hazırlayın.
- 50 mL proteaz inhibitörleri çözümleri hazırlamak: phenylmethylsulfonyl florür (PMSF) isopropanol, 100 mM kurmak, benzamidine hidroklorid hidrat (100 mM) ve ε-amino kaproik asit (50 mM).
Not: PMSF ve amino kaproik asit ay 4 ° C'de çözümde kararlı olmakla birlikte, benzamidine çözüm-20 ° C'de muhafaza edilmelidir
- Aşağıdaki çözümleri deneyin önceki gün hazırlamak ve tüm çözümler 4 ° C'de depolayın
- Orta pH 8.4 Tricine-KOH (20 mM, pH 8.4), içeren öğütme 4 L hazırlamak sorbitol (0.4 M), EDTA (10 mM, pH 8) ve NaHCO3 (10 mM). PH NaOH Pelet ekleyerek ayarlayın. Sadece kullanmadan önce Sığır serum albumin (BSA) %0.1 (w/v) ekleyin ve iyice karıştırın.
- Orta (2 x) pH 7,6 Tricine-KOH (20 mM, pH 7,6), içeren yıkama 500 mL hazırlamak sorbitol (0,8 M), MgCl2 (5 mM) ve EDTA (2.5 mM). PH NaOH Pelet ekleyerek ayarlayın. Böyle çözüm çamaşır Orta (1 x) elde etmek için hazırlanması Percoll degrade çözüm sonra sulandırmak.
- 200 mL Percoll degrade çözeltisi kloroplast arıtma Percoll çamaşır Orta (2 x) ile karıştırılarak (v/v) Percoll % 50 son bir çözüm elde etmek için eşit bir ses seviyesinde hazırlamak / 0.4 M sorbitol.
- 50 mL sukroz çözümleri bezleri (10 mM, pH 7.8), MgCl2 (4 mM) ve sukroz (0,3 M, 0,6 M ve 0.93 M) farklı konsantrasyonlarda karıştırılarak kloroplast ayırma için hazır olun.
- Aşağıdaki gradyanlar ve deney başlamadan önce arabellekleri hazırlamak.
- Percoll degradeler altı tüpleri hazırlayın (her %50 30 mL içeren Percoll / 0.4 M sorbitol) 38,700 x g 55 dk. 4 ° C'de için de Santrifüjü tarafından Fren degradeler karıştırma önlemek için uzak tutmak. Santrifüjü sonra soğuk bir odada ön şekillendirilmesi degradeler içeren kadar kullanmak tüpler saklayın.
- Sükroz degradeler, dört tüpler üç aşağıdaki sükroz katmandan oluşan her degrade ile hazırlamak: 0.93 M, 2.5 mL 0,6 M ve 0,3 M sukroz 2 mL 3 mL. Dikkatle her katmanı ile 0.93 M altındaki başlangıç ve 0,3 M ile üst kısmında finisaj peristaltik pompa kullanarak, yer paylaşımı.
- Hipotonik orta 50 mL bezleri (10 mM, pH 7.8), MgCl2 (4 mM), PMSF (1 mM isopropanol kurulmuş,), benzamidine hidroklorid hidrat (1 mM) ve ε-amino kaproik asit (0.5 mM) içeren kloroplast lizis için hazırlayın. Arabellek buza kullanmak kadar saklamak.
- 50 mL bezleri (10 mM, pH 7.8), PMSF (1 mM), benzamidine hidroklorid hidrat (1 mM) ve ε-amino kaproik asit (0.5 mM) içeren bir arabellek yıkama membran hazırlayın. Arabellek buza kullanmak kadar saklamak.
2. büyüme ve Arabidopsis yaprakları hasat
- Arabidopsis bitkilerin büyüme için 4 büyük plastik tava Arabidopsis bitkilerin tohum her tavada 30 mg Ekim tarafından (0.5-1 m2bir toplam alan için) hazır olun. Arabidopsis bitkiler için 5 hafta 12 saat ışık-siklet 23 ° c (gün) / 18 ° C (gece), 150 mikron m-2 s-1bir ışık şiddeti ile büyümek.
- Gecede deneme (kloroplast içinde nişasta granülleri miktarını azaltmak için) önce bir karanlık ve soğuk oda (4 ° C) tesislerinde kuluçkaya.
- Bir 1 L ölçek önceden tartmak ve yaprak malzemeden hasat başlamadan önce buza koyun.
- Hasat Arabidopsis toprak (kompost) kaçınarak bırakır. Kabı yeniden tartmak ve doku ağırlık kaydedin.
Not: 400-500 g yaprak malzemenin dört tava bekleniyor. - Yaprakları arabellek öğütme 2 L ile soğuk bir odada homojenize (BSA daha önce üç kez Ekle) / 2 s yüksek hızda bir karıştırıcıda her zaman.
- Homogenate soğuk bir odada muslin 4 kat ve naylon blutex bir tabaka kullanarak filtre. Tüm sıvı ayıklamak için muslin/naylon blutex içinde homogenate yaprakları yavaşça sık.
- Blender Kupası ikinci çıkarılması için kalan dokuda kurtarmak. 2.5 ve orta ve yeni öğütme 2 L (soğuk bir odada) 4-5 kat muslin kullanarak 2.6 numaralı adımları yineleyin.
3. ham kloroplast fark Santrifüjü kullanarak saflaştırılması
- Aynı derecede altı 500 ml'lik şişe içine ham hücre özü dağıtabilir ve şişe buz Santrifüjü önce yerleştirin. En kısa zamanda en yüksek hızı (2,070 x g) (maksimum hızlanma ve fren üzerinde 4 ° C) ulaşıldıktan 2 dk santrifüj.
- Yavaşça süpernatant atmak.
- Bir su pompası ile kalan süpernatant Aspire edin ve buz üzerinde konsantre ham kloroplast içeren parçaları tutmak.
- Yavaşça bir asgari miktar çamaşır Orta (1 x) ekleyerek granül resuspend (kombine kloroplast süspansiyonlar son hacmi 36 mL =) bir fırça veya eğri bir plastik spatula kullanarak. 10 mL damlalıklı, orta her şişe yıkama 3 mL eklemek için kullanın.
Not: damlalıklı kloroplast kırılma önlemek için çok güzel ipuçları ile kullanmayın. Alternatif olarak, daha büyük bir delik oluşturmak için bir tıraş bıçağı ile bir damlalıklı mavi ucu kesilmiş. - Resuspended kloroplast bir tüp 10 mL damlalıklı kullanarak toplama. Karışımı yavaşça Percoll degradeler üzerinde yükleme önce homojen bir süspansiyon elde etmek için tüp ters çevirme.
4. sürekli Percoll degrade üzerinde sağlam kloroplast saflaştırılması
- Üstünde tepe-in her kloroplast kırılma önlemek için bir 10 mL damlalıklı kullanarak altı Percoll degradeler kloroplast süspansiyon 6 mL yük yavaş.
- Degradeler 13,300 x g, sallanan-kova rotor kullanarak 4 ° C de 10 dakika santrifüj kapasitesi.
Not: Hızlanma yavaş olmalı ve fren bağlantısı (fren kapalı veya yavaş yavaşlama) Percoll degradeler karıştırma önlemek için. - Kırık kloroplast ve bozulmamış mitokondri bir su pompası kullanarak içerir üst aşama Aspire edin ve bozulmamış kloroplast alt mevcut almak aşama (geniş koyu yeşil bant) ile 10 mL damlalıklı. Çekirdek ve hücre artıkları (tüp alt kısmında bulunur) sağlam kloroplast (Şekil 2A) ile Aspire değil dikkatli olun.
- 3-4-kat çamaşır arabellek (1 x) ile bozulmamış kloroplast süspansiyon sulandırmak. En kısa zamanda en yüksek hızı (2,070 x g, 4 ° C) (maksimum hızlanma ve fren üzerinde) ulaşıldıktan 2 dk santrifüj.
- Dikkatle süpernatant atmak.
- Tamamen kalan süpernatant bir su pompası ile Aspire edin ve buz üzerinde konsantre olduğu gibi kloroplast Pelet tutun.
- Kloroplast lizis önce yaklaşık 1 mL, Orta (1 x) Sodyum Lauryl Sülfat polyacrylamide jel elektroforez (SDS-sayfa) ve western Blot kullanarak daha fazla analizleri için yıkama sağlam kloroplast kesir bir aliquot unutmayın. Küçük bir protein konsantrasyonu tayini için olduğu gibi bu kloroplast, aliquot devam et. Sağlam kloroplast kesir daha fazla deneyler için sıvı azot depolamak.
5. sağlam kloroplast hipotonik tampon ve kloroplast alt bölmeler arıtma kesintili sükroz degradeler kullanarak lysis
- Proteaz inhibitörleri (son hacim 12 mL geçmemelidir) içeren hipotonik ortamda Pelet resuspending tarafından arıtılmış sağlam kloroplast parçalayıcı.
Not: kloroplast, intactness (kloroplast yukarı ve aşağı Pelet değil tamamen resuspended sürece pipetting) daha fazla gerekli olduğundan bu adıma, damlalıklı iyi ipuçları (mavi ipuçları) ile kullanımı mümkündür. Arabidopsis kloroplast (bezelye kloroplast için örneğin karşılaştırıldığında) çok kırılgan ve onların lizis kuluçka sonra hipotonik ortamda hemen hemen hemen. - Yavaş yavaş lysed kloroplast peristaltik pompa kullanarak her ön şekillendirilmesi sükroz degradeler üst kısmında 3 mL yük.
- Ultracentrifuge (70.000 x g, 4 ° C'de) 1 h için degradeleri. Hipotonik orta tampon önce Santrifüjü kullanarak tüpler, çiftlerini dengelemeyi.
- Dikkatle çözünür stromal proteinler degrade (her degrade 3 mL) üst aşaması pipetting tarafından yeniden elde etmek (Şekil 2B). Bir aliquot protein konsantrasyonu7tespiti için al. Stroma daha fazla deneyler için sıvı azot depolamak.
- Her degrade kalan üst aşaması için bir su pompası ile sarı bant Aspire edin.
- Damlalıklı (yaklaşık her degrade üzerinden 1 mL) ile sarı bant (zarf) almak. Bir tüp zarflarda havuz.
- Her degrade kalan aşaması için bir su pompası ile thylakoid Pelet kaldırın.
6. çamaşır ve konsantrasyon Thylakoid ve zarf membran sistemleri
- Thylakoid granül (yeşil Pelet) arabellek (1 x) (proteaz inhibitörleri ile) yıkama membran en küçük birim (2 mL) resuspend.
- Zarf ve thylakoid süspansiyonlar seyreltik 3-4-kat membran çamaşır Orta (10 ml ses seviyesini) ve ultracentrifuge (110.000 x g, 4 ° C'de) 1 h için. Arabellek Santrifüjü önce yıkama membran kullanarak tüpler, çiftlerini dengelemeyi.
- Dikkatli bir su pompası ile supernatants Aspire edin.
- Yaklaşık 100 µL arabelleğe (ile proteaz inhibitörleri) zarf Pelet yıkama membran ekleyin. Bir aliquot protein konsantrasyonu7tespiti için al. Arıtılmış zarf membran hazırlık sıvı azot depolamak.
- Thylakoids Pelet önbellekle (proteaz inhibitörleri) yıkama membran 3 mL resuspend. Bir aliquot protein konsantrasyonu7tespiti için al. Thylakoid membran kesir sıvı azot depolamak.
Sonuçlar
Birbirini izleyen adımları arıtılmış kloroplast ve onların alt bölmeler ile sonuçlanan yordam Şekil 2' de sürdürülür. Percoll gradyan (Şekil 2A) sağlam kloroplast kırık kloroplast ve mitokondri (üst degradenin) veya çekirdek ve hücre artıkları (alt geçişin) ayırt sağlar. Bir ozmotik şok sayesinde Percoll saf organelleri rüptürü sonra ortaya çıkan kesirler sükroz degradeyi (Şekil 2B) ayrılır. Stroma (çözünür parçası kloroplast) sükroz geçişin yüzeyi ölü olarak yatıyor. Hafif zarf membran veziküller 0,6/0.93 M Sükroz arabiriminde ayrı bir sarı bant olarak kazanılmaktadır. En ağır thylakoid membranlar veziküller tüp alt kısmında yoğunlaşmıştır. Kurtarma, çamaşır ve iki membran kesirler konsantrasyon sonra proteinler sayılabilir ve tüm dört kesirler bileşimi bir SDS-sayfasında (Şekil 2C) analiz edilir. Şerit bir eşit protein olarak (her saf kesir 20 µg) yüklenir. Kloroplast yalnızca zarf proteinlerin % 1 ve % 50 proteindir stroma veya thylakoids içeren bilmek, bu çapraz bulaşma arıtılmış zarf hazırlıkların diğer kloroplast alt bölmeler ile abartma eğilimindedir. Ancak, bu yöntem zarf kesir çapraz kirletici proteinlerin dakika miktarları tespit etmek için izin verir. İşaretleyicileri her bölmesi (Yani, bol protein) üzerinden kesirler çapraz bulaşma değerlendirilmesinde çok faydalıdır. Gerçekten de, thylakoid ve zarf membran kesirler çok düşük miktarlarda büyük alt birimi, RuBisCO (RBCL), (50 kDa) stroma en bol protein içeren bekleniyor. Kırık kloroplast nedeniyle bu stromal protein8kaybı sağlam kloroplast üzerinden kolayca ayırt edilebilir. Karmaşık proteinleri (LHCP) hasat ışık zar zor gerekir 25-kDa bol thylakoid bileşen vardır (% 3 daha az) zarf membranlar9kontamine. Son olarak, fosfat Trioz fosfat ışınlama (trompet), yani ancak saf zarf kesir onun güçlü zenginleştirme nedeniyle görülür bir 30-kDa proteinidir (Yani, 50-100 x) için bütün kloroplast karşılaştırıldığında zarf kesir ayıklar. Burada açıklanan yöntemi kullanarak, kloroplast alt bölmeler genellikle kötü çapraz-western-blot analizleri (2D rakam) yönettiği tüm üç alt bölmeler bilinen işaretleri karşı antikorlar güvenerek kullanarak doğruladı olarak kirlenmiş: stroma dan çözünür ketol-asit reductoisomerase (KARI), kloroplast zarf bakır ATPaz (HMA1) ve karmaşık proteinleri (LHCP) hasat ışık thylakoid membranlar. Üç alt bölmeler çapraz bulaşma immunoblotting ve kütle spektrometresi analizleri9kullanarak sayılabilir. Stroma genellikle zarf veya thylakoid fraksiyonları tarafından kontamine değil, saflaştırılmış zarf kesirler %3 thylakoid protein içerir ve proteinlerin % 10 ilâ stroma üzerinden. Proteinler stroma gelen kötü thylakoid membranlar (az % 1) kontamine ancak thylakoids zarf membran proteinlerinin % 3'e kadar içerir. Böylece kloroplast proteinler, mevcut yöntemi hakiki subplastidial konumunu belirlenmesinde önemli bir rol olması da subplastidial yerelleştirme kaynaklanan proteinlerin hakkında hatalı sonuçlar sınırlar daha contaminations çapraz.
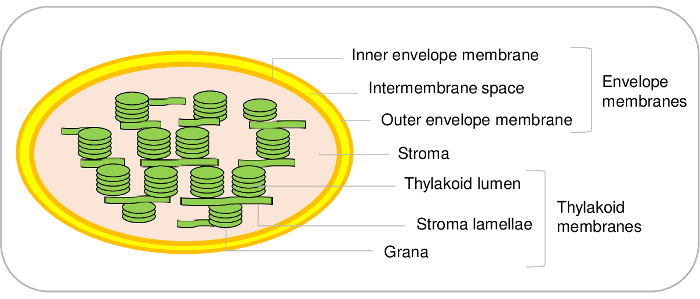
Şekil 1: kloroplast alt bölmeler temsilcisi düzeninin. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
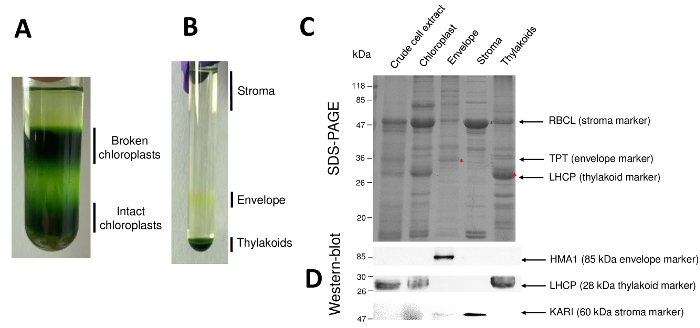
Şekil 2: sağlam kloroplast arınma ve onların üç ana alt bölme Percoll ve sukroz degradeler kullanarak. A. kırık ve bozulmamış kloroplast ayrılması sağlayan Percoll gradyan. B. stroma, zarf ve thylakoid kesirler ayrılması sağlayan sükroz degrade. C. temsilcisi SDS-sayfa proteinlerin sağlam kloroplast ve her alt kartı yuvası üzerinden bol işaretleri görselleştirmek için izin üç ana alt bölmeler. Her lane proteinlerin 10 µg içerir. Moleküler Ağırlık işaretleri: RBCL, RuBisCO (stroma için işaretleyici); in büyük alt birimi Trompet, fosfat/Trioz-fosfat ışınlama (zarf için işaretleyici); LHCP, karmaşık proteinleri (thylakoid için işaretleyici) hasat ışık. D. her alt kartı yuvası belirli işaretleri (belirli antikorları kullanarak) tespit etmek için izin Western-blot deneyler: kloroplast zarf bakır ATPaz HMA110, karmaşık proteinleri LHCP thylakoid dan hasat ışık Membranlar11ve stroma9ketol-asit reductoisomerase KARI. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Mevcut madde kloroplast (ve onların alt bölmeler) arındırmak için kullanılan adım adım iletişim kuralı detaylara Arabidopsis thalianaamaçlamaktadır. Ve kullanıma sunulması, komple genom sıra neredeyse yirmi yıl önce büyük koleksiyonları topluma sunulan ekleme mutantların beri Arabidopsis şimdi yaygın bir modeli bitkisi olarak kabul edilir. Ancak, bu bitki genetik yaklaşımlar için mükemmel adapte iken, gelişmekte olan bu model biyokimyasal ve fizyolojik araçlarına uyum için gerekli bilim adamları bitki. Böylece yaprak ıspanak12 veya bezelye13 gibi köklü biyokimyasal modellerin üzerinden omnivor etkin kloroplast arındırmak için izin iletişim kuralları adapte gerekiyordu. İlk yöntem Arabidopsis kloroplast arıtma 199814, Arabidopsis genom dizisi sürümünden önce yayımlandı. Birkaç yıl sonra basit yöntemleri Arabidopsis kloroplast arıtılmış organelleri proteinler alınmasıyla vitro analiz amaçlayan çalışmalar ile uyumlu izole için kullanılabilir15,16yapılmıştır. Ancak, bu yöntemleri yüksek saflık ve arıtılmış kloroplast fotosentetik etkinlik korunması birleştirmek için izin vermedi. Son zamanlarda17, hızlı bir yöntem, Percoll degradeler kullanımına dayanıyor ve ölçülen Arabidopsis başlangıç yapraklarda fotosentez oranı neredeyse % 90 tutulacağı sağlar kurulmuştur.
Burada açıklanan iletişim kuralı Arabidopsis kloroplast saflık mükemmel bir düzeyde arındırmak için izin verir. Gerçekten de, diğer hücre bölmeleri gelen kirletici immünolojik algılama arıtılmış organelleri mitokondrial yoksun olduğunu gösterdi ve plazma zarı işaretleyicileri9,10. Bu iletişim kuralı da birkaç Arabidopsis ecotypes18, Columbia (Col) veya Wassilewskija (WS), Yani, gibi kloroplast arındırmak için verimli genom için kullanılan veya ifade ecotypes sıra Etiketler (ESTs) sıralama Ayrıca Arabidopsisiçinde T-DNA ekleme mutantlar oluşturmak için ama projeleri. Proteomik çalışmalar yapılması gerektiğinde, diğer bir deyişle, mevcut Protokolü Arabidopsisgelen bu iki başvuru ecotypes ile uyumludur. Son olarak, mevcut iletişim kuralını kullanarak kloroplast verim--dan ıspanak veya bezelye yaprakları (Yani, Percoll saf kloroplast fazla ile karşılaştırıldığında klorofil içeriğinde üzerinden ölçülen % 3, başlatma sırasında elde edilen bir benzer klorofil tutar yaprakları başlayan mevcut). Ne zaman organelleri 5-hafta-yaşlı Arabidopsis yaprakların 500 g Saf protein açısından, kloroplast proteinlerin yakın 50 mg verimidir.
Böyle bir iyi verim (ve kloroplast bütünlüğü), ulaşmak için bir ancak özen özel birkaç adım mevcut protokolünü kullanırken. Arabidopsis kloroplast (Bu durum için bezelye kloroplast, örneğin değildir) son derece kırılgan bir yapıdır. Belirli dikkat böylece arıtma sırasında organelleri büyük ölçekli rüptürü önlemek için gereklidir. Nişasta granülleri kloroplast içinde mevcut boyutunu ve sayısını sağlam kloroplast hazırlanması için kritik öneme sahiptir. Nitekim, büyük nişasta tahıl içeren kloroplast genellikle ham kloroplast kesirler12konsantre amaçlayan ilk fark centrifugations adımları sırasında kesilir. Bu nedenle, bitkiler gecede bir karanlık ve soğuk oda (4 ° C) nişasta miktarını azaltmak için deneme önce tutulmalıdır.
Mevcut iletişim kuralının yeni kullanıcılar daha büyük miktarlarda yaprak malzeme (daha büyük yaprakları ile eski Arabidopsis bitkilerden büyük rozet) başlatmak için cazip saf kloroplast kurtarılması geliştirmek çalışıyor. Ancak, bizim ellerde, Genç yapraklarından (5-hafta-yaşlı) verim, saflık ve arıtılmış organelleri bütünlüğünü birleştirmek için en iyi uzlaşma ulaşıyor. Gerçekten de, çok eski yaprakları çok kloroplast bütünlük19üzerinde olumsuz bir etkisi olarak gösterildi fenolik bileşikler olarak zenginleştirilmiş.
Son olarak, (doku bileme) ilk ayıklama adım başka bir kritik adım olduğunu. Karıştırma işlemi birkaç saniye için sınırlı olmalıdır. Yukarıda belirtildiği gibi yeni kullanıcıların daha uzun karıştırma, kullanmak için böylece güçlü arıtılmış organelleri verimini artırmak bekliyor meyillidir. Ancak, daha uzun etkili karıştırma yaprakları daha fazla malzeme yayımlarsa, kırık kloroplast oranı hızla ham hücre hulâsa içinde artar görünür. Bu yüksek oran orta sağlam kloroplast kırık nedeniyle daha fazla arıtma adımları (ayrılık Percoll degradeler üzerinde) şiddetle etkilenir ve arıtma verimi beklenmedik bir şekilde düşüktür.
Kullanılabilirlik organelleri arındırmak için belirli iletişim kurallarının kloroplast örnekleri üzerinde yapılacak deneyler proteomik tabanlı yüksek üretilen iş bir dizi izin. Bu veri böylece alanında biyologlar için doğru bir hücre altı (ve subplastidial) yerelleştirme için birçok kloroplast protein sağlayan birkaç ortak veritabanları6, sunuldu. Bu kimliği zarf proteinleri özellikle doğruydu ve kloroplast içinde önemli bir rol oynarken küçük kloroplast bileşeni (kloroplast proteinlerin % 1-2) zarf membranlar temsil ettiğinden konum çoğunlukla bu analizleri daha önce bilinmeyen kaldı metabolizma ve dipnotlar5,20. Burada açıklanan protokol kullanılarak, son zamanlarda Arabidopsis üzerinden üç ana kloroplast bölmeleri bileşimi analiz (Yani, stroma, thylakoids ve zarf membran sistemi)9. (Spektral sayma) bir yarı kantitatif proteomik yaklaşım üzerinde bağlı olarak, biz bu üç kloroplast bölmeleri proteinler yüzlerce bölümleme değerlendirmek başardık.
Kloroplast Arabidopsisüzerinden üç ana bölmeleri arındırmak için mevcut protokol izin verirken, kloroplast içinde ek alt bölmeler ayırt etmek de mümkündür. Nitekim, zarf membran sistemi iç ve dış zarf membranlar (Şekil 1) yapılır. Ancak, bizim bilgi en iyi şekilde kurulacak bir yöntem iç ve dış zarf membranlar Arabidopsis kloroplast üzerinden arındırmak için kalır. İç ve dış zarf membranlar ıspanak bezelye veya21 22 kloroplast saf. Arabidopsis ana sınırlandırılması çoğunlukla malzeme başlayan sınırlayıcı tutarlardan sonuçlanır. 500 g Arabidopsis yaprak (ki zaten bir büyüme odası 1 m2 yüzey gerektirir) başlayarak zarf proteinlerin sadece 100 µg arındırıcı sağlar. Öte yandan, o ile başlayan piyasa, kloroplast8 büyük miktarda arındırmak için ve bir verim bu malzemeden zarf proteinlerin 3-10 mg ile kesmek için 5-10 kg ıspanak yaprakları kolaydır.
Aynı thylakoid alt bölmeler için geçerlidir. Gerçekten de, thylakoids ışık yapılmış membran veziküller (lamellae) ve yoğun yapıları (grana) (Şekil 1). Belirli iletişim kuralları Arabidopsis23,24iki bu bölmeleri ayırt etmek kullanılabilir. Yine, bir nicel proteomik analize dayalı, biz son zamanlarda bu iki alt bölmeler24saat içinde mevcut proteinler kaydediliyor. Bu yaklaşımlar, edebiyat, derinlemesine bir araştırma ile birlikte doğrulamadan veya hipotezler yüzlerce thylakoid proteinler, subplastidial konumu için teklif izin. Ancak, ek membran microdomains thylakoids eğri boşluklarında bulunduğunu unutmamak gerekir. Bu lipoprotein alt bölmeleri veya plastoglobules, thylakoid membran için kalıcı olarak birleştiğinde ve proteinler25belirli bir kümesi içerir. Mevcut iletişim kuralını kullanarak, böylece bu belirli proteinler diğer thylakoid bileşenlerinden ayırt etmek mümkün değil.
Bazı orijinal (bilinen) zarf, stroma ve thylakoid bileşenleri hala algılanan proteinler listelerinden eksik vardır. Hedeflenen biyokimyasal ve immünolojik analizleri ile birlikte MS duyarlılık sürekli iyileştirilmesi kloroplast içerik, çeşitli alt bölmeler bileşimi tam bir repertuar doğru tekrar çok yardımcı olacaktır.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser INRA bitki biyolojisi ve yetiştirme bölümü ve Labex GRAL (ANR-10-LABX-49-01) IB için ortak bir Doktora Bursu tarafından desteklenmiştir. Biz de ANR proje ANR-15-IDEX-02, Dr. Olivier Vallon (IBPC Paris) LHCP ve Dr. Renaud Dumas (LPCV, Grenoble) karşı antikorlar için kabul KARI karşı antikorlar için istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
Referanslar
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır