Method Article
Подготовка хлоропласта суб отсеков от Arabidopsis для анализа белка локализации Immunoblotting или протеомики
В этой статье
Резюме
Здесь мы опишем способ очистить нетронутыми хлоропластов Arabidopsis листья и их три основных суб отсеков (конверт, стромы и тилакоидов), с помощью сочетания дифференциального centrifugations, непрерывной Percoll градиенты, и разрывными сахарозы градиенты. Этот метод является ценным для subplastidial и внутриклеточных Локализация белков immunoblotting и протеомики.
Аннотация
Хлоропластов являются основными компонентами растительных клеток. Такие пластид выполнения многих важнейших функций, таких как ассимиляции углерода, серы и азота, а также синтез основных метаболитов. Эти органеллы состоят из следующих трех основных суб отсеков. Конверт, характеризуется двумя мембраны, окружает органелл и управления коммуникационных пластид с других клеточных компартментов. Строма является растворимы фазы хлоропластов и основной сайт, где углекислого газа преобразуется в углеводы. Тилакоидной мембраны является внутренней мембраны сеть, состоящая из Грано (плоский сжатых мешки) и ламели (менее плотной структуры), где oxygenic фотосинтез занимает место. Настоящий Протокол описывает шаг за шагом процедуры, необходимые для очистки, с помощью дифференциальной centrifugations и Percoll градиенты, нетронутыми хлоропластов Arabidopsis, и их фракционирование, используя сахарозу градиентов, в трех суб отсеков (то есть, конверт, стромы и тилакоидов). Этот протокол также содержит инструкции о том, как оценить чистоту этих фракций, с использованием маркеров, связанные в различных отсеках суб хлоропластов. Метод, описанный здесь ценно для локализации subplastidial белков с помощью immunoblotting, но и для субцеллюлярные и subplastidial протеомики и другие исследования.
Введение
Хлоропластов являются основными компонентами растительных клеток. Они являются производными от цианобактерий предка, который прошел endosymbiosis и в конечном итоге превратилась органелл в ходе эволюции1,2. Такие органеллы содержат три основных отсеков (рис. 1). Конверт системы производится из внутренней и наружной мембраны, окружающие органеллы. Этот двойной мембраной Система содержит различных ферментов, участвующих в метаболизме липидов и пигменты и посвящен главным образом для управления связи между пластид и цитозоле. Он содержит различные транспортные системы, которые позволяют импорт ядерных кодировке белков и обмен ионов и метаболитов между цитозоле и хлоропластов, таким образом регулирующие основные метаболические функции завод ячейка3,4 . Стромы, растворимы фазы хлоропластов, содержит ферменты цикл Кальвина (CO2 ассимиляции), синтез различных метаболитов, включая аминокислоты и витамины и транскрипции и трансляции механизмов пластид. Тилакоидной мембраны представляет собой сеть широко организованной внутренней мембраны, где проходит свет этапа фотосинтеза. Таким образом хлоропластов являются местом, где основные метаболические пути происходят5.
Для того чтобы расшифровать новых регулирующих механизмов, которые управляют хлоропласта динамика и физиологии, определяя суб пластидная Локализация белков хлоропласта таким образом имеет решающее значение для поддержки целевых исследований, стремясь лучше понять функции белков в модели организмов6. Для того, чтобы получить доступ к подлинной subplastidial локализации этих белков, поэтому важно, чтобы начать с чистой subplastidial фракции (конверт мембраны, стромы и тилакоидов). В этом контексте, целью настоящего Протокола является очистить нетронутыми хлоропластов из листьев Arabidopsis , с использованием дифференциальной centrifugations и непрерывной Percoll градиенты и чтобы фракционировать их с использованием разрывных сахарозы градиентов, в трех суб отсеков (то есть, конверт, стромы и тилакоидов). Метод, описанный здесь также предоставляет инструкции для оценки чистоты очищенной суб organellar фракций, с использованием маркеров, связанные в различных отсеках суб хлоропластов. Этот протокол является ценным для локализации subplastidial белков, используя immunoblotting и для дальнейшего анализа очищенный фракций, с использованием масс-спектрометрия (МС)-на основе протеомических исследований.
протокол
1. Подготовка буферов, запасов решений и градиенты
- Подготовить следующие акции решений, которые могут храниться до 6 месяцев при 4 ° C.
- Подготовка 1 Л Трицин буфер (1 M, рН 8,4) и буфер Трицин (1 M, рН 7,6). Отрегулируйте пэ-аш, добавив Кох окатышей.
- Подготовка 1 Л Этилендиаминтетрауксусная кислота (рН 8 ЭДТА, 0,5 М) и 3-(N-morpholino) пропан перфтороктановой сульфоновой кислоты (МОПЫ) буфера (1 M, pH 7,8). Отрегулируйте пэ-аш путем добавления NaOH окатышей.
- Подготовка 50 мл MgCl2 (1 M).
- Подготовка 50 мл протеазы ингибиторы решения: phenylmethylsulfonyl фторид (PMSF в изопропаноле, 100 мм), benzamidine гидрохлорида гидрат (100 мм) и ε-аминокислоты капроновая кислота (50 мм).
Примечание: Хотя PMSF и амино капроновая кислота являются стабильными в растворе для месяцев при температуре 4 ° C, benzamidine раствор должен храниться при-20 ° C.
- Подготовить следующие решения за день до эксперимента и хранить все решения при 4 ° C.
- Подготовка 4 L измельчения Средний рН 8,4, содержащие Трицин-Кох (20 мм, pH 8.4), сорбитол (0,4 М), ЭДТА (10 мм, pH 8) и NaHCO3 (10 мм). Отрегулируйте пэ-аш путем добавления NaOH окатышей. Добавьте бычьим сывороточным альбумином (БСА) 0,1% (w/v) непосредственно перед использованием и хорошо перемешайте.
- Подготовка 500 мл моющего среднего (2 x) рН 7,6, содержащие Трицин-Кох (20 мм, pH 7,6), сорбитол (0,8 М), MgCl2 (5 мм) и ЭДТА (2,5 мм). Отрегулируйте пэ-аш путем добавления NaOH окатышей. Разбавьте такое решение после подготовки градиентного раствора Percoll для получения среднего стиральные (1 x).
- Подготовка 200 мл Percoll раствора градиент для очистки хлоропласта путем смешивания Percoll с стиральная среднего (2 x) на равных громкость чтобы получить окончательное решение на 50% (v/v) Percoll / сорбита 0,4 М.
- Подготовка 50 мл растворов сахарозы для хлоропластов фракционирование путем смешивания МОПЫ (10 мм, pH 7,8), MgCl2 (4 мм) и различных концентраций сахарозы (0,3 М, 0,6 М и 0,93 М).
- Подготовьте следующие градиентов и буферов до начала эксперимента.
- Подготовить шесть трубы Percoll градиентов (каждый содержит 30 мл 50% Percoll / сорбита 0,4 М) центрифугированием при 38,700 x g 55 мин при 4 ° C. Держите тормоза от для предотвращения смешивания градиентов. После центрифугирования Храните пробирки, содержащие предварительно градиенты в холодной комнате до использования.
- Подготовить четыре трубы сахарозы градиентов, с каждого градиента, формируется из трех следующих сахарозы слоев: 3 мл 0,93 М, 2,5 мл 0,6 М, и 2 мл 0,3 М сахарозы. Тщательно наложение каждый слой, с использованием перистальтического насоса начиная с 0,93 М в нижней части и заканчивая 0,3 М в верхней.
- Подготовка 50 мл гипотонический среды лизис хлоропластов, содержащие МОПЫ (10 мм, pH 7,8), MgCl2 (4 мм), PMSF (1 мм, в изопропиловый спирт), benzamidine гидрохлорида гидрат (1 мм) и ε-аминокислоты капроновая кислота (0,5 мм). Сохранить буфер на льду до использования.
- Подготовка 50 мл мембраны отмывающего буфера, содержащий МОПЫ (10 мм, pH 7,8), PMSF (1 мм), benzamidine гидрохлорида гидрат (1 мм) и ε-аминокислоты капроновая кислота (0,5 мм). Сохранить буфер на льду до использования.
2. рост и уборки листьев Arabidopsis
- Для роста растений Arabidopsis подготовиться 4 большие пластиковые поддоны (общей площадью 0,5 – 1 м2) Arabidopsis растений, посев семян в каждом Пан 30 мг. Растут растения арабидопсис 5 недель в 12-h свет цикла при 23 ° C (день) / 18 ° C (ночь) с интенсивностью освещения 150 мкм m s-2 -1.
- Инкубируйте растений в темной и холодной комнате (4 ° C) на ночь до эксперимента (чтобы уменьшить количество гранул крахмала в хлоропластах).
- Предварительно весят стакан емкостью 1 Л, а затем поместите его на льду перед началом уборки листьев материала.
- Урожай листьев Arabidopsis , избегая почвы (компост). Повторно взвесить стакан и запишите Вес ткани.
Примечание: 400-500 г листьев материала, как ожидается от четырех кастрюли. - Однородный листья в холодной комнате с 2 Л шлифовальных буфера (добавить BSA перед использованием) три раза / 2 s каждый раз, в блендере на высокой скорости.
- Фильтр огневки в холодной комнате, используя 4 слоев муслин и один слой нейлона blutex. Осторожно выжмите огневки листья внутри муслина/нейлон blutex чтобы извлечь все жидкости.
- Восстановите оставшиеся ткани в чашке блендер для второй добычи. Повторите шаги 2.5 и 2.6, используя 2 Л шлифование средних и новые 4-5 слоев муслина (в холодной комнате).
3. очистка сырой хлоропластов, с помощью дифференциального центрифугирования
- Поровну распределить сырой сотовый экстракт в шесть 500 мл бутылки и место бутылки на льду перед центрифугированием. Центрифуги для 2 мин, как только достигается максимальная скорость (2070 x g) (максимальное ускорение и тормоз, 4 ° C).
- Осторожно удалить супернатант.
- Аспирационная оставшиеся супернатанта, с помощью водяного насоса и держать гранулы, содержащие концентрации нефти хлоропласты на льду.
- Нежно ресуспензируйте окатышей, добавив минимальный объем стирки среднего (1 x) (конечный объем комбинированных хлоропласта суспензий = 36 мл) с помощью кисточки или изогнутые пластиковый шпатель. Использование пипетки 10 мл для добавления 3 мл моющего среднего в каждой бутылке.
Примечание: Не используйте пипетки с очень тонкой советы чтобы избежать поломки хлоропластов. Кроме того вырежьте синий наконечник пипетки с лезвием бритвы для создания больших отверстие. - Сбор ресуспензированы хлоропластов в одной из труб с помощью пипетки 10 мл. Осторожно Смешайте, инвертирование трубки для получения однородной подвеска перед погрузкой на Percoll градиенты.
4. Очистка нетронутыми хлоропласты на постоянной Percoll градиент
- Медленно нагрузки 6 мл суспензии хлоропласта на вершине каждого из шести Percoll градиенты с помощью пипетки 10 мл во избежание поломки хлоропластов.
- Центрифуга градиентов для 10 мин на 13,300 x g, 4 ° C, с помощью ротора размахивая ведро.
Примечание: Ускорение должно быть медленным, и должен быть отключен тормоз (тормоза покинуть или медленно замедления) для предотвращения смешивания Percoll градиентов. - Аспирационная Верхний этап, который содержит сломанной хлоропластов и нетронутыми митохондрий, с помощью водяной насос и затем извлечь нетронутыми хлоропластов в нижней фазе (широкая полоса темно зеленый) с 10 мл пипетки. Будьте осторожны, чтобы не аспирационная ядер и ячейки мусор (находится в нижней части трубки) с нетронутыми хлоропласты (рис. 2A).
- Разбавьте 3-4 раза нетронутыми хлоропласта подвеска с Отмывающий буфер (1 x). Центрифуги для 2 мин, как только достигается максимальная скорость (2070 x g, 4 ° C) (максимальное ускорение и тормоз).
- Тщательно удалить супернатант.
- Полностью аспирационная оставшиеся супернатант с водяной насос и держать Пелле концентрированных нетронутыми хлоропласты на льду.
- До лизис хлоропластов Держите Алиготе нетронутыми хлоропласта фракции в приблизительно 1 мл промывки среднего (1 x) для дальнейшего анализа с использованием натрия Додециловый сульфат электрофореза геля полиакриламида (SDS-PAGE) и Западный blotting. Храните небольшой аликвота этих нетронутыми хлоропластов для определения концентрации белка. Сохраните нетронутыми хлоропласта фракция в жидком азоте для дальнейших экспериментов.
5. lysis нетронутыми хлоропластов, используя гипотонический буфер и очистки хлоропласта суб отсеков на разрывные сахарозы градиенты
- Лизируйте очищенный нетронутыми хлоропластов, resuspending гранулы в гипотонический среды, которая содержит ингибиторы протеазы (окончательный объем не должен превышать 12 мл).
Примечание: От этого шага, использование пипетки с тонкой советы (синий советы) возможен, поскольку целостности хлоропластов больше не важно, (дозирование хлоропластов вверх и вниз до тех пор, как гранулы не высокомобильна полностью). Arabidopsis хлоропластов являются очень хрупкими, (по сравнению с хлоропластах гороха, например) и их лизис почти немедленно после инкубации в гипотонический среде. - Медленно нагрузки 3 мл лизированных хлоропластов на вершине каждой предварительно сахарозы градиенты с использованием перистальтического насоса.
- Ультрацентрифуги градиентов для 1 ч при (70 000 x g, 4 ° C). Баланс пары труб с использованием гипотонический средних буфера до центрифугирования.
- Тщательно восстановить растворимые белки стромы, закупорить этапа верхнего градиента (3 мл от каждого градиента) (рис. 2B). Возьмите Алиготе для определения концентрации белка7. Храните стромы в жидком азоте для дальнейших экспериментов.
- Аспирационная этапа оставшиеся верхние каждого градиента до желтой полосой, с помощью водяного насоса.
- Пипетки (примерно 1 мл от каждого градиента) для извлечения желтая полоса (конверт). Бильярд конвертов в одной из труб.
- Удалите оставшиеся стадии каждого градиента до тилакоидов Пелле, с помощью водяного насоса.
6. мытье и концентрации тилакоидов и конверт мембранных систем
- Ресуспензируйте тилакоидов окатышей (сырые окатыши) в минимальный объем (2 mL) мембраны отмывающего буфера (1 x) (с ингибиторами протеазы).
- Разбавить конверт и тилакоидов подвески 3-4 раза в среде стирки мембрана (регулировка громкости по 10 мл) и ультрацентрифугирования за 1 ч при (110 000 x g, 4 ° C). Баланс пары труб с помощью мембраны отмывающего буфера перед центрифугированием.
- Тщательно аспирационная supernatants, с помощью водяного насоса.
- Добавьте примерно 100 мкл мембраны отмывающего буфера (с ингибиторами протеазы) конверт Пелле. Возьмите Алиготе для определения концентрации белка7. Храните очищенную конверт мембраны подготовки в жидком азоте.
- Ресуспензируйте тилакоидов Пелле в 3 мл мембраны отмывающего буфера (с ингибиторами протеазы). Возьмите Алиготе для определения концентрации белка7. Хранить тилакоидной мембраны фракция в жидком азоте.
Результаты
Последовательные шаги процедуры приводит к очищенной хлоропластов и их суб отсеков возобновил на рисунке 2. Percoll градиент (рисунок 2A) позволяет отличить нетронутыми хлоропластов от сломанной хлоропластов и митохондрии (верхней части градиента) или ядер и ячейки мусор (внизу градиент). После разрыва очищенный Percoll органеллы благодаря осмотическим шоком результирующей дроби разделены на градиент сахарозы (рис. 2B). Стромы (растворимые частью хлоропластов) плавает на поверхности сахарозы градиента. Мембрана везикулы света конверт восстанавливаются как дискретные желтая полоса в интерфейсе 0,6/0,93 М сахарозы. Тяжелая тилакоидной мембраны везикулы сосредоточены в нижней части трубки. После восстановления, мытья и концентрации фракций двух мембраны количественно белки и состав всех четырех фракций анализируется на SDS-PAGE (рис. 2 c). Полосы загружаются на основе равных белка (20 мкг каждая очищенная фракция). Зная, что хлоропласты содержат только 1% конверт белков и 50% белков из стромы или Тилакоиды, это, как правило, переоценивают перекрестного загрязнения очищенного конверт препаратов с другими суб отсеков хлоропластов. Однако этот метод позволяет обнаружить мизерных количествах кросс загрязнять конверт фракция белков. Маркеры от каждого отсека (т.е., обильные протеины) очень полезны при оценке загрязнения фракций. Действительно фракций мембрана тилакоида и конверт, как ожидается, содержат очень низкие объемы большие субъединицы Рибулозобисфосфаткарбоксилаза (RBCL), наиболее обильные белка из стромы (50 kDa). Сломанной хлоропластов можно легко отличить от нетронутыми хлоропласта из-за потери этого стромальные белка8. Свет, уборки комплекс белков (LHCP) — 25 кДа обильные тилакоидов компоненты, которые должны едва (менее 3%), загрязнить конверт мембраны9. Наконец, фосфат Триозы фосфат вступают (TPT) является 30-kDa белок, который виден только в очищенной конверт фракции из-за его сильного обогащения (т.е., 50-100 x) в конверт фракции по сравнению с всего хлоропласта экстрактов. Используя метод, описанный здесь, суб отсеков хлоропластов, как правило, плохо кросс загрязненных подтверждено с помощью Западной блот анализ (Рисунок 2D) опираясь на антитела, направленные против известных маркеров всех трех суб отсеков: растворимые ketol кислоты reductoisomerase (Кари) от стромы, конверт хлоропласта медь АТФаза (HMA1) и свет, уборки комплекс белков (LHCP) от тилакоидной мембраны. Перекрестного загрязнения трех суб отсеки могут быть количественно с помощью immunoblotting и масс спектрометрии анализов9. В то время как стромы обычно не загрязнены конверт или тилакоидных фракций, очищенный конверт фракции содержат 3% тилакоидных белков и до 10% белков от стромы. Белки из стромы плохо загрязнить тилакоидной мембраны (менее 1%), но тилакоидов содержат до 3% конверт мембранных белков. Больше, чем иметь решающую роль в выявлении подлинных subplastidial расположение хлоропласта белков, нынешний метод таким образом также ограничивает ошибочным выводам о локализации subplastidial белков, обусловленные крест загрязнений.
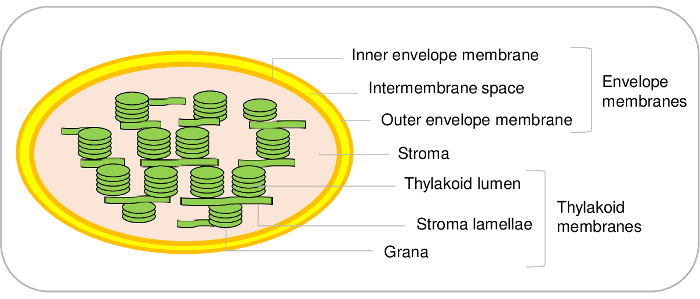
Рисунок 1: представитель схема суб отсеков хлоропласта. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
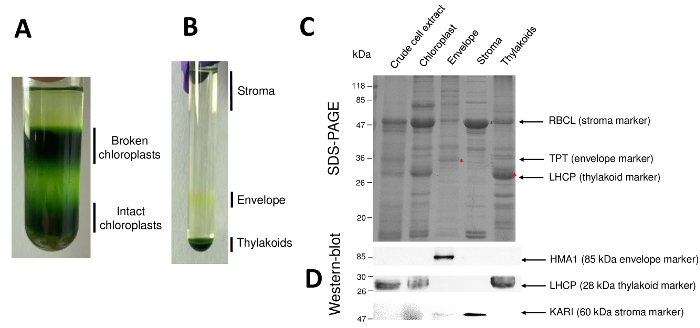
Рисунок 2: Очистка нетронутыми хлоропластов и их три основных югу отсеков с использованием Percoll и сахароза градиентов. A. Percoll градиент позволяет разделение сломанной и нетронутыми хлоропластов. Б. градиент сахарозы, позволяя разделение стромы, конверт и тилакоидных фракций. C. Представитель SDS-PAGE белков от нетронутыми хлоропластов и их три основных суб отсеков, позволяя визуализировать обильные маркеры от каждого суб отсека. Каждый Лейн содержит 10 мкг белков. Маркеры молекулярный вес: RBCL, большой субблок Рибулозобисфосфаткарбоксилаза (маркер для строма); ТПТ, фосфат/Триозы фосфат вступают (маркер для конверта); LHCP, легкая уборка комплекс белков (маркер для тилакоидов). D. Западная помарка эксперименты, позволяющий обнаружить конкретные маркеры (с использованием специфических антител) из каждого суб отсека: хлоропласта конверт меди АТФазы HMA110, свет, уборки сложные белки LHCP от тилакоидов мембраны11и ketol кислоты reductoisomerase Кари из стромы9. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Настоящей статьи направлен на подробно шаг за шагом протокол, используемый для очистки хлоропласты (и их вложенные отсеков) от Arabidopsis thaliana. Поскольку доступность его полного генома почти два десятилетия назад и большие коллекции мутантов вставки доступны для сообщества Arabidopsis теперь широко признается как модель завод. Однако в то время как этот завод был отлично приспособлены для генетических подходов, завод ученых, необходимые для адаптации биохимических и физиологических инструменты для этой новой модели. Протоколы, позволяя таким образом очистить фотосинтетически активные хлоропластов из листьев устоявшихся биохимические модели как шпинат12 или гороха13 пришлось быть адаптированы. Первый метод, описывая очистки Arabidopsis хлоропластов был опубликован в 1998 году14, непосредственно перед выпуском последовательности геном арабидопсиса . Несколько лет спустя, простые методы для изоляции Arabidopsis хлоропластов совместимы с целью анализа в vitro импорта белков в очищенной органеллы исследований были сделаны доступно15,16. Однако эти методы не позволяют сочетать высокий уровень чистоты и сохранение фотосинтетической активности очищенный хлоропластов. Совсем недавно17, быстрый метод был создан, который основывается на использовании Percoll градиенты и позволяет сохранить почти 90% от фотосинтеза измеряется в начальный листья арабидопсиса.
Протокол, описанные здесь позволяет очистить Arabidopsis хлоропласты на превосходном уровне чистоты. Действительно, иммунологические обнаружения загрязнителей из других клеточных компартментов показал, что очищенный органеллы лишены митохондрий и маркеры плазматическую мембрану9,10. Этот протокол был также эффективно очищают хлоропластов от нескольких Arabidopsis экотипов18, как Columbia (Col) или Wassilewskija (WS), то есть, экотипов, которые были использованы для генома или выразили последовательности Теги (ЭБТ) последовательности проекты, но также генерировать T-ДНК вставки мутантов в арабидопсиса. Другими словами когда протеомики исследования должны быть выполнены, настоящий Протокол совместим с этих двух экотипов ссылку от арабидопсиса. Наконец доходность хлоропластов, используя настоящий протокол похож на полученные при запуске из шпината или гороха листья(т.е. 3%, как измерено от содержания хлорофилла в Percoll очищенная хлоропласта по сравнению с общей Хлорофилл сумма в начиная листья). С точки зрения белки урожайность находится недалеко от 50 мг хлоропласта белков, когда органеллы очищаются от 500 g 5-недельных Arabidopsis листьев.
Для достижения такой хороший урожай (и целостности хлоропласта), однако следует обратить особое внимание на несколько шагов при использовании настоящего Протокола. Хлоропластов в проростках Arabidopsis является чрезвычайно хрупкой структурой (это не в случае хлоропластах гороха, например). Чтобы избежать крупномасштабного разрушения органеллы во время очистки таким образом требуется особое внимание. Количество и размер гранул крахмала в хлоропластах имеют решающее значение для подготовки нетронутыми хлоропластов. Действительно хлоропласты, содержащих большие крахмала зерна обычно будет нарушена во время первоначального дифференциального centrifugations шаги стремится сконцентрировать фракций нефти хлоропласта12. Таким образом растения должны храниться на ночь в темной и холодной комнате (4 ° C) до эксперимента, чтобы уменьшить количество крахмала.
Новых пользователей настоящего Протокола может быть соблазн начинать с больших количеств материала листьев (огромные розеток из старых Arabidopsis растений с более крупные листья) пытается повысить восстановление очищенной хлоропластов. Однако, в наших руках начиная от молодых листьев (5-неделю Старый) является наилучший компромисс объединить урожайности, чистоты и целостности очищенный органеллы. Действительно слишком старые листья сильно обогащенный в фенольных соединений, которые были показаны, чтобы иметь негативное воздействие на целостность хлоропласта19.
Наконец первоначальное извлечение шаг (шлифовка ткани) – еще один важный шаг. Процесс наложения должно быть ограничено до нескольких секунд. Как указывалось выше, новых пользователей может возникнуть соблазн использовать больше смешивания, таким образом, ожидая сильно улучшить доходность очищенный органеллы. Однако если больше смешивания эффективно выпускает больше материала из листьев, похоже, что доля сломанной хлоропластов быстро возрастает в экстракте сырой ячейки. Вследствие этого высокий коэффициент сломанной нетронутыми хлоропластов в среде дальнейшие шаги очистки (разделение на подъемах Percoll) сильно пострадавших и доходность очистки неожиданно ниже.
Наличие конкретных протоколов для очистки органеллы позволили серии высокой пропускной способности на основе протеомики эксперименты проводятся на образцах хлоропластов. Эти данные были доступны в нескольких общедоступных баз данных6, обеспечивая для биологов в области точной субцеллюлярные (и subplastidial) локализации для многих белков хлоропластов. Это было особенно актуально для конверт белков, чья личность и местонахождение основном оставалась неизвестной до этих анализов, поскольку конверт мембраны представляют собой незначительные хлоропласта компонент (1-2% белков хлоропластов) играя ключевую роль в хлоропласте метаболизм и биогенеза5,20. Используя протокол, описанный здесь, мы недавно проанализировали состав трех главных хлоропласта отсеков от выращивания арабидопсиса (т.е., стромы, Тилакоиды и конверт мембраны системы)9. На основе полуколичественного протеомики подхода (спектральный подсчета), мы смогли оценить секционирование сотни белков в этих трех отсеков хлоропластов.
Хотя настоящий протокол позволяет очистить три основных отсеков хлоропласта от Arabidopsis, это также можно выделить дополнительные вложенные отсеков в хлоропластов. Действительно конверт мембраны системы состоит из внутренней и внешней оболочки оболочки (рис. 1). Однако в меру наших знаний, метод для того чтобы очистить внутренний и внешний конверт мембраны из хлоропластов Arabidopsis остается должен быть создан. Внутренний и внешний конверт мембраны могут быть очищены от шпината21 или гороха22 хлоропластов. Основное ограничение Arabidopsis главным образом результаты от ограничения количества исходного материала. Начиная с 500 г листьев арабидопсиса (который уже требует 1 м2 поверхности в камере роста) позволяет очищать только 100 мкг конверт белков. С другой стороны это легко начать с 5-10 кг шпинат уходит с рынка, чтобы очистить большое количество хлоропластов8 и покончить с выходом 3 до 10 мг конверт белков из этого материала.
То же самое верно для тилакоидов суб отсеков. Действительно, тилакоидов изготовлены из света мембрана везикулы (ламели) и плотной структуры (Грана) (рис. 1). Различать эти два отделения в проростках Arabidopsis23,24доступны конкретные протоколы. Опять же основываясь на анализе количественных протеомики, мы недавно опись белков, присутствующих в эти два подпункта отсеков24. Эти подходы, а также углубленное исследование литературы, Допускается проверка, или предлагая гипотезы, subplastidial расположение сотен тилакоидных белков. Однако важно отметить, что дополнительные мембраны microdomains присутствуют на изогнутые поля тилакоидов. Эти липопротеинов суб отсеков, или plastoglobules, постоянно соединены тилакоидной мембраны и содержат определенный набор белков25. Используя настоящий Протокол, он таким образом не позволяет отличить эти специфические белки от других компонентов тилакоидов.
Некоторые подлинные (хорошо известных) конверт, строма или тилакоидов компоненты по-прежнему отсутствуют из списка обнаруженных белков. Вместе с целевых биохимические и иммунологические анализы постоянное улучшение чувствительности MS будет иметь большую помощь, чтобы вернуться к хлоропласта содержание к полный репертуар состава его различных суб отсеков.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана совместного PhD стипендии в IB от ИПРА биологии растений и разведения отдела и от Labex GRAL (АНР-10-LABX-49-01). Мы также хотели бы признать НРУ проекта АНР-15-IDEX-02, доктор Olivier Vallon (МКПП Париж) на наличие антител против LHCP и доктор Renaud Дюма (LPCV, Гренобль) для антител против Кари.
Материалы
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
Ссылки
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены