Method Article
הכנת כלורופלסט תאי המשנה של תודרנית לניתוח של חלבון לוקליזציה Immunoblotting או פרוטאומיקס
In This Article
Summary
כאן, אנו מתארים שיטה לטהר מהכלורופלסט ללא פגע מן העלים תודרנית שלהם שלוש הראשי תת התאים (מעטפה, משתית, thylakoids), באמצעות שילוב של centrifugations דיפרנציאלית, מעברי צבע, Percoll רציף, מעברי צבע סוכרוז מקוטע. השיטה היא יקר עבור subplastidial ולוקליזציה subcellular של חלבונים על-ידי immunoblotting פרוטאומיקס.
Abstract
מהכלורופלסט הם המרכיבים העיקריים של תאי צמחים. Plastids כזה למלא פונקציות מכריע רבות כגון הטמעת פחמן, גופרית, חנקן, כמו גם סינתזה של מטבוליטים חיוני. Organelles אלה מורכבות של הבאים שלושה מפתחות המשנה התאים. המעטפה, המאופיינת על ידי שתי ממברנות המקיף את אברון ושולט על התקשורת של פלסטידה עם תאים תאים אחרים. Stroma הוא השלב מסיסים של כלורופלסט, האתר המרכזי שבו פחמן דו-חמצני מומר פחמימות. קרום תילקואיד היא הרשת קרום פנימי המורכב grana (שקי דחוס שטוח) ומניחים lamellae (מבנים צפופים פחות), בו פוטוסינתזה oxygenic לוקח. בפרוטוקול הנוכחי מתאר צעד אחר צעד הליכים הדרושים עבור הטיהור, באמצעות centrifugations דיפרנציאלית ומעברי Percoll, של מהכלורופלסט שלם מתוך תודרניתולאחר fractionation שלהם, באמצעות מעברי צבע סוכרוז, ב-3 תאים תת (קרי, מעטפה, משתית ו thylakoids). פרוטוקול זה גם מתן הוראות כיצד להעריך את הטוהר של השברים האלה באמצעות סמנים משויך התאים כלורופלסט תת השונים. השיטה המתוארת כאן יקר, עבור subplastidial לוקליזציה של חלבונים באמצעות immunoblotting, אלא גם עבור subcellular ו- subplastidial פרוטאומיקס, מחקרים אחרים.
Introduction
מהכלורופלסט הם המרכיבים העיקריים של תאי צמחים. הם שואבים אב קדמון cyanobacterial יש מיתוג של endosymbiosis, בסופו של דבר התפתח כמו אברון במהלך האבולוציה1,2. Organelles כאלה מכילים שלושה ראשי מדורים (איור 1). מערכת מעטפה עשויה הפנימית של וממברנות החיצוני המקיף את אברון. מערכת זו קרום כפול מכיל אנזימים שונים המעורבים במטבוליזם של שומנים, פיגמנטים, והוא בעיקר המוקדש השליטה של התקשורת בין plastids את ציטוזול. הוא מכיל מערכות תחבורה שונים המאפשרים היבוא של חלבונים גרעיניים מקודד ולאחר החלפת יונים ו מטבוליטים בין את ציטוזול של כלורופלסט במטרה לווסת פונקציות מטבוליות חיוניות של הצמח תא3,4 . Stroma, השלב מסיסים כלורופלסט, מכיל אנזימים של מחזור קלווין (CO2 התבוללות), הסינתזה של מטבוליטים שונים כולל חומצות אמינו, ויטמינים של machineries תמלול ותרגום של פלסטידה. קרום תילקואיד היא רשת קרום פנימי נרחב מאורגנות שם מתקיים שלב אור של פוטוסינתזה. ובכך, מהכלורופלסט הם המקום שבו מסלולים מטבוליים חיוניים להתרחש5.
כדי לפענח את מנגנוני הרגולציה חדשים הקובעות את הדינמיקה כלורופלסט, פיזיולוגיה, הגדרת לוקליזציה תת-plastidial של כלורופלסט חלבונים ולכן קריטי כדי לתמוך יישוב מחקרים במטרה להבין טוב יותר את פונקציות חלבונים מודל אורגניזמים6. על מנת לקבל גישה לוקליזציה subplastidial מקורית של חלבונים אלה, ולכן חיוני כדי להתחיל שברים subplastidial מאוד טהור (מעטפה ממברנות stroma, thylakoids). בהקשר זה, מטרת הפרוטוקול הנוכחי היא לטהר מהכלורופלסט ללא פגע מן העלים תודרנית שימוש דיפרנציאלי centrifugations ומעברי Percoll רציף, וכדי fractionate אותם באמצעות מעברי צבע סוכרוז מקוטע, ב-3 תאים תת (קרי, מעטפה, משתית ו thylakoids). השיטה המתוארת כאן גם מספק הוראות כדי להעריך את טוהר מטוהרים שברים תת-אבחון באמצעות סמנים משויך התאים כלורופלסט תת השונים. פרוטוקול זה יקר, עבור subplastidial לוקליזציה של חלבונים באמצעות immunoblotting ועבור ניתוח נוסף של שברים מטוהרים באמצעות ספקטרומטר מסה (MS)-המבוסס על מחקרים פרוטיאומיה מבנית.
Protocol
1. הכנת מאגרי, פתרונות מניות ומילויים הדרגתיים
- להכין הפתרונות המניות הבא ניתן לאחסן 6 חודשים ב 4 º C.
- להכין 1 ליטר של מאגר Tricine (1 מ', pH 8.4) ומאגר Tricine (1 מ', pH 7.6). להתאים את ה-pH על-ידי הוספת קו כדורי.
- להכין 1 ליטר של חומצה ethylenediaminetetraacetic (EDTA, 0.5 M, pH 8) 3-(N-morpholino) פרופן sulfonic חומצה (MOPS) מאגר (1 מ', pH 7.8). להתאים את ה-pH על-ידי הוספת כדורי NaOH.
- להכין 50 מ של MgCl2 (1 מ').
- הכנת 50 מ של פרוטאז מעכבי פתרונות: phenylmethylsulfonyl פלואוריד (PMSF להגדיר באלכוהול איזופרופיל, 100 מ מ), benzamidine הידרוכלוריד הידרוקסיד (100 מ מ), ו- caproic חדוה אמינו חומצה (50 מ מ).
הערה: בעוד PMSF וחומצה caproic אמינו הם יציבים בתמיסה למשך חודשים 4 ° C, benzamidine פתרון צריך להיות מאוחסן ב-20 ° C.
- להכין את הפתרונות הבאים יום לפני הניסוי ולאחסן את כל הפתרונות ב 4 º C.
- להכין 4 ליטרים של שיוף בינונית pH 8.4 המכיל Tricine-קו (20 מ מ, pH 8.4), בסורביטול (0.4 מ'), EDTA (10 מ מ, pH 8) ו- NaHCO3 (10 מ מ). להתאים את ה-pH על-ידי הוספת כדורי NaOH. להוסיף שור אלבומין (BSA) ב- 0.1% (w/v) רק לפני השימוש ומערבבים היטב.
- הכנת 500 מ"ל של כביסה בינוני (2x) pH 7.6 המכיל Tricine-קו (20 מ מ, pH 7.6), בסורביטול (0.8 מ'), MgCl2 (5 מ מ) ו- EDTA (2.5 מ מ). להתאים את ה-pH על-ידי הוספת כדורי NaOH. לדלל את פתרון כזה לאחר הכנה של פתרון הדרגתי Percoll כדי לקבל כביסה בינוני (1 x).
- להכין 200 מ של פתרון הדרגתי Percoll לטיהור כלורופלסט על ידי ערבוב Percoll כביסה בינונית (2x) אמצעי שווה לקבל פתרון סופי ב-50% (v/v) Percoll / 0.4 M בסורביטול.
- היכונו 50 מ של סוכרוז פתרונות כלורופלסט fractionation על ידי ערבוב מגבים (10 מ מ, pH 7.8), MgCl2 (4 מ מ) וריכוזים שונים של סוכרוז (0.3 M, 0.6 מטר ו- 0.93 M).
- הכינו את מעברי צבע הבאות ואת מאגרי לפני הפעלת הניסוי.
- הכן טורפדו 6 של מעברי צבע Percoll (אחד המכיל 30 מ של 50% Percoll / 0.4 M בסורביטול) על ידי צנטריפוגה ב g x 38,700 במשך 55 דקות ב 4 º C. להוריד את הבלם כדי למנוע מיזוג של מעברי הצבע. לאחר צנטריפוגה, לאחסן הצינורות המכילים את מעברי צבע preformed בחדר קר עד השימוש.
- להכין 4 שפופרות של סוכרוז מעברי צבע, עם כל מעבר צבע יצרו של שלוש שכבות סוכרוז הבאים: 3 מ"ל של 0.93 מ', 2.5 מ של 0.6 מטר, 2 מ של 0.3 M סוכרוז. בזהירות כשכבת-על כל שכבה, באמצעות משאבה סחרור שמתחילות באות 0.93 M בתחתית וגימור עם 0.3 M בחלק העליון.
- היכונו 50 מ של מדיום היפוטוניק כלורופלסט פירוק המכיל מגבים (10 מ מ, pH 7.8), MgCl2 (4 מ מ), PMSF (1 מ מ, להגדיר באלכוהול איזופרופיל), benzamidine הידרוכלוריד הידרוקסיד (1 מ מ) ו- caproic חדוה אמינו חומצה (0.5 מ מ). לאחסן את המאגר על הקרח עד השימוש.
- להכין 50 מ של הממברנה שטיפה מאגר המכיל מגבים (10 מ מ, pH 7.8), PMSF (1 מ מ), benzamidine הידרוכלוריד הידרוקסיד (1 מ מ) ו- caproic חדוה אמינו חומצה (0.5 מ מ). לאחסן את המאגר על הקרח עד השימוש.
2. צמיחה קצירת תודרנית עלים
- לצמיחה של תודרנית צמחים, להכין 4 מחבתות פלסטיק גדולים (משטח הכולל של 0.5 עד 1 מ'2) של תודרנית צמחים על ידי זריעה 30 מ"ג של הזרעים במחבת בכל. לגדל צמחים תודרנית למשך 5 שבועות ב 12-h מחזור אור-23 ° C (יום) / 18 ° C (לילה) עם עוצמת האור של 150 μM m s-2 -1.
- דגירה צמחים בחדר חשוך וקר (4 מעלות צלזיוס) למשך הלילה לפני הניסוי (כדי להפחית את כמות עמילן בגרגרים מהכלורופלסט).
- לשקול מראש את גביע 1 ליטר, ואז למקם אותו על הקרח לפני תחילת קציר עלה חומר.
- קציר תודרנית עלים על ידי הימנעות אדמה (קומפוסט). לשקול מחדש את. הספל, רושמות את משקל הרקמה.
הערה: 400 עד 500 גרם של חומר עלה צפויים מ 4 מחבתות. - Homogenize עלים בחדר קר עם 2 ל' של שחיקה מאגר (להוסיף BSA לפני השימוש) שלוש פעמים / 2 s בכל פעם, בבלנדר במהירות גבוהה.
- לסנן את homogenate בחדר קר באמצעות 4 שכבות של המוסלין שכבה אחת של blutex ניילון. סחוט בעדינות את העלים homogenate פנימה blutex המוסלין/ניילון כדי לחלץ את כל הנוזל.
- לשחזר הרקמה הנותרת בגביע בלנדר לחילוץ השני. חזור על שלבים 2.5 ו- 2.6 באמצעות 2 ל' של שחיקה בינוני וחדשים 4-5 שכבות של המוסלין (בחדר קר).
3. טיהור של מהכלורופלסט גולמי באמצעות צנטריפוגה דיפרנציאלית
- באותה מידה להפיץ את תמצית תא גסה לתוך שישה בקבוקי 500 מ"ל ולמקם את הבקבוקים על הקרח לפני צנטריפוגה. צנטריפוגה למשך 2 דקות, ברגע המהירות המרבית (2,070 x g) הינו נגיש (האצה מקסימלית, בלם ב, 4 ° C).
- להתעלם בעדינות את תגובת שיקוע.
- וארוקן את תגובת שיקוע הנותר באמצעות משאבה המים ולשמור את כדורי המכיל מהכלורופלסט גולמי מרוכז על קרח.
- בעדינות resuspend כדורי על-ידי הוספת נפח מינימלי של כביסה בינוני (1 x) (נפח סופי המתלים כלורופלסט משולב = 36 מ"ל) בעזרת מברשת או מרית פלסטיק מעוגל. השתמש pipet 10 מ"ל כדי להוסיף 3 מ"ל של כביסה במדיום כל בקבוק.
הערה: אין להשתמש pipet עם טיפים יפה מאוד כדי למנוע שבירה של מהכלורופלסט. לחלופין, חותכים את קצה כחול pipet עם סכין גילוח כדי ליצור חור גדול יותר. - לאסוף בתורה מהכלורופלסט resuspended בצינור אחד באמצעות pipet של 10 מ"ל. מערבבים בעדינות על-ידי היפוך צינור כדי לקבל השעיה הומוגני לפני העמסה על מעברי צבע Percoll.
4. טיהור של מהכלורופלסט שלם על רציף הדרגתי Percoll
- לאט לאט לטעון 6 מ של המתלה כלורופלסט על גבי כל אחת Percoll שישה מעברי צבע באמצעות pipet 10 מ"ל כדי למנוע שבירה של מהכלורופלסט.
- Centrifuge מעברי הצבע 10 דקות ב ומכרה כ-13,300 x g, 4 ° C באמצעות רוטור מתנדנד-דלי.
הערה: ההאצה צריך להיות איטי, צריך לנתק את הבלם (בלם את או ההאטה איטי) כדי למנוע מיזוג של מעברי הצבע Percoll. - תשאף השלב העליון המכילה מהכלורופלסט שבור של המיטוכונדריה שלם באמצעות משאבה מים ולאחר מכן מאחזרים נוכח התחתון ללא פגע מהכלורופלסט תלת פאזי (פס ירוק כהה רחבה) עם pipet 10 מ"ל. יש להיזהר לא תשאף גרעינים ופסולת תאים (נמצא בחלק התחתון של הצינור) עם בתורה מהכלורופלסט שלם (איור 2 א).
- לדלל 3-4-מקפלים המתלים כלורופלסט שלם עם מאגר כביסה (1 x). צנטריפוגה למשך 2 דקות, ברגע המהירות המרבית (2,070 x g, 4 ° C) הינו נגיש (האצה מקסימלית, בלם ב).
- בזהירות למחוק את תגובת שיקוע.
- לגמרי מחוק לגמרי את תגובת שיקוע הנותרים עם משאבה מים ולשמור את גלולה מרוכזת מהכלורופלסט שלם על קרח.
- לפני פירוק כלורופלסט, לשמור על aliquot של כלורופלסט שלם שבר כ 1 מ"ל של כביסה בינוני (1 x) עבור ניתוחים נוספים באמצעות סודיום dodecyl סולפט לזיהוי בג'ל (מרחביות-עמוד) סופג המערבי. שמור קטן aliquot של אלה מהכלורופלסט שלם עבור קביעת ריכוז חלבון. אחסן את השבר כלורופלסט שלם חנקן נוזלי לניסויים נוספים.
5. פירוק של מהכלורופלסט שלם באמצעות מאגר היפוטוניק טיהור של תאים תת כלורופלסט על מעברי צבע סוכרוז מקוטע
- Lyse בתורה מהכלורופלסט מטוהרים ללא פגע על ידי resuspending בגדר בינוני היפוטוניק המכיל מעכבי פרוטאז (האחסון הסופי לא יעלה על 12 מ ל).
הערה: של שלב זה, השימוש pipet עם טיפים בסדר (טיפים כחול) אפשרי מאז intactness של מהכלורופלסט חיונית יותר (pipetting מהכלורופלסט למעלה ולמטה כל עוד גלולה לא resuspended לגמרי). תודרנית מהכלורופלסט הם מאוד שבירים (בהשוואה מהכלורופלסט אפונה, לדוגמה), והוא פירוק שלהם כמעט מיידית לאחר דגירה בינוני היפוטוניק. - לאט לאט לטעון 3 מ"ל של בתורה מהכלורופלסט lysed בראש כל מעברי צבע preformed סוכרוז באמצעות משאבה סחרור.
- Ultracentrifuge מעברי הצבע עבור h 1 (g 70,000 x, 4 ° C). לאזן זוגות של צינורות באמצעות מאגר בינוני היפוטוניק לפני צנטריפוגה.
- בזהירות לשחזר את החלבונים סטרומה מסיסים על-ידי pipetting השלב העליון של מעבר הצבע (3 מ"ל של מעבר הצבע) (איור 2B). קח את aliquot עבור קביעת ריכוז חלבון7. לאחסן stroma חנקן נוזלי לניסויים נוספים.
- האחות השלב העליון הנותרים של מעבר הצבע עד הלהקה צהוב באמצעות משאבה מים.
- אחזר את הלהקה צהוב (המעטפה) עם pipet (כ 1 מ"ל של מעבר הצבע). בריכת המעטפות שפופרת אחת.
- הסר את השלב הנותרים של מעבר הצבע עד בגדר תילקואיד באמצעות משאבה מים.
6. כביסה וריכוז תילקואיד ומערכות ממברנות מעטפה
- Resuspend את תילקואיד פתיתים ירוק באמצעי אחסון מינימלי (2 מ ל) של קרום שטיפה מאגר (1 x) (עם מעכבי פרוטאז).
- לדלל את המתלים המעטפה ואת תילקואיד 3-4-קיפול במדיום כביסה ממברנה (להתאים את עוצמת הקול כדי 10 מ ל) ו- ultracentrifuge עבור 1 h (110,000 x g, 4 ° C). לאזן זוגות של צינורות באמצעות ממברנה שטיפה מאגר לפני צנטריפוגה.
- בזהירות וארוקן את supernatants באמצעות משאבה מים.
- להוסיף כ- 100 µL של הממברנה שטיפה מאגר (עם מעכבי פרוטאז) כדי בגדר מעטפה. קח את aliquot עבור קביעת ריכוז חלבון7. לאחסן ההכנה ממברנה המעטפה מטוהרים חנקן נוזלי.
- Resuspend thylakoids צנפה ב- 3 מ"ל של הממברנה שטיפה מאגר (עם מעכבי פרוטאז). קח את aliquot עבור קביעת ריכוז חלבון7. לאחסן תילקואיד ממברנה שבר חנקן נוזלי.
תוצאות
שלבים רצופים של ההליך וכתוצאה מכך כלורופלסט מטוהרים תאי המשנה שלהם הם חידש באיור2. מעבר הצבע Percoll (איור 2 א) מאפשר הבחנה מהכלורופלסט שלם של כלורופלסט שבור והמיטוכונדריה (למעלה של המילוי ההדרגתי) או גרעינים שאריות תאים (בחלק התחתון של מעבר הצבע). לאחר שבר organelles Percoll-טיהור הודות מכת אוסמוטי, שברים וכתוצאה מכך מופרדים על מעבר הדרגתי סוכרוז (איור 2B). Stroma (מסיס חלק כלורופלסט) צף על פני השטח של מעבר הצבע סוכרוז. מעטפה אור קרום שלפוחית התאוששו כלהקה צהוב דיסקרטית-הממשק 0.6/0.93 M סוכרוז. השלפוחיות המוגלתיות ממברנות תילקואיד הכבד מרוכזים בחלק התחתון של הצינור. לאחר השחזור, כביסה, ריכוז של קרום שני השברים, חלבונים הם לכמת ומנותח ההרכב של כל ארבעה שברים בעמוד מרחביות-(איור 2C). המסלולים נטענים על בסיס חלבון שווה (20 µg של כל שבר מטוהרים). בידיעה כי מהכלורופלסט מכילים רק 1% של המעטפה חלבונים ו- 50% של חלבונים stroma, או את thylakoids, זה נוטה בהערכת יכולתו של זיהום צולב של המעטפה מטוהרים ההכנות עם תאים משנה אחרים כלורופלסט. עם זאת, שיטה זו מאפשרת לזהות כמויות זעירות של חלבונים קרוס-מזהם השבר מעטפה. סמנים של כל תא (קרי, שופע חלבונים) הם מאוד מועיל בהערכת זיהום צולב של השברים. אכן, שברים ממברנה תילקואיד ומעטפה צפויים מכילים כמויות נמוכות מאוד של יחידת משנה גדולה של RuBisCO (RBCL), החלבון הנפוץ ביותר מ stroma (50 kDa). מהכלורופלסט שבור יכול בקלות להבחין בין כלורופלסט שלם בשל האובדן של זה חלבון סטרומה8. האור קציר חלבונים מורכבים (LHCP) הם רכיבים תילקואיד שופע 25-kDa צריך בקושי (פחות מ- 3%) לזהם את המעטפה ממברנות9. לבסוף, translocator פוספט-triose-פוספט (TPT) הוא חלבון 30-kDa מוצגת רק בהשבר המעטפה מטוהרים בשל את העשרת חזקה (קרי, 50 ל- 100 x) בהשבר המעטפה בהשוואה כלורופלסט כל תמציות. באמצעות השיטה המתוארת כאן, תאים תת כלורופלסט בדרך כלל גרוע הצלב-מזוהמים כמו אושרו תוך שימוש מערבי-כתם ניתוחים (איור דו-ממדי) בהסתמך על נוגדנים נגד סמנים הידוע של כל שלושת התאים תת: מסיסים ketol בחומצה reductoisomerase (קארי) מ stroma, המעטפה כלורופלסט נחושת ATPase (HMA1), ואת אור קציר חלבונים מורכבים (LHCP) של הממברנות תילקואיד. זיהום צולב של התאים משנה 3 ניתן לכמת באמצעות immunoblotting והן מסה ספקטרומטר ניתוחים9. בעוד stroma בדרך כלל לא מזוהם על ידי שברים מעטפה או תילקואיד, שברים המעטפה מטוהרים מכילים 3% של חלבונים תילקואיד ו עד 10% של חלבונים מן stroma. מהחלבונים stroma לקוי לזהם את הקרומים תילקואיד (פחות מ 1%) אבל thylakoids להכיל עד 3% של המעטפה קרום חלבונים. יותר ממה שיש תפקיד מכריע בזיהוי המיקום subplastidial מקורית של כלורופלסט חלבונים, השיטה הנוכחית ובכך מגביל גם מסקנות שגויות לגבי subplastidial לוקליזציה של חלבונים הנובע לחצות מציג.
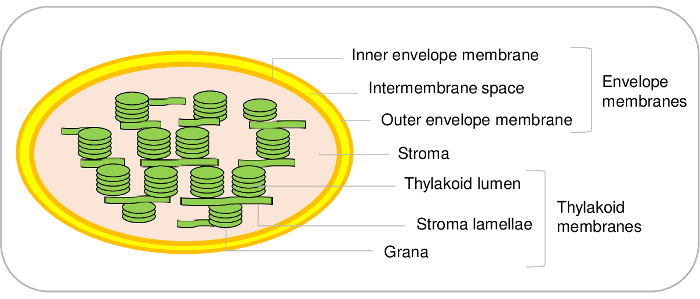
איור 1: ערכת נציג של תאים תת כלורופלסט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
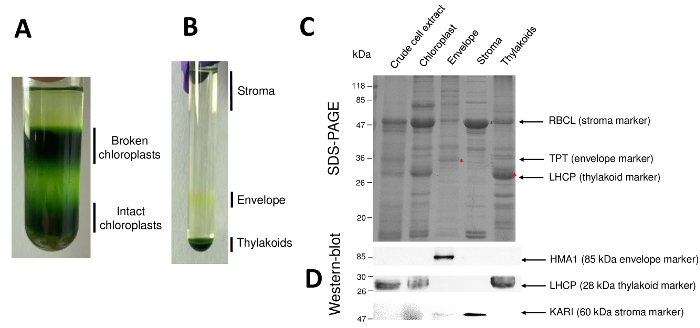
איור 2: טיהור של מהכלורופלסט ללא פגע, המרכזית שלוש תת compartments באמצעות מעברי צבע Percoll וסוכרוז. א Percoll הדרגתי המאפשר הפרדת מהכלורופלסט שבור ללא פגע. B. סוכרוז הדרגתי המאפשר הפרדת stroma, מעטפה, תילקואיד שברים. ג. נציג מרחביות-דף של חלבונים מהכלורופלסט ללא פגע, את התאים שלושה תת העיקרי המאפשר להמחיש סמני בשפע של כל תא משנה. כל ליין מכיל 10 µg של חלבונים. משקל מולקולרי סמנים: RBCL, יחידת משנה גדולה של RuBisCO (סמן stroma); TPT, פוספט/triose-פוספט translocator (סמן המעטפה); . LHCP, אור קציר חלבונים מורכבים (סמן תילקואיד). D. ניסויים המערבי-כתם המאפשר לזהות סמנים ספציפי (באמצעות נוגדנים ספציפיים) של כל תא משנה: כלורופלסט מעטפת נחושת ATPase HMA110, האור קציר המורכב מהחלבונים LHCP תילקואיד ממברנות11, ו- reductoisomerase ketol בחומצה של קארי משתית9. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
המאמר הנוכחי שואפת פירוט פרוטוקול צעד אחר צעד שמשמש לטהר מהכלורופלסט (וגם את התאים משנה) של תודרנית לבנה. מאז הזמינות של רצף הגנום המלא שלו כמעט שני עשורים, ואת אוספים גדולים של מוטציות הכניסה לרשות הקהילה, תודרנית עכשיו מקובל כמו צמח מודל. עם זאת, בעוד הצמח הזה היה מותאם בצורה מושלמת עבור גישות גנטיות, צמח המדענים צריך להתאים כלים הביוכימי פיזיולוגיים למודל זה המתעוררים. פרוטוקולים ומאפשר לטהר מהכלורופלסט photosynthetically הפעיל מן העלים ומבוססת הביוכימי דגמים כמו תרד12 או אפונה13 וכך היה צריך להיות מותאם. השיטה הראשונה המתארת טיהור של תודרנית מהכלורופלסט פורסם ב 199814, לפני שחרורו של רצף הגנום תודרנית . מספר שנים מאוחר יותר, פשוט שיטות לבידוד תודרנית מהכלורופלסט התואמים מחקרים במטרה לנתח במבחנה ייבוא של חלבונים ב- organelles מטוהרים נעשו זמינים15,16. עם זאת, שיטות אלה לא איפשרה לשלב בין רמה גבוהה של טוהר ושימור הפעילות פוטוסינתטיים של בתורה מהכלורופלסט מטוהרים. לאחרונה17, שיטה מהירה הוקמה, אשר נסמכת על השימוש של מעברי צבע Percoll, ומאפשר לשמור כמעט 90% של קצב פוטוסינתזה נמדד העלים ההתחלתי של תודרנית.
הפרוטוקול המתואר כאן מאפשר לטהר תודרנית מהכלורופלסט ברמה מעולה של טוהר. אכן, זיהוי אימונולוגי של מזהמים של תאים תאים אחרים הדגימו כי organelles מטוהרת הם חסרי מיטוכונדריאלי קרום פלזמה סמני9,10. פרוטוקול זה גם היה יעיל לטהר מהכלורופלסט של מספר תודרנית ecotypes18, כמו קולומביה (Col) או Wassilewskija (WS), קרי, ecotypes משמש הגנום או הביע רצף תגיות (ESTs) רצף פרויקטים אבל גם, כדי ליצור ב- T-DNA ההכנסה מוטציות ב תודרנית. במילים אחרות, כאשר מחקרים פרוטאומיקס חייב להתבצע, פרוטוקול הנוכחי הוא תואם ecotypes התייחסות שני אלה של תודרנית. לבסוף, התשואה של מהכלורופלסט משתמש בפרוטוקול הנוכחי הוא דומה לזה המתקבל כאשר החל מעלי תרד או אפונה (קרי, 3%, כפי שנמדד מן התוכן כלורופיל כלורופלסט מטוהר Percoll בהשוואה לסה כלורופיל הסכום הנוכחי החל עלים). במונחים של חלבונים, התשואה קרובה 50 מ"ג של כלורופלסט חלבונים, כאשר organelles וגופם מטוהר מ 500 גרם של בת שבוע 5 תודרנית עלים.
כדי להגיע כזה של תשואה טובה (ותקינות כלורופלסט), אחד עם זאת צריך לשים לב מיוחד במספר שלבים בעת שימוש בפרוטוקול הנוכחי. כלורופלסט ב תודרנית הוא מבנה רגישים במיוחד (זהו לא המקרה מהכלורופלסט אפונה, לדוגמה). תשומת לב מסוימת ולכן נדרשת כדי למנוע קרע בקנה מידה גדול של organelles במהלך טיהור. המספר והגודל של גרגרי עמילן נוכח מהכלורופלסט הם קריטיים עבור הכנת מהכלורופלסט ללא פגע. אכן, מהכלורופלסט המכיל עמילן גדול תבואה בדרך כלל יהיה שבור במהלך השלבים centrifugations מבדלת הראשונית שמטרתה להתרכז כלורופלסט גולמי שברים12. לכן, הצמחים יש לשמור לילה בחדר חשוך וקר (4 ° C) לפני הניסוי, כדי להפחית את כמות עמילן.
משתמשים חדשים של הפרוטוקול הנוכחי יכול להיות מפתה כדי להתחיל כמויות גדולות יותר של החומר העלה (ענק רוזטות מצמחים תודרנית הישן עם עלים גדולים) מנסה לשפר את ההתאוששות של מהכלורופלסט מטוהרים. עם זאת, בידיים שלנו, החל מעלים צעירים (5-בת שבוע) הוא הפשרה הטובה ביותר לשלב בין התשואה, טוהר, שלמות organelles מטוהרים. אכן, עלים זקנים מדי מאוד מועשרים תרכובות בעל תאים פנוליים כי הוצגו יש השפעה שלילית על תקינות כלורופלסט19.
לבסוף, השלב הראשוני החילוץ (שחיקה של הרקמה) היא עוד צעד קריטי. תהליך המיזוג חייב להיות מוגבל כמה שניות. כאמור לעיל, משתמשים חדשים עלול להתפתות להשתמש מיזוג יותר, ובכך מצפה מאוד לשפר את התשואה של organelles מטוהרים. עם זאת, אם המיזוג יותר ביעילות משחרר עוד חומר של עלים, נראה כי שיעור מהכלורופלסט שבור במהירות מגביר תמצית תא גולמי. בשל זה יחס גבוה של שבור כדי מהכלורופלסט שלם בטווח הבינוני, עוד צעדים טיהור (ההפרדה על מעברי צבע Percoll) בחום מושפע, התשואה של הטיהור הוא נמוך באופן בלתי צפוי.
הזמינות של פרוטוקולים ספציפיים לטהר organelles אפשרו סדרה של תפוקה גבוהה מבוסס פרוטאומיקס ניסויים להתנהל על דגימות כלורופלסט. נתונים אלה נעשו זמינים ב מספר מסדי נתונים ציבוריים6, ובכך לספק ביולוגים בשדה לוקליזציה subcellular (וגם subplastidial) מדויק של חלבונים כלורופלסט רבים. זה היה נכון במיוחד עבור המעטפה חלבונים אשר זהותו, מיקום נותרה בעיקר ידוע לפני ניתוחים אלה, מאז המעטפה ממברנות מהוות רכיב כלורופלסט מינור (1-2% מכלל החלבונים כלורופלסט) בעת ששיחק תפקיד מפתח כלורופלסט חילוף החומרים, להן5,20. באמצעות פרוטוקול המתואר כאן, ניתחנו לאחרונה את ההרכב של התאים העיקריים כלורופלסט שלושה מן תודרנית (קרי, stroma, את thylakoids, ועל מערכת קרום מעטפה)9. בהתבסס על גישה פרוטאומיקס הכמותיים למחצה (ספירת ספקטרלי), היינו יכולים להעריך חלוקת מאות חלבונים בקרונות כלורופלסט שלושה אלה.
בעוד בפרוטוקול הנוכחי מאפשר לטהר את שלושה תאי העיקרי כלורופלסט מ תודרנית, זה גם ניתן להבחין בתאים תת נוספים כלורופלסט. ואכן, מערכת קרום המעטפה מורכב הפנימי, את הקרומים המעטפה החיצונית (איור 1). עם זאת, לפי מיטב ידיעתנו, שיטה לטהר את המעטפה הפנימית והחיצונית ממברנות של תודרנית מהכלורופלסט נשאר שתוקם. המעטפה הפנימית והחיצונית ממברנות יכול להיטהר מן מהכלורופלסט22 21 או אפונה תרד. המגבלה העיקרית של תודרנית נובעת בעיקר הגבלת כמויות החל חומר. החל מ- 500 גרם של תודרנית עלים (אשר כבר מחייב 1 מ' משטח2 בחדר צמיחה) מאפשר טיהור µg רק 100 של המעטפה חלבונים. מצד שני, קל להתחיל עם 5-10 ק ג תרד עלים מן השוק, לטהר את כמות גדולה של מהכלורופלסט8 , עם תשואה של 3-10 מ ג של המעטפה חלבונים מן החומר הזה.
אותו הדבר נכון עבור תאים תת תילקואיד. אכן, thylakoids עשויים אור קרום שלפוחית (lamellae) ומבנים צפוף (grana) (איור 1). פרוטוקולים ספציפיים זמינים להבחין בין אלה שני תאים תודרנית23,24. שוב, על סמך ניתוח כמותי פרוטאומיקס, אנחנו לאחרונה מטופלים החלבונים המצויים אלה שני תאים משנה24. גישות אלה, יחד עם חקירה מעמיקה של הספרות, מותר אימות, או מציע היפותזה עבור, המיקום subplastidial של מאות תילקואיד חלבונים. עם זאת, חשוב לציין כי microdomains ממברנה נוספים נמצאים בשולי מעוקל thylakoids. אלה תאים תת ליפופרוטאין, או plastoglobules, הם ביחד לצמיתות לממברנות תילקואיד ומכילים קבוצה ספציפית של חלבונים25. משתמש בפרוטוקול הנוכחי, ולכן בלתי אפשרי להבחין חלבונים ספציפיים אלה לבין רכיבים אחרים תילקואיד.
מקורית (ידוע) המעטפה, משתית או תילקואיד רכיבים מסוימים חסרים עדיין מתוך הרשימות של חלבונים שזוהו. יחד עם ניתוחים הביוכימי ו יישוב, שיפור מתמיד של MS רגישות יהיה לעזר רב לבקר את התוכן כלורופלסט לכיוון רפרטואר שלם של ההרכב של תאים תת השונים שלה.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מלגת הדוקטורט משותפת כדי ליברות ביולוגית הצמח INRA וחילוק הרבייה ומן את GRAL Labex (ANR-10-LABX-49-01). אנחנו רוצים גם להכיר את הפרוייקט ANR ANR-15-IDEX-02, ד ר אוליבייה ואלון (IBPC פריז) עבור נוגדנים נגד LHCP, ד ר רנוד דיומא (LPCV, גרנובל) עבור נוגדנים נגד של קארי.
Materials
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
References
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved