Method Article
Preparação de cloroplasto sub compartimentos de Arabidopsis para a análise da localização da proteína pelo Immunoblotting ou Proteomics
Neste Artigo
Resumo
Aqui, descrevemos um método para purificar cloroplastos intactos de Arabidopsis folhas e seus três principais compartimentos sub (envelope, estroma e contém), usando uma combinação de centrifugações diferenciais, contínuo de Percoll, e gradientes de sacarose descontínuo. O método é valioso para subplastidial e Localização subcellular das proteínas por immunoblotting e proteômica.
Resumo
Cloroplastos são principais componentes das células vegetais. Tais plastídeos cumprem muitas funções cruciais, tais como a assimilação de carbono, enxofre e nitrogênio, bem como a síntese de metabólitos essenciais. Estas organelas consistem dos seguintes três compartimentos sub chaves. O envelope, caracterizado por duas membranas, rodeia a organela e controla a comunicação do plastídeo com outros compartimentos da célula. O estroma é a fase solúvel do cloroplasto e o site principal, onde o dióxido de carbono é convertido em hidratos de carbono. A membrana tilacoides é a rede de membrana interna consistindo de grana (ZCE compactado plana) e lamelas (estruturas menos densas), onde a fotossíntese oxygenic toma lugar. O presente protocolo descreve passo a passo os procedimentos necessários para a purificação, usando centrifugações diferenciais e Percoll, dos cloroplastos intactos de Arabidopsise seu fracionamento, usando gradientes de sacarose, em três compartimentos de sub (ou seja, envelope, estroma e contém). Este protocolo também fornece instruções sobre como avaliar a pureza destas frações usando marcadores associados a vários compartimentos sub do cloroplasto. O método descrito aqui é valioso para a localização de subplastidial de proteínas usando immunoblotting, mas também para subcellular e subplastidial proteomics e outros estudos.
Introdução
Cloroplastos são principais componentes das células vegetais. Eles derivam de um ancestral de cianobactérias que tem sofrido uma endossimbiose e eventualmente evoluiu como uma organela durante a evolução de1,2. Tais organelas contêm três compartimentos principais (Figura 1). O sistema de envelope é feito de um interior e um exterior membranas que cercam a organela. Este sistema de membrana dupla contém várias enzimas envolvidas no metabolismo de lipídios e pigmentos e na maior parte é dedicado ao controle da comunicação entre os plastídeos e citoplasma. Ele contém vários sistemas de transporte que permitem a importação de proteínas nucleares codificado e a troca de íons e metabólitos entre o citosol e o cloroplasto, portanto, regular as funções metabólicas essenciais da planta célula3,4 . O estroma, a fase solúvel do cloroplasto, contém enzimas do ciclo de Calvin (assimilação de CO2 ), a síntese de vários metabólitos, incluindo aminoácidos e vitaminas e os mecanismos de transcrição e tradução do plastídeo. A membrana tilacoides é uma rede de membrana interna amplamente organizada onde ocorre a fase luminosa da fotossíntese. Desse modo, os cloroplastos são o lugar onde vias metabólicas essenciais ocorrem5.
A fim de decifrar os novos mecanismos reguladores que controlam a dinâmica do cloroplasto e fisiologia, definindo a localização sub-plastidial das proteínas cloroplasto, portanto, é fundamental para apoiar estudos direcionados, com o objetivo de entender melhor as funções de proteínas em organismos de modelo6. Para obter acesso para a localização de subplastidial genuíno destas proteínas, assim, é essencial para iniciar a partir de frações de subplastidial altamente puro (membranas de envelope, estroma e contém). Neste contexto, o objectivo do presente protocolo é para purificar os cloroplastos intactos de Arabidopsis folhas usando diferenciais centrifugações e contínua de Percoll e fractionate-los usando gradientes descontínuos de sacarose, em três compartimentos de sub (ou seja, envelope, estroma e contém). O método descrito aqui também fornece instruções para avaliar a pureza das frações de sub-organellar purificadas usando marcadores associados a vários compartimentos sub do cloroplasto. Este protocolo é valioso para a localização de subplastidial de proteínas usando immunoblotting e para posterior análise de frações purificadas utilizando espectrometria de massa (MS)-com base em estudos de proteômica.
Protocolo
1. preparação de Buffers, soluções estoque e gradientes
- Preparar as seguintes soluções de ações que podem ser armazenadas a 6 meses a 4 ° C.
- Prepare 1 L de buffers de Tricine (1 M, pH 8.4) e Tricine (1 M, pH 7,6). Ajuste o pH pela adição de KOH Pelotas.
- Prepare 1 L de ácido etilenodiaminotetracético (pH de EDTA, 0,5 M, 8) e 3-(N-morpholino) tampão de ácido sulfônico (MOPS) propano (1 M, pH 7,8). Ajuste o pH adicionando NaOH Pelotas.
- Prepare 50 mL de MgCl2 (1 M).
- Preparar 50 mL de protease inibidores soluções: fluoreto de phenylmethylsulfonyl (PMSF criada em isopropanol, 100 mM), hidrato de cloridrato de benzamidina (100mm) e ε-amino ácido caproico (50 mM).
Nota: Enquanto PMSF e amino ácido caproico são estáveis em solução por meses a 4 ° C, Benzamidina solução deve ser armazenada a-20 ° C.
- Preparar as seguintes soluções no dia anterior o experimento e armazenar todas as soluções a 4 ° C.
- Preparar 4 L de moagem média pH 8,4 contendo Tricine-KOH (20 mM, pH 8,4), sorbitol (0,4 M), EDTA (10 mM, pH 8) e NaHCO3 (10 mM). Ajuste o pH adicionando NaOH Pelotas. Adicionar albumina de soro bovino (BSA) em 0,1% (p/v) imediatamente antes da utilização e misture bem.
- Preparar 500 mL de lavar o pH do meio (2x) 7,6 contendo Tricine-KOH (20 mM, pH 7,6), sorbitol (0,8 M), MgCl2 (5 mM) e EDTA (2,5 mM). Ajuste o pH adicionando NaOH Pelotas. Dilua a solução deste tipo após a preparação da solução de gradiente de Percoll para obter o meio de lavagem (1x).
- Preparar 200 mL de solução de gradiente de Percoll para purificação de cloroplasto misturando Percoll com lavagem meio (2x) em um volume igual de obter uma solução final em 50% (v/v) Percoll / 0,4 M sorbitol.
- Prepare-se 50 mL de soluções de sacarose para fracionamento de cloroplasto através da mistura de diferentes concentrações de sacarose (0,3 M, 0,6 M e M 0,93), MgCl2 (4 mM) e MOPS (10 mM, pH 7,8).
- Prepare a seguir gradientes e buffers antes de iniciar o experimento.
- Prepare-se seis tubos de Percoll (cada um contendo 30 mL de um 50% Percoll / 0,4 M sorbitol) por centrifugação a 38.700 x g, durante 55 min a 4 ° C. Tira o freio para evitar a mistura dos gradientes. Após a centrifugação, armazene os tubos contendo os gradientes pré-formados em uma sala fria até o uso.
- Prepare-se quatro tubos de gradientes de sacarose, com cada gradiente formado por três camadas de sacarose seguintes: 3 mL de 0,93 M, 2,5 mL de 0,6 M e 2 mL de 0,3 M de sacarose. Cuidadosamente sobreposição de cada camada, usando uma bomba peristáltica, começando com 0,93 M na parte inferior e acabamento com 0,3 M no topo.
- Prepare 50 mL do meio hipotónico para lise de cloroplastos contendo MOPS (10 mM, pH 7,8), MgCl2 (4 mM), PMSF (1 mM, criado em isopropanol), hidrato de cloridrato de benzamidina (1 mM) e ε-amino ácido caproico (0,5 mM). Armazene o buffer no gelo até o uso.
- Prepare 50 mL de membrana lavando o buffer que contém o MOPS (10 mM, pH 7,8), PMSF (1 mM), hidrato de cloridrato de benzamidina (1 mM) e ε-amino ácido caproico (0,5 mM). Armazene o buffer no gelo até o uso.
2. crescimento e colheita das folhas de Arabidopsis
- Para o crescimento de plantas de Arabidopsis , prepare 4 bandejas de plástico grandes (para uma superfície total de 0,5 a 1 m2) de Arabidopsis plantas por sementeira 30 mg de sementes em cada panela. Cultivar plantas de Arabidopsis por 5 semanas no ciclo de luz de 12-h a 23 ° C (dia) / 18 ° C (noite) com uma intensidade de luz de 150 μM m-2 s-1.
- Incube as plantas em um quarto escuro e frio (4 ° C) durante a noite antes do experimento (para reduzir a quantidade de grânulos de amido nos cloroplastos).
- Pre-pesar num copo de 1 L e coloque-o no gelo antes de começar a colheita de material da folha.
- Colha folhas de Arabidopsis , evitando solo (adubo). Re-pesar o béquer e registar o peso do tecido.
Nota: 400 a 500 g de material da folha são esperados de quatro panelas. - Homogeneizar as folhas em uma sala fria com 2 L de tampão de moagem (adicionar BSA antes do uso) três vezes / 2 s de cada vez, em um liquidificador em alta velocidade.
- Filtre o homogeneizado em uma sala fria, usando uma camada de nylon blutex e 4 camadas de musselina. Esprema suavemente as folhas homogenate dentro a blutex de musselina (nylon) para extrair todo o líquido.
- Recupere o tecido restante no copo liquidificador para uma segunda extração. Repita as etapas de 2.5 e 2.6 usando 2 L de moagem médio e novo 4-5 camadas de musselina (em uma sala fria).
3. purificação dos cloroplastos brutos usando centrifugação diferencial
- Igualmente, distribuir o extrato bruto de celular em seis garrafas de 500 mL e coloque as garrafas no gelo antes de centrifugação. Centrífuga para 2 min, assim como a velocidade máxima (2.070 x g) for atingida (máxima aceleração e freio, no 4 ° C).
- Delicadamente, desprezar o sobrenadante.
- Aspire o sobrenadante restante usando uma bomba de água e manter os pellets contendo cloroplastos brutos concentrados no gelo.
- Resuspenda suavemente pelotas adicionando um volume mínimo de meio de lavagem (1x) (volume final de suspensões do cloroplasto combinada = 36 mL) usando um pincel ou uma espátula de plástico curvada. Use uma pipeta de 10 mL, adicionar 3 mL de meio em cada frasco de lavagem.
Nota: Não use pipeta com pontas muito finas para evitar a ruptura dos cloroplastos. Alternativamente, corte a ponta azul de uma pipeta com uma lâmina de barbear para gerar um furo maior. - Colete os cloroplastos ressuspensão em um tubo usando uma pipeta de 10 mL. Misture suavemente por inversão do tubo para obter uma suspensão homogênea antes do carregamento de Percoll.
4. purificação dos cloroplastos intactos em gradiente de Percoll contínua
- Lentamente carrega 6 mL de suspensão de cloroplasto em cima de cada um dos seis Percoll gradientes usando uma pipeta de 10 mL para evitar a ruptura dos cloroplastos.
- Centrifugue os gradientes por 10 min a 13.300 x g, 4 ° C, utilizando um rotor balançando-balde.
Nota: A aceleração deve ser lenta, e deve ser desligado o freio (freio fora ou desaceleração lenta) para evitar a mistura da de Percoll. - Aspire a fase superior que contém quebrados cloroplastos e mitocôndrias intactas, usando uma bomba de água e então recuperar intactos cloroplastos presentes na parte inferior com uma pipeta de 10 mL de fase (a banda larga de verde-escuro). Tenha cuidado para não aspirar núcleos e fragmentos de células (encontrado na parte inferior do tubo) com os cloroplastos intactos (Figura 2A).
- Dilua 3-4-fold a suspensão de cloroplastos intactos com tampão de lavagem (1x). Centrífuga para 2 min, logo que a velocidade máxima (2.070 x g, 4 ° C) é atingida (máxima aceleração e freio na).
- Cuidadosamente, desprezar o sobrenadante.
- Completamente, aspirar o sobrenadante restante com uma bomba de água e manter o sedimento de concentrado cloroplastos intactos no gelo.
- Antes do lysis do cloroplasto, manter uma alíquota da fração intacta do cloroplasto em cerca de 1 mL de meio (1x) para análises mais adicionais usando a eletroforese em gel de poliacrilamida sulfato dodecyl de sódio (SDS-PAGE) e mancha ocidental de lavagem. Manter uma pequena alíquota desses cloroplastos intactos para determinação da concentração da proteína. Armazene a fração de cloroplasto intacta em nitrogênio líquido para novas experiências.
5. lise dos cloroplastos intactos usando um Buffer hipotônica e purificação de sub compartimentos cloroplasto em gradientes de sacarose descontínuos
- Lise os cloroplastos intactos purificados por resuspending a pelota em meio hipotônica que contém inibidores de protease (o volume final não deve exceder 12 mL).
Nota: Desta etapa, o uso da pipeta com dicas bem (dicas azuis) é possível desde que a integridade dos cloroplastos é não mais essencial (pipetagem cloroplastos acima e para baixo enquanto pelota não é inteiramente resuspended). Arabidopsis cloroplastos são muito frágeis (quando comparado com cloroplastos de ervilha, por exemplo) e sua lise é quase imediata após incubação em meio hipotônica. - Carrega lentamente 3 mL de cloroplastos lisados no topo de cada gradientes de sacarose pré-formadas utilizando uma bomba peristáltica.
- Se os gradientes para 1 h a (70.000 x g, 4 ° C). Pares de equilíbrio de tubos usando hipotônica buffer médio antes da centrifugação.
- Cuidadosamente, recuperar as proteínas solúveis do estroma pipetando a fase superior do gradiente (3 mL de cada gradiente) (Figura 2B). Tome uma alíquota para determinação da concentração de proteína7. Armazene o estroma em nitrogênio líquido para novas experiências.
- Aspire a fase superior restante de cada gradiente até a faixa amarela, usando uma bomba de água.
- Recupere a faixa amarela (o envelope) com uma pipeta (aproximadamente 1 mL de cada gradiente). Agrupe todos os envelopes em um tubo.
- A fase restante de cada gradiente até remova o sedimento de tilacoides usando uma bomba de água.
6. lavagem e concentração dos tilacoides e sistemas de membrana do Envelope
- Resuspenda as pelotas de tilacoides (Pelotas verdes) em um volume mínimo (2 mL) da membrana lavando buffer (1x) (com inibidores de protease).
- Diluir os envelope e tilacoides suspensões 3-4-fold no meio de lavagem de membrana (ajuste o volume para 10ml) e se por 1h a (110.000 x g, 4 ° C). Pares de tubos usando membrana lavando a reserva antes da centrifugação de equilíbrio.
- Aspire cuidadosamente com os sobrenadantes usando uma bomba de água.
- Adicione cerca de 100 µ l de buffer (com inibidores de protease) para a pelota de envelope de lavagem de membrana. Tome uma alíquota para determinação da concentração de proteína7. Armazene a preparação de membrana do envelope purificada em nitrogênio líquido.
- Resuspenda o pellet contém em 3 mL de membrana lavando buffer (com inibidores de protease). Tome uma alíquota para determinação da concentração de proteína7. Armazenar a fração de membrana tilacoides em nitrogênio líquido.
Resultados
Sucessivas etapas do processo, resultando em cloroplasto purificado e seus compartimentos sub for retomadas na Figura 2. O gradiente de Percoll (Figura 2A) permite distinguir cloroplastos intactos de quebrado cloroplasto e mitocôndria (topo do gradiente) ou núcleos e detritos celulares (parte inferior do gradiente). Após a ruptura das organelas Percoll-purificado graças a um choque de osmótica, as frações resultantes são separadas em um gradiente de sacarose (Figura 2B). O estroma (parte solúvel do cloroplasto) está flutuando na superfície do gradiente de sacarose. As vesículas de membrana do envelope de luz são recuperadas como uma banda amarela discreta na interface 0.6/0,93 M de sacarose. As mais pesadas vesículas de membranas tilacoides estão concentradas na parte inferior do tubo. Após a recuperação, a lavagem e a concentração das frações duas membranas, as proteínas são quantificadas e a composição de todos os quatro fracções é analisada em um SDS-PAGE (Figura 2). As pistas são carregadas em uma base de proteína igual (20 µ g de cada fração purificada). Sabendo-se que os cloroplastos contêm apenas 1% das proteínas do envelope e 50% de proteínas do estroma ou do contém, isto tende a superestimar a contaminação cruzada de preparações purificadas de envelope com outros compartimentos sub cloroplasto. No entanto, este método permite para detectar quantidades minuciosas de proteínas Cruz-contaminando a fração de envelope. Marcadores de cada compartimento (i.e., abundantes proteínas) são muito úteis para avaliar a contaminação cruzada das frações. Com efeito, as frações de membrana tilacoides e envelope deverão conter quantidades muito baixas de grande subunidade de RuBisCO (RBCL), a proteína mais abundante do estroma (50 kDa). Cloroplastos quebrados facilmente distingue cloroplasto intacto devido à perda desta proteína do estroma8. A luz da colheita proteínas complexas (LHCP) são componentes de tilacoides abundante de 25-kDa que devem mal contaminar (menos de 3%) envelope membranas9. Finalmente, o translocator triose-fosfato-fosfato (TPT) é uma proteína de 30-kDa que só é visível na fração purificada envelope devido à sua forte enriquecimento (ou seja, 50 a 100 x) na fração de envelope, quando comparado ao cloroplasto todo extrai. Usando o método descrito aqui, cloroplasto sub compartimentos são geralmente mal Cruz contaminada como confirmado usando análises de western-blot (Figura 2D) contando com anticorpos dirigidos contra marcadores conhecidos de todos os três compartimentos sub: o reductoisomerase de ketol-ácido solúvel (KARI) de estroma, o envelope de cloroplasto cobre ATPase (HMA1) e a luz da colheita proteínas complexas (LHCP) partir das membranas dos tilacoides. Contaminação cruzada dos três compartimentos sub pode ser quantificada usando ambos immunoblotting e massa espectrometria análises9. Enquanto o estroma geralmente não está contaminado por fracções de envelope ou tilacoides, as frações purificadas envelope contém 3% de proteínas de tilacoides e até 10% de proteínas do estroma. Proteínas do estroma mal contaminam as membranas tilacoides (menos de 1%), mas contém contêm até 3% de proteínas de membrana do envelope. Mais do que ter um papel crucial em identificar a localização de subplastidial genuíno de proteínas cloroplasto, o presente método, portanto, também limita a conclusões errôneas sobre a localização de subplastidial das proteínas resultantes da cruzam contaminações.
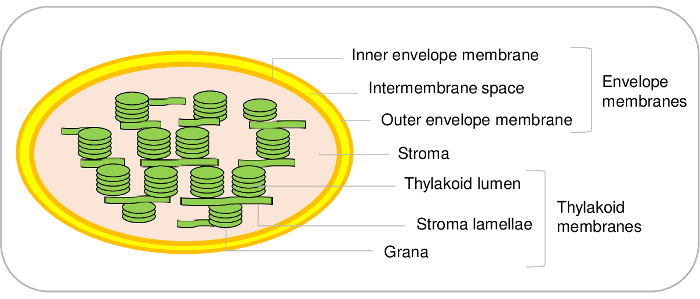
Figura 1: esquema representativa dos compartimentos sub cloroplasto. Clique aqui para ver uma versão maior desta figura.
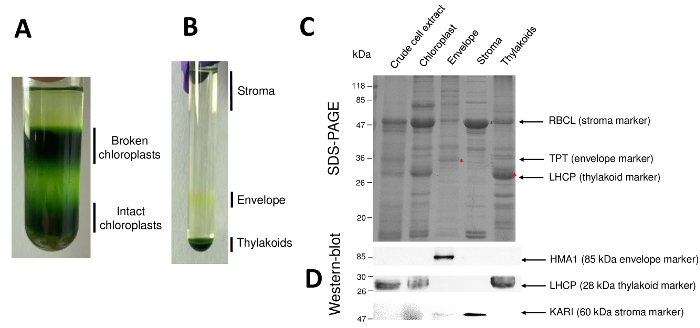
Figura 2: purificação dos cloroplastos intactos e suas três principais compartimentos sub usando gradientes de Percoll e sacarose. R. gradiente de Percoll permitindo a separação dos cloroplastos intactos e quebrados. B. gradiente de sacarose, permitindo a separação das frações de estroma, envelope e tilacoides. C. representante de SDS-PAGE das proteínas dos cloroplastos intactos e seus três compartimentos sub principais permitindo Visualizar marcadores abundantes de cada compartimento secundário. Cada pista contém 10 µ g de proteínas. Marcadores de peso molecular: RBCL, grande subunidade da RuBisCO (marcador para o estroma); TPT, translocator fosfato/triose-fosfato (marcador para o envelope); LHCP, luz colheita proteínas complexas (marcador para os tilacoides). D. experimentos de Western-blot, permitindo detectar marcadores específicos (usando anticorpos específicos) de cada compartimento secundário: o cloroplasto envelope cobre ATPase HMA110, a luz colheita proteínas complexas LHCP partir os tilacoides membranas de11e o reductoisomerase de ketol-ácido KARI o estroma9. Clique aqui para ver uma versão maior desta figura.
Discussão
O presente artigo visa detalhar o passo a passo protocolo usado para purificar cloroplastos (e seus compartimentos sub) de Arabidopsis thaliana. Desde a disponibilidade de sua sequência completa do genoma, há quase duas décadas e de grandes coleções de mutantes de inserção disponibilizados para a Comunidade, Arabidopsis é agora amplamente aceito como uma planta de modelo. No entanto, enquanto esta planta foi perfeitamente adaptada para abordagens genéticas, os cientistas planta precisavam adaptar ferramentas bioquímicas e fisiológicas que este modelo emergente. Protocolos que permite para purificar fotossinteticamente ativos cloroplastos das folhas de modelos bioquímicos bem estabelecidas como espinafre12 ou ervilha13 assim, tinham que ser adaptado. O primeiro método descrevendo a purificação de Arabidopsis cloroplastos foi publicado em 199814, pouco antes do lançamento da sequência do genoma de Arabidopsis . Vários anos mais tarde, simples métodos para isolar Arabidopsis cloroplastos compatíveis com estudos com o objetivo de analisar em vitro importação de proteínas em organelas purificadas foram feitos disponível15,16. No entanto, esses métodos não podem para combinar o alto nível de pureza e preservação da atividade fotossintética de cloroplastos purificadas. Mais recentemente17, um método rápido foi estabelecido, que se baseia na utilização de Percoll e permite manter quase 90% da taxa de fotossíntese medida nas folhas inicial de Arabidopsis.
O protocolo descrito aqui permite purificar Arabidopsis cloroplastos em um excelente nível de pureza. Com efeito, deteção imunológica de contaminantes de outros compartimentos celulares demonstrou que as organelas purificadas são desprovidas de mitocondrial e marcadores de membrana plasmática9,10. Este protocolo foi também eficiente para purificar cloroplastos de várias Arabidopsis ecotipos18, como Columbia (Col) ou Wassilewskija (WS), ou seja, os ecotipos que foram utilizados para genoma ou expressa sequência etiquetas (ESTs) sequenciamento projetos, mas também para gerar mutantes de inserção de T-DNA em Arabidopsis. Em outras palavras, quando estudos de proteômica tem que ser realizada, o presente protocolo é compatível com esses dois ecótipos de referência de Arabidopsis. Finalmente, o rendimento dos cloroplastos utilizando o presente protocolo é semelhante ao obtido quando a partir de folhas de espinafre ou ervilha (ou seja, 3%, medido a partir do conteúdo de clorofila no cloroplasto Percoll-purificado quando comparado com o total quantidade de clorofila presente na partida deixa). Em termos de proteínas, o rendimento está perto de 50 mg de proteínas cloroplasto, quando organelas são purificadas de 500 g de folhas de Arabidopsis 5 semanas de idade.
Para alcançar tal um bom rendimento (e integridade do cloroplasto), uma porém deve prestar especial atenção à várias etapas ao usar o presente protocolo. O cloroplasto em Arabidopsis é uma estrutura extremamente frágil (isto não é o caso dos cloroplastos de ervilha, por exemplo). Atenção específica, portanto, é necessário para evitar a ruptura em grande escala das organelas durante a purificação. O número e tamanho dos grânulos de amido presentes nos cloroplastos são críticos para a preparação dos cloroplastos intactos. Na verdade, cloroplastos contendo grãos de amido grandes geralmente será quebrados durante etapas de centrifugações diferencial inicial, com o objetivo de concentrar o cloroplasto bruto fracções12. Portanto, as plantas devem ser mantidas durante a noite em um quarto escuro e frio (4 ° C) antes do experimento, para reduzir a quantidade de amido.
Novos usuários do presente protocolo podem ser tentados a começar de maiores quantidades de material da folha (enormes rosetas de velho Arabidopsis plantas com folhas maiores) tentando melhorar a recuperação dos cloroplastos purificadas. No entanto, em nossas mãos, a partir de folhas jovens (5 semanas de idade) é o melhor compromisso para combinar o rendimento, pureza e integridade das organelas purificadas. Na verdade, folhas velhas também altamente ricos em compostos fenólicos que foram mostrados para ter um impacto negativo no cloroplasto integridade19.
Finalmente, a etapa de extração inicial (moagem do tecido) é outro passo fundamental. O processo de misturando deve ser limitado a alguns segundos. Como dito acima, novos usuários poderiam ser tentados usar mais tempo de mistura, esperando assim fortemente melhorar o rendimento de organelas purificadas. No entanto, se mistura mais eficazmente libera mais material das folhas, parece que a proporção de cloroplastos quebrados aumenta rapidamente no extrato bruto de célula. Devido a esta relação elevada da quebrada de cloroplastos intactos no meio, mais etapas de purificação (separação de Percoll) são fortemente afetadas e o rendimento da purificação é inesperadamente inferior.
Disponibilidade de protocolos específicos para purificar organelas permitiram uma série de alto rendimento baseada em proteômica experiências conduzidas em amostras de cloroplasto. Estes dados foram disponibilizados em várias bases de dados públicas6, proporcionando uma exata localização subcellular (e subplastidial) para muitas proteínas cloroplasto para biólogos no campo. Isso era especialmente verdadeiro para as proteínas do envelope, cuja identidade e localização principalmente permaneceu desconhecida antes destas análises, como membranas de envelope representam um componente menor cloroplasto (1-2% das proteínas cloroplasto) enquanto estiver jogando um papel chave no cloroplasto metabolismo e biogênese5,20. Usando o protocolo descrito aqui, recentemente foram analisados a composição dos três compartimentos principais cloroplasto de Arabidopsis (i.e., o estroma, o contém e o sistema de membrana do envelope)9. Baseado em uma abordagem proteômica semi-quantitativa (contando espectral), fomos capazes de avaliar o particionamento de centenas de proteínas nestes três compartimentos de cloroplasto.
Enquanto o presente protocolo permite purificar os três principais compartimentos do cloroplasto de Arabidopsis, é também possível distinguir compartimentos sub adicionais no cloroplasto. Com efeito, o sistema de membrana do envelope é feito do interior e as membranas do envelope exterior (Figura 1). No entanto, o melhor de nosso conhecimento, um método para purificar as membranas interna e externa do envelope de Arabidopsis cloroplastos permanece a ser estabelecida. As membranas interna e externa do envelope podem ser purificadas de cloroplastos de22 21 ou ervilha espinafre. A principal limitação de Arabidopsis resulta principalmente dos montantes das limitantes de material começar. A partir de 500 g de folhas de Arabidopsis (que já requer 1 m2 de superfície em uma câmara de crescimento) permite purificar apenas 100 µ g de proteínas do envelope. Por outro lado, é fácil começar com 5-10 kg de espinafre sai do mercado, para purificar a grande quantidade de cloroplastos8 e para finalizar com um rendimento de 3 a 10 mg de proteínas do envelope deste material.
O mesmo é verdadeiro para compartimentos sub tilacoides. Na verdade, contém é feitos de luz vesículas de membrana (lamelas) e estruturas densas (grana) (Figura 1). Protocolos específicos estão disponíveis para distinguir esses dois compartimentos em Arabidopsis23,24. Novamente, com base numa análise proteômica quantitativa, nós recentemente inventariado as proteínas presentes nestes dois compartimentos sub24. Essas abordagens, juntamente com uma investigação aprofundada da literatura, permitiu validar, ou propor hipóteses para, o local de subplastidial de centenas de proteínas de tilacoides. No entanto, é importante notar que microdomains membrana adicionais estão presentes nas margens curvas de contém. Estes compartimentos sub lipoproteína, ou plastoglobules, são permanentemente acoplados nas membranas tilacoides e contêm um conjunto específico de proteínas25. Usando o presente protocolo, não é assim possível distinguir estas proteínas específicas de outros componentes de tilacoides.
Alguns componentes genuínos de envelope, estroma ou tilacoides (conhecidos) são ainda falta nas listas das proteínas detectadas. Juntamente com alvo Análises bioquímicas e imunológicas, a melhoria contínua do MS sensibilidade será de grande ajuda para revisitar o conteúdo do cloroplasto em direção um repertório completo da composição de seus vários compartimentos sub.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado por uma bolsa de doutoramento conjunta ao IB do INRA planta biologia e divisão de criação e do Labex GRAL (ANR-10-LABX-49-01). Também gostaríamos de reconhecer o projeto ANR ANR-15-IDEX-02, Dr. Olivier Vallon (IBPC Paris) para detecção de anticorpos contra LHCP e Dr. Renaud Dumas (LPCV, Grenoble) para detecção de anticorpos contra KARI.
Materiais
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17089101 | |
| Tricine | Roth | 6977.2 | |
| Sorbitol | Roth | 6213.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Promega | H5032 | |
| NaHCO3 | Roth | 8551.1 | |
| Bovine serum albumin (BSA) | Roth | 8076.5 | |
| MgCl2 | Roth | 2189.1 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Benzamidine | Sigma | B6506 | |
| ε-amino caproic acid | Fluka | 21530 | |
| 3-(N-morpholino) propane sulfonic acid (MOPS) | Roth | 6979.3 | |
| Sucrose | Roth | 9286.2 | |
| Acrylamide stock: 30% (w/v) acrylamide, 0.8% (w/v) bisacrylamide | Roth | 3029.1 | |
| Tris | Fisher | BP152-5 | |
| Sodium dodecyl sulfate (SDS) | Roth | 1057.1 | |
| Tetramethylethylenediamine (TEMED) | Sigma | T-8133 | |
| Ammonium persulfate (APS) | Roth | 9592.1 | |
| Glycerol | Roth | 3783.1 | |
| Bromophenol blue | USB | US12370 | |
| Glycin | Roth | 3908.3 | |
| Gel staining medium | Clini-sciences | GEN-QC-STAIN | |
| Ethanol | CARLO ERBA | 528151 | |
| NaCl | Euromedex | 1112-A | |
| Triton X-100 | Promega | H5141 | |
| Fat-free milk powder | Régilait | ||
| HCl | Fisher | H/1150/PB15 | |
| KOH pellets | Sigma | 1.05012 | |
| NaOH pellets | CARLO ERBA | 480507 | |
| Anti-HMA1 antibody | Seigneurin-Berny et al, 2006 | Used at a 1:1000 dilution | |
| Anti-KARI antibody | Ferro et al, 2010 | Used at a 1:1000 dilution | |
| Anti-LHCP antibody | Vallon et al, 1991 | Used at a 1:25,000 dilution | |
| P-coumaric acid | Sigma | C-9008 | |
| Luminol (3-aminophalhydrazin) | Fluka | 9253 | |
| Dimethyl sulfoxide (DMSO). | Sigma | D5879 | |
| Large (30 cm × 45 cm) plastic cases | Puteaux | 162135 | |
| A. thaliana seeds | Around 30 mg of seeds for a whole case | ||
| Compost "Floragard" | Puteaux | 16311770 | |
| Growth rooms | 12-h light cycle, set at 23°C (day) / 18°C (night) with a light intensity of 150 μmol/m2/s. | ||
| Muslin or cheesecloth | Raffin | 70116 | 80-cm-large |
| Nylon blutex 50 μm aperture | Tripette et Renaud, Sailly Saillisel | 50 μm aperture | |
| Motor-driven blender, three speeds, 1 gallon (4 L) capacity | Waring Blender | ||
| Fixed-angle rotors JLA-10.500 (6 × 500-mL plastic bottles) | Beckman Coulter | ||
| Beckman JA-20 rotor | Beckman Coulter | ||
| JA-20 (6 × 50 mL polypropylene tubes) | Sorvall instruments | ||
| Swinging-bucket rotor JS-13.1 (6 × 50 mL polycarbonate tubes) | Beckman Coulter | ||
| SW 41 Ti rotor (6 × 13.2 mL ultraclear tubes) | Beckman Coulter | ||
| SW 41 Ti rotor tubes (13.2 mL ultraclear tubes) | Beckman Coulter | ||
| Ultracentrifuge (Beckman L7) | Beckman Coulter | ||
| Centrifuge (Beckman JSE-06D18) | Beckman Coulter | ||
| Microcentrifuge | Eppendorf 5415D or equivalent | ||
| Water pump connected to a Pasteur pipette via a plastic tube. | |||
| Nitrocellulose membranes | BA85, Schleicher and Schuell | ||
| Filter paper | 3MM, Whatman, Maidstone | ||
| Liquid nitrogen | |||
| Peristaltic pump | Gilson | ||
| Gel electrophoresis apparatus with the various accessories needed for protein separation by electrophoresis (combs, plates and casting apparatus). | Bio-Rad Protean 3 or equivalent | ||
| System for protein transfer to nitrocellulose membranes | Bio-Rad Protean 3 or equivalent |
Referências
- Zimorski, V., Ku, C., Martin, W. F., Gould, S. B. Endosymbiotic theory for organelle origins. Current Opinion in Microbiology. 22, 38-48 (2014).
- Gould, S. B., Waller, R. F., McFadden, G. I. Plastid evolution. Annual Review of Plant Biology. 59, 491-517 (2008).
- Linka, N., Weber, A. P. Intracellular metabolite transporters in plants. Molecular Plant. 3 (1), 21-53 (2010).
- Block, M. A., Douce, R., Joyard, J., Rolland, N. Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol. Photosynthesis Research. 92 (2), 225-244 (2007).
- Rolland, N., et al. The biosynthetic capacities of the plastids and integration between cytoplasmic and chloroplast processes. Annual Review of Genetics. 46, 233-264 (2012).
- Agrawal, G. K., et al. Plant organelle proteomics: collaborating for optimal cell function. Mass Spectrometry Reviews. 30 (5), 772-853 (2011).
- Chua, N. -. H. [40] Electrophoretic analysis of chloroplast proteins. Methods in Enzymology. 69, 434-446 (1980).
- Seigneurin-Berny, D., Salvi, D., Joyard, J., Rolland, N. Purification of intact chloroplasts from Arabidopsis and spinach leaves by isopycnic centrifugation. Current Protocols in Cell Biology. , (2008).
- Ferro, M., et al. AT_CHLORO, a comprehensive chloroplast proteome database with subplastidial localization and curated information on envelope proteins. Molecular & Cell Proteomics. 9 (6), 1063-1084 (2010).
- Seigneurin-Berny, D., et al. HMA1, a new Cu-ATPase of the chloroplast envelope, is essential for growth under adverse light conditions. Journal of Biological Chemistry. 281 (5), 2882-2892 (2006).
- Vallon, O., et al. Lateral redistribution of cytochrome b6/f complexes along thylakoid membranes upon state transitions. Proceedings of the National Academy of Sciences of the United States of America. 88 (18), 8262-8266 (1991).
- Douce, R. J. J., Edelman, M., Hallick, R. B., Chua, N. -. H. Purification of the chloroplast. Methods in Chloroplast Molecular Biology. , 239-256 (1982).
- Cerovic, Z. G., Plesnicar, M. An improved procedure for the isolation of intact chloroplasts of high photosynthetic capacity. Biochemical Journal. 223 (2), 543-545 (1984).
- Kunst, L. Preparation of physiologically active chloroplasts from Arabidopsis. Methods in Molecular Biology. 82, 43-48 (1998).
- Aronsson, H., Jarvis, P. A simple method for isolating import-competent Arabidopsis chloroplasts. FEBS Letters. 529 (2-3), 215-220 (2002).
- Ling, Q., Jarvis, P. Analysis of Protein Import into Chloroplasts Isolated from Stressed Plants. Journal of Visualized Experiments. (117), (2016).
- Seigneurin-Berny, D., Salvi, D., Dorne, A. J., Joyard, J., Rolland, N. Percoll-purified and photosynthetically active chloroplasts from Arabidopsis thaliana leaves. Plant Physiology and Biochemistry. 46 (11), 951-955 (2008).
- Salvi, D., Rolland, N., Joyard, J., Ferro, M. Purification and proteomic analysis of chloroplasts and their sub-organellar compartments. Methods in Molecular Biology. 432, 19-36 (2008).
- Walker, D. . The use of the oxygen electrode and fluorescence probes in simple measurements of photosynthesis. , (1990).
- Jarvis, P., Lopez-Juez, E. Biogenesis and homeostasis of chloroplasts and other plastids. Nature Reviews Molecular Cell Biology. 14 (12), 787-802 (2013).
- Block, M. A., Dorne, A. J., Joyard, J., Douce, R. Preparation and characterization of membrane fractions enriched in outer and inner envelope membranes from spinach chloroplasts. II. Biochemical characterization. Journal of Biological Chemistry. 258 (21), 13281-13286 (1983).
- Soll, J. Phosphoproteins and protein-kinase activity in isolated envelopes of pea (Pisum sativum L.) chloroplasts. Planta. 166 (3), 394-400 (1985).
- Moyet, L., Salvi, D., Tomizioli, M., Seigneurin-Berny, D., Rolland, N. Preparation of Membrane Fractions (Envelope, Thylakoids, Grana, and Stroma Lamellae) from Arabidopsis Chloroplasts for Quantitative Proteomic Investigations and Other Studies. Methods in Molecular Biology. 1696, 117-136 (2018).
- Tomizioli, M., et al. Deciphering thylakoid sub-compartments using a mass spectrometry-based approach. Molecular & Cellular Proteomics. 13 (8), 2147-2167 (2014).
- Spicher, L., Kessler, F. Unexpected roles of plastoglobules (plastid lipid droplets) in vitamin K1 and E metabolism. Current Opinion in Plant Biology. 25, 123-129 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados