A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة اتصالات بين الخلايا مفرق الأصفر يوديد فلورسنت بروتين-الفجوة
In This Article
Summary
نقدم هنا، بروتوكولا مقايسة اتصالات بين الخلايا مفرق فجوة رواية المصممة للفرز الفائق الفجوة تقاطع تحوير المواد الكيميائية لاكتشاف المخدرات وتقييم السمية.
Abstract
هي تقاطعات الفجوة (جيس) غشاء الخلية القنوات التي تتيح نشر جزيئات أصغر من 1 كاتشين بين الخلايا المتجاورة. كما لديهم أدوار الفسيولوجية والمرضية، هناك حاجة إلى فحوصات الكشف (HTS) الفائق لتحديد المغيرون GJ في فحوصات علم السموم واكتشاف المخدرات. مقايسة اتصالات بين الخلايا مفرق (I يفب ججيك) رواية يوديد الأصفر فلوري بروتين، فجوة تلبي هذه الحاجة. وهو تحليل يستند إلى الخلية بما في ذلك الخلايا يقبلون والجهات المانحة التي صممت للتعبير عن ثابت متغير بروتين فلوري صفراء (يفب)، الذين fluorescence حساسية تطفئ يوديد، أو SLC26A4، الناقل يوديد، على التوالي. عندما تتم إضافة يوديد لثقافة مختلطة من أنواع الخلايا اثنين، التي تدخل الخلايا المانحة عبر الناقل SLC26A4 ومنتشر إلى الخلايا المجاورة يقبلون عبر ججس حيث أنهم إخماد fluorescence يفب. الأسفار يفب يقاس ببئر في وضع حركية. ويعكس معدل التبريد يفب GJ النشاط. المقايسة موثوق بها وسريعة ما يكفي لاستخدامها ل HTS. ويرد وصف البروتوكول للمقايسة يفب-جيك استخدام الخلايا LN215، والخلايا البشرية الدبقي،.
Introduction
الفجوة في تقاطعات (ججس) بمثابة قنوات بين الخلايا للسماح بنشر الجزيئات الصغيرة من < 1 كاتشين مثل المواد الغذائية ونواتج الأيض وجزيئات إرسال الإشارات بين الخلايا المتجاورة. تتضمن عناصر هالة هيميتشاننيل أو كونيكسون في كل خلية، ويشكل كل كونيكسون ستة كونيكسينس (ككسس)1. جيس وككسس قد استخدمت في فحوصات علم السموم من المواد المسببة للسرطان مثل الهيدروكربونات العطرية (PAH)، التي هي GJ مثبطات2،،من34. لقد ارتبطت جيك تعطلت مع نونجينوتوكسيك التسرطن5،6. كهدف علاجية محتملة، أبلغ عن مشاركة GJ في أنواع فرعية معينة من مضبوطات7،8، الحماية من القلب والمخ الاسكيمية/ضخه إصابة9، النصفي مع هالة10، إصابة الكبد الناجم عن المخدرات6،11، والجرح شفاء12. فحوصات الكشف (HTS) الفائق مطلوبة لتحديد المواد الكيميائية تحوير GJ أو الأجسام المضادة لاكتشاف العقاقير، لفحوصات علم السموم، وتحديد المنظمين الخلوية رواية GJ النشاط. يمكن أيضا استخدام فحوصات HTS للتحقيق في علاقات الهيكل والنشاط GJ المغيرون2،13،،من1415.
وتشمل بعض فحوصات ججيك نقل صبغ أو تقنيات المشبك التصحيح المزدوج. إبليس الأصفر CH (LY) واستر أسيتوكسيميثيل كالسين (كالسين-ص) قد استخدمت في فحوصات الصبغة والنقل. الخلايا غير المسامية للي، والتي يتم تقديمها بواسطة microinjection أو كشط تحميل انهانسر. مرة واحدة داخل الخلية، LY ينتشر في المجاورة الخلايا عن طريق جيس وهو جزيئي النشاط GJ بحجم الهجرة لي16. وعادة ما تنطوي فحوصات كالسين-ص الفجوة-الأسفار الانتعاش بعد17،فوتوبليتشينج18. كالسين-ص هو صبغة بيرمينت خلية التي يتم تحويل إينتراسيلولارلي إلى كالسين غير منفذة استراز جوهرية. المقايسة يتطلب مجهر [كنفوكل] لمراقبة نقل كالسين-صباحا في خلية من تلك المحيطة بأنه عقب الليزر فوتوبليتشينج. إذا كانت موجودة جيس الوظيفية، كالسين-صباحا في الخلايا المجاورة يدخل الخلايا فوتوبليتشيد ويتم استردادها الأسفار. هو جزيئي النشاط GJ بمدى الانتعاش الأسفار من الخلايا فوتوبلياتشيد. فحوصات الصبغة والنقل هي شاقة وتستغرق وقتاً طويلاً أو حساسيات منخفضة. لقط التصحيح المزدوج هو أسلوب الكهربية أن التدابير الموصلية هالة. أنها حساسة نسبيا، مع اعتماد مباشر من الموصلية في عدد جيس مفتوحة19؛ بيد أنه من الناحية الفنية تطالب، تستغرق وقتاً طويلاً ومكلفة20. وكان وضع مقايسة يفب-جيك لاستخدامها في HTS.
ويبين الشكل 1 المكونات والخطوات للمقايسة جيك-يفب، الذي يستخدم الخلايا يقبلون معربا عن متغير يفب يوديد حساسة إذ تضع H148Q و I152L (يفبQL) والخلايا المانحة معربا عن يوديد الناقل (SLC26A4)21 . تسمح الطفرات اثنين قام يفبQL تسقيه من الأسفار يوديد22. تتم إضافة اليود إلى يقبلون شارك مثقف وخلايا المانحين؛ لا تقم بإدخال الخلايا يقبلون، ولكنها هي التي تتناولها الناقلين SLC26A4 الحالي على الخلايا المانحة. اليود في الخلايا المانحة منتشر عبر جيس عاملة في خلايا يقبلون المجاورة حيث أنهم إخماد fluorescence يفبQL . إذا أغلقت جيس أو حظرها بواسطة مثبطات، لا يمكن إدخال يوديد الخلايا يقبلون لإخماد الأسفار. ويعكس معدل التبريد يفبQL GJ النشاط. إجراء المقايسة ججيك-يفب معقدة ولا تستغرق وقتاً طويلاً. وهو متوافق مع HTS ويمكن استخدامها لاختبار آثار عدد كبير من المركبات في النشاط GJ في فترة زمنية قصيرة نسبيا. أنه يتطلب فقط يقبلون وخلايا المانحين والحلين الملح متوازنة. البروتوكول هو موضح أدناه تستند إلى خلايا LN215 Cx الرئيسية التي يتم Cx4321. مستقبلات LN215-يفبQL و LN215--أنا− المانحة خلايا تم إنشاؤها بواسطة توصيل مع lentiviruses معربا عن21،يفبQL أو SLC26A423.
Protocol
1-جيل من الإعراب عن يفبQL و SLC26A4 لينتيفيروسيس
- تنمو خلايا الكلي الجنينية البشرية HEK293T إلى 80% كونفلوينسي على ألواح الثقافة 100 مم. تعديل النسر المتوسطة (دميم دولبيكو) وتستكمل مع 10% مصل بقرى الجنين و 100 يو/مليلتر البنسلين و 100 ميكروغرام/مل ستربتوميسين هو ثقافة الوسيلة المستخدمة في جميع أنحاء البروتوكول للحفاظ على HEK293T والخلايا الأخرى المذكورة أدناه.
- لوحات معطف الثقافة 6-جيدا بإضافة 2 مل من 0.005 في المائة من بولي-L-يسين العقيمة (PLL) الحل لكل بئر للحد الأدنى 10 نضح الحل PLL وشطف السطح مرتين مع 2 مل الماء المعقم.
- أغسل HEK293T الخلايا التي تحتوي على 10 مل فوسفات مخزنة المالحة (PBS) ومعاملة مونولاييرس خلية في كل طبق 100 ملم مع 2 مل من محلول يدتا التربسين 0.25% في 37 درجة مئوية لمل 5 إضافة 3 كحد أدنى من الثقافة المتوسطة وريسوسبيند الخلايا.
- عد الخلايا في هيموسيتوميتير وضبط كثافة تعليق خلية إلى خلايا/مل 250,000 في الثقافة المتوسطة وإضافة خلايا 500,000 في 2 مل من الثقافة المتوسطة لكل المغلفة يسين جيدا من لوحات 6-جيدا. احتضان الخلايا في 5 هوميديفيد الهواء الغلاف الجوي في 37 درجة مئوية ح 24% CO295% ثم قم باستبدال المتوسطة الثقافة مع دميم دون البنسلين أو والستربتوميسين.
- في أنبوب 1.5 مل، تمييع 20 ميليلتر من تعداء الكاشف مع 500 ميليلتر من دميم دون المصل أو المضادات الحيوية. المزيج بلطف بيبيتينج واسمحوا الوقوف في درجة حرارة الغرفة لمدة 5 دقائق.
- وفي الوقت نفسه، "الماصة؛" 250 ميليلتر من دميم في كل من أنبوبين 1.5 مل ثم قم بإضافة 1500 نانوغرام من بلفكس-النشطين اقتصاديا-يفبQL أو pLenti6P-SLC26A4، 1225 نانوغرام من psPAX2 و 375 نانوغرام pMD2.G لكل منهما. والبلازميدات لينتيفيرال اثنين تم وصفه سابقا21. إضافة 250 ميليلتر من كاشف تعداء المخفف لكل أنبوبة بلازميد وتخلط بلطف واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
- بعد 20 دقيقة، إضافة 500 ميليلتر من تعداء الكاشف وبلازميد المجمعات في أنابيب 1.5 مل دروبويسي لكل لوحة الثقافة جيدا في الخطوة 1، 4، ومزيج هزاز لوحة ذهابا وإيابا. احتضان خلايا في 37 درجة مئوية في حاضنة2 CO ح 12.
- استبدال المتوسطة 2.5 مل متوسطة طازجة واحتضانها 48 ساعة إضافية. ثم ضع لوحة الثقافة على الجليد لمدة 5 دقائق للحفاظ على المتوسط مكيفة تحتوي على لينتيفيروس مبردة للمحافظة على العدوى.
- الحصاد في الوسائط التي تحتوي على لينتيفيروسيس ونقل إلى أنابيب مخروطية الشكل 15 مل. الطرد المركزي في 3,000 س ز عند 4 درجة مئوية لمدة 3 دقائق ثم قم بإزالة الخلايا HEK293T العائمة من المادة طافية عن طريق الترشيح في 0.4 ميكرومتر.
- قم بتخزين الوسائط التي تحتوي على لينتيفيروسيس في 4 درجات مئوية للاستخدام خلال يومين. لاستخدامها في وقت لاحق، تخزين 200 ميليلتر مختبرين في −80 درجة مئوية.
2-جيل LN215-يفبQL و LN215--أنا− الخلايا بتوصيل لينتيفيرال
- تنمو خلايا LN215 في لوحات الثقافة 100 مم إلى 80% كونفلوينسي في دميم وتستكمل مع البنسلين يو/مليلتر 100 10% مصل بقرى الجنين (FBS)، و 100 ميكروغرام/مل ستربتوميسين كما هو موضح أعلاه.
ملاحظة: إذا كان الإنزيم يفب-جيك يجري استخدام خط خلية مختلفة، استخدام المتوسطة الثقافة المناسبة. LN215-يفبQL، و LN215--أنا– الخلايا التي يمكن أن توفرها المؤسسة الجامعات وقطاع الصناعة، وجامعة يونسي. الرجاء الاتصال بكاتب المقابلة. - قبل يوم واحد من توصيل، غسل الخلايا مرتين مع 10 مل من برنامج تلفزيوني، تعامل مع 2 مل من 0.25% التربسين-يدتا في 37 درجة مئوية للحد الأدنى 3 ريسوسبيند الخلايا في 5 مل من الثقافة المتوسطة مع ماصة 10 مل مقايسات وضبط الكثافة إلى 50,000 خلايا/مل. إضافة خلايا 20,000 في 400 ميليلتر لوسائل الإعلام لكل بئر من لوحة الثقافة 24-جيدا للعلاج لا مراقبة الفيروس ويفبQLوالخلايا SLC26A4.
- بعد 24 ساعة حضانة عند 37 درجة مئوية، ترانسدوسي بئرين بالاستعاضة عن المتوسط الثقافة مع 400 ميليلتر من خليط 1:1 بلفكس-النشطين اقتصاديا-يفبQL أو لينتيفيروس pLenti6P-SLC26A4 والمتوسطة ثقافة جديدة تستكمل مع بوليبريني بتركيز نهائي 4 ميكروغرام/مل. للا مراقبة الفيروس، استبدل بالثقافة المتوسطة.
- احتضان الخلايا في 37 درجة مئوية ح 15، نضح المتوسطة التي تحتوي على لينتيفيروسيس، وإضافة جديدة الثقافة المتوسطة، واحتضان الخلايا ح 72 إضافية.
تنبيه: لمنع تلوث lentivirus بين الآبار، استخدام نصائح جديدة أو بيبيتس لكل بئر عند نضح المتوسطة الثقافة التي تحتوي على لينتيفيروس أو الاستغناء عن متوسط نمو جديدة. - أغسل الخلايا في كل منهما جيدا مرتين مع 0.5 مل من برنامج تلفزيوني، تعامل مع 300 ميليلتر يدتا التربسين للحد الأدنى 3 ريسوسبيند الخلايا في 2 مل من الثقافة المتوسطة وطبق في لوحات الثقافة ستة-جيدا مع 2 ميكروغرام/مل بوروميسين.
- الثقافة الخلايا الموجودة في الوسائط التي تحتوي على 2 ميكروغرام/مل بوروميسين حتى يتم كافة الخلايا في عنصر التحكم أيضا الميت (مستدير أو عائم، عندما لاحظ في المجهر)، التي عادة ما يستغرق أسبوعا. تحديث وسائل الإعلام الثقافة التي تحتوي على بوروميسين كل يوم خلال فترة الاختيار. إذا كان LN215 أو LN215-يفبQL --أنا– روافد الثقافات أصبح قبل اكتمال الانتقاء، ونقل الخلايا إلى 100 مم لوحة ويستمر التحديد كما في الخطوة 2، 5.
3-إعداد الحلول المطلوبة للفحص
- إعداد 500 مل ج-حل (10 حبيس، 140 ملم كلوريد الصوديوم، الجلوكوز 10 مم، 5 ملم بوكل، 1 مم مجكل2، و 1 ملم كاكل2) و 500 مل من الحل (10 ملم حبيس، 140 ملم ناي، الجلوكوز 10 مم، 5 بوكل، و 1 ملم كاكل2).
- ضبط الأس الهيدروجيني كل الحلول إلى 7.4 مع هيدروكسيد الصوديوم ن 1، وتعقيم الحلول بتصفيات في 0.4 ميكرون للتخزين. تخزين عند 4 درجة مئوية لمدة تصل إلى شهر واحد. فحص درجة الحموضة قبل استخدام.
4-طلاء LN215-يفبQL و LN215--أنا− الخلايا
- الثقافة LN215-يفبQL و LN215--أنا خلايا− في لوحات 100 ملم بشكل منفصل في مستنبت الوصول إلى الفئات السكانية اللازمة للتحليل. LN215-يفبQL و LN215-أنا كونفلوينسي 80% في لوحات 100 مم، وخلايا− في 40 في المائة على التوالي، تكفي مقايسة لوحة 96-جيدا.
- يوم واحد قبل إجراء الفحص جيك-يفب، يغسل كل لوحة الثقافة 100 ملم مع 10 مل من برنامج تلفزيوني. التعامل مع كل لوحة مع 2 مل من محلول يدتا التربسين 0.25% واحتضان في 37 درجة مئوية للحد الأدنى 5 ريسوسبيند الخلايا الموجودة في كل لوحة في 4 مل من الثقافة المتوسطة ونقل إلى أنابيب مخروطية الشكل 15 مل.
- بيليه الخلايا باستخدام الطرد المركزي في س 1,000 ز للحد الأدنى 3 تجاهل المادة طافية وريسوسبيند كل خلية بيليه مع 5 مل من الثقافة المتوسطة. تفكيك أي كتل الخلية إلى الخلايا المفردة بيبيتينج صعودا وهبوطاً من حوالي 20 مرة مع ماصة 10 مل مصلية.
- عد الخلايا في هيموسيتوميتير، وتمييع الخلايا في المتوسط الثقافة جعل تعليق خلية من LN215-يفبQL في خلايا/مل 80,000 و LN215--أنا− في خلايا/مل 160,000.
- مزيج 7 مل من LN215-يفبQL و 7 مل من LN215--أنا− تعليق خلية في المكمن. إضافة 100 ميليلتر من الخليط لكل بئر من لوحة الثقافة خلية 96-جيدا ماصة متعددة باستخدام.
ملاحظة: لإضافة 100 ميليلتر من الخليط في كل من لوحة خلية 96-جيدا جيدا، هناك حاجة حوالي 10 مل تعليق خلية مختلطة. من المستحسن جعل تعليق خلية أكثر من اللازم. - احتضان الخلايا في هوميديفيد 5% CO295% الهواء في 37 درجة مئوية ح 24. LN215-يفبQL و LN215--أنا−خلية ثقافة ينبغي أن تكون روافد 100% عند إجراء الفحص.
5-إجراء المقايسة جيك -يفب
ملاحظة: استخدام مجهر الأسفار مع 20 x التكبير، وعامل تصفية بروتينات فلورية خضراء لتحقق لوحات 96-جيدا للتأكد من وجود لا كتل من LN215-يفبQL أو الخلايا LN215-SLC26A4 وأن الثقافات الخلية تماما المتلاقية وتوزع جيدا قبل القيام الفحص.
- 30 دقيقة على الأقل قبل القيام الفحص، قم بتشغيل ميكروسكوبية وتعيين إلى 37 درجة مئوية.
- تغسل الأنابيب حاقن الآلي مع 3 مل إيثانول 70 ٪، 3 مل من الماء المقطر، ثم مل 3-الحل بمعدل تدفق 300 ميليلتر/s.
- ج-وأنا-الحلول إلى 37 درجة مئوية في حوض ماء دافئ.
ملاحظة: كما هو مطلوب 100 ميليلتر لكل حل لكل بئر من لوحة 96، حسنا، حوالي 10 مل من كل حل ضروري لكل فحص. 10 مل إضافية للحل هناك حاجة فتيلة كل لوحة (ما مجموعة 20 مل) و 25 مل إضافية من ج-الحل المسبق للغسيل كل لوحة (ما مجموعة 35 مل). - نضح المتوسطة النمو أو عكس لوحة لإفراغ؛ الاستفادة من بقايا المتوسطة.
ملاحظة: يؤدي المصل البقري الأجنة المتبقية في وسائط النمو fluorescence الخلفية وانخفاض في نوعية التحليل. - إضافة 200 ميليلتر ج-حل لكل بئر من خزان استخدام ماصة الأقنية. ج-الحل نضح أو عكس لوحة فارغة والاستفادة من الحلول المتبقية.
- إضافة 50 ميليلتر ميليلتر ج-الحل، 1 ميليلتر من 2.5 ملم مخزون المواد الكيميائية (انظر الجدول 1) أو ديميثيلسولفوكسيدي ([دمس]) كوسيلة، وثم 50 ميليلتر ميليلتر ج-حل لكل بئر مع ماصة متعددة القنوات.
ملاحظة: يتم حل معظم الكواشف كيميائية مكتبة في [دمس]، وتصل إلى 1% (v/v) مسموح به في معظم الاختبارات المستندة إلى خلية24. [دمس] لديها كثافة أعلى من الماء، الكواشف المذابة في [دمس] تميل إلى النزول إلى أسفل عند إضافة إلى الآبار لوحة الثقافة، التي تزعج تركيزات الحلول المقايسة. وهذا يمكن التحايل عليها بإضافة 50 ميليلتر ج-الحل والكاشفات في [دمس] 50 ميليلتر ج من-الحل في النظام. آخر 50 ميليلتر من ج-الحل الاختلاط. - احتضان الخلايا عند 37 درجة مئوية في الهواء، وليس في شركة 5%2. يمكن تعديل فترة حضانة المرض، ولكن 10 دقيقة كافية عادة المغيرون أيون-قناة للعمل.
- أثناء الحضانة، بتعيين برنامج قارئ الميكروسكوبية لحقن 100 ميليلتر من أنا-الحل لكل بئر في 1 s وقياس الأسفار 10 s على 0.4 s فترات. مجموعة القارئ إلى قراءة الأسفار من الأسفل. سرعة الحقن الموصى به 135 ميليلتر/س. تعيين الطول الموجي الإثارة إلى 485 نانومتر والقراءة الانبعاثات في 520 نانومتر.
ملاحظة: الإعدادات التفصيلية لبرامج قارئ الميكروسكوبية كما يلي.- انقر فوق الزر إدارة البروتوكولات .
- انقر فوق الزر جديد . تحديد كثافة Fluorescence في المقطع أسلوب القياس، و كذلك الوضع في القراءة وضع المقطع. بعد ذلك، انقر فوق الزر "موافق" . سوف تظهر علامة تبويب جديدة.
- في القائمة معلمات الأساسية ، تعيين الطول الموجي الإثارة إلى 485 نانومتر والانبعاثات في 520 نانومتر. حدد أسفل الألياف البصرية لقراءة الأسفار من الأسفل. بدء القياس تعيين الوقت لتكون "0 s"، عدد الفواصل الزمنية لتكون "25"، عدد ومضات كل بئر، والفاصل الزمني لتكون "20"، ووقت الفاصل الزمني لتكون "0.4 s".
- في القائمة تخطيط ، رسم منطقة اللوحة قراءة.
- في القائمة تركيزات/وحدات التخزين/شاكينج ، تعيين القارئ الميكروسكوبية لحقن 100 ميليلتر من أنا-الحل لكل بئر بسرعة حقن ميليلتر/s 135.
ملاحظة: تجنب سرعات الحقن لأنها يمكن أن تؤدي إلى مفرزة من الخلايا. - في القائمة وقت الحقن ، تعيين وقت البدء حقن 1 s. ثم، انقر فوق الزر بدء القياس .
- وبعد الحضانة، وضع لوحات 96-جيدا في القارئ الميكروسكوبية وبدء القياس بواسطة النقر فوق الزر بدء القياس مرة أخرى.
6-حساب النشاط جيك
- حساب النسب المئوية لتبريد يفبQL والنشاط جيك ك23
يفبQL تبريد (%) =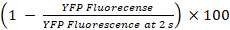
جيك النشاط (%) =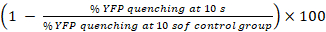
ملاحظة: من حيث المبدأ، جيك النشاط ينبغي أن تكون محسوبة من الفرق بين النسب المئوية للأسفار يفب في الآبار مع يقبلون الخلايا والخلايا المانحة ويقبلون-الخلية المقابلة آبار فقط. ومع ذلك، كما LN215-يفبQL تظهر الخلايا ضئيلة يفب تبريد يوديد بعد 10 s، نحن لا تأخذ خلفية يفب تبريد في الاعتبار عند القيام باستخدام LN215-يفبQL و LN215 HTS-أنا– الخلايا.
النتائج
تسعة وعشرون الثقافة 96-جيدا لوحات استخدمت لفحص المواد الكيميائية 2,320 التعرف على رواية جيك المغيرون بمقايسة جيك-يفب باستخدام LN215-يفبQL و LN215--أنا− الخلايا. وترد النتائج التي تم الحصول عليها مع لوحة ممثل في الشكل 2. النسبة المئوية للأسفار يفب في كل ?...
Discussion
يمكن استخدام التحليل يفب-جيك ل HTS لأنها قوية وسريعة وغير مكلفة. يعتبر فحص HTS قوية إذا Z '-عامل أعلى من 0.525. انظر تشانغ وآخرون للحصول على وصف للتحليل الإحصائي المستخدمة لتقييم مدى ملاءمة HTS فحوصات25. عندما تستخدم الخلايا LN215، Z '-كان عامل > 0.5 دون أي التحسين المقايسة. إذا ك?...
Disclosures
الكتاب قد لا يوجد تضارب في الكشف عن.
Acknowledgements
هذا البحث كان يدعمها "البرنامج بحوث العلوم الأساسية" عبر الوطنية بحوث مؤسسة من كوريا (جبهة الخلاص الوطني) ممولة من وزارة التربية والتعليم (2011-0023701، 2016R1D1A1A02937397، و 2018R1A6A1A03023718).
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
References
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved