このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヨウ化黄色蛍光タンパク質ギャップ結合細胞間コミュニケーション アッセイ
要約
ここでは、ギャップ ジャンクション変調化学薬品、薬剤の発見および毒性評価の高スループット スクリーニング用に設計された新しいギャップ接合細胞間コミュニケーション試金のためのプロトコルを提案する.
要約
ギャップ結合 (GJs) は、隣接するセル間 1 kDa より小さい分子の拡散を許可する細胞膜チャンネルです。彼らは、生理学的および病理学的役割を持っていると薬の発見と毒性の試金の GJ 変調器を識別するハイスループットス クリーニング (HTS) 試金の必要があります。新規ヨウ化黄色蛍光タンパク質-ギャップ結合細胞間コミュニケーション (私-YFP-ギャップ) アッセイは、この必要性を満たしています。安定の蛍光はそれぞれ急冷ヨウ化、または SLC26A4、ヨウ化物輸送によって敏感に黄色い蛍光蛋白質 (YFP) バリアントを表現する設計されてアクセプターと提供者の細胞を含む細胞ベースのアッセイです。2 つのセル型の混合培養にヨウ化を追加すると、彼らは SLC26A4 トランスポーターを介してドナー細胞を入力し、YFP の蛍光をいやす GJs を介して隣接する受容体細胞に拡散します。YFP の蛍光は、キネティック モードでもが測定されます。YFP の失活速度は、GJ のアクティビティを反映しています。試金は信頼性が高く、十分な HTS. に使用される急速ですひと神経膠腫細胞 LN215 細胞を用いて YFP-ギャップの試金のためのプロトコルを説明します。
概要
ギャップ結合 (GJs) の小分子の拡散を許可する細胞間のチャネルとして < 1 kDa の栄養素、代謝産物、隣接する細胞間シグナル伝達分子など。接合部の要素は、各セルに hemichannel またはコネクソンを含めるし、各コネクソンはコネキシン (Cxs) 61を構成します。GJs と Cxs 多環芳香族炭化水素 (PAH) GJ 阻害剤2,3,4であるなどの発癌物質の毒性アッセイに使用されています。混乱ギャップは非遺伝毒性発癌5,6に関連付けられています。発作7、8心臓と脳虚血・再灌流傷害9、10のオーラを伴う片頭痛からの保護の特定のサブタイプの潜在的な治療上のターゲットとして GJ の関与が報告されています。薬物性肝障害6,11, および創傷治癒12。ハイスループットス クリーニング (HTS) 試金が GJ 変調化学物質や毒物学の試金のための薬剤の発見のための抗体を識別し、GJ 活動の新しい細胞調節を識別するために必要です。HTS アッセイは、GJ 変調2,13,14,15の構造活性相関を調査にも使用できます。
いくつかのギャップのアッセイは、熱転写またはデュアル パッチク ランプ法に含まれます。ルシファー黄色 CH (LY) およびカルセイン アセトキシメチルセファロスポリン エステル (カルセイン AM) は、熱転写の試金で使用されています。セルは LY マイクロインジェクション、読み込み、こすりまたはエレクトロポレーションで導入された透過性はありません。一度細胞内 LY は隣接セルを介してGJs に広がっており、GJ 活動は LY 移行16の範囲によって試金されます。カルセイン AM の試金は通常フォトブリーチング17,18後ギャップ蛍光回復を含みます。カルセイン AM は、不浸透性のカルセインに本質的なエステラーゼによって細胞内変換はセル側の透過物染料です。アッセイでは、共焦点顕微鏡レーザー光に続くそれを取り囲むものからセルにカルセイン AM の転送を観察する必要があります。機能 GJs が存在する場合、隣接するセルにカルセイン AM photobleached 細胞に入るし、蛍光の回復します。GJ 活動が photobleached 細胞の蛍光回復の程度によって試金されます。熱転写の試金は手間と時間がかかることも低感度。デュアル パッチ クランプ接合コンダクタンスを測定する電気生理学的手法です。それは比較的敏感、オープン GJs19; 数コンダクタンスの直接依存性しかし、それは技術的に難しく、時間がかかり、高価な20。HTS. で開発された YFP-ギャップ測定
図 1は、コンポーネントとベアリング H148Q および I152L ヨウ化感応 YFP バリアントを発現する受容体細胞を利用して - YFP ギャップ分析の手順を示しています (YFPQL) とヨウ化物輸送 (SLC26A4) を表現するドナー細胞21.YFPQLによって運ばれる 2 つの突然変異は、ヨウ化22による蛍光の消光を許可します。沃化物が共存培養アクセプタとドナー細胞に追加されます。彼らは受容体細胞を入力しないが、ドナー細胞の存在 SLC26A4 トランスポーターによってとられます。沃化物ドナー細胞の拡散機能 GJs YFPQL蛍光いやす隣接する受容体細胞に。GJs が終了または阻害剤によってブロックされている場合、ヨウ化は蛍光を抑制する受容体細胞を入力できません。YFPQLの失活速度は、GJ のアクティビティを反映しています。YFP ギャップ試金プロシージャ複雑でも時間がかかる。高温超伝導との互換性であり、比較的短い期間で多数の化合物が GJ 活性に及ぼす影響をテストに使用することができます。アクセプタ ドナー細胞と 2 つのバランスの取れた塩のソリューションを必要があります。下記プロトコルは、その主要な Cx が配列とコネキシン 4321LN215 セルに基づいています。LN215 YFPQL受容体と LN215-私−ドナー細胞が異 YFPQLまたは SLC26A421,23を表現すると伝達によって生成されました。
プロトコル
1 異 YFPQLと SLC26A4 表現の生成
- 80% に HEK293T の人間の萌芽期の腎臓の細胞成長 100 mm 培養皿に合流します。ダルベッコ変更イーグル培地 (DMEM) 10% 牛胎児血清、100 U/mL ペニシリン、100 μ g/mL ストレプトマイシンと、HEK293T と下記その他の細胞を維持するために、プロトコルの全体で使用される文化媒体です。
- コート 6 ウェル培養皿で 10 分間も滅菌ポリ L リジン (PLL) ソリューションの 0.005 %2 mL を追加して PLL ソリューションを吸引し、2 回 2 mL の滅菌水で洗い流して表面。
- リン酸 10 mL で洗い、HEK293T 細胞は緩衝生理食塩水 (PBS)、3 分追加 5 mL の培地の 37 ° C で 0.25% トリプシン-EDTA 溶液 2 mL で各 100 mm ディッシュでセル単一層を扱い、細胞を再懸濁します。
- 診断でセルをカウントし 250,000 セル/ml 培養液中に細胞懸濁液の密度を調整し、培地 2 mL に 6 ウェル プレートのリジン コーティングそれぞれの 500,000 のセルを追加します。加湿 5 内のセルをインキュベート % CO295 %24 h 37 ° C での大気中の空気し、ペニシリンやストレプトマイシンなし DMEM に培養液を交換します。
- 1.5 mL チューブで 500 μ L の血清または抗生物質なし DMEM のトランスフェクション試薬の 20 μ L を希釈します。ピペットで穏やかに混合し、5 分間室温放置します。
- 一方、ピペットの 2 つの 1.5 mL チューブのそれぞれに DMEM を 250 μ l 添加し、375 psPAX2 の 1225 ng や pLenti6P SLC26A4QL pLVX EIP YFP 1500 ng を追加各 pMD2.G の ng。レンチ ウイルスの 2 種のプラスミドは、前述の21をされています。各プラスミド管に希釈したトランスフェクション試薬の 250 μ L を追加、穏やかに混合、室温で 20 分間インキュベートします。
- 20 分後トランスフェクション試薬とプラスミド錯体を 500 μ l 添加 1.5 mL チューブに滴下に追加手順 1.4 とミックスにも各培養プレート ロッキング プレートを前後。12 h の CO2インキュベーターで 37 ° C でセルを孵化させなさい。
- 2.5 ml の新鮮な媒体の媒体を交換し、さらに 48 時間インキュベートします。次にレンチ ウイルスの感染性を維持するために冷蔵を含む馴化培地を保つために 5 分間氷の上培養プレートを置きます。
- レンチを含むメディアを収穫し、15 mL の円錐管に転送します。3 分の 4 ° C で 3,000 x gで遠心し、上清から 0.4 μ m のろ過によって浮遊 HEK293T 細胞を削除します。
- 2 日以内の使用のための 4 ° C でレンチを含むメディアを格納します。後で使用するため保存 −80 ° c. で 200 μ 因数
2. LN215 YFPQLおよび LN215 の生成-私レンチ ウイルス伝達による−細胞
- 80% に LN215 100 mm 培養皿の細胞成長 10% 牛胎児血清 (FBS) 100 U/mL ペニシリンと前述の 100 μ g/mL ストレプトマイシン DMEM で合流します。
注: 場合 YFP ギャップ分析は、別のセルの行を使用して行われている、適切な培養培地を使用します。LN215 YFPQL、および LN215-私の-延世大学校産業大学財団が提供できます。対応する作成者に問い合わせてください。 - 1 日前に伝達、洗って 37 ° C で 3 分間で 0.25% トリプシン-EDTA の 2 ml と 10 mL の PBS、治療 2 回セルを 5 mL の培地 10 mL の血清学のピペットで細胞を再懸濁します、50,000 セル/ml の密度を調整します。メディアの 400 μ L でないウイルス制御、YFPQL、SLC26A4 細胞と治療 24 ウェル培養プレートの各ウェルに 20,000 セルを追加します。
- 37 ° C で培養 24 時間後に、400 μ L pLVX EIP YFPQLまたは pLenti6P SLC26A4 レンチと polybrene 最終 4 μ G/ml の濃度で添加新鮮な培養液中の 1:1 混合物の培養液を置き換えることによって 2 つの井戸を変換します。ないウイルス コントロールの培養液に置き換えます。
- 15 h の 37 ° C で細胞をインキュベート レンチを含む培地を吸引、新鮮な培養液を追加し、さらに 72 時間細胞を孵化させなさい。
注意: 井戸間レンチ ウイルスの汚染を防ぐためには、使用して新しいヒントや pipets 各ウェルのレンチ ウイルスを含む培養液を吸引または新鮮な成長培地を分注するとき。 - 洗っても二度各セル PBS の 0.5 mL で扱うトリプシン-EDTA の 300 μ L で 3 分が 2 ml 培養液中の細胞、2 μ G/ml 産 6 ウェル培養皿でプレートを再懸濁します。
- コントロールのすべてのセルはよく死んでいるまで 2 μ G/ml ピューロマイシンを含んでいる媒体で細胞の培養 (丸型または浮動顕微鏡で観察すると)、通常 1 週間かかります。選考期間中毎日ピューロマイシンを含む培地を更新します。場合 LN215 YFPQLまたは LN215-私は-文化になる合流選択が完了する前に、転送 100 mm までのセル板し、ステップ 2.5 のように選択を続行します。
3. アッセイに必要な溶液の調製
- 500 mL C ソリューション (10 mM HEPES、140 mM の NaCl、10 mM グルコース、5 mM KCl、MgCl2、1 mM と 1 mM の CaCl2) とソリューション (10 mM HEPES、140 mM 10 mM グルコース、KCl、5 mM と 1 mM の CaCl2NaI) 500 mL を準備します。
- ソリューション ストレージの 0.4 μ m でろ過滅菌、1 N NaOH で 7.4 に両方の溶液の pH を調整します。1 ヶ月 4 ° C で保存します。使用前に pH をチェックします。
4. めっき LN215 YFPQLおよび LN215-私−セル
- 文化 LN215 YFPQL LN215-私−細胞アッセイに必要な人口に到達するための培養培地で個別に 100 mm の版。LN215 YFPQLおよび LN215-私 40%−セルと 100 mm プレートで 80% の confluency それぞれ、96 ウェル プレートの試金のため十分です。
- YFP ギャップ分析を実施する前に 1 日 10 mL の PBS 各 100 mm 培養プレートを洗います。0.25% トリプシン-EDTA 溶液 2 mL、各プレートを扱い、5 分培養培地 4 mL、15 mL の円錐管に転送の各プレートで細胞を再懸濁しますの 37 ° C で孵化させなさい。
- 上澄み 1,000 x gで 3 分間破棄での遠心分離によって細胞をペレットし、5 ml の培地の各細胞ペレットを再懸濁します。10 mL の血清ピペットで上下に約 20 倍をピペッティングによる単一セルの細胞塊を破る。
- 検定のセルをカウントし、80,000 細胞/ml で LN215 YFPQLおよび LN215 の細胞懸濁液に培養液中の細胞を希釈-私 160,000 細胞/ml で− 。
- 7 mL LN215 YFPQLと LN215 7 mL をミックス-私貯水池である−細胞の懸濁液。マルチ チャンネル ピペットを使用して 96 ウェルの細胞培養プレートの各ウェルに 100 μ L の混合物を追加します。
注: セルの 96 ウェル プレートの各ウェルに 100 μ L の混合物を追加するには、混合細胞懸濁液の約 10 mL が必要です。必要以上細胞懸濁液を確認することをお勧めします。 - 細胞をインキュベートの 5% CO295 %24 h の 37 ° C で空気を加湿します。LN215 YFPQLおよび LN215-私−細胞培養アッセイを行ったとき 100% 合流をする必要があります。
5-YFPギャップ分析を実施
メモ: を使用して 20 倍の倍率で蛍光顕微鏡や 96 ウェルのプレートを確認してくださいそこに GFP フィルターは、LN215 YFPQLまたは LN215 SLC26A4 細胞の塊ではありませんし、培養細胞が完全に合流し、前にも分散アッセイを行っています。
- アッセイを行う前に、少なくとも 30 分は、マイクロ プレートをオンにし、37 ° C に設定
- 70% のエタノールの 3 mL、3 mL の蒸留水、し - 溶液 3 mL を自動注入器のチューブを 300 μ L/秒の流量で洗ってください。
- C- と私-ソリューション水のバスで 37 ° c を温めます。
注: 96 ウェル プレートの各ウェルに 100 μ L の各ソリューションを必要に応じて約 10 mL の各ソリューションがそれぞれの試金のため必要です。私はソリューションの追加 10 mL 各プレート (20 mL の合計) をプライミングに必要な各プレート (35 mL の合計) を洗浄するため C ソリューションの追加 25 mL は必要があります。 - 成長培地を吸引またはそれを空にする板を反転残留中をタップします。
注: 成長媒体の牛胎児血清の残留分析品質の背景の蛍光性の低下とが発生します。 - マルチ チャンネル ピペットを用いた貯留層から C 溶液 200 μ L を各ウェルに追加します。C ソリューションを吸引したり、空にして残液をタップ プレートを反転したり。
- 50 μ L μ l 添加 2.5 mM 化学株式の 1 μ L、C ソリューション (表 1参照) 車両としてジメチルスルホキシド (DMSO) や、50 μ L μ L マルチ チャンネル ピペットの各ウェルに C ソリューション。
注: 化学ライブラリのほとんどの試薬 DMSO に溶解しているほとんどの細胞に基づく試金24で最大 1% (v/v) が許可されて.DMSO は水よりも密度が高いため、DMSO に溶解した試薬を試験溶液の濃度を妨げる下培養プレート井戸に追加するときにダウンする傾向があります。これは、順序で C ソリューション、DMSO、試薬 50 μ L C ソリューションの 50 μ L を追加することによって回避できます。C ソリューションの最後の 50 μ L を混合するためです。 - 37 ° c の空気 5% CO2ではなく、セルを孵化させなさい。インキュベーション時間を変更することができます、しかし、10 分は行動するイオン チャネルの変調器は通常十分です。
- 1 私ソリューション各ウェルに 100 μ L を注入するためのマイクロ プレート リーダー プログラムを設定、インキュベーション中に s 10 の蛍光を測定して 0.4 秒間隔で s。底から蛍光を読み取るためのリーダーを設定します。推奨される注入速度は 135 μ L/s. セット 485 nm と読んで 520 で発光励起波長 nm。
注: マイクロ プレート リーダー プログラムの設定の詳細は次のとおりです。- 管理プロトコルをクリックします。
- 新しいボタンをクリックします。読書の測定方法] セクションともモードで蛍光強度を選択モード] セクション。次に、 [ok]ボタンをクリックします。新しいタブが表示されます。
- 基本的なパラメーターメニュー設定励起波長 485 nm と 520 で発光 nm。下部ファイバー下から蛍光を読み取ることを選択します。セット測定開始する時刻「0 s」、間隔が「25」、点滅の数好評につき、間隔は"20"とする時間間隔の数"0.4 s」。
- レイアウトメニューで読めるようにプレートの領域を描画します。
- 濃度/ボリューム/Shackingメニューで 135 μ L/s 射出速度の私ソリューション各ウェルに 100 μ L 注入するマイクロ プレート リーダーを設定します。
注: は、彼らは細胞の剥離につながりますので射出速度を避けてください。 - 射出時間メニューで設定 1 注入開始時刻 s。測定を開始] ボタンをクリックします。
- インキュベーション後、マイクロ プレート リーダーの 96 ウェルのプレートを配置し、測定を開始ボタンをもう一度クリックして、測定を開始します。
6. ギャップ アクティビティの計算
- YFPQL焼入れ23としてギャップ活動のパーセンテージを計算します。
YFPQL焼入れ (%) =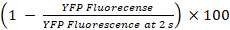
ギャップ アクティビティ (%) =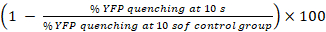
注: 原則として、ギャップ活動から計算するようにドナー細胞受容体細胞とウェルズに YFP 蛍光の割合の違いと対応する受容体細胞のみ井戸します。ただし、LN215 YFPQLとして細胞を示す無視 YFP 焼ヨウ化に 10 s、我々 を取らない背景 YFP 焼考慮に際しては HTS LN215 YFPQLと LN215 を使用して-私の-細胞。
結果
29 96 ウェル培養皿は LN215 YFPQLおよび LN215 を使用して - YFP ギャップ分析によって小説のギャップ変調器を識別する 2,320 化学物質をスクリーニングするため使用された-私−セル。代表板で得られた結果は、図 2のとおりです。各ウェルに YFP 蛍光の割合は図 2Aの線グラフとして表示されます、各?...
ディスカッション
堅牢・迅速かつ安価なので、高温超伝導の YFP ギャップ分析を使用できます。HTS アッセイは、堅牢なと見なされます場合 Z'-0.525上記要因です。「高温超伝導体の適合性を評価するために使用する統計解析説明の張ら25の試金します。LN215 セルを使用すると、Z'-要因だった > 任意のアッセイの最適化なし 0.5。他の細胞型、試金およびその Z で使用されます '-?...
開示事項
著者はある利益相反を開示します。
謝辞
この研究は、基本的な科学研究開発プログラムを通じて、国立研究財団の韓国 (NRF) 教育省によって資金を供給によって支えられた (2011-0023701、2016R1D1A1A02937397、および 2018R1A6A1A03023718)。
資料
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
参考文献
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved