Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un essai de Communication intercellulaire-jonction iodure-jaune Fluorescent Protein-Gap
Dans cet article
Résumé
Nous présentons ici un protocole pour un dosage de communication intercellulaire de jonction gap roman conçu pour le criblage à haut débit de gap junction-modulation produits chimiques pour la découverte et l’évaluation toxicologique.
Résumé
Jonctions lacunaires (JL) sont des canaux de la membrane cellulaire qui permettent la diffusion des molécules plus petite que 1 kDa entre des cellules adjacentes. Car ils ont des rôles physiologiques et pathologiques, on besoin de haut débit (HTS) de dépistage tests pour identifier les modulateurs GJ lors d’essais de toxicologie et découverte de drogue. Un dosage de jonction intercellulaire communication (I-YFP-CIJL) roman iodure-jaune fluorescent protein-gap répond à ce besoin. C’est un essai sur les cellules dont les cellules accepteur et donateurs qui ont été conçues pour exprimer stablement une variante de la protéine fluorescente jaune (YFP), dont la fluorescence est sensiblement piégée par iodure ou SLC26A4, un transporteur d’iodure, respectivement. Lorsque l’iodure est ajouté à une culture mixte des deux types cellulaires, ils entrer dans les cellules du donneur via le transporteur SLC26A4 et diffusent vers les cellules adjacentes accepteur via GJs où ils étancher la fluorescence de la YFP. YFP fluorescence est mesurée bien par bien en mode cinétique. Le taux d’extinction YFP reflète l’activité GJ. Le test est fiable et assez rapide à utiliser pour HTS Le protocole de l’essai j’ai-YFP-CIJL à l’aide des LN215 des cellules, cellules de gliome humain, est décrite.
Introduction
Jonctions lacunaires (JL) agissent comme des canaux intercellulaires pour permettre la diffusion de petites molécules de < 1 kDa comme nutriments, métabolites et molécules de signalisation entre des cellules adjacentes. Les éléments jonctionnelles comprennent un hémicanaux ou connexon dans chaque cellule et chaque connexon constitue six connexines (CX)1. JL et CX ont été utilisés dans les essais de toxicologie des carcinogènes comme les hydrocarbures aromatiques polycycliques (HAP), qui sont des inhibiteurs GJ2,3,4. CIJL perturbée a été associée par génotoxiques carcinogenèse5,6. Comme une cible thérapeutique potentielle, implication GJ a signalé en particuliers sous-types de saisies7,8, protection du cardiaques et cérébrales ischémie/reperfusion injury9, migraine avec aura10, lésion hépatique induite par le médicament6,11et12de cicatrisation. Tests de dépistage (HTS) haut débit sont nécessaires pour identifier les produits chimiques modulant GJ ou des anticorps pour la découverte de médicaments, pour les tests de toxicologie et d’identifier de nouveaux régulateurs cellulaires d’activité GJ. Tests de HTS permet également d’étudier les relations structure-activité de GJ modulateurs2,13,14,15.
Certains tests CIJL comprennent le transfert de teinture ou de techniques de double patch clamp. Lucifer jaune CH (LY) et calcéine acétoxyméthyl ester (calcéine-AM) ont été utilisés dans des essais de transfert de la teinture. Les cellules ne sont pas perméables à LY, qui est introduit par micro-injection, gratter chargement ou électroporation. Une fois à l’intérieur de la cellule, LY se répand dans les voisins des cellules via GJs et GJ l’activité est mesurée par l’ampleur de la migration de LY16. Tests de Calcéine-AM impliquent généralement récupération de gap-fluorescence après Photoblanchiment17,18. Calcéine-AM est un colorant cellulaire perméable est transformé intracellulairement calcéine imperméable par une estérase intrinsèque. Le test nécessite un microscope confocal pour observer le transfert de calcéine-AM dans une cellule de ceux qui l’entourent après Photoblanchiment laser. Si JL fonctionnels est présents, calcéine-AM dans des cellules adjacentes pénètre dans les cellules de la photobleached et la fluorescence est récupérée. GJ l’activité est mesurée par le degré de récupération de la fluorescence des cellules photobleached. Le transfert de teinture dosages sont laborieux et fastidieux ou ont une sensibilité faible. Patch double serrage est une méthode électrophysiologique qui mesure la conductance jonctionnelle. Il est relativement sensible, avec une dépendance directe de la conductance sur le nombre d’open JL19; Toutefois, il est techniquement difficile, chronophage et coûteux20. Le je-YFP-CIJL a été développé pour une utilisation en HTS
La figure 1 illustre les composants et les étapes du test j’ai-YFP CIJL, qui utilise des cellules accepteur exprimant une variante YFP iodure sensibles portant H148Q et I152L (YFPQL) et donneur de cellules exprimant un transporteur iodure (SLC26A4)21 . Les deux mutations portées par YFPQL permettent l’extinction de fluorescence par iodure22. Iodures sont ajoutés à l’accepteur co cultivée et les cellules du donneur ; ils n’entrent pas dans les cellules de l’accepteur, mais sont absorbés par les transporteurs SLC26A4 présents sur les cellules du donneur. Iodures dans les cellules du donneur diffusent à travers de JL fonctionnel dans les cellules adjacentes accepteur où ils étancher la fluorescence YFPQL . Si JL est fermés ou bloqués par les inhibiteurs, iodure ne peut pas entrer les cellules accepteur pour étancher la fluorescence. Le taux d’extinction YFPQL reflète l’activité GJ. Le mode OPERATOIRE j’ai-YFP CIJL n’est ni compliqué ni votre temps. Il est compatible avec HTS et peut être utilisé pour tester les effets d’un grand nombre de composés sur l’activité GJ dans une période relativement courte. Il faut seulement accepteur et cellules du donneur et deux solutions salines équilibrées. Le protocole décrit ci-dessous est basé sur LN215 cellules dont Cx majeur est Cx4321. Le récepteur LN215-YFPQL et LN215-j’ai− cellules du donneur ont été générés par transduction avec lentivirus exprimant YFPQL ou SLC26A421,23.
Protocole
1. génération de lentivirus exprimant YFPQL et SLC26A4
- La croissance de cellules humaines embryonnaires de rein HEK293T à 80 % confluency sur les plaques de culture de 100 mm. Modifié Eagle (DMEM de Dulbecco) additionné de sérum de veau fœtal 10 %, 100 U/mL de pénicilline et 100 µg/mL de streptomycine est le milieu de culture utilisé dans tout le protocole pour maintenir HEK293T et autres cellules mentionnées ci-dessous.
- Plaques 6 puits culture manteau en ajoutant 2 mL de 0,005 % d’une solution stérile poly-L-lysine (PLL) dans chaque puits pendant 10 min. aspirer la solution PLL et rincer la surface deux fois avec 2 mL d’eau stérile.
- Laver le HEK293T cellules avec 10 mL de phosphate solution saline tamponnée (PBS) et traitent les monocouches de cellules dans chaque plat de 100 mm avec 2 mL de solution de trypsine-EDTA de 0,25 % à 37 ° C pendant 3 min. ajouter 5 mL de milieu de culture et remettre les cellules en suspension.
- Compter les cellules dans un hémocytomètre et ajuster la densité de la suspension cellulaire à 250 000 cellules/mL dans le milieu de culture et ajouter 500 000 cellules dans 2 mL de milieu de culture à chacune lysine revêtu bien des plaques 6 puits. Incuber les cellules dans un 5 humidifié CO295 % l’atmosphérique à 37 ° C pendant 24 h et puis remplacez le milieu de culture par DMEM sans la pénicilline ou la streptomycine.
- Dans un tube de 1,5 mL, diluer 20 µL de réactif de transfection avec 500 µL de DMEM sans sérum ou des antibiotiques. Mélanger doucement en pipettant également et laisser reposer à température ambiante pendant 5 min.
- Pendant ce temps, distribuer 250 µL de DMEM dans chacun des deux tubes de 1,5 mL et puis ajoutez 1500 ng de pLVX-EIP-YFPQL ou pLenti6P-SLC26A4, 1225 ng de psPAX2 et 375 ng de pMD2.G à chacun. Les deux plasmides des gènes ont été décrites précédemment21. Ajouter 250 µL de réactif de transfection dilué dans chaque tube de plasmide, mélanger doucement et incuber pendant 20 min à température ambiante.
- Après 20 min, ajouter 500 µL de complexes de réactif et plasmide de transfection dans les tubes de 1,5 mL goutte à goutte chaque plaque de culture bien à l’étape 1.4 et mélange en balançant la plaque avant et en arrière. Incuber les cellules à 37 ° C dans un incubateur à CO2 pendant 12 h.
- Remplacez le support par 2,5 mL de milieu frais et incuber pendant 48 h supplémentaires. Placez ensuite la plaque de culture sur la glace pendant 5 min garder le milieu conditionné contenant lentivirus réfrigérés pour maintenir l’infectiosité.
- Récolter les médias contenant des lentivirus et transfert à tubes coniques 15 mL. Centrifuger à 3 000 g à 4 ° C pendant 3 min, puis retirez les cellules HEK293T flottants du surnageant par filtration à 0,4 µm.
- Stocker les médias contenant des lentivirus à 4 ° C pour une utilisation en 2 jours. Pour une utilisation ultérieure, stocker 200 µL d’extraits à −80 ° C.
2. génération de LN215-YFPQL et LN215-j’ai− cellules par transduction lentiviraux
- La croissance de cellules LN215 en plaques de culture de 100 mm à 80 % confluency en DMEM additionné de 10 % sérum fœtal (SVF) 100 U/mL de pénicilline et 100 µg/mL de streptomycine comme décrit ci-dessus.
Remarque : Si le test j’ai-YFP-CIJL est mené à l’aide d’une lignée de cellules différentes, utiliser le milieu de culture approprié. LN215-YFPQLet LN215-je– cellules peuvent être fournis par la fondation de l’université-industrie, Université de Yonsei. Veuillez communiquer avec l’auteur-correspondant. - Veille de transduction, laver les cellules deux fois 10 ml de PBS, traitent avec 2 mL de 0,25 % de trypsine-EDTA à 37 ° C pendant 3 min. remettre en suspension les cellules dans 5 mL de milieu de culture avec une pipette sérologique de 10 mL et ajuster la densité à 50 000 cellules/mL. Ajouter 20 000 cellules dans 400 µL de médias dans chaque puits d’une plaque 24 puits de culture pour un traitement sans viruscontrol et YFPQLSLC26A4 cellules.
- Après 24 h d’incubation à 37 ° C, transduce deux puits en remplaçant le milieu de culture avec 400 ml d’un mélange de 1:1 de pLVX-EIP-YFPQL ou pLenti6P-SLC26A4 lentivirus et milieu de culture frais additionné de polybrene à une concentration finale de 4 µg/mL. Pour aucun contrôle de virus, remplacez par le milieu de culture.
- Incuber les cellules à 37 ° C pendant 15 h, aspirer le support contenant des lentivirus, ajoute le milieu de culture frais et incuber les cellules pendant 72 h supplémentaires.
Attention : Pour prévenir la contamination des lentivirus entre puits, utilisez nouvelles astuces ou pipettes pour chaque puits lorsque vous aspirez le milieu de culture contenant des lentivirus ou dispenser de milieu frais. - Laver que les cellules chacune bien deux fois avec 0,5 mL de PBS, traitent avec 300 µL de trypsine-EDTA pour 3 min. remettre en suspension les cellules dans 2 mL de milieu de culture et la plaque en plaques 6 puits culture avec la puromycine 2 µg/mL.
- La culture des cellules dans un milieu contenant la puromycine 2 µg/mL jusqu'à ce que toutes les cellules dans le contrôle sont bien morts (ronds ou flottant à observé au microscope), qui prend habituellement une semaine. Actualiser les milieux de culture contenant la puromycine tous les deux jours au cours de la période de sélection. Si LN215-YFPQL ou LN215-je– confluente de cultures devenus avant sélection terminée, transfert les cellules à 100 mm sur plaque et continuent à choisir comme au point 2.5.
3. préparation des solutions requises pour le dosage
- Préparer 500 mL de solution C (10 mM HEPES, 140 mM NaCl, glucose de 10 mM, 5 mM KCl, 1 mM MgCl2et 1 mM CaCl2) et 500 mL de solution (10 mM HEPES, 140 mM NaI, glucose de 10 mM, 5 mM de KCl et 1 mM CaCl2).
- Ajuster le pH de ces deux solutions à 7,4 avec NaOH N 1, stériliser les solutions de filtrations à 0,4 µm pour le stockage. Conserver à 4 ° C pendant environ 1 mois. Vérifier le pH avant d’utiliser.
4. le LN215-YFPQL et LN215 de placage-j’ai− cellules
- La culture LN215-YFPQL et LN215-j’ai− cellules en plaques de 100 mm séparément en milieu de culture pour atteindre les populations requises pour l’analyse. LN215-YFPQL et LN215-j’ai− cellules dans 40 % et 80 % confluence en plaques de 100 mm, respectivement, sont suffisantes pour un dosage de la plaque à 96 puits.
- Un jour avant d’effectuer le test de CIJL j’ai-YFP, laver chaque plaque de culture de 100 mm avec 10 mL de PBS. Traiter chaque plaque avec 2 mL de solution de trypsine-EDTA de 0,25 % et incuber à 37 ° C pendant 5 min. remettre en suspension les cellules dans chaque assiette dans 4 mL de milieu de culture et de la transférer dans les tubes coniques 15 mL.
- Les cellules de granule par centrifugation à 1 000 x g pendant 3 min. jeter le surnageant et remettre chaque culot cellulaire avec 5 mL de milieu de culture. Briser tout amas de cellules en cellules individuelles par pipetage de haut en bas environ 20 fois avec une pipette sérologique de 10 mL.
- Compter les cellules dans un hémocytomètre et diluer les cellules dans le milieu de culture pour faire des suspensions cellulaires de LN215-YFPQL à 80 000 cellules/mL et LN215-j’ai− à 160 000 cellules/mL.
- Mélanger 7 mL de LN215-YFPQL et 7 mL de LN215-j’ai des suspensions cellulaires− dans un réservoir. Ajouter 100 µL du mélange dans chaque puits d’une plaque de culture de cellules de 96 puits à l’aide d’une pipette multicanaux.
Remarque : Pour ajouter 100 µL du mélange dans chaque puits de la plaque à 96 puits cellulaire, environ 10 mL de suspension cellulaire mixte est nécessaire. Il est recommandé de faire plus de suspension de cellules que nécessaire. - Incuber les cellules à humidifier 5 % CO295 % air à 37 ° C pendant 24 h. Le LN215-YFPQL et LN215-j’ai−cell culture doit être anastomosé 100 % lorsque l’essai est effectué.
5. effectuer le test de CIJL j’ai-YFP
Remarque : Utiliser un microscope à fluorescence avec un grossissement de 20 x et un filtre GFP pour s’assurer que les plaques de 96 puits il ne sont aucuns massifs de LN215-YFPQL ou SLC26A4-LN215 cellules et que les cultures cellulaires sont entièrement confluentes et bien distribuée avant effectuer le test.
- Au moins 30 min avant de faire l’essai, mettre en marche une microplaque et réglé à 37 ° C.
- Laver le tube d’un injecteur automatique avec 3 mL d’éthanol à 70 %, 3 mL d’eau distillée, puis 3 mL de solution j’ai à un débit de 300 µL/s.
- Réchauffer les C-I-solutions et à 37 ° C dans un bain-marie.
Remarque : Comme 100 µL de chaque solution est nécessaire pour chaque puits de la plaque à 96 puits, environ 10 mL de chaque solution est nécessaire pour chaque dosage. 10 mL de la solution j’ai supplémentaire est nécessaire pour amorcer chaque plaque (20 mL au total) et 25 mL de la solution C supplémentaire est nécessaire pour le lavage de chaque plaque (35 mL au total). - Aspirez le milieu de croissance ou d’inverser la plaque pour vider Tapez sur moyen résiduel.
NOTE : Sérum de veau fœtal résiduelle dans les milieux de culture provoque fluorescence de fond et une baisse de qualité dosage. - Ajouter 200 µL de solution-C dans chaque puits d’un réservoir à l’aide d’une pipette multicanaux. Aspirer la solution C ou inverser la plaque pour vider et taper la solution résiduelle.
- Ajouter 50 µL µL C-solution, 1 µL de stock chimique de 2,5 mM (voir tableau 1) ou diméthylsulfoxyde (DMSO) comme un véhicule et puis 50 µL µL solution-C dans chaque puits avec une pipette multicanaux.
Remarque : La plupart des réactifs dans une bibliothèque de produits chimique sont dissous dans le DMSO et jusqu'à 1 % (v/v) est autorisé dans la plupart des tests basés sur les cellules24. DMSO ayant une densité plus élevée que l’eau, réactifs dissous dans le DMSO ont tendance à descendre vers le bas lors de l’ajout dans les puits de plaque de culture, qui perturbe les concentrations des solutions de test. Ceci peut être contourné en ajoutant 50 µL de la solution C, réactifs dans le DMSO et 50 µL C de - solution dans l’ordre. Le dernier 50 µL de solution C est pour le mélange. - Incuber les cellules à 37 ° C dans l’air, et non dans les 5 % de CO2. Le temps d’incubation peut être modifié, mais 10 min est généralement suffisant pour modulateurs des canaux ioniques à agir.
- Durant l’incubation, définir le programme de lecteur de microplaques à injecter 100 µL de je-solution dans chaque puits à 1 s et de mesurer la fluorescence pendant 10 s intervalles de 0,4 s. Réglez le lecteur pour lire la fluorescence du fond. La vitesse d’injection recommandées est 135 µL/s. ensemble la longueur d’onde d’excitation à 485 nm et lire l’émission à 520 nm.
Remarque : Les paramètres détaillés pour les programmes de lecteur de microplaques sont comme suit.- Cliquez sur le bouton de gestion des protocoles .
- Cliquez sur le bouton nouveau . Sélectionner l' Intensité de Fluorescence à la section méthode de mesure et Bien le Mode en lecture section mode. Ensuite, cliquez sur le bouton OK . Nouvel onglet s’affiche.
- Dans le menu Paramètres de base , définissez la longueur d’onde d’excitation à 485 nm et l’émission à 520 nm. Sélectionnez Fond optique lire la fluorescence du fond. Set mesure commencer à temps pour être « 0 s », le nombre d’intervalles à être « 25 », nombre d’éclairs par puits et intervalle d’être « 20 » et intervalle de temps à être « 0,4 s ».
- Dans le menu disposition , tirer la région de la plaque pour être lu.
- Dans le menu de Concentrations/Volumes/Shacking , régler le lecteur de microplaques à injecter 100 µL de je-solution dans chaque puits avec 135 vitesse d’injection µL/s.
Remarque : Évitez les vitesses plus rapides de l’injection car ils peuvent entraîner le détachement des cellules. - Dans le menu de temps d’Injection , réglez l’heure de début d’injection à 1 s. Puis, cliquez sur le bouton Démarrer mesureur .
- Après incubation, placer les plaques de 96 puits dans le lecteur de microplaques et démarrer la mesure en cliquant sur le bouton Démarrer mesureur à nouveau.
6. calcul de l’activité CIJL
- Calculer les pourcentages de YFPQL trempe et activité CIJL23
YFPQL trempe (%) =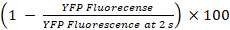
L’activité CIJL (%) =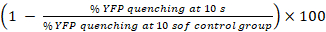
Remarque : En principe, activité CIJL devrait être calculée par la différence des pourcentages de fluorescence YFP dans les puits avec des cellules de l’accepteur et de cellules du donneur et l’accepteur-cellule correspondante puits seulement. Toutefois, comme LN215-YFPQL cellules montrent négligeable YFP trempe par iodure après 10 s, nous ne prenons pas la trempe fond YFP en considération lorsqu’il mène HTS en utilisant LN215-YFPQL et LN215-je– cellules.
Résultats
Vingt-neuf plaques de 96 puits de culture ont été utilisées pour écran 2 320 produits chimiques afin d’identifier de nouveaux modulateurs CIJL essai CIJL YFP-j’ai de la LN215-YFPQL et LN215-j’ai− cellules. Les résultats obtenus avec une plaque représentante sont présentés dans la Figure 2. Le pourcentage de la fluorescence de la YFP dans chaque puits s’affiche comme un ligne graphique en Figure 2
Discussion
Le test j’ai-YFP-CIJL peut être utilisé pour HTS parce qu’il est robuste, rapide et peu coûteux. Un dosage HTS est considéré comme robuste si la Z'-facteur est supérieure à 0,525. Voir Zhang et coll. pour obtenir une description de l’analyse statistique utilisée pour évaluer l’adéquation des HTS essais25. Lorsque des cellules LN215 ont été utilisées, le Z'-facteur était > 0,5 sans aucune optimisation de dosage. Si les autres types de cellules sont util...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Cette recherche a été financée par le programme de recherche sciences fondamentales grâce à la fondation de la recherche nationale de Corée (NRF) financé par le ministère de l’éducation (2011-0023701, 2016R1D1A1A02937397 et 2018R1A6A1A03023718).
matériels
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
Références
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon