Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de comunicación Unión intercelular yoduro amarillo fluorescente proteína-Gap
En este artículo
Resumen
Aquí, presentamos un protocolo para un ensayo de comunicación intercelular cruce nuevo espacio diseñado para el cribado de alto rendimiento de productos químicos modulación de ensambladura de gap para el descubrimiento de medicamentos y evaluación toxicológica.
Resumen
Uniones comunicantes (GJs) son canales de la membrana de la célula que permiten difusión de moléculas más pequeñas que 1 kDa entre células adyacentes. Ya que tienen funciones fisiológicas y patológicas, hay necesidad de high-throughput screening (HTS) ensayos para identificar moduladores GJ en ensayos de toxicología y descubrimiento de drogas. Un ensayo de novela yoduro amarillo fluorescente proteína-gap comunicación Unión intercelular (I-YFP-GJIC) satisface esta necesidad. Es un ensayo basado en células como aceptor y donante de las células que están diseñadas para expresar estable una variante de la proteína amarilla fluorescente (YFP), cuya fluorescencia sensible se apaga por yoduro o SLC26A4, un transportador de yoduro, respectivamente. Cuando el yodo se añade a un cultivo mixto de los dos tipos celulares, entran en las células donantes vía el transportador SLC26A4 y difusa a las células adyacentes aceptador via GJs donde apaga la fluorescencia de YFP. Fluorescencia de YFP se mide bien por bien en un modo cinético. La tasa de amortiguamiento YFP refleja actividad GJ. El ensayo es fiable y rápida para HTS Se describe el protocolo para el ensayo de YFP-GJIC utilizando las células LN215, las células de glioma humano.
Introducción
Uniones comunicantes (GJs) actúan como Canales intercelulares que permiten la difusión de moléculas pequeñas de < 1 kDa como nutrientes, metabolitos y moléculas de señalización entre células adyacentes. Los elementos de Unión incluyen un hemichannel o connexon en cada célula, y cada connexon constituye seis conexinas (Cxs)1. GJs y Cxs se han utilizado en los ensayos de Toxicología de carcinógenos como los hidrocarburos aromáticos policíclicos (PAH), que son inhibidores GJ2,3,4. GJIC interrumpida se ha asociado con nongenotoxic carcinogénesis5,6. Como una diana terapéutica potencial, participación de GJ se ha divulgado en particular subtipos de convulsiones7,8, protección cardiaca y cerebro isquemia/reperfusión lesiones9, migraña con aura10, lesión hepática inducida por drogas6,11y12de cicatrización. Ensayos de high-throughput screening (HTS) son necesarios para identificar productos químicos modulación de GJ o anticuerpos para el descubrimiento de medicamentos, para los ensayos de Toxicología e identificar nuevos celulares reguladores de actividad GJ. Ensayos HTS pueden utilizarse también para investigar las relaciones estructura-actividad de GJ moduladores2,13,14,15.
Algunos ensayos GJIC incluyen transferencia de tinte o técnicas de sujeción de doble parche. Lucifer amarillo CH (LY) y éster acetoxymethyl de calceína (calceína-AM) se han utilizado en los ensayos de transferencia del tinte. Las células no son permeables a LY, que es introducido por microinyección, carga del rascado o electroporación. Una vez dentro de la célula, LY se extiende en vecino las células vía GJs y actividad GJ es analizado por la magnitud de la migración LY del16. Ensayos de calceína-AM implican generalmente recuperación de gap-Fluorescencia Tras Fotoblanqueo17,18. Calceína-AM es un colorante florescente de la célula que se convierte intracelularmente en calceína impermeable por una esterasa intrínseca. El ensayo requiere de un microscopio confocal para observar a la transferencia de calceína-AM en un celular de los que lo rodean después de photobleaching láser. Si GJs funcionales están presentes, calceína-AM en células adyacentes entra en las células photobleached y la fluorescencia se recupera. Actividad GJ es analizado por el grado de recuperación de fluorescencia de las células photobleached. Ensayos de transferencia del tinte están laborioso y desperdiciador de tiempo o tienen baja sensibilidad. Doble parche es un método electrofisiológico que mide conductancia junctional. Es relativamente sensible, con una dependencia directa de la conductancia en el número de GJs abierto19; sin embargo, es técnicamente exigente, lento y costoso20. El ensayo de YFP-GJIC fue desarrollado para su uso en el HTS.
La figura 1 ilustra los componentes y pasos del ensayo GJIC-YFP, que utiliza células de aceptador expresan una variante YFP yoduro sensibles teniendo H148Q y I152L (YFPQL) y células del donante manifestando un transportador de yoduro (SLC26A4)21 . Las dos mutaciones por YFPQL permiten el amortiguamiento de la fluorescencia por yoduro22. Se añaden yoduros aceptador Co cultivado y células de un donante; no entrar en las células del aceptador, pero son tomadas por los transportadores de SLC26A4 presente en las células del donante. Yoduro en las células del donante se difunden a través de GJs funcionamiento en células aceptor adyacente donde apaga la fluorescencia de YFPQL . Si GJs cerrados o bloqueados por inhibidores, yoduro no puede entrar en las células de aceptador para apagar de la fluorescencia. La tasa de amortiguamiento YFPQL refleja actividad GJ. El procedimiento del ensayo-YFP GJIC no es complicado ni mucho tiempo. Es compatible con HTS y puede utilizarse para probar los efectos de un gran número de compuestos en la actividad GJ en un período relativamente corto. Requiere sólo aceptador y células de donante y dos soluciones salinas equilibradas. El protocolo descrito a continuación se basa en células de LN215 cuya principales Cx es de Cx4321. El receptor LN215-YFPQL y LN215-I− células del donante se generaron por transducción con lentivirus expresando YFPQL o SLC26A421,23.
Protocolo
1. generación de lentiviruses expresando YFPQL y SLC26A4
- Crecer las células de riñón embrionario humano HEK293T 80% confluency en las placas de cultivo de 100 mm. Modificado Eagle Medium (DMEM de Dulbecco) suplementado con suero bovino fetal 10%, 100 U/mL de penicilina y estreptomicina μg/mL 100 es el medio de cultivo utilizado en el protocolo de mantener HEK293T y otras células que se mencionan a continuación.
- Capa bien 6 placas por cada bien durante 10 minutos, añadir 2 mL de 0.005% de solución estéril de (PLL) de poli-l-lisina aspiración la solución PLL y enjuague la superficie dos veces con 2 mL de agua estéril.
- Células de lavado el HEK293T con 10 mL de fosfato tampón salino (PBS) y tratan las monocapas de células en cada plato de 100 mm con 2 mL de solución al 0.25% tripsina-EDTA a 37 ° C por 3 minutos agregar 5 mL de medio de cultivo y resuspender las células.
- Contar las células en un hemocitómetro y ajustar la densidad de la suspensión celular a 250.000 células/mL en medio de cultivo y añadir 500.000 células en 2 mL de medio de cultivo cada una lisina revestido de placas de 6 pocillos. Incubar las células en un vapor 5% CO295% aire ambiente a 37 ° C durante 24 h y luego reemplazar el medio de cultivo por DMEM sin penicilina o estreptomicina.
- En un tubo de 1,5 mL, diluir 20 μl de reactivo de transfección con 500 μl de DMEM sin suero ni antibióticos. Mezclar suavemente mediante pipeteo y deje reposar a temperatura ambiente durante 5 minutos.
- Mientras tanto, pipetear 250 μl de DMEM en cada uno de dos tubos de 1.5 mL y luego añadir 1500 ng pLVX-EIP-YFPQL , 1225 ng de psPAX2 y pLenti6P-SLC26A4, 375 ng de pMD2.G a cada uno. La dos plásmidos lentivirales han sido previamente descritos21. Añadir 250 μl de reactivo de transfección diluido a cada tubo de plásmido, mezclar suavemente e incubar durante 20 min a temperatura ambiente.
- Después de 20 min, agregar 500 μl de reactivo y plásmido complejos de transfección en los tubos de 1.5 mL gota a gota a cada placa de cultivo bien en el paso 1.4 y mezcla, meciendo la placa hacia adelante y hacia atrás. Incube las células a 37 ° C en un incubador de CO2 de 12 h.
- Reemplazar el medio con 2,5 mL de medio fresco e incubar durante 48 h adicional. Luego coloque la placa de cultivo en hielo durante 5 minutos mantener el medio acondicionado con lentivirus refrigerados para mantener la infectividad.
- Los medios de comunicación que contiene lentivirus de la cosecha y transferir a tubos cónicos de 15 mL. Centrifugar a 3.000 x g a 4 ° C por 3 min y luego saque flotantes células HEK293T el sobrenadante por filtración a 0.4 μm.
- Almacenar los medios de comunicación que contiene lentivirus a 4 ° C para su uso dentro de 2 días. Para su uso posterior, almacenar 200 alícuotas μl a −80 ° C.
2. generación de LN215-YFPQL y LN215-I− células por transducción lentivirales
- Crecen las células LN215 en las placas de cultivo de 100 mm al 80% confluency en DMEM suplementado con 10% suero bovino fetal (FBS) 100 U/mL de penicilina y estreptomicina 100 de μg/mL como se describe anteriormente.
Nota: Si se lleva a cabo el ensayo de YFP-GJIC utilizando una línea celular diferente, utilice el medio de cultivo apropiado. LN215-YFPQLy LN215-I– las células pueden ser proporcionadas por la Fundación Universidad-empresa, Universidad de Yonsei. Por favor, póngase en contacto con el autor correspondiente. - Un día antes de transducción, lavan las células dos veces con 10 mL de PBS, tratan con 2 mL de 0.25% tripsina-EDTA a 37 ° C por 3 min resuspender las células en 5 mL de medio de cultivo con una pipeta serológica de 10 mL y ajustar la densidad a 50.000 células/mL. Añadir 20.000 células en 400 μL de medios de comunicación a cada pocillo de una placa de 24 pocillos cultura para tratamiento sin control de virus, YFPQL, como células SLC26A4.
- Después de 24 h de incubación a 37 ° C, transduce dos pozos mediante la sustitución del medio de cultivo con 400 μL de una mezcla 1:1 de pLVX-EIP-YFPQL o SLC26A4 pLenti6P lentivirus y fresco medio de cultivo suplementado con polibreno a una concentración final de 4 μg/mL. No hay controles de virus, reemplazar con medio de cultivo.
- Incube las células a 37 ° C durante 15 h, Aspire el medio con lentivirus, agregar medio de cultivo fresco e Incube las células por un adicional 72 h.
PRECAUCIÓN: Para evitar la contaminación de lentivirus entre pozos, utilizar puntas nuevas o pipetas para cada pozo al aspirar el medio de cultivo con lentivirus o servir de medio de cultivo fresco. - Lavado de que las células en cada pozo dos veces con 0,5 mL de PBS, tratan con 300 μL de tripsina-EDTA para 3 minutos resuspender las células en 2 mL de medio de cultivo y placa de la pozo seis placas con 2 puromicina μg/mL.
- Las células en medios que contienen 2 puromicina μg/mL hasta todas las células del control bien muertas de la cultura (en forma redonda o flotando cuando la observa en microscopio), que generalmente toma una semana. Actualizar los medios de cultivo que contienen puromicina cada otro día durante el período de selección. Si LN215-YFPQL o LN215-I– confluyente de las culturas se convierten antes de que termine la selección, transferencia de las células a 100 mm de la placa y seguir la selección como en el paso 2.5.
3. preparación de soluciones necesarias para el análisis de
- Preparar 500 mL de solución C (10 mM HEPES, 140 mM NaCl, 10 mM de glucosa, 5 mM KCl, 1 mM MgCl2y 1 mM de CaCl2) y 500 mL de-solution (10 mM HEPES, 140 mM NaI, glucosa 10 mM, 5 mM KCl y 1 mM de CaCl2).
- Ajustar el pH de ambas soluciones a 7,4 con 1 N NaOH, esterilizar las soluciones por filtraciones en 0,4 μm para el almacenamiento. Almacenar a 4 ° C durante 1 mes. Revise el pH antes de usar.
4. de la galjanoplastia del LN215-YFPQL y LN215-I− células
- La cultura LN215-YFPQL y LN215-I− células en placas de 100 mm por separado en medio de cultivo para alcanzar la población necesaria para el ensayo. LN215-YFPQL y LN215-I− células en 40% y 80% de confluencia en las placas de 100 mm, respectivamente, son suficientes para un ensayo de placa de 96 pocillos.
- Un día antes de realizar el ensayo GJIC-YFP, lave cada placa de cultivo de 100 mm con 10 mL de PBS. Tratar cada placa con 2 mL de solución al 0.25% tripsina-EDTA e incubar a 37 ° C por 5 min resuspender las células en cada placa en 4 mL de medio de cultivo y transferencia a tubos cónicos de 15 mL.
- Sedimenten las células por centrifugación a 1.000 x g durante 3 min descartar el sobrenadante y resuspender cada precipitado con 5 mL de medio de cultivo de células. Romper cualquier grumos de células en las células mediante pipeteo arriba y abajo unas 20 veces con una pipeta serológica de 10 mL.
- Contar las células en un hemocitómetro y diluir las células en el medio de cultivo para hacer suspensiones celulares de LN215-YFPQL 80.000 células/ml y LN215-I− 160.000 células/ml.
- Mezclar 7 mL de LN215-YFPQL y 7 mL de LN215-I− suspensiones celulares en un embalse. Añada 100 μl de la mezcla en cada pocillo de una placa de cultivo celular de 96 pozos utilizando una pipeta multicanal.
Nota: Para agregar 100 μl de la mezcla en cada pocillo de la placa de 96 pocillos de la célula, es necesario aproximadamente 10 mL de la suspensión celular mixta. Se recomienda hacer la suspensión más que lo necesario. - Incubar las células en humidificado 5% CO295% aire a 37 ° C durante 24 h. El LN215-YFPQL y LN215-I−cultivo de celular debe ser 100% confluente cuando se lleva a cabo el ensayo.
5. llevar a cabo el ensayo GJIC -YFP
Nota: Utilice un microscopio de fluorescencia con 20 aumentos y un filtro GFP al verificar las placas de 96 pozos que allí no hay grupos de LN215-YFPQL o SLC26A4 LN215 células y que los cultivos celulares son completamente confluente y bien distribuida antes de llevando a cabo el ensayo.
- Por lo menos 30 min antes de realizar el ensayo, active una microplaca y ajuste a 37 ° C.
- Lavar el tubo de un inyector automático con 3 mL de etanol al 70%, 3 mL de agua destilada y luego 3 mL de solución de a un caudal de 300 μL/s.
- Caliente el C y-soluciones a 37 ° C en el baño de agua.
Nota: 100 μl de cada solución necesaria para cada pocillo de la placa de 96 pozos, aproximadamente 10 mL de cada solución se necesita para cada ensayo. Es necesario un adicional 10 mL de la solución de cebado de cada plato (un total de 20 mL) y un adicional 25 mL de la solución C es necesario para el lavado de cada plato (un total de 35 mL). - Aspirar el medio de crecimiento o invertir la placa para vaciar golpee hacia fuera medio residual.
Nota: El suero bovino fetal Residual en los medios de crecimiento hace fluorescencia del fondo y una disminución en calidad de ensayo. - Añadir 200 μL de solución C a cada pocillo un depósito utilizando una pipeta multicanal. Aspirar la solución C o invertir la placa para vaciar y golpee hacia fuera de la solución residual.
- Añadir 50 μl μl solución C, 1 μl de caldo químico 2,5 mM (ver tabla 1) o dimetilsulfóxido (DMSO) como un vehículo y luego 50 μl μl solución de C en cada pocillo con una pipeta multicanal.
Nota: Más reactivos en una biblioteca química están disuelto en DMSO y se permite hasta un 1% (v/v) en ensayos de células mayor parte24. Como DMSO tiene una mayor densidad que el agua, reactivos disueltos en DMSO tienden a bajar hasta el fondo cuando se añade a los pocillos de la placa de cultivo, que perturba las concentraciones de las soluciones de ensayo. Esto puede eludirse mediante la adición de 50 μl de la solución C, reactivos en DMSO y 50 μl C de - solución en orden. El último 50 μl de la solución C es para la mezcla. - Incube las células a 37 ° C en aire, no en 5% CO2. El tiempo de incubación puede ser modificado, pero 10 minutos es suficiente para moduladores de canales iónicos para actuar.
- Durante la incubación, establecer el programa de lector de microplacas para inyectar 100 μl de solución en cada pocillo en 1 s y medir la fluorescencia para 10 s intervalos de 0,4 s. Configurar el lector para leer la fluorescencia de la parte inferior. La velocidad de inyección recomendada es 135 μl/s. sistema la longitud de onda de excitación a 485 nm y leer la emisión a 520 nm.
Nota: Los siguientes parámetros detallados para los programas de lector de microplacas.- Haga clic en el botón administrar protocolos .
- Haga clic en el botón nuevo . Seleccionar la Intensidad de fluorescencia en la sección de método de medición y Bien en la lectura sección de modo. A continuación, haga clic en el botón OK . Nueva pestaña aparecerán.
- En el menú de Parámetros básicos , establecer la longitud de onda de excitación a 485 nm y la emisión a 520 nm. Seleccione el Fondo óptica leer la fluorescencia de la parte inferior. Set medida empezar a tiempo "0 s", el número de intervalos que "el 25", número de parpadeos por pozo, intervalo que "20" e intervalo de tiempo que "0,4 s".
- En el menú diseño , dibujar la región de la placa para ser leído.
- En el menú de Las concentraciones/volúmenes/Shacking , configurar el lector de microplacas para inyectar 100 μl de solución en cada pocillo con 135 μl/s de velocidad de inyección.
Nota: Evite velocidades más rápidas de la inyección porque puede resultar en el desprendimiento de las células. - En el menú de tiempo de inyección , configurar el tiempo de comienzo de inyección 1 s. Entonces, haga clic en el botón de Inicio de medición .
- Después de la incubación, coloque las placas de 96 pocillos en el lector de microplacas y comenzar la medición haciendo clic en botón de la Medida de comenzar nuevamente.
6. cálculo de actividades GJIC
- Calcular los porcentajes de amortiguamiento de YFPQL y actividades GJIC como23
YFPQL amortiguamiento (%) =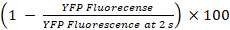
Actividades GJIC (%) =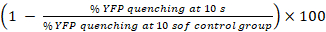
Nota: En principio, actividades GJIC se calculará por la diferencia de los porcentajes de fluorescencia YFP en pozos con aceptador de la células y células de donante y la correspondiente celda de aceptador solamente pozos. Sin embargo, como LN215-YFPQL las células muestran insignificante YFP Temple por yoduro después de 10 s, tomamos el amortiguamiento de YFP fondo en cuenta al realizar HTS con LN215-YFPQL y LN215-I– las células.
Resultados
29 placas 96 pocillos fueron utilizadas para detectar productos 2.320 químicos para identificar moduladores GJIC novela por ensayo GJIC-YFP usando el LN215-YFPQL y LN215-I− células. Los resultados obtenidos con una placa representativa se muestran en la figura 2. El porcentaje de fluorescencia de YFP en cada pozo se muestra como un gráfico de líneas en la figura 2A y el porcentaje de a...
Discusión
El ensayo de YFP-GJIC puede utilizarse para HTS porque es robusto, rápido y barato. Un ensayo HTS es considerado robusto si el Z'-factor está por encima de 0,525. Ver Zhang et al. para una descripción del análisis estadístico utilizado para evaluar la idoneidad de HTS ensayos25. Cuando se utilizaron las células de LN215, el Z'-factor fue > 0,5 sin ninguna optimización de ensayo. Si se utilizan otros tipos de células en el ensayo y su Z'-factor es < 0.5, la robustez ...
Divulgaciones
Los autores no tienen conflictos de interés divulgar.
Agradecimientos
Esta investigación fue apoyada por el programa de investigación de ciencia básica a través de la nacional investigación Fundación de Corea (NRF) financiado por el Ministerio de Educación (2011-0023701, 2016R1D1A1A02937397 y 2018R1A6A1A03023718).
Materiales
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
Referencias
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados