É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de comunicação intercelular junção iodeto-amarelo fluorescente proteína-Gap
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para um ensaio de comunicação intercelular junção romance lacuna projetado para o rastreio da elevado-produção de químicos de junção-modulando de lacuna para descoberta de drogas e avaliação toxicológica.
Resumo
Junções (GJs) são canais de membrana celular que permitem a difusão de moléculas menores que 1 kDa entre células adjacentes. Como eles têm papéis fisiológicos e patológicos, há necessidade de elevado-throughput screening (HTS) ensaios para identificar moduladores GJ em ensaios de toxicologia e descoberta de drogas. Um ensaio de comunicação intercelular-junção (I-YFP-GJIC) romance iodeto-amarelo fluorescente proteína-lacuna preenche essa necessidade. É um ensaio baseados em células, incluindo células aceitador e doadores que são projetadas para expressar estàvel uma variante da proteína fluorescente amarela (YFP), cuja fluorescência é saciada com sensibilidade por iodeto, ou SLC26A4, transportador de iodeto, respectivamente. Quando o iodeto é adicionado a uma cultura mista, os tipos de duas células, eles entram as células do doador através do transportador de SLC26A4 e difundem para as células adjacentes aceitador através de GJs onde eles saciar a fluorescência YFP. YFP fluorescência é medida bem por bem em um modo cinético. A taxa de resfriamento YFP reflete a atividade GJ. O ensaio é confiável e rápida o suficiente para ser usado para HTS O protocolo para o ensaio YFP GJIC usando as células LN215, células de glioma humano, é descrito.
Introdução
Junções (GJs) atuam como Canais intercelulares para permitir a difusão de pequenas moléculas de < 1 kDa como nutrientes, metabolitos e moléculas de sinalização entre células adjacentes. Os elementos juncionais incluem um hemichannel ou connexon em cada célula, e cada connexon constitui seis connexins (Cxs)1. GJs e Cxs têm sido utilizados em ensaios de toxicologia de carcinógenos como hidrocarbonetos aromáticos policíclicos (PAH), que são inibidores GJ2,3,4. Interrompido GJIC tem sido associada com nongenotoxic carcinogênese5,6. Como um potencial alvo terapêutico, GJ envolvimento tem sido relatado em particulares subtipos de convulsões7,8, proteção de cardíacos e cérebro isquemia/reperfusão lesão9, enxaqueca com aura10, lesão hepática induzida por drogas6,11e12de cicatrização de feridas. Elevado-throughput screening (HTS) ensaios são necessários para identificar produtos químicos GJ-modulando ou anticorpos para descoberta de drogas, para ensaios de toxicologia e identificar o romance celulares reguladores da atividade GJ. Ensaios HTS também podem ser usados para investigar as relações estrutura-atividade de GJ moduladores2,13,14,15.
Alguns ensaios GJIC incluem a transferência de tintura ou técnicas de braçadeira do remendo dual. Amarelo de Lúcifer CH (LY) e calceína acetoximetil éster (calceína-AM) têm sido utilizados em ensaios de corante-transferência. As células não são permeáveis a LY, que é introduzido pela microinjeção, raspar a carregar ou eletroporação. Uma vez dentro da célula, LY se espalha em vizinhos células através do GJs e atividade GJ é analisada pela extensão do LY migração16. Ensaios de calceína-AM geralmente envolvem recuperação lacuna-fluorescência após fotobranqueamento17,18. Calceína-AM é um corante permeant-célula que é convertido intracelular calceína impermeável por uma esterase intrínseca. O ensaio requer um microscópio confocal para observar a transferência de calceína-AM em uma célula de aqueles ao seu redor seguindo fotobranqueamento do laser. Se GJs funcionais estão presentes, em células adjacentes da calceína-AM entra as células foto e a fluorescência é recuperada. Atividade GJ é analisada pela extensão da recuperação de fluorescência das células foto. Ensaios com tintura-transferência são trabalhosos e demorados ou têm baixa sensibilidade. Remendo de duplo fixação é um método eletrofisiológico que mede a condutância juncional. É relativamente sensível, com uma dependência direta de condutância no número de aberto GJs19; no entanto, é tecnicamente exigente, demorado e caro20. O ensaio YFP GJIC foi desenvolvido para uso em HTS
A Figura 1 ilustra os componentes e as etapas do ensaio eu YFP GJIC, que utiliza células de aceitador expressando uma variante de iodeto sensíveis YFP rolamento H148Q e I152L (YFPQL) e doador de células expressando um transportador de iodeto (SLC26A4)21 . As duas mutações transportadas por YFPQL permitem têmpera de fluorescência por iodeto22. Iodetos são adicionados ao aceitador co cultivada e as células do doador; Eles não entram as células aceitador, mas são ocupados pelos transportadores de SLC26A4 presentes sobre as células do doador. Iodetos nas células do doador se espalham através de funcionamento GJs células adjacentes aceitador onde eles saciar a fluorescência YFPQL . Se GJs são fechadas ou bloqueadas por inibidores, iodeto não pode inserir as células aceitador para saciar a fluorescência. A taxa de resfriamento YFPQL reflete a atividade GJ. O procedimento de ensaio GJIC eu-YFP não é complicado nem demorado. É compatível com HTS e pode ser usado para testar os efeitos de um grande número de compostos na atividade GJ em um período relativamente curto. Requer apenas aceitador e células do doador e duas soluções de sal equilibradas. O protocolo descrito abaixo baseia-se em células LN215, cujo principal Cx é Cx4321. O receptor de LN215-YFPQL e o LN215-eu− células de doadores foram geradas por transdução com lentivírus expressando YFPQL ou SLC26A421,23.
Protocolo
1. geração de lentivírus expressando YFPQL e SLC26A4
- Desenvolvem-se células de rim embrionário humano HEK293T 80% confluencia em placas de cultura de 100 mm. Modificado águia médio (DMEM de Dulbecco) suplementado com 10% de soro fetal bovino, 100 U/mL penicilina e estreptomicina 100 de µ g/mL é o meio de cultura utilizado em todo o protocolo para manter HEK293T e outras células abaixo mencionadas.
- Placas de cultura 6-poços de casaco, adicionando 2 mL de 0,005% de solução estéril (PLL) e poli-L-lisina para cada poço de 10 min. aspirar a solução PLL e enxaguar a superfície duas vezes com 2 mL de água estéril.
- Lavar o HEK293T células com 10 mL de fosfato tampão salino (PBS) e tratam as monocamadas de células em cada prato de 100 mm com 2 mL de solução de EDTA-tripsina 0,25% a 37 ° C por 3 min. Adicione 5 mL de meio de cultura e ressuspender as células.
- Contar as células em um hemocytometer e ajustar a densidade da suspensão para 250.000 células/mL em meio de cultura celular e adicionar 500.000 células em 2 mL de meio de cultura a cada lisina-revestido de placas 6-poços. Incubar as células em um umidificado 5% CO295% ar atmosfera a 37 ° C por 24 h e, em seguida, substituir o meio de cultura com DMEM sem penicilina ou estreptomicina.
- Em um tubo de 1,5 mL, dilua 20 µ l de reagente de transfeccao com 500 µ l de DMEM sem soro ou antibióticos. Misture suavemente pipetando e deixe descansar em temperatura ambiente por 5 min.
- Enquanto isso, pipete 250 µ l de DMEM em cada um dos dois tubos de 1,5 mL e adicione 1500 ng de pLVX-EIP-YFPQL ou pLenti6P-SLC26A4, 1225 ng de psPAX2 e 375 ng de pMD2.G para cada um. Os dois Lentivirus Plasmideos têm sido descritas anteriormente21. Adicionar 250 µ l de reagente de transfeccao diluídos para cada tubo de plasmídeo, misture delicadamente e incubar durante 20 min à temperatura ambiente.
- Depois de 20 min, adicione 500 µ l de reagente e plasmídeo complexos de transfeccao em tubos de 1,5 mL gota a gota para cada placa de cultura bem em etapa 1.4 e misture, balançando a placa e para trás. Incube as células a 37 ° C numa incubadora de CO2 por 12 h.
- Substituir o medium com 2,5 mL de meio fresco e incubar por um adicional 48 h. Em seguida coloque a placa de cultura no gelo por 5 min manter o meio condicionado contendo lentivirus refrigerados para manter a infecciosidade.
- A mídia contendo lentivírus da colheita e transferir para tubos cônico de 15 mL. Centrifugar a 3.000 x g a 4 ° C por 3 min e remova flutuante HEK293T células do sobrenadante por filtração em 0,4 µm.
- Armazene a mídia contendo lentivírus a 4 ° C, para uso dentro de 2 dias. Para uso posterior, armazenar 200 alíquotas µ l −80 ° C.
2. geração de LN215-YFPQL e LN215-eu− células por transdução Lentivirus
- Desenvolvem-se células LN215 em placas de cultura de 100 mm a 80% confluencia em DMEM suplementado com 10% de soro fetal bovino (FBS) 100 U/mL penicilina e estreptomicina 100 de µ g/mL como descrito acima.
Nota: Se o ensaio YFP GJIC é realizado usando uma linha de celular diferente, use o meio de cultura apropriado. LN215-YFPQLe LN215-eu– células podem ser fornecidas pela Fundação Universidade-indústria, Universidade Yonsei. Entre em contato com o autor correspondente. - Um dia antes de transdução, lave as células duas vezes com 10 mL de PBS, tratam com 2 mL de 0,25% do trypsin-EDTA a 37 ° C por 3 min. Ressuspender as células em 5 mL de meio de cultura com uma pipeta sorológica de 10 mL e ajustar a densidade de 50.000 células/mL. Adicione 20.000 células em 400 µ l de mídia para cada poço de uma placa de cultura de 24 poços para tratamento como não há controle do vírus, YFPQLe células SLC26A4.
- Após 24h de incubação a 37 ° C, transduce dois poços, substituindo o meio de cultura com 400 µ l de uma mistura 1:1 de pLVX-EIP-YFPQL ou lentivirus de pLenti6P-SLC26A4 e meio de cultura fresco suplementado com polybrene em uma concentração final de 4 µ g/mL. Para controles sem vírus, substitua com meio de cultura.
- Incubar a 37 ° C por 15 h células, Aspire o meio contendo lentivírus, adicionar meio de cultura fresco e incubar as células para um adicional 72 h.
Atenção: Para evitar a contaminação de lentivirus entre poços, use novas dicas ou pipetas para cada poço quando você Aspire o meio de cultura contendo lentivirus ou dispensa o meio de cultura fresco. - Lavagem que das células em cada bem duas vezes com 0,5 mL de PBS, tratam com 300 µ l de tripsina-EDTA por 3 min. Ressuspender as células em 2 mL de meio de cultura e placa em placas de cultura de seis poços com 2 puromicina µ g/mL.
- Cultura de células em meios contendo 2 puromicina µ g/mL, até que todas as células no Controlarar bem estão mortas (redondas ou flutuante quando observada no microscópio), que geralmente leva uma semana. Atualize os meios de cultura contendo puromicina cada outro dia durante o período de seleção. Se LN215-YFPQL ou LN215-eu– confluente culturas tornam-se antes de ser concluída seleção, transferência, as células a 100 mm da placa e continuam a seleção como na etapa 2.5.
3. preparação das soluções necessárias para o ensaio
- Prepare 500 mL de solução-C (10 mM HEPES, 140 mM de NaCl, glicose 10 mM, 5 mM KCl, 1 mM MgCl2e 1 mM CaCl2) e 500 mL de solução eu-(10 mM HEPES, 140mm NaI, glicose de 10 mM, 5 mM KCl e 1 mM CaCl2).
- Ajustar o pH de ambas as soluções para 7,4 com 1 N de NaOH, esterilizar as soluções por filtrações em 0,4 µm para armazenamento. Armazenar a 4 ° C por até 1 mês. Verificar o pH antes de usar.
4. chapeamento do LN215-YFPQL e LN215-eu− células
- Cultura LN215-YFPQL e LN215-eu− células em placas de 100mm separadamente em meio de cultura para atingir as populações necessárias para o ensaio. LN215-YFPQL e LN215-eu− células em 40% e 80% de confluência em chapas de 100 milímetros, respectivamente, são suficientes para um ensaio de placa de 96 poços.
- Um dia antes de realizar o ensaio GJIC eu-YFP, lave cada placa de cultura de 100 mm com 10 mL de PBS. Tratar cada placa com 2 mL de solução de EDTA-tripsina 0,25% e incubar a 37 ° C por 5 min. Ressuspender as células em cada prato em 4 mL de meio de cultura e transferência para tubos cônico de 15 mL.
- As células de pelotas por centrifugação a 1.000 x g durante 3 min. descartar o sobrenadante e ressuspender cada célula com 5 mL de meio de cultura. Quebre qualquer touceiras de célula em células únicas pipetando acima e para baixo cerca de 20 vezes com uma pipeta sorológica 10ml.
- Contar as células em um hemocytometer e diluir as células em meio de cultura para fazer suspensões celulares de LN215-YFPQL a 80.000 células/mL e LN215-eu− a 160.000 células/mL.
- Misture 7 mL de LN215-YFPQL e 7 mL de LN215-eu− suspensões celulares em um reservatório. Adicione 100 µ l da mistura a cada poço de uma placa de cultura de células 96 poços utilizando uma pipeta multicanal.
Nota: Para adicionar 100 µ l da mistura em cada poço da placa de 96 poços células, é necessário cerca de 10 mL da suspensão de células mistas. É aconselhável fazer a suspensão de células mais do que o necessário. - Incube as celulas em humedecidas 5% CO2ar de 95% a 37 ° C por 24 h. O LN215-YFPQL e LN215-eu−cultura de pilha deve ser confluente de 100% quando o ensaio é realizado.
5. realizar o ensaio GJIC eu-YFP
Nota: Utilize um microscópio de fluorescência com ampliação de 20 x e um filtro GFP para verificar as placas de 96 poços para ter certeza, lá não são nenhum grupos de LN215-YFPQL ou células de LN215-SLC26A4, e que as culturas de células são totalmente confluente e bem distribuída antes realização do ensaio.
- Pelo menos 30 min antes de fazer o ensaio, ligue uma microplaca e definir a 37 ° C.
- Lave o tubo de um injetor automático com 3 mL de etanol a 70%, 3 mL de água destilada e em seguida 3 mL de solução-eu com um caudal de 300 µ l/s.
- Aquecer a C - e eu-soluções para 37 ° C em banho-maria.
Nota: Como 100 µ l de cada solução é necessário para cada poço da placa de 96 poços, cerca de 10 mL de cada solução é necessária para cada ensaio. Um adicional 10 mL da solução é necessária para aprontar cada placa (total de 20 mL) e um adicional 25 mL da solução-C é necessário para a lavagem de cada placa (total de 35 mL). - Aspire o meio de crescimento ou inverter a placa para esvaziá-la; Bata a mão médio residual.
Nota: Residual soro bovino fetal na mídia crescimento causa fluorescência de fundo e um declínio na qualidade do ensaio. - Adicione 200 µ l de solução-C para cada poço de um reservatório, utilizando uma pipeta multicanal. Aspirar a solução C ou inverter a placa para esvaziar e toque em solução residual.
- Adicionar 50 µ l µ l C-solução, 1 µ l de ações químicas de 2,5 mM (ver tabela 1) ou dimetilsulfóxido (DMSO) como um veículo e em seguida 50 µ l µ l C-solução para cada poço com uma pipeta multicanal.
Nota: a maioria dos reagentes em uma biblioteca de química são dissolvidos em DMSO e até 1% (v/v) é permitido na maioria dos ensaios cell-based24. Como DMSO tem uma densidade mais elevada do que a água, os reagentes dissolvidos em DMSO tendem a descer para o fundo quando adicionado aos poços da placa de cultura, que perturba as concentrações das soluções de ensaio. Isto pode ser contornado pela adição de 50 µ l de solução-C, reagentes em DMSO e 50 µ l C de - solução em ordem. A última 50 µ l de solução-C é para a mistura. - Incube a 37 ° C no ar, não em 5% CO2células. O tempo de incubação pode ser modificado, mas 10 min é geralmente suficiente para moduladores de canal iônico a agir.
- Durante a incubação, definir o programa de leitor de microplacas para injetar 100 µ l de eu-solução para cada poço, 1 s e medir a fluorescência para 10 s intervalos de 0,4 s. Defina o leitor para ler a fluorescência do fundo. A velocidade de injeção recomendada é 135 µ l/s. Set o comprimento de onda de excitação de 485 nm e leitura das emissões em 520 nm.
Nota: As configurações detalhadas para os programas de leitor de microplacas são como segue.- Clique no botão Gerenciar protocolos .
- Clique no botão novo . Selecione a Intensidade da fluorescência na seção de método de medição e Modo de bem na leitura modo seção. Em seguida, clique no botão Okey . Nova aba aparecerá.
- No menu de Parâmetros básicos , definir o comprimento de onda de excitação de 485 nm e emissão em 520 nm. Selecione o Fundo óptica para ler a fluorescência do fundo. Conjunto de medição começar a tempo de ser "0 s", o número de intervalos a ser "25", número de flashes por alvéolo, intervalo para ser "20" e intervalo de tempo para ser "0.4 s".
- No menu Layout , desenhe a região da placa para ser lido.
- No menu de Concentrações/Volumes/Shacking , defina o leitor de microplacas para injetar 100 µ l de eu-solução para cada poço com 135 µ l/s de velocidade de injeção.
Nota: Evite velocidades de injeção porque podem resultar no desprendimento de células. - No menu do tempo de injeção , defina a hora de início de injeção a 1 s. Em seguida, clique no botão Iniciar a medição .
- Após a incubação, colocar as placas de 96 poços no leitor de microplacas e iniciar a medição clicando o botão de Medição começar novamente.
6. cálculo da atividade GJIC
- Calcular as percentagens de YFPQL têmpera e atividade GJIC como23
YFPQL têmpera (%) =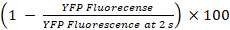
Atividade GJIC (%) =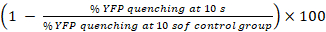
Nota: Em princípio, a atividade GJIC deve ser calculada pela diferença entre as percentagens de fluorescência YFP em poços com aceitador células e células do doador e o aceptor-célula correspondente somente poços. No entanto, como LN215-YFPQL células mostram insignificante YFP têmpera por iodeto após 10 s, não levamos o fundo YFP têmpera em conta quando conduzindo HTS usando LN215-YFPQL e LN215-eu– células.
Resultados
Vinte e nove placas de 96 poços de cultura foram usadas para 2.320 químicos para identificar novos moduladores GJIC de tela por ensaio GJIC eu-YFP usando o LN215 e o LN215-YFPQL -eu− células. Os resultados obtidos com um prato representativo são mostrados na Figura 2. A porcentagem de fluorescência YFP em cada poço é mostrada como um gráfico de linha na Figura 2 e o percentual de a...
Discussão
O ensaio YFP GJIC pode ser usado para HTS, porque é robusto, rápido e barato. Um ensaio HTS é considerado robusto se o Z'-fator é acima de 0,525. Ver Zhang et al para obter uma descrição da análise estatística usada para avaliar a adequação de HTS ensaios25. Quando as células de LN215 foram usadas, o Z'-fator foi > 0,5 sem qualquer otimização de ensaio. Se outros tipos de células são usados no ensaio e seu Z'-fator é < 0.5, a robustez pode ser melhorada, ala...
Divulgações
Os autores têm sem conflitos de interesse a divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo programa de pesquisa de ciência básica através da nacional Research Foundation de Coreia (NRF) financiado pelo Ministério da educação (2011-0023701, 2016R1D1A1A02937397 e 2018R1A6A1A03023718).
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
Referências
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados