Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Jodid-gelb fluoreszierende Protein-Gap Junction-interzelluläre Kommunikation Assay
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll für eine neuartige Lücke Kreuzung interzelluläre Kommunikation Assay für den Hochdurchsatz-Screening von Lücke Kreuzung modulierende Chemikalien für die Arzneimittelforschung und toxikologische Bewertung entwickelt.
Zusammenfassung
GAP Junctions (GJs) sind Zellmembran-Kanäle, die Diffusion von Molekülen zwischen benachbarten Zellen kleiner als 1 kDa ermöglichen. Da sie physiologische und pathologische Rollen haben, braucht der Hochdurchsatz-screening (HTS) Assays, GJ-Modulatoren in Drug Discovery und Toxikologie Tests zu identifizieren. Ein neuartige Jodid-gelb fluoreszierende Protein-Gap Junction interzelluläre Kommunikation (I-YFP-GJIC) Assay erfüllt dieses Bedürfnis. Es ist eine zellbasierte Assays einschließlich Akzeptor und Spender-Zellen, die entwickelt sind, um stabil gelb fluoreszierenden Proteins (YFP) Variante, zum Ausdruck bringen deren Fluoreszenz sensibel von Jodid oder SLC26A4, ein Transporter Jodid bzw. gestillt ist. Wenn eine Mischkultur aus zwei Zelltypen Jodid hinzugefügt wird, sie betreten die Spenderzellen über den SLC26A4-Transporter und diffundieren zu den angrenzenden Akzeptor-Zellen über GJs wo sie die YFP Fluoreszenz zu stillen. YFP Fluoreszenz wird nun durch die nun in einem kinetischen Modus gemessen. Die YFP abschrecken Rate spiegelt GJ Aktivität. Der Test ist zuverlässig und schnell genug für HTS verwendet werden Das Protokoll für die e-YFP-GJIC-Assay mit LN215 Gliom menschliche Zellen, wird beschrieben.
Einleitung
GAP Junctions (GJs) fungieren als interzelluläre Kanäle ermöglichen die Diffusion kleiner Moleküle von < 1 kDa wie Nährstoffe, Stoffwechselprodukte und Signalmoleküle zwischen benachbarten Zellen. Die Knoten Elemente sind mit einem Hemichannel oder Connexon in jede Zelle und jedes Connexon stellt sechs Connexine (Cxs)1. GJs und Cxs wurden in Toxikologie Tests von Karzinogenen wie polyzyklische aromatische Kohlenwasserstoffe (PAK), verwendet die GJ-Hemmer2,3,4sind. Gestörten GJIC wurde Nongenotoxic Karzinogenese5,6zugeordnet. Als eine mögliche therapeutische Ziel wurde GJ Beteiligung in bestimmte Subtypen der Anfälle7,8, Schutz von Herz und Gehirn Ischämie/Reperfusion Verletzungen9, Migräne mit Aura10berichtet, Arzneimittel-induzierte Leberschäden6,11und12der Wundheilung. Hochdurchsatz-screening (HTS) Tests sind erforderlich, GJ moduliert Chemikalien oder Antikörper für die Arzneimittelforschung für Toxikologie Assays zu identifizieren und zu neuartigen zelluläre Regulatoren des GJ Aktivität zu identifizieren. HTS-Assays können auch zur Untersuchung von Struktur-Aktivitäts-Beziehungen von GJ Modulatoren2,13,14,15.
Einige GJIC-Assays sind Dye Transfer oder dual Patch-Clamp-Techniken. Luzifer gelb CH (LY) und Calcein Acetoxymethyl Ester (Calcein-AM) wurden in Farbübertragungs-Tests verwendet. Zellen sind nicht durchlässig für LY, die durch Mikroinjektion, Schaben laden oder Elektroporation eingebracht wird. Einmal im Inneren der Zelle LY breitet sich in benachbarten Zellen über GJs und GJ Aktivität wird durch das Ausmaß der LY Migration16untersucht. Calcein-AM-Assays beinhalten in der Regel Lücke-Fluoreszenz Erholung nach Immunofluoreszenz17,18. Calcein-AM ist ein Zelle-permeationsfähigen Farbstoff, der durch eine intrinsische Esterase intrazellulär in undurchlässigen Calcein umgewandelt wird. Der Test erfordert ein confocal Mikroskop zu beobachten, die Übertragung von Calcein-AM in eine Zelle von diejenigen, die es nach Laser Immunofluoreszenz. Wenn funktionale GJs vorhanden sind, Calcein-AM in benachbarten Zellen tritt die Photobleached Zellen und die Fluoreszenz wird wiederhergestellt. GJ-Aktivität wird durch das Ausmaß der Fluoreszenz Erholung der Photobleached Zellen untersucht. Farbübertragungs-Assays sind mühsam und zeitaufwändig oder niedrige Empfindlichkeiten. Dual Patch spannen ist eine elektrophysiologische Methode, die Knoten Leitwert misst. Es ist relativ empfindlich, durch eine direkte Abhängigkeit der Leitfähigkeit die Anzahl der offenen GJs19; jedoch ist es technisch anspruchsvoll, zeitaufwendig und teuer20. Die e-YFP-GJIC-Assay wurde entwickelt für den Einsatz in HTS
Abbildung 1 zeigt die Komponenten und die Schritte des-YFP GJIC Assays, die Akzeptor-Zellen mit dem Ausdruck einer Iodid-Sensitive YFP Variante mit H148Q und I152L nutzt (YFPQL) und Spenderzellen mit dem Ausdruck einer Iodid-Transporter (SLC26A4)21 . Die beiden Mutationen durchführte, YFPQL ermöglichen abschrecken der Fluoreszenz von Iodid22. Jodide sind Co kultivierten Akzeptor und Spenderzellen hinzugefügt; Geben Sie nicht die Akzeptor-Zellen, sondern werden durch die vorliegenden SLC26A4-Transporter auf der Spenderzellen aufgegriffen. Jodide in die Spenderzellen diffundieren durch funktionierende GJs in angrenzenden Akzeptor Zellen, wo sie die YFPQL Fluoreszenz zu stillen. GJs sind geschlossen oder durch Inhibitoren blockiert, kann nicht Iodid der Akzeptor Körperzellen um die Fluoreszenz stillen gelangen. Die YFPQL abschrecken Rate spiegelt GJ Aktivität. Die Testverfahren YFP GJIC ist weder kompliziert noch zeitaufwändig. Es ist kompatibel mit HTS und kann verwendet werden, um die Auswirkungen einer großen Anzahl von Verbindungen auf GJ Aktivität in einem relativ kurzen Zeitraum zu testen. Es erfordert nur Akzeptor und Spenderzellen und zwei ausgewogene Salzlösungen. Das unten beschriebene Protokoll basiert auf LN215 Zellen, deren großen Cx Cx4321ist. LN215 und LN215-YFPQL Rezeptor-ich− Spenderzellen entstanden durch Transduktion mit Lentiviren YFPQL oder SLC26A421,23zum Ausdruck zu bringen.
Protokoll
1. Generation von Lentiviren YFPQL und SLC26A4 zum Ausdruck bringen
- Wachsen Sie, HEK293T menschlichen embryonalen Nierenzellen um 80 % confluency auf 100 mm Kultur Platten. Dulbeccos geändert Eagle Medium (DMEM) mit 10 % fötalen Rinderserum, 100 U/mL Penicillin und 100 µg/mL Streptomycin ergänzt wird das Kulturmedium im gesamten Protokoll verwendet, um HEK293T und andere Zellen, die unten genannten aufrechtzuerhalten.
- Mantel Kultur 6-Well-Platten durch Zugabe von 2 mL 0,005 % der sterilen Poly-L-Lysin (PLL) Lösung in jede Vertiefung für 10 min. Aspirieren der PLL-Lösung und spülen Sie die Fläche zweimal mit 2 mL sterilem Wasser.
- Waschen der HEK293T Zellen mit 10 mL von Phosphat gepufferte Kochsalzlösung (PBS) und die Zelle Monoschichten in jedes Gericht 100 mm mit 2 mL 0,25 % Trypsin-EDTA-Lösung bei 37 ° C für 3 Minuten fügen Sie 5 mL Kulturmedium zu behandeln und Aufschwemmen der Zellen.
- Zählen der Zellen in einem Hemocytometer und passen Sie die Dichte der Zellsuspension auf 250.000 Zellen/mL in Kulturmedium und 500.000 Zellen hinzufügen in 2 mL Kulturmedium jeweils Lysin auch der 6-Well-Platten beschichtet. Inkubieren Sie die Zellen in einem befeuchteten 5 % CO295 % Luft-Atmosphäre bei 37 ° C für 24 h und ersetzen Sie das Kulturmedium mit DMEM ohne Penicillin und Streptomycin.
- Verdünnen Sie in einer Röhre 1,5 mL 20 µL Transfection Reagens mit 500 µL DMEM ohne Serum oder Antibiotika. Mischen von pipettieren und 5 min bei Raumtemperatur stehen lassen.
- Unterdessen pipette 250 µL DMEM in jedes zwei 1,5 mL Rohre und fügen Sie dann 1500 ng pLVX-EIP-YFPQL oder pLenti6P-SLC26A4, 1225 ng von psPAX2 und 375 ng der pMD2.G zueinander. Die zwei Lentivirale Plasmide wurden zuvor beschriebenen21. Jedes Plasmid-Rohr 250 µL verdünnter Transfection Reagens hinzufügen, vorsichtig mischen und 20 min bei Raumtemperatur inkubieren.
- Fügen Sie nach 20 min 500 µL Transfection Reagens und Plasmid-komplexe in 1,5 mL-Tuben tropfenweise auf jede Kultur Platte gut in Schritt 1.4 und Mischen von der Platte hin und her schaukeln hinzu. Inkubieren Sie Zellen bei 37 ° C in einem CO-2 -Inkubator für 12 h.
- Ersetzen Sie das Medium mit 2,5 mL frisches Medium und weitere 48 h inkubieren. Dann legen Sie die Kultur-Platte auf Eis für 5 min die konditionierte Lentivirus gekühlt um Infektiosität beizubehalten-haltigem Medium zu halten.
- Das Medium mit Lentiviren ernten und transfer zum 15 mL konische Röhrchen. Bei 3.000 X g bei 4 ° C für 3 min Zentrifugieren Sie und entfernen Sie HEK293T Einzelfeldern des Überstands durch Filtration bei 0,4 µm.
- Speichern Sie das Medium mit Lentiviren bei 4 ° C für den Einsatz innerhalb von 2 Tagen. Für die spätere Verwendung speichern Sie 200 µL-Aliquots bei −80 ° C.
2. Generation der LN215-YFPQL und LN215-ich− Zellen durch Lentivirale Transduktion
- Wachsen Sie LN215 Zellen in Kultur-Platten von 100 mm bis zu 80 % confluency in DMEM mit 10 % fetalen bovine Serum (FBS) 100 U/mL Penicillin und 100 µg/mL Streptomycin wie oben beschrieben ergänzt.
Hinweis: Wenn der e-YFP-GJIC-Test erfolgt über eine andere Zelle her, verwenden Sie die entsprechenden Kulturmedium. LN215-YFPQLund LN215-ich– Zellen zur Verfügung gestellt von der University-Industry Foundation, Yonsei Universität. Kontaktieren Sie bitte den entsprechenden Autoren. - Einen Tag vor Transduktion, Waschen der Zellen mit 2 mL 0,25 % Trypsin-EDTA bei 37 ° C für 3 min. zweimal mit 10 mL PBS, behandeln die Zellen in 5 mL Kulturmedium mit einer serologischen 10 mL-Pipette Aufschwemmen und passen Sie die Dichte bis 50.000 Zellen/mL. Fügen Sie 20.000 Zellen in 400 µL der Medien, in jede Vertiefung einer 24-Well-Kultur-Platte für die Behandlung als kein Virus Control, YFPQLund SLC26A4 Zellen.
- Transduzieren Sie nach 24 h Inkubation bei 37 ° C zwei Brunnen indem das Kulturmedium mit 400 µL einer 1:1 Mischung aus pLVX-EIP-YFPQL oder pLenti6P-SLC26A4-Lentivirus und frischen Kulturmedium mit Polybrene auf eine Endkonzentration von 4 µg/mL ergänzt. Ersetzen Sie für keine Virus-Steuerelemente mit Nährmedium.
- Inkubieren Sie die Zellen bei 37 ° C für 15 h, aspirieren Sie Lentiviren-haltigem Medium fügen Sie frischen Kulturmedium hinzu und inkubieren Sie die Zellen für weitere 72 h.
Achtung: Um Lentivirus zwischen Brunnen zu vermeiden, verwenden Sie neue Tipps oder Mehrkanalpipette für jedes gut beim Aspirieren Kulturmedium mit Lentivirus oder frische Wachstumsmedium zu verzichten. - Wäsche, die die Zellen in jedem gut zweimal mit 0,5 mL PBS, mit 300 µL Trypsin-EDTA zu behandeln, für 3 min. aufzuwirbeln, die Zellen in 2 mL Kulturmedium und Platte in sechs Brunnen Kultur Platten mit 2 µg/mL Puromycin.
- Kulturzellen in Medien mit 2 µg/mL Puromycin, bis alle Zellen im Steuerelement nun tot sind (rundes oder schwimmende, wenn Sie im Mikroskop beobachtet), die in der Regel dauert eine Woche. Aktualisieren Sie die Nährmedien mit Puromycin täglich während den Selektionszeitraum. Wenn LN215-YFPQL oder LN215-ich– Zusammenfluss der Kulturen werden vor Auswahl abgeschlossen ist, übertragen die Zellen bis zu 100 mm Platte und Auswahl wie im Schritt 2.5 weiter.
3. Vorbereitung der Lösungen für den assay
- 500 mL C-Lösung (10 mM HEPES, 140 mM NaCl, Glukose 10 mM, 5 mM KCl, 1 mM MgCl2und 1 mM CaCl2) und 500 mL Lösung (10 mM HEPES, 140 mM NaI, 10 mM Glukose, 5 mM KCl und 1 mM CaCl2) vorzubereiten.
- Stellen Sie den pH-Wert der beiden Lösungen auf 7,4 mit 1 N NaOH, Sterilisieren Sie die Lösungen von Filtrationen bei 0,4 µm für die Lagerung zu. Lagerung bei 4 ° C für bis zu 1 Monat. Kontrollieren Sie vor der Benutzung den pH-Wert.
(4) die LN215-YFPQL und LN215 Beschichtung-ich− Zellen
- Kultur LN215-YFPQL und LN215-ich− Zellen in 100 mm Platten separat in Kulturmedium, die Bevölkerung für Assay erforderliche zu erreichen. LN215-YFPQL und LN215-ich− Zellen in 40 % und 80 % Konfluenz in 100 mm Platten, bzw. sind ausreichend für eine 96-Well-Platte-Assay.
- Waschen Sie einen Tag vor der Durchführung der-YFP GJIC Assay, jede 100 mm-Kultur-Platte mit 10 mL PBS. Jede Platte mit 2 mL 0,25 % Trypsin-EDTA-Lösung zu behandeln und Inkubation bei 37 ° C für 5 min. Aufschwemmen der Zellen in jeder Platte in 4 mL Kulturmedium und Transfer zum 15 mL konische Röhrchen.
- Pellet-Zellen durch Zentrifugation bei 1.000 X g für 3 min. verwerfen des Überstands und jede Zelle Pellet mit 5 mL Kulturmedium aufzuwirbeln. Jede Zelle Klumpen in Einzelzellen von oben und unten ca. 20 Mal mit einer serologischen 10 mL-Pipette Pipettieren zerbrechen.
- Zählen der Zellen in einem Hemocytometer und verdünnen Sie die Zellen in das Kulturmedium Zellsuspensionen LN215-YFPQL bei 80.000 Zellen/mL und LN215 zu machen-ich− bei 160.000 Zellen/mL.
- 7 mL LN215-YFPQL und 7 mL LN215 mischen-ich− Zellsuspensionen in ein Reservoir. Jede Vertiefung einer 96-Well-Zelle-Kultur-Platte mit einer Mehrkanal-Pipette fügen Sie 100 µL der Mischung hinzu.
Hinweis: Um 100 µL des Gemisches in jede Vertiefung der Zellplatte 96-Well hinzuzufügen, wird etwa 10 mL gemischte Zellsuspension benötigt. Es wird empfohlen, mehr Zellsuspension als nötig zu machen. - Inkubieren Sie die Zellen in befeuchtet 5 % CO295 % Luft bei 37 ° C für 24 h. Die LN215-YFPQL und LN215-ich−Zellkultur sollte 100 % Zusammenfluss sein, wenn der Test durchgeführt wird.
(5) Durchführung von-YFP GJIC assay
Hinweis: Verwenden Sie ein Fluoreszenzmikroskop mit 20 X Vergrößerung und ein GLP-Filter 96-Well-Platten prüfen um sicher zu sein es keine Klumpen des LN215-YFPQL oder LN215-SLC26A4-Zellen und die Zellkulturen sind voll konfluierende und gut verteilte vor Durchführung des Tests.
- Mindestens 30 min vorher die Probe Einschalten einer Mikrotestplatte und auf 37 ° C.
- Waschen Sie das Rohr der automatisierten Injektor mit 3 mL 70 % igem Ethanol, 3 mL destilliertem Wasser und 3 mL Lösung bei einer Durchflussmenge von 300 µL/s.
- Erwärmen Sie die C - und ich-Lösungen auf 37 ° C im Wasserbad.
Hinweis: Bei Bedarf 100 µL jeder Lösung für jedes gut die 96-Well-Platte benötigt ca. 10 mL der jeweiligen Lösung für jedes Assay. Eine zusätzliche 10 mL der Lösung für jede Platte (insgesamt 20 mL) Grundierung erforderlich ist und eine zusätzliche 25 mL der C-Lösung wird zum Waschen jede Platte (insgesamt 35 mL) benötigt. - Aspirieren Sie das Wachstumsmedium oder invertieren Sie die Platte, um ihn zu entleeren; Tippen Sie auf, passives Medium.
Hinweis: Passives fötalen Rinderserum in den Wachstumsmedien verursacht Hintergrundfluoreszenz und einem Rückgang in Assay-Qualität. - Geben Sie 200 µL des C-Lösung in jeder aus einem Reservoir mit einer Mehrkanal-Pipette. Aspirieren Sie die C-Lösung oder umkehren Sie die Platte zu leeren und tippen Sie auf verbleibende Lösung.
- Fügen Sie 50 µL µL C-Lösung 1 µL 2,5 mM chemischen Lager (siehe Tabelle 1) oder Dimethylsulfoxide (DMSO) als Vehikel und dann 50 µL µL C-Lösung in jede Vertiefung mit einer Mehrkanal-Pipette.
Hinweis: Die meisten Reagenzien in einer chemischen Bibliothek sind in DMSO gelöst und bis zu 1 % (V/V) ist in den meisten zellbasierte Assays24zulässig. DMSO hat eine höhere Dichte als Wasser, tendenziell Reagenzien, die in DMSO gelöst sinken auf den Boden, wenn die Kultur Platte Brunnen hinzugefügt was die Konzentration der Assay-Lösungen stört. Dies kann umgangen werden, durch Zugabe von 50 µL der C-Lösung und Reagenzien in DMSO 50 µL C - Lösung in Ordnung. Die letzten 50 µL der C-Lösung ist für das Mischen. - Inkubation der Zellen bei 37 ° C in Luft, nicht in 5 % CO2. Die Inkubationszeit kann geändert werden, aber 10 min ist in der Regel ausreichend für Ionenkanal Modulatoren, zu handeln.
- Während der Inkubation, setzen die Mikrotestplatte Leseprogramm, 100 µL des ich-Lösung in jede Vertiefung 1 injizieren s und zur Messung der Fluoreszenz für 10 s 0,4 s Intervallen. Legen Sie den Leser Fluoreszenz von unten zu lesen. Die empfohlene Einspritzgeschwindigkeit ist 135 µL/s. Set die Erregung Wellenlänge 485 nm und lesen die Emission bei 520 nm.
Hinweis: Detaillierte Einstellungen für die Mikrotestplatte-Reader-Programme sind wie folgt.- Klicken Sie auf Protokolle verwalten .
- Klicken Sie auf die Schaltfläche neu . Wählen Sie die Fluoreszenz-Intensität in der Messstrecke Methode und Gut-Modus in der Lesung Abschnitt Modus. Klicken Sie auf die Schaltfläche " OK ". Neue Registerkarte wird angezeigt.
- Im Menü Grundparameter eingestellt die Erregung Wellenlänge auf 485 nm und die Emission bei 520 nm. Wählen Sie aus der Unteren Optic Fluoreszenz von unten zu lesen. Eingestellten Messung Startzeit sein "0 s", Anzahl der Intervalle zu "25", Anzahl der Blitze pro Bohrloch, und Intervall "20" sein und Intervallzeit sein "0,4 s".
- Zeichnen Sie im Menü Layout Region der Platte gelesen werden.
- Im Menü Konzentrationen/Volumes/Shacking einstellen des Mikrotestplatte Lesers 100 µL des ich-Lösung in jede Vertiefung mit 135 µL/s Einspritzgeschwindigkeit zu injizieren.
Hinweis: Vermeiden Sie schnellere Einspritzgeschwindigkeiten, weil sie in Ablösung der Zellen führen können. - Im Menü Einspritzzeit legen die Injektion Startzeit 1 s. Klicken Sie auf die Schaltfläche " Messung starten ".
- Nach der Inkubation der 96-Well-Platten in der Mikrotestplatte Leser und starten Sie die Messung durch nochmaliges Klicken Starten Messtaste.
6. Berechnung der GJIC-Aktivität
- Berechnen Sie die Prozentsätze der YFPQL abschrecken und GJIC Tätigkeit als23
YFPQL abschrecken (%) =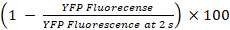
GJIC Aktivität (%) =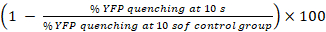
Hinweis: Im Prinzip GJIC Aktivität berechnet werden soll aus der Differenz der Prozentsätze der YFP Fluoreszenz in Brunnen mit Akzeptor und Spenderzellen und die entsprechende Akzeptor-Zelle nur Brunnen. Als LN215-YFPQL Zellen zeigen jedoch vernachlässigbar YFP abschrecken von Jodid nach 10 s, wir nehmen Sie nicht den Hintergrund YFP abschrecken zu berücksichtigen bei der Durchführung von HTS mit LN215-YFPQL und LN215-ich– Zellen.
Ergebnisse
Neunundzwanzig Kultur 96-Well Platten dienten 2.320 Chemikalien um neuartige GJIC Modulatoren identifizieren den Bildschirm-YFP GJIC Assay unter Verwendung der LN215-YFPQL und LN215-ich− Zellen. Mit einem repräsentativen Teller erzielten Ergebnisse sind in Abbildung 2dargestellt. Der Anteil der YFP Fluoreszenz in jede Vertiefung ist als Liniendiagramm in Abbildung 2A und der Prozentsatz d...
Diskussion
E-YFP-GJIC-Assay kann für HTS verwendet werden, denn es robust, schnell und preiswert ist. Ein HTS Assay gilt als robust wenn die Z'-Faktor ist über 0,525. Siehe Zhang Et Al. für eine Beschreibung der statistischen Analyse zur Beurteilung der Eignung von HTS-Assays25. Wenn LN215 Zellen verwendet wurden, die Z'-Faktor war > 0,5 ohne jede Assay-Optimierung. Wenn andere Zelltypen in der Test und seine Z verwendet werden "-Faktor ist < 0,5, die Robustheit durch die Verlänge...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenlegen.
Danksagungen
Diese Forschung wurde unterstützt durch das grundlegende Wissenschaft Forschungsprogramm durch die National Research Foundation von Korea (NRF) finanziert durch das Ministerium für Bildung (2011-0023701, 2016R1D1A1A02937397 und 2018R1A6A1A03023718).
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well plate | SPL | 30096 | |
| Calcium chloride (CaCl2) | Sigma | C5670 | I-solution |
| D-(+)-Glucose | Sigma | G7021 | C-solution, I-solution |
| Dimethyl sulfoxide (DMSO) | sigma | 276855 | |
| HEPES | Sigma | RES6003H-B7 | C-solution, I-solution |
| Lipofectamine 2000 | Invitrogen | 11668-027 | transfection reagent |
| Magnesium chloride hexahydrate (MgCl2 6H2O) | Sigma | M2393 | C-solution |
| Microplate reader | BMG LabTech | POLARstar Omega 415-1618 | |
| pMD2.G | Addgene | #12259 | |
| Polybrene | sigma | H9268 | |
| Poly-L-lysine solution | sigma | P4707 | |
| Potassium chloride (KCl) | Sigma | P5405 | C-solution, I-solution |
| psPAX2 | Addgene | #12260 | |
| Puromycin Dihydrochloride | sigma | P8833 | |
| Sodium chloride (NaCl) | Sigma | S5886 | C-solution, I-solution |
| Sodium hyroxide (NaOH) | Sigma | S2770 | |
| Sodium Iodide (NaI) | Sigma | 383112 | I-solution |
Referenzen
- Goodenough, D. a., Goliger, J. a., Paul, D. L. Connexins, connexons, and Intercellular Communication. Annual Review of Biochemistry. 65, 475-502 (1996).
- Upham, B. L., Weis, L. M., Trosko, J. E. Modulated Gap Junctional Intercellular Communication as a Biomarker of PAH Epigenetic Toxicity: Structure-Function Relationship. Environmental Health Perspectives. 106, 975 (1998).
- U, J. E. T., Chang, C., Upham, B., Wilson, M. Epigenetic toxicology as toxicant-induced changes in intracellular signalling leading to altered gap junctional intercellular communication. Toxicology Letters. , 71-78 (1998).
- Yamasaki, H. Role of disrupted gap junctional intercellular communications in detection and characterization of carcinogens. Mutation Research - Reviews in Genetic Toxicology. , (1996).
- Yamasaki, H., et al. Gap junctional intercellular communication and cell proliferation during rat liver carcinogenesis. Environmental Health Perspectives. 101, 191-197 (1993).
- Vinken, M., et al. Gap junctional intercellular communication as a target for liver toxicity and carcinogenicity. Critical Reviews in Biochemistry and Molecular Biology. 44, 201-222 (2009).
- Fonseca, C. G., Green, C. R., Nicholson, L. F. B. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy. Brain Research. 929 (1), 105-116 (2002).
- Garbelli, R., et al. Expression of connexin 43 in the human epileptic and drug-resistant cerebral cortex. Neurology. 76 (10), 895-902 (2011).
- Schulz, R., et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection. Pharmacology and Therapeutics. 153, 90-106 (2015).
- Sarrouilhe, D., Dejean, C., Mesnil, M. Involvement of gap junction channels in the pathophysiology of migraine with aura. Frontiers in Physiology. , (2014).
- Patel, S. J., et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure. Nature Biotechnology. 30 (2), 179-183 (2012).
- Kandyba, E. E., Hodgins, M. B., Martin, P. E. A murine living skin equivalent amenable to live-cell imaging: analysis of the roles of connexins in the epidermis. Journal of Investigative Dermatology. 128 (4), 1039-1049 (2008).
- Upham, B. L., et al. Differential roles of 2 , 6 , and 8 carbon ceramides on the modulation of gap junctional communication and apoptosis during carcinogenesis. Cancer Letters. 191, 27-34 (2003).
- Upham, B. L., et al. Structure-activity-dependent regulation of cell communication by perfluorinated fatty acids using in vivo and in vitro model systems. Environmental Health Perspectives. 117 (4), 545-551 (2009).
- Weis, L. M., et al. Bay or Baylike Regions of Polycyclic Aromatic Hydrocarbons Were Potent Inhibitors of Gap Intercellular Communication. Environmental Health Perspectives. 106 (1), 17-22 (1998).
- el-Fouly, M. H., Trosko, J. E., Chang, C. C. Scrape-Loading and Dye Transfer: A Rapid and Simple Technique to Study Gap Junctional Intercellular Communication. Experimental Cell Research. 168 (2), 422-430 (1987).
- Wade, M. H., Trosko, J. E., Schindler, M. Photobleaching Assay of Gap Junction- Mediated Communication Between Human Cells. Advancement of Science. 232 (4749), 525-528 (2010).
- Abbaci, M., et al. In vitro characterization of gap junctional intercellular communication by gap-FRAP technique. Proceedings of SPIE. , 585909 (2005).
- Neyton, J., Trautmann, A. Single-channel currents of an intercellular junction. Nature. 317 (6035), 331-335 (1985).
- Wilders, R., Jongsma, H. J. Limitations of the dual voltage clamp method in assaying conductance and kinetics of gap junction channels. Biophysical Journal. 63 (4), 942-953 (1992).
- Lee, J. Y., Choi, E. J., Lee, J. A new high-throughput screening-compatible gap junctional intercellular communication assay. BMC Biotechnology. 15 (1), 1-9 (2015).
- Galietta, L. J. V., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Letters. 499 (3), 220-224 (2001).
- Lee, J. Y., Yoon, S. M., Choi, E. J., Lee, J. Terbinafine inhibits gap junctional intercellular communication. Toxicology and Applied Pharmacology. 307, 102-107 (2016).
- Hughes, J., Rees, S., Kalindjian, S., Philpott, K. Principles of early drug discovery. British Journal of Pharmacology. 162 (6), 1239-1249 (2011).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Upham, B. L. Role of Integrative Signaling Through Gap Junctions in Toxicology. Current Protocols in Toxicology. , (2011).
- Schalper, K. A., et al. Modulation of gap junction channels and hemichannels by growth factors. Molecular BioSystems. 8 (3), 685-698 (2012).
- Kulkarni, G. V., Mcculloch, C. A. G. Serum deprivation induces apoptotic cell death in a subset of Balb / c 3T3 fibroblasts. Journal of Cell Science. 1179, 1169-1179 (1994).
- Harris, A. L., Locke, D. Permeability of Connexin Channels. Connexins. , 165-206 (2009).
- Choi, E. J., Yeo, J. H., Yoon, S. M., Lee, J. Gambogic Acid and Its Analogs Inhibit Gap. Junctional Intercellular Communication. 9, 1-10 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten