A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام أكسيد الديوتريوم كأداة غير غازية وغير قاتلة لتقييم تكوين الجسم واستهلاك المياه في الثدييات
In This Article
Summary
تصف هذه المقالة تقنية تخفيف أكسيد الديوتريوم في ثدييين ، وهو حشرة وآكلة لحوم ، لتحديد إجمالي مياه الجسم ، وكتلة الجسم الهزيلة ، وكتلة الدهون في الجسم ، واستهلاك المياه.
Abstract
نظم تسجيل حالة الجسم ومؤشرات حالة الجسم هي التقنيات الشائعة المستخدمة لتقييم الحالة الصحية أو اللياقة البدنية للأنواع. نظم تسجيل حالة الجسم تعتمد على المقيّم ولديها القدرة على أن تكون ذاتية للغاية. يمكن الخلط بين مؤشرات حالة الجسم عن طريق الأعلاف ، وآثار وزن الجسم ، وكذلك المشاكل الإحصائية والاستدلالية. بديل لأنظمة تسجيل حالة الجسم ومؤشرات حالة الجسم هو استخدام نظائر مستقرة مثل أكسيد الديوتريوم لتحديد تكوين الجسم. طريقة تخفيف أكسيد الديوتريوم هي تقنية كمية قابلة للتكرار تستخدم لتقدير تكوين الجسم في البشر والحياة البرية والأنواع المحلية. بالإضافة إلى ذلك ، يمكن استخدام تقنية تخفيف أكسيد الديوتريوم لتحديد استهلاك المياه لفرد من الحيوانات. هنا ، نصف التكيف من تقنية تخفيف أكسيد الديوتريوم لتقييم تكوين الجسم في الخفافيش البنية الكبيرة(Eptesicus fuscus)وتقييم استهلاك المياه في القطط(Felis catis).
Introduction
نظم تسجيل حالة الجسم ومؤشرات حالة الجسم هي التقنيات الشائعة المستخدمة لتقييم الحالة الصحية أو اللياقة البدنية للأنواع1،2. العديد من الأنواع المنزلية والحيوانية لديها فريدة من نوعها حالة الجسم التهديف (BCS) النظم التي تستخدم لتقييم العضلات الحيوانية والأنسجة الدهنية السطحية3. ومع ذلك، يعتمد تقييم BCS على المقيّم - بمعنى أن BCS هو قياس موضوعي أو شبه كمي عند تقييمه من قبل مقيّم مدرب. في أنواع الحياة البرية ، تستخدم مؤشرات حالة الجسم بشكل شائع بدلاً من BCS وتستند إلى نسبة كتلة الجسم إلى حجم الجسم أو كتلة الجسم إلى الساعد2. وغالبا ما تكون مشوشة indicis حالة الجسم من آثار الأعلاف ويمكن الخلط بين حجم الجسم وكذلك المشاكل الإحصائية والاستدلال4.
بديل لأنظمة تسجيل حالة الجسم ومؤشرات حالة الجسم هو استخدام نظائر مستقرة لتحديد تكوين الجسم. أحد النظائر المستقرة الشائعة الاستخدام هو أكسيد الديوتريوم (D2O)، وهو شكل غير مشع من الماء تكون فيه ذرات الهيدروجين نظائر الديوتريوم. يمكن أن تكون طريقة تخفيف أكسيد الديوتريوم الموصوفة في هذه الدراسة تقنية غير ذاتية وكمية وقابلة للتكرار تستخدم لتقدير تكوين الجسم في البشر5 ومجموعة واسعة من الأنواع4،6،7. هذه التقنية يمكن أن تكون مفيدة لدراسة تكوين الجسم في الحياة البرية. على سبيل المثال، يمكن استخدامه لتقييم التغيرات الطولية في تكوين الجسم، كما هو الحال قبل وبعد إجراء الإدارة. ومع ذلك ، في بعض أنواع الحياة البرية يمكن أن يكون أكسيد الديوتريوم مبالغة في محتوى المياه الفعلي8. لذلك ، عند تكييف هذه التقنية لنوع ما ، من المهم التحقق من صحة الطريقة من خلال مقارنة طريقة أكسيد الديوتريوم بتحليل الذبيحة للأنواع غير المهددة بالانقراض. بالنسبة للأنواع المهددة والمهددة بالانقراض، ينبغي اعتبار طريقة غير مدمرة مثل قياس امتصاص الأشعة السينية المزدوج (DXA) طريقة مقارنة بديلة للطريقة المدمرة القياسية الذهبية للتحليل الكامل للجثث.
بالإضافة إلى تكوين الجسم ، يمكن استخدام تقنية التخفيف D2O لتحديد استهلاك المياه لفرد من الحيوانات9. يمكن استخدام هذا التطبيق الفريد من D2O للإجابة ليس فقط على أسئلة البحث ، ولكن يمكن أن يكون مفيدًا لتقييم استهلاك المياه لالحيوانات الفردية الموجودة في بيئات اجتماعية كبيرة.
هنا ، نصف تكييف تقنية التخفيف D2O لتقييم تكوين الجسم في الحشرات ، الخفافيش البنية الكبيرة(Eptesicus fuscus)، ولتقييم استهلاك المياه في آكل اللحوم ، والقطط(Felis catis).
Protocol
تمت الموافقة على جميع التجارب الموصوفة هنا من قبل لجنة رعاية الحيوانات واستخدامها في جامعة ميسوري وأجريت بموجب تصريح التحصيل العلمي للحياة البرية (تصريح #16409 #17649).
1. إعداد حل العقيمة، متساوي التوتر، ممحلول D2O حل الأسهم
- جعل حل الأسهم 50 مل من 9.0 ز / لتر مالات D2O.
- تزن 450 ملغ من الصف الصيدلانية NaCl ونقل جميع NaCl إلى 100 مل، كوب معقم. سجل المبلغ الدقيق لـ NaCl إلى 4 خانات عشرية في دفتر المختبر.
- باستخدام اسطوانة تخرج معقمة، قياس 50 غرام من ≥ 99.8٪ أكسيد الديوتريوم ونقل إلى الكأس المعقم الذي يحتوي على NaCl. تسجيل الكمية الدقيقة من أكسيد الديوتريوم إلى 4 خانات عشرية في دفتر المختبر أو جدول البيانات.
- تصفية 10 مل من قوة الإسموسوتيك NaCl (9.0 غرام / لتر) من خلال فلتر القرص المعقم غير المسرطنة مع المسام تحت الميكروين (0.2 ميكرومتر).
- إرفاق إبرة 20 G إلى فلتر القرص المعقم غير المسرطنة مع المسام تحت الميكروين (0.2 ميكرومتر) مزودة ببرميل حقنة 10 مل. أدخل في الحاجز من قارورة فارغة 100 مل العقيمة.
- إرفاق أنبوب فراغ إلى إبرة 22 G وأدخل الإبرة في الحاجز من قارورة فارغة 100 مل العقيمة.
- صب 10 مل من محلول المخزون في برميل الحقنة. بدوره ببطء على الفراغ حتى يبدأ حل الأسهم D2O لتصفية ببطء في قارورة معقمة. الاستمرار في صب D2O حل المخزون في برميل حقنة حتى يتم تصفية جميع مل 50.
ملاحظة: قد يحتاج محلول المخزون إلى تخفيفأو تركيز حسب الجرعة المطلوبة. تختلف جرعة D2O استنادًا إلى الأنواع وحساسية الطريقة التحليلية. بالنسبة للقطط، تم استخدام محلول العمل لإدارة جرعة قدرها 0.7 غرام /كغ د2O. حل المخزون المذكورة أعلاه يقلل من كمية الحل NaCl أدخلت تحت الجلد إلى الحيوان في حين لا يزال يسمح قياس دقيق للجرعة. بالنسبة للثدييات الصغيرة مثل الخفافيش ، يجب تخفيف هذا التركيز إلى محلول عامل مثل 0.1600 جرام / مل. يسمح هذا التركيز بقياس جرعة 0.75 غرام/كغ D2O بدقة وتدار في محلول NaCl 100 ميكرولتر أو أقل.
2. إعداد العقيمة، متساوي التوتر، ممحلول D2O حل الأسهم العمل للخفافيش
- اوزن قارورة معقمة فارغة سعة 10 مل وسجل الوزن إلى أقرب 4 خانات عشرية. مقياس الـ"تِر"
- استخدم حقنة 1.0 مل لنقل 0.65 مل من محلول المخزون D2O إلى قارورة العقيمة الفارغة 10 مل. سجل الوزن من D2O إلى 4 خانات عشرية. مقياس الـ"تِر"
- احسب حجم D2O في القارورة الفارغة 10 مل. استخدم المعادلة التالية.

حيث يتم تسجيل الوزن W وD هو كثافة 99.8٪ D2O (1.107 ز/مل). - استخدم الحجم المحسوب والوزن المعروف للD2O لتحديد حجم محلول المحلول المُليالم المتساوي التوتر المطلوب لجعل محلول العمل 0.1600 جرام/مل.
- أدخل في الحاجز من قارورة معقمة 10 مل، إبرة 22 G (تعلق على أنبوب فراغ). أدخل في الحاجز من القارورة المعقمة 10 مل، إبرة 20 G (تعلق على مرشح حقنة 0.22 ميكرومتر مزودة ببرميل حقنة 10 مل).
- صب كتلة محسوبة / حجم NaCl متساوي التوتر في برميل حقنة وبدوره على فراغ للسماح بالتنقيط بطيئة في قارورة 10 مل معقمة.
- تسجيل وزن القارورة وضمان إنشاء حل عمل ~ 0.1600 ز / مل.
3. تحديد تكوين الجسم من الخفافيش البني الكبير(Eptesicus fucsus)مع D2O
ملاحظة: حل المخزون D2O المستخدمة في البروتوكول هو 0.1598 غ/مل. قبل جمع الدم، تأكد من أن إزالة ما يصل إلى 200 ميكرولتر من الدم سيكون ≤ 10٪ من إجمالي حجم الدم من الخفافيش وضمن لجنة رعاية الحيوان المؤسسية واستخدامها (IACUC) وضعت المبادئ التوجيهية لجمع الدم. يجب أن تكون جميع الحيوانات صائما أو البطن بالصام لضمان معدة فارغة. وجبة حديثة يمكن أن تغير وزن الحيوان مما أدى إلى نتائج مشوشة منذ حسابات لتحديد الدهون في الجسم تعتمد على كتلة الجسم من الحيوان.
- تهوّي مضرب بني كبير
- استخدام 5.0٪ isoflurane للتحريض. الحفاظ على مستوى مستقر من التخدير باستخدام 0.5٪ - 3.0٪ الإيأولوفوران.
- تحديد عمق التخدير السليم عن طريق اختبار منعكس الانسحاب دواسة (معسر إصبع القدم الخفافيش). يجب أن لا يستجيب الخفافيش للإحساس ويجب أن يبقى معدل التنفس بطيئاً ومستقراً. ضبط isoflurane حسب الحاجة للحفاظ على مستوى مستقر من التخدير.
- سجل مستوى isoflurane، ومعدل ضربات القلب، ومعدل التنفس، وغيرها من المعلومات على النحو المطلوب من قبل IACUC.
- وزن الخفافيش البني الكبير وتسجيل الوزن إلى 4 أماكن عشرية.
- تنظيف uropatagium (غشاء الذيل) على الوريد interfemoral مع وسادة الإعدادية الكحول والسماح لتجف. تطبيق طبقة رقيقة من هلام البترول على الوريد interfemoral.
- استخدام إبرة 29 G لثقب الجزء الظهري من الوريد interfemoral وجمع 100 ميكرولتر من الدم باستخدام أنابيب الشعيرات الدموية الهيبارين الصوديوم البلاستيكية. ضمان الخلط الكافي للدم كله مع الهيبارين الصوديوم عن طريق المتداول بلطف كل أنبوب بعد جمع وتسمية الأنبوب.
- باستخدام آلة DXA معايرة للثدييات الصغيرة، والحصول على ثلاثة مسح DXA من الخفافيش10.
- تحديد الكتلة (في ز) من D2O لحقن عن طريق ضرب وزن الخفافيش في كجم من قبل D2O جرعة 0.75 ز/كغ. تحديد حجم الجرعة D2O المحسوبة (V) عن طريق قسمة وزن جرعة D2O على تركيز محلول العمل.
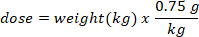
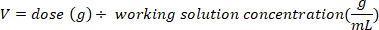
- استخدام حقنة الأنسولين مع إبرة 29 G تعلق لرسم حجم D2O محسوبة. وزن D2O، حقنة الأنسولين، وإبرة. سجل إلى 4 خانات عشرية.
- حقن D2O تحت الجلد على منطقة الورك الظهرية من الخفافيش المؤكّد.
- السماح للخفافيش لاسترداد من التخدير وتسجيل وقت الحقن.
- مباشرة بعد الحقن، وزن حقنة الأنسولين فارغة الآن مع إبرة 29 G المرفقة. تسجيل الوزن إلى 4 خانات عشرية.
- تحديد جرعة D2O حقن عن طريق طرح الوزن بعد الحقن من حقنة الأنسولين من قبل الحقن D2O شغل حقنة الأنسولين. سجل إلى 4 خانات عشرية.
- في غضون 30 دقيقة بعد جمع الدم، واستخدام جهاز الطرد المركزي hematocrit لتدور كل أنبوب الشعيرات الدموية لمدة 5 دقيقة. إذا كان جهاز الطرد المركزي hematocrit يسمح سرعات متعددة، تعيين إلى 10،000 × ز.
- استخدام مقص حاد لقطع أنبوب الشعيرات الدموية البلاستيكية بين الدم كله والبلازما. استخدم ماصة 200 ميكرولتر لطرد البلازما مباشرة إلى أنبوب تخزين موسوم بـ 500 ميكرولتر.
- بعد فترة المعادلة ، اجمع 100 ميكرولتر آخر من الدم من الوريد البينمائي.
ملاحظة: تختلف فترة المعادلة حسب الأنواع وإذا دخلت الخفافيش في طوربور. بالنسبة للخفافيش البنية الكبيرة ، عادة ما تكون 2 h كافية لفترة المعادلة. - فصل البلازما في الثانية وصفت، 500 ميكرولتر المسمار أنبوب المسمار عن طريق تكرار الخطوة 3.13. تخزين العينات في -20 درجة مئوية أو أكثر برودة حتى التحليل.
4. فورييه تحويل الأشعة تحت الحمراء التحليل الطيفي
- ضبط درجة حرارة حمام من السُرّم إلى 60 درجة مئوية لتسهيل التقطير (السماح بفصل الماء و D2O من مكونات الدم الأخرى).
- ماصة 50 ميكرولتر من كل عينة البلازما والقياسية على داخل 1.5 مل غطاء أنبوب الطرد المركزي الصغير مخروطي. بما في ذلك المعايير التي تحتوي على تركيزات معروفة من D2O كمراقبة الجودة.
ملاحظة: من الناحية المثالية سيكون لكل الحيوان ثلاثة يكرر لكل عينة ومتوسط تكرار الثلاثة التي تم الإبلاغ عنها. ونظراً لمحدودية حجم العينة وحجم العينة المطلوبة لمعدات الأشعة تحت الحمراء FT التي استخدمها المؤلفون، لم تُجرى أي نسخ متماثلة لعينات الخفافيش. إذا كانت أي عينة تحتوي على أقل من 50 ميكرولتر من البلازما ، فإن كمية العينة على غطاء أنبوب الطرد المركزي المخروطي وتسجيل الحجم. - الحفاظ على غطاء الطرد المركزي الدقيق رأسا على عقب والمسمار 1.5 مل أنبوب الطرد المركزي المخروطية على الغطاء. ضع الأنبوب المقلوب (المقلوب) مع الغطاء في اتصال مع حمام الرُمفي لمدة لا تقل عن 12 ساعة (بين عشية وضحاها).
- بعد 12 ساعة، قم بإزالة الغطاء واستبداله بغطاء جديد ونظيف. نبض أنبوب الطرد المركزي الدقيق لمدة 10 s في جهاز الطرد المركزي.
- إنشاء المعايير التالية: 0 جزء في المليون (0 ملغ D2O في 1 لتر الماء المقطر)، 293 جزء في المليون (293 ملغ D2O في 1 لتر الماء المقطر)، 585 جزء في المليون (585 ملغ D2O في 1 لتر الماء المقطر)، 878 جزء في المليون (878 ملغ D2O في 1 لتر الماء المقطر)، و 1170 جزء في المليون D2O (1170 ملغ D2O في 1 L الماء المقطر).
ملاحظة: يتم اقتراح القيم أعلاه لمنحنى قياسي. يمكن استخدام القيم البديلة مثل 250 جزء في المليون و 500 جزء في المليون و750 جزء في المليون وما إلى ذلك. - تثبيت خلية انتقال سائل ة في مطياف الأشعة تحت الحمراء (FTIR)(جدول المواد)لتحويل فورييه تحويل الطيف الضوئي (FTIR). ملء الخلية مع الميثانول وتوصيل منفذ الحقن. ملء الخلية ببطء مع المياه الخلفية في حين إزالة بعناية حقنة الميثانول للحد من خطر فقاعات الهواء. إرفاق أنابيب إلى منفذ الإخراج للسماح بإزالة العينات بعد التحليل.
- إعداد برنامج مطياف FTIR(جدول المواد)لتحليل D2O في الماء. يتم سرد إعدادات المعلمة لبرنامج مطياف المستخدمة في هذا البروتوكول في الجدول 1.
- جمع عينة خلفية باستخدام المخفف، 0.22 ميكرومتر تصفية، المياه المقطرة. وينبغي أن يكون هذا هو نفس الماء المستخدم للمعايير.
- حقن 40 ميكرولتر من 0 جزء في المليون D2O وتسجيل الأطياف. حفظ الأطياف كملف قيم فاصلة منفصلة (CSV).
- الاستمرار في حقن وحفظ أطياف جميع المعايير لإنشاء منحنى قياسي.
- كرر الخلفية والمنحنى القياسي كل 60-90 دقيقة.
- حقن 40 ميكرولتر من كل عينة مقطرة في خلية الإرسال السائل وحفظ الأطياف.
ملاحظة: تغيير حجم الحقن من المعايير والعينات المقطرة على أساس حجم خلية انتقال السائل. استخدام أصغر حجم خلية انتقال السائل إذا كان حجم العينة أقل من 40 ميكرولتر أو تمييع 1:1 مع المياه المقطرة الخلفية. - تحديد تركيز D2O لكل عينة من أطياف FTIR باستخدام برنامج جدول بيانات كما وصفه جينينغز وآخرون11 أو البرنامج الطيفي. عند إجراء عمليات النسخ المتماثلة، استخدم متوسط التركيز لحساب تكوين الجسم.
5. حساب تكوين الجسم
- تحويل إثراء الديوتيريوم (جزء في المليون) إلى تركيز الذرة في المئة لكل عينة باستخدام المعادلة التالية12:
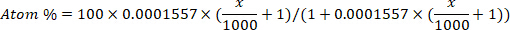
حيث x هو إثراء الديوتريوم المقاس (جزء في المليون) من العينة و 0.0001557 هو جزء الخلد من الديوتريوم المبلغ عنه في فيينا معيار متوسط مياه المحيطات (VSMOW)13. - حساب إجمالي ماء الجسم لكل عينة باستخدام المعادلة التالية4،12،14:
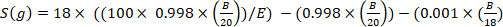 )
)
حيث E هو التخصيب المقاس (الذرة) من الديوتريوم في العينة بعد تصحيح الخلفية، B هو كتلة الحقن في ز، و 0.998 هو تركيز D حقن2O.
ملاحظة: تبادل الديوتريوم مع الهيدروجين labile يسبب 2٪ المبالغة في إجمالي كتلة مياه الجسم. وينبغي تصحيح مجموع مياه الجسم عن طريق خفض إجمالي تقدير كتلة مياه الجسم بنسبة 2٪ من وزن الجسم. - تقدير كتلة خالية من الدهون (كتلة الجسم الهزيل وجميع المكونات الأخرى غير الدهون) من كل الخفافيش باستخدام المعادلة التالية:

ملاحظة: استخدم القيمة المقبولة تقليديًا البالغة 0.732 لمحتوى الرطوبة الكسري لكتلة الجسم الهزيلة للخفافيش الصحية وغير المرضعة. يمكن أن يتغير محتوى الرطوبة الكسرية للكتلة الخالية من الدهون في اللوعات البنية الكبيرة استنادًا إلى أسبوع ما بعد الولادة15. بالنسبة للأنواع الأخرى ، استخدم القيم المنشورة في الأدب أو حدد محتوى الرطوبة الكسرية لكتلة الجسم الهزيلة قبل إجراء حسابات كتلة الجسم الهزيل. - تقدير كتلة الدهون في الجسم باستخدام المعادلة التالية:
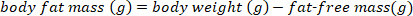
- تحويل كتلة الدهون في الجسم في ز إلى نسبة مئوية من كتلة الدهون في الجسم باستخدام المعادلة التالية:

6. تحديد تكوين المياه في آكل اللحوم(فيليس كاتوس، القط المنزلي)
- إعداد حل الأسهم كما هو موضح في القسم 1.
- وزن كل قطة إلى أقرب 3 أرقام عشرية وسجل الوزن. حساب الجرعة لكل قطة كما هو موضح في الخطوة 3.6 باستخدام جرعة D2O من 0.70 غرام / كجم.
- إعداد كل جرعة كما هو موضح في الخطوات 3.7−3.8. باستخدام حقنة 3 مل أو 5 مل مع إبرة 22 G بدلا ً من حقنة الأنسولين.
- جمع 500 ميكرولتر من الدم الكامل وإدارة تحت الجلد في وقت لاحق 0.7 ز / كغ د2O. طرد مركزي كامل الدم في 2000 × ز لمدة 15 دقيقة وتخزين البلازما في 1.5 مل أنابيب المسمار المسمار الدقيقة في -20 درجة مئوية حتى التحليل.
- جمع 500 ميكرولتر من الدم الكامل 4 ح بعد الحقن. الطرد المركزي الدم كله في 2000 ز لمدة 15 دقيقة وتخزين البلازما في 1.5 مل أنابيب المسمار المسمار microcentrifuge في -20 درجة مئوية حتى التحليل.
- جمع 500 ميكرولتر من الدم الكامل 14 يوما بعد الحقن. الطرد المركزي الدم كله في 2000 ز لمدة 15 دقيقة وتخزين البلازما في 1.5 مل أنابيب المسمار المسمار microcentrifuge في -20 درجة مئوية حتى التحليل.
ملاحظة: يمكن أن يستند عدد الأيام بين جمع الدم إلى الاحتياجات التجريبية وفترة ما بعد الحقن التي يمكن فيها اكتشاف D2O فوق مستويات الخلفية. أربعة عشر يوما كان طول كتل العلاج الغذائي من هوبر وآخرون9. - إجراء تحليل الأشعة تحت الحمراء FT وفقا للقسم 4 وحساب تكوين الجسم وفقا للقسم 5 من هذا البروتوكول.
- حساب استهلاك المياه في مل / يوم باستخدام المعادلات التالية:
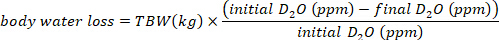
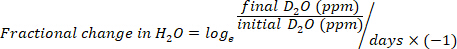
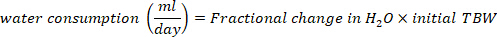
حيث TBW هو مجموع مياه الجسم، الأولي D2O والنهائي D2O هي تركيزات تقاس في جزء في المليون في عينات D2O بعد الحقن.
النتائج
يمكن استخدام تقنية تخفيف أكسيد الديوتريوم لتقييم تكوين الجسم لمجموعة متنوعة من الأنواع. لإثبات القدرة على التكيف، ونحن الإبلاغ عن أول استخدام لتقنية تخفيف أكسيد الديوتريوم في الأنواع الخفافيش الحشرية في أمريكا الشمالية، Eptesicus fuscus، الخفافيش البني الكبير للحصول عل?...
Discussion
وقد استخدم استخدام أكسيد الديوتريوم لتحديد TBW منذ 1940s17 ويستخدم في البشر ومجموعة متنوعة من الأنواع المنزلية والحياة البرية4،6،7. وقد تم تطوير تقنيات أخرى غير مدمرة بما في ذلك تحليل المعاوقة الكهربائية الحيوية (BIA)، DXA، والرنين ا...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا البحث من قبل اتفاقية التعاون MDC (#416) ، اتفاقية تعاونية خدمات الغابات الأمريكية (16-JV-11242311-118) ، الأكاديمية الأمريكية للتغذية البيطرية ووالثام / رويال كانين ، منحة الولايات المتحدة الأمريكية (رقم المنحة: 00049049) ، منحة تدريب المعاهد القومية للصحة (رقم المنحة: T32OS011126) ، وبرنامج علماء البحوث البيطرية في جامعة ميسوري. يشكر المؤلفون شانون إهلرز على مراجعتها المسبقة لهذه المخطوطة. نشكر الدكتور روبرت باكيوس على توفير معايير D2O والسماح باستخدام مختبره.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
References
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved