A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש תחמוצת דאונטיום ככלי לא פולשני, לא קטלני להערכת הרכב הגוף צריכת המים ביונקים
In This Article
Summary
מאמר זה מתאר את הטכניקה לדילול תחמוצת הדאויום בשני יונקים, אוכלי בשר וטורף, כדי לקבוע מי הגוף המלא, מסת הגוף רזה, מסת שומן הגוף, ואת צריכת המים.
Abstract
מצב הגוף מערכות הניקוד ומדדי מצב הגוף הם טכניקות נפוצות המשמשות להערכת מצב הבריאות או הכושר של מינים. מצב הגוף מערכות הניקוד הם תלויי מעריך ויש להם את הפוטנציאל להיות סובייקטיבי מאוד. מדדי מצב הגוף יכול להיות מבולבל על ידי מזון, ההשפעות של משקל הגוף, כמו גם בעיות סטטיסטיות ומסקנות. חלופה למצב הגוף מערכות הניקוד מדדי מצב הגוף משתמש איזוטופ יציב כגון תחמוצת דאונטיום כדי לקבוע הרכב הגוף. השיטה לדילול תחמוצת דאונטיום היא שיטה כמותית, המשמשת להערכת הרכב הגוף בבני אדם, חיות בר, ומינים ביתיים. בנוסף, ניתן להשתמש בטכניקת הדילול תחמוצת הדאויום כדי לקבוע את צריכת המים של בעל חיים יחיד. כאן, אנו מתארים את עיבוד של טכניקת הדילול תחמוצת דאומיום להערכת הרכב הגוף בעטלפים חומים גדולים (eptesicus גומא) ולהערכת צריכת המים אצל חתולים (felis catis).
Introduction
מצב הגוף מערכות הניקוד ומדדי מצב הגוף הם טכניקות נפוצות המשמשות להערכת מצב הבריאות או הכושר של מין1,2. מינים רבים ביתיים וזואולוגיים יש מערכות ייחודיות הגוף הבקיע (BCS) מערכת המשמשים להערכת השריר של בעל החיים רקמת שומן שטחית3. עם זאת, הערכת BCS מסתמך על המאבחן — כלומר BCS היא מדידה אובייקטיבית או חצי כמותית כאשר מוערך על ידי מעריך מיומן. במינים של חיות הבר, מדדי מצב הגוף משמשים בדרך כלל ולא BCS ומבוססים על היחס של מסת הגוף לגודל הגוף או מסת הגוף לזרוע2. מצב הגוף הצביע מבולבל לעתים קרובות על ידי ההשפעות של האוכל והוא יכול להיות מבולבל על ידי גודל הגוף, כמו גם בעיות סטטיסטיות ומסקנות4.
חלופה למצב הגוף מערכות הבקיע ומדדי המצב הגוף משתמש איזוטופ יציב כדי לקבוע את הרכב הגוף. איזוטופ יציב בשימוש נפוץ הוא תחמוצת דאוטיום (D2O), צורה לא רדיואקטיבית של מים שבו אטומי המימן הם איזוטופים מימן. השיטה לדילול תחמוצת דאונטיום המתואר במחקר זה יכול להיות שאינה סובייקטיבית, כמותית, ו לשחזור טכניקה המשמש להערכת הרכב הגוף בבני אדם5 מגוון רחב של זנים4,6,7. טכניקה זו יכולה להיות יתרון עבור לימוד הרכב הגוף בחיות בר. לדוגמה, ניתן להשתמש בה להערכת שינויי האורך בקומפוזיציה הגוף, כגון לפני ואחרי פעולת ניהול. עם זאת, בכמה מינים של חיות בר דאומיום תחמוצת יכול להיות מפריז באופן מיותר את תוכן המים בפועל8. לכן, בהתאמת הטכניקה למין, חשוב לאמת את השיטה באמצעות השוואת שיטת התחמוצת הדאוטריום לניתוח של מינים שאינם בסכנת הכחדה. עבור מינים מאוימים ובסכנת הכחדה, יש להתייחס לשיטה לא הרסנית כגון בדיקת רנטגן כפולה (DXA) כשיטת השוואה חלופית לשיטה ההרסנית בתקן הזהב לניתוח מוחלט של הגווייה.
בנוסף לקומפוזיציה הגוף, ניתן להשתמש בטכניקת הדילול D2O כדי לקבוע את צריכת המים של בעל חיים בודד9. יישום ייחודי זה של D2O יכול לשמש כדי לענות לא רק שאלות מחקר, אבל יכול להיות שימושי להערכת צריכת המים של בעלי חיים בודדים שוכנו הגדרות חברתיות גדולות.
כאן, אנו מתארים את עיבוד של טכניקת D2O דילול להערכת הרכב הגוף ב אוכלי בשר, עטלפים חומים גדולים (eptesicus גומא), ולהערכת צריכת המים בטורף, חתולים (felis catis).
Protocol
כל הניסויים המתוארים כאן אושרו על ידי הוועדה לטיפול בבעלי חיים של אוניברסיטת מיזורי ובניצוחו של משרד החוץ במיזורי (MDC) היתר האוסף המדעי (היתרים #16409 ו#17649).
1. הכנת התמיסה סטרילית, איזוטוניק, מניות2O של הפתרון
- להפוך פתרון מניות 50 mL של 9.0 g/L salinated D2O.
- שוקלים 450 מ ג של תרופות כיתה ולהעביר את כל ה-, לתוך 100 מ ל, מעוקר בגביע. הקלט את הכמות המדויקת של הפונקציה לארבעה מקומות עשרוניים במחברת המעבדה.
- באמצעות צילינדר לסיים סטרילי, למדוד 50 g של ≥ 99.8% מתוך תחמוצת העברת לתוך הגביע סטרילי המכיל את הנאל. הקלט את הכמות המדויקת של תחמוצת דאומיום ל -4 מקומות עשרוניים במחברת המעבדה או בגיליון האלקטרוני.
- מסנן 10 מ ל של כוח isosmotic (9.0 g/L) דרך מסנן דיסק סטרילי לא פירוגני עם נקבוביות יקרונים יקרון (0.2 μm).
- לצרף 20 גרם מחט מסנן דיסק סטרילי ללא פירוגניים עם נקבוביות יקרונים יקרון (0.2 μm) מצויד בחבית 10 מ"ל מזרק. הכנס לתוך המחיצה של 100 mL בקבוקון ריק סטרילי.
- לצרף שפופרת ואקום ל 22 המחט G ולהכניס את המחט לתוך המחיצה של 100 mL בקבוקון ריק סטרילי.
- יוצקים 10 מ ל של פתרון המניה לתוך חבית המזרק. לאט להדליק את הוואקום עד D2O פתרון המניה מתחיל לאט לסנן לתוך בקבוקון סטרילי. להמשיך למזוג את הפתרון2O מניות לתוך חבית מזרק עד כל 50 mL מסונן.
הערה: ייתכן שפתרון המניה צריך להיות מדולל או מרוכז בהתאם למינון הנדרש. המינון של D2O ישתנו בהתבסס על המינים ואת הרגישות של השיטה האנליטית. עבור חתולים, פתרון העבודה שימש לניהול מנה של 0.7 g/ק"ג D2O. פתרון המניה שתוארה לעיל ממזער את כמות התמיסה התת-עורי שהוצגה לבעל החיים תוך שהיא עדיין מאפשרת מדידה מדויקת של המינון. עבור יונקים קטנים כגון עטלפים, ריכוז זה חייב להיות מדולל לפתרון עובד כגון 0.1600 g/mL. ריכוז זה מאפשר את המינון של 0.75 g/kg D2O להיות נמדד במדויק ומנוהל כ 100 μl או פחות פתרון.
2. הכנת מניות סטרילי, איזוטוניקה, מלאי2O לעבוד פתרון עבור עטלפים
- שוקלים 10 mL ריק בקבוקון סטרילי ומשקל השיא הקרוב ביותר 4 המקומות העשרוניים. . קנה המידה של האריזה
- השתמש מזרק 1.0 mL כדי להעביר 0.65 mL של הפתרון מניות D2O לעבר, 10 ml ריק בקבוקון סטרילי. משקל השיא של D2O עד 4 מקומות עשרוניים. . קנה המידה של האריזה
- לחשב את עוצמת הקול של D2O ב 10 מ"ל בקבוקון ריק. השתמש במשוואה הבאה.

כאשר W הוא משקל נרשם D הוא צפיפות של 99.8% D2O (1.107 g/mL). - השתמש באמצעי האחסון המחושב ובמשקל הידוע של D2O כדי לקבוע את הנפח של מלוחים איזוטוניקה נדרש לעשות ~ 0.1600 g/mL פתרון העבודה.
- הכנס לתוך המחיצה של 10 מ"ל בקבוקון סטרילי, המחט G 22 (מחובר שפופרת ואקום). הכנס לתוך המחיצה של 10 מ"ל בקבוקון סטרילי, 20 גרם מחט (מצורף מסנן מזרק 0.22 יקרומטר מצויד עם חבית מזרק mL 10).
- יוצקים את מסה/נפח מחושב של איזוטוניקה לתוך חבית המזרק ולהדליק את הוואקום כדי לאפשר טפטוף איטי לתוך בקבוקון סטרילי 10 mL.
- להקליט את המשקל של המבחנה ולהבטיח ~ 0.1600 g/mL פתרון העבודה נוצר.
3. קביעת הרכב הגוף של עטלפים חומים גדולים (Eptesicus האדום) עם D2O
הערה: פתרון המניה של D2O בשימוש בפרוטוקול הוא 0.1598 g/mL. לפני איסוף דם, להבטיח כי הסרת עד 200 μL של דם יהיה ≤ 10% של נפח הדם הכולל של המחבט הוא בתוך טיפול בעלי חיים מוסדיים והשימוש של הוועדה (IACUC) הוקמה הנחיות לאיסוף דם. כל בעלי החיים צריכים להיות מpalpated בבטן ולדאוג לקיבה ריקה. הארוחה האחרונה יכולה לשנות את משקלו של בעל החיים וכתוצאה מכך תוצאות מבולבל מאז חישובים לקביעת שומן הגוף להסתמך על מסת הגוף של החיה.
- . לממש מחבט חום גדול
- השתמש ב-5.0% isoffor השראה. שמירה על מישור יציב של הרדמה באמצעות 0.5%-3.0% isofלוריאן.
- לקבוע עומק הרדמה נכונה על ידי בדיקת רפלקס הנסיגה דוושה (צובט את הבהונות של המחבט). המחבט לא צריך להגיב על התחושה ואת קצב הנשימה צריך להישאר איטי ויציב. לשמור על מישור יציב. של הרדמה
- שיעור הקלטה, רמת לב, קצב נשימה ומידע נוסף כנדרש על ידי IACUC.
- שוקלים את המחבט החום הגדול ומקליטים את המשקל ל -4 מקומות עשרוניים.
- נקו את הuropatagium (קרום הזנב) מעל וריד הירך עם משטח הכנה לאלכוהול ומאפשרים ייבוש. למרוח שכבה דקה של ריבת. נפט על הווריד הפנימי
- השתמש במחט של 29 G כדי לנקב את החלק הגוייתי של הווריד הבין ולאסוף 100 μL של דם באמצעות צינורות פלסטיק הפארין הפרין הנתרן. להבטיח ערבוב הולם של הדם כולו עם הפארין נתרן על ידי מתגלגל בעדינות כל צינור אחרי האוסף תווית הצינור.
- באמצעות מכונת DXA מכויל עבור יונקים קטנים, להשיג שלושה סריקות DXA של המחבט10.
- לקבוע את המסה (ב g) של D2O להזריק על ידי הכפלת משקל העטלף ק ג על ידי מינון D2O של 0.75 g/ק"ג. לקבוע את הנפח של מינון D2o מחושב (V) על ידי חלוקת המשקל של מינון d2o על ידי ריכוז של פתרון העבודה.
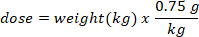
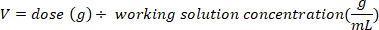
- השתמש מזרק אינסולין עם מחט של 29 גרם מוצמד לצייר את הנפח של D2O מחושב. שוקלים את D2O, מזרק אינסולין, ואת המחט. הקלטה ל-4 מקומות עשרוניים.
- הכנס את D2O תת-עורי על האזור הירך התחתית של העטלף מורדם.
- אפשר עטלף להתאושש הרדמה ולהקליט את הזמן של הזרקה.
- מיד לאחר ההזרקה, שוקלים את מזרק האינסולין הריק כעת עם מחט של 29 גרם מוצמד. הקלט את המשקל לארבעה מקומות עשרוניים.
- לקבוע את המינון של D2O מוזרק על ידי הפחתת משקל שלאחר ההזרקה של מזרק האינסולין מן ההזרקה לפני הזריקה D2O מילא מזרק אינסולין. הקלטה ל-4 מקומות עשרוניים.
- בתוך 30 דקות של איסוף דם הודעה, השתמש בצנטריפוגה המטקריט כדי לסובב כל צינור נימי עבור 5 דקות. אם צנטריפוגה המטקריט מאפשרת מהירויות מרובות, להגדיר ל 10,000 x g.
- השתמשו במספריים חדים כדי לחתוך את צינור הקפילר הפלסטי בין כל הדם והפלסמה. השתמש בפיפטה 200 μL כדי לגרש את הפלזמה ישירות לתוך מתויג, 500 שפופרת אחסון μL.
- לאחר תקופת האקוויליציה, לאסוף עוד 100 μL של דם מווריד הירך.
הערה: התקופה העורפלת תשתנה לפי מינים ואם העטלפים ילכו לכיוון ההפוך. עבור עטלפים חומים גדולים, בדרך כלל 2 h הוא מספיק עבור תקופת השיווציה. - הפרד הפלזמה לתוך מתויג שני, 500 μL מיקרוצנטריפוגה בורג שפופרת העליון על ידי צעד חוזר 3.13. לחנות דגימות ב-20 ° c או קר עד הניתוח.
4. פורייה-המרה ספקטרופוטומטר אינפרא אדום ניתוח
- הגדר את טמפרטורת אמבט חול עד 60 ° צ' כדי להקל על זיקוק (לאפשר הפרדת מים ו-D2O מרכיבי דם אחרים).
- פיפטה 50 μL של כל דגימת פלזמה ותקן על החלק הפנימי של כובע צינור מיקרו-מיקרוצנטריפוגה של 1.5 mL. כולל סטנדרטים המכילים ריכוזים ידועים של D2O כבקרת איכות.
הערה: באופן אידיאלי לכל בעל חיים יהיו שלושה משכפל לכל מדגם וממוצע שלושת המשכפלת מדווח. בשל נפח המדגם המוגבל ואת נפח המדגם הנדרש עבור ציוד FT-IR מנוצל על ידי המחברים, לא בוצעו משכפל עבור דגימות העטלף. אם מדגם כלשהו מכיל פחות מ-50 μL של פלזמה, מנקז את כמות המדגם על כובע צינור המיקרו-צנטריפוגה החרוט ולהקליט את עוצמת הקול. - שמור את המכסה מיקרוצנטריפוגה הפוך ולהרוס את הצינור 1.5 mL מיקרוצנטריפוגה חרוט על הכובע. מניחים את הצינור הפוך (הפוך) עם הכובע במגע עם החול באמבט חול למינימום של 12 h (לילה).
- לאחר 12 h, להסיר את הכובע ולהחליף עם כובע חדש, נקי. דופק את צינור המיקרוצנטריפוגה. במשך 10 ס מ בצנטריפוגה
- צור את התקנים הבאים: 0 עמודים לדקה (0 mg D2O ב-1 ליטר מים מזוקקים), 293 דפים לדקה (293 mg d2o ב-1 מים מזוקקים), 585 Ppm (585 mg d2o ב 1 l מזוקק מים), 878 ppm (878 mg d2o ב 1 מזוקק מים), ו-1170 ppm d2o (1170 mg d2o ב 1 מים מזוקקים).
הערה: הערכים לעיל מוצעים עבור עקומה רגילה. ערכים חלופיים כגון 250 ppm, 500 ppm, 750 ppm, וכן הלאה ניתן להשתמש. - התקן תא שידור נוזלי לתוך ספקטרומטר פורייה ספקטרופוטומטר (FTIR) (טבלת חומרים). מלא את התא עם מתנול וחבר את יציאת ההזרקה. באיטיות למלא את התא עם מים ברקע תוך הסרת בזהירות את המזרק מתנול כדי להפחית את הסיכון של בועות אוויר. צרף צינורות ליציאת פלט כדי לאפשר הסרה של דגימות לאחר ניתוח.
- הכן את תוכנת הספקטרומטר FTIR (טבלת חומרים) לניתוח של D2O במים. הגדרות הפרמטרים עבור התוכנה הספקטרומטר המשמשות בפרוטוקול זה מפורטות בטבלה 1.
- לאסוף דגימת רקע באמצעות דילול, 0.22 μm-מסוננים, מים מזוקקים. זה אמור להיות אותו המים. שמשמשים לסטנדרטים
- הכנס 40 μL של 0 ppm D2O והקלט את הספקטרום. שמור את הספקטרום כקובץ ערכים מופרדים באמצעות פסיקים (CSV).
- המשך להזריק ולשמור את הספקטרום של כל התקנים כדי ליצור עקומה סטנדרטית.
- חזור על הרקע והעקומה הסטנדרטיים כל 60 עד 90 דקות.
- הכנס 40 μL של כל מדגם מזוקק לתוך תא השידור הנוזלי ולשמור את ספקטרום.
הערה: לשנות את נפח ההזרקה של התקנים ודגימות מזוקקים המבוססות על נפח של תא שידור נוזלי. השתמש באמצעי אחסון קטן יותר תא שידור נוזלי אם הנפח לדוגמה הוא מתחת 40 μL או לדלל 1:1 עם מים מזוקקים ברקע. - לקבוע את הריכוז של D2O של כל מדגם מ-ftir ספקטרה באמצעות תוכנית גיליון אלקטרוני כפי שמתואר על ידי ג'נינגס et al.11 או את התוכנה ספקטרלית. בעת ביצוע משכפל, השתמש בריכוז הממוצע כדי לחשב את הרכב הגוף.
5. חישוב הרכב הגוף
- המרת העשרה דאוטריום (ppm) עד אטום אחוז הריכוז עבור כל מדגם באמצעות המשוואה הבאה12:
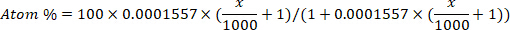
כאשר x הוא העשרה הנמדד דאויום (ppm) של המדגם ו 0.0001557 הוא חלק שומה של דאומיום דיווח בווינה תקן רגיל המים האוקיינוס (VSMOW)13. - לחשב את כל מי הגוף עבור כל דוגמה באמצעות המשוואה הבאה4,12,14:
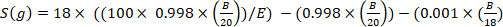 )
)
כאשר E הוא העשרה נמדד (אטום%) של דאוטריום במדגם לאחר תיקון רקע, B הוא מסת ההזרקה ב-g, ו 0.998 הוא ריכוז של D2O הזריק.
הערה: החלפת דאוטריום עם מימן יציב משך גורם 2% הערכה יתר של מסת המים הגוף הכולל. יש לתקן את כל מי הגוף על ידי הפחתת האומדן הכולל של מי הגוף על ידי 2% ממשקל הגוף. - העריכו את מסה נטולת שומן (מסת גוף רזה וכל הרכיבים האחרים שאינם שומן) של כל עטלף באמצעות המשוואה הבאה:

הערה: השתמש בערך המקובל מקובל של 0.732 עבור תוכן הלחות החלקי של מסת הגוף הרזה עבור בריאה, מהתייבשות, עטלפים שאינם מניקות. התוכן החלקי לחות של מסה נטולת שומן יכול לשנות את החומים הגדולים המלידתי על בסיס שבוע הפוסט15. עבור מינים אחרים, להשתמש בערכים שפורסמו בספרות או לקבוע את התוכן החלקי לחות של מסת הגוף רזה לפני ביצוע חישובים של מסת הגוף רזה. - העריכו את מסת השומן בגוף באמצעות המשוואה הבאה:
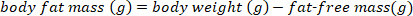
- להמיר את מסת שומן הגוף ב-g כדי אחוז מסת שומן הגוף באמצעות המשוואה הבאה:

6. קביעת הרכב המים בטורף (חתולים ביתיים)
- הכן את פתרון המניה כמתואר בסעיף 1.
- שוקלים כל חתול עד 3 המקומות הקרובים ביותר ומשקל שיא. לחשב את המינון עבור כל חתול כמתואר בשלב 3.6 באמצעות מינון D2O של 0.70 g/ק"ג.
- הכינו כל מנה כמתואר בצעדים 3.7-3.8. באמצעות מזרק 3 מ ל או 5 מ ל עם מחט של 22 גרם במקום מזרק אינסולין.
- לאסוף 500 μL של דם שלם ולאחר מכן מנהל תת-עורי את 0.7 g/ק"ג D2O. צנטריפוגה דם שלם ב 2,000 x g עבור 15 דקות ולאחסן פלזמה ב 1.5 mL מיקרוצנטריפוגה בורג צינורות העליון ב-20 ° c עד ניתוח.
- לאסוף 500 μL של דם שלם 4 h לאחר ההזרקה. צנטריפוגה דם שלם ב 2,000 x g עבור 15 דקות ולאחסן פלזמה ב 1.5 mL מיקרוצנטריפוגה בורג צינורות העליון ב-20 ° c עד ניתוח.
- לאסוף 500 μL של דם שלם 14 ימים לאחר ההזרקה. צנטריפוגה דם שלם ב 2,000 x g עבור 15 דקות ולאחסן פלזמה ב 1.5 mL מיקרוצנטריפוגה בורג צינורות העליון ב-20 ° c עד ניתוח.
הערה: מספר הימים בין איסוף הדם יכול להיות מבוסס על הצרכים הניסיוניים ואת התקופה שלאחר ההזרקה שבה D2O ניתן להבחין מעל רמות הרקע. 14 ימים היה אורכו של גושי טיפול תזונתיים מהופר ואח '9. - לבצע ניתוח FT-IR לפי סעיף 4 ולחשב את הרכב הגוף לפי סעיף 5 של פרוטוקול זה.
- חישוב צריכת המים ב-mL/day באמצעות המשוואות הבאות:
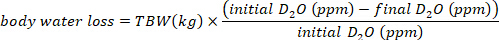
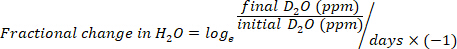
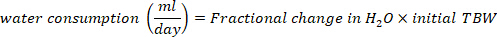
כאשר TBW היא מי הגוף הכולל, D הראשונית2o ו-d הסופי2o הם ריכוזים שנמדדו לדקה בתוך לאחר ההזרקה d2oדגימות.
תוצאות
ניתן להשתמש בטכניקת הדילול תחמוצת הדאויום כדי להעריך את הרכב הגוף של מגוון מינים. כדי להדגים את הסתגלות, אנו מדווחים על השימוש הראשון של הטכניקה לדילול תחמוצת דאומיום במינים insectivorous bat בצפון אמריקה, eptesicus גומא, העטלף החום הגדול עבור תוצאות המייצג. מישור העיתוי הושלם ע...
Discussion
השימוש תחמוצת דאומיום כדי לקבוע tbw כבר בשימוש מאז 1940 s17 והוא משמש בבני אדם מגוון של מינים מקומיים וחיות בר4,6,7. טכניקות אחרות שאינן הרסניות פותחו כולל ניתוח עכבה ביולוגית (BIA), DXA, ותהודה מגנטית כמותית (QMR). לכל שיטה יש יתרונות וחסר...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה היה נתמך על ידי MDC הסכם שיתופי (#416), ארה ב השירות היער שיתופי הסכם (16-JV-11242311-118), האקדמיה האמריקנית לתזונה וטרינרית וולת/רויאל Canin, ארה ב גרנט (גרנט מספר: 00049049), NIH הדרכה מענק (גרנט מספר: T32OS011126), והאוניברסיטה של מיזורי המחברים מודים לשנון על הסקירה המוקדמת של כתב היד. אנו מודים ד ר רוברט Backus על מתן סטנדרטים D2O ולאפשר שימוש במעבדה שלו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
References
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved