Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование оксида дейтерия в качестве неинвазивного, нелетального инструмента для оценки состава тела и потребления воды у млекопитающих
В этой статье
Резюме
В этой статье описывается техника разбавления оксида дейтерия у двух млекопитающих, инсективора и плотоядных, чтобы определить общую воду тела, мышечную массу тела, жировую массу и потребление воды.
Аннотация
Системы оценки состояния тела и индексы состояния тела являются общими методами, используемыми для оценки состояния здоровья или пригодности вида. Системы оценки состояния тела зависят от оценщика и могут быть весьма субъективными. Индексы состояния тела могут быть сбиты с толку кормления, эффекты массы тела, а также статистические и inferential проблемы. Альтернативой системы оценки состояния тела и индексы состояния тела использует стабильный изотоп, такой как оксид дейтерия, чтобы определить состав тела. Метод разбавления оксида дейтерия является повторяемым, количественным методом, используемым для оценки состава тела людей, диких животных и домашних видов. Кроме того, метод разбавления оксида дейтерия может быть использован для определения потребления воды отдельным животным. Здесь мы описываем адаптацию метода разбавления оксида дейтерия для оценки состава тела у больших коричневых летучих мышей(Eptesicus fuscus) и для оценки потребления воды у кошек(Felis catis).
Введение
Системы оценки состояния тела и индексы состояния тела являются общими методами, используемыми для оценки состояния здоровья или пригодности вида1,2. Многие отечественные и зоологические виды имеют уникальные системы оценки состояния тела (BCS), которые используются для оценки мышц животного и поверхностной жировой ткани3. Однако оценка БКС опирается на оценщика, что означает, что БКС является объективным или полуколичественным измерением при оценке квалифицированным оценщиком. В дикой природе, состояние тела индексы обычно используются, а не BCS и основаны на соотношении массы тела к размеру тела или массы тела предплечья2. Состояние тела indicis часто путают последствия кормления и могут быть сбиты с толку размер тела, а также статистические и inferential проблемы4.
Альтернативой системы оценки состояния тела и индексы состояния тела использует стабильный изотоп для определения состава тела. Одним из часто используемых стабильных изотопов является оксид дейтерия (D2O), нерадиоактивная форма воды, в которой атомы водорода являются изотопами дейтерия. Метод разбавления оксида дейтерия, описанный в данном исследовании, может быть несубъективным, количественным и повторяемым методом, используемым для оценки состава тела у людей5 и широкого круга видов4,6,7. Этот метод может быть выгодным для изучения состава тела в дикой природе. Например, он может быть использован для оценки продольных изменений в составе тела, таких как до и после действия управления. Однако, в некоторых видах дикой природы оксида дейтерия может переоценить фактическое содержание воды8. Поэтому при адаптации метода для вида важно проверить метод, сравнив метод оксида дейтерия с анализом туши для видов, не находящихся под угрозой исчезновения. Для видов, находящихся под угрозой исчезновения и находящихся под угрозой исчезновения, неразрушающий метод, такой как двойной рентгеновская абсорфтиометрия (DXA), следует рассматривать в качестве альтернативного метода сравнения с золотым стандартом разрушительного метода полного анализа туши.
В дополнение к составу тела, d2O разбавления техника может быть использована для определения потребления воды отдельных животных9. Это уникальное приложение D2O может быть использовано для ответа не только на исследовательские вопросы, но может быть полезно для оценки потребления воды отдельных животных (ы) размещены в больших социальных условиях.
Здесь мы описываем адаптацию d2O разбавления техники для оценки состава тела в насекомояле, большие коричневые летучие мыши (Eptesicus fuscus), и для оценки потребления воды в плотоядных, кошек (Felis catis).
протокол
Все эксперименты, описанные здесь, были одобрены Комитетом по уходу и использованию животных Университета Миссури и проведены в рамках Департамента охраны природы штата Миссури (MDC) разрешение на научную коллекцию дикой природы (Permit #16409 and #17649).
1. Подготовка стерильного, изотонического, засоленного раствора D2O
- Сделать 50 мл бульонного раствора 9,0 г/л засоленным D2O.
- Взвесить 450 мг фармацевтического сорта NaCl и переложить все NaCl в 100 мл стерилизованного стакана. Запишите точное количество NaCl до 4 десятичных мест в лабораторной записной книжке.
- Используя стерильный цилиндр, измерьте 50 г оксида дейтерия 99,8% и перенесите в стерильный стакан, содержащий NaCl. Запишите точное количество оксида дейтерия до 4 десятичных мест в лабораторной записной книжке или электронной таблице.
- Фильтр 10 мл изосмотической силы NaCl (9,0 г/л) через непирогенный стерильный дисковый фильтр с субмикронными порами (0,2 мкм).
- Прикрепите иглу 20 G к непирогенному стерильному дисковому фильтру с субмикронными порами (0,2 мкм), оснащенными бочкой шприца 10 мл. Вставьте в перегородку стерильной пустой флакон 100 мл.
- Прикрепите вакуумную трубку к игле 22 G и вставьте иглу в перегородку стерильной пустой флакон 100 мл.
- Налейте 10 мл бульонного раствора в бочку шприца. Медленно включите вакуум до тех пор, пока раствор запаса D2O не начнет медленно фильтроваться в стерильный флакон. Продолжайте залить раствор запаса D2O в бочку шприца до тех пор, пока не будут отфильтрочены все 50 мл.
ПРИМЕЧАНИЕ: Склад раствор может быть разбавлен или концентрирован в зависимости от необходимой дозы. Доза D2O будет варьироваться в зависимости от вида и чувствительности аналитического метода. Для кошек рабочий раствор использовался для введения дозы 0,7 г/кг D2O. Биржевое решение, описанное выше, сводит к минимуму количество раствора NaCl, введенного подкожно животному, в то же время позволяя точно измерять дозу. Для мелких млекопитающих, таких как летучие мыши, эта концентрация должна быть разбавлена рабочим раствором, таким как 0.1600 g/mL. Эта концентрация позволяет точно измерить дозу 0,75 г/кг D2O и вводить его примерно в 100 л или менее в растворе NaCl.
2. Подготовка стерильных, изотонических, засоленных D2O складе рабочего решения для летучих мышей
- Взвесьте 10 мл пустой стерильный флакон и рекордный вес до ближайших 4 десятичных мест. Масштаб Таза.
- Используйте шприц объемом 1,0 мл для передачи 0,65 мл раствора запаса D2O в tared, 10 мл пустой стерильный флакон. Рекордный вес D2O до 4 десятичных мест. Масштаб Таза.
- Рассчитайте объем D2O в пустом флаконе 10 мл. Используйте следующее уравнение.

где W зарегистрирован вес и D плотность 99,8% D2O (1,107 г/мл). - Используйте расчетный объем и известный вес D2O, чтобы определить объем изотонического соля, необходимого для изготовления рабочего решения в размере 0,1600 г/мл.
- Вставьте в перегородку стерильной флакона 10 мл, иглу 22 G (прикрепленная к вакуумной трубке). Вставьте в перегородку стерильной флакона 10 мл, иглу 20 G (прилагается к фильтру шприца 0,22 мкм, оснащенному бочкой шприца 10 мл).
- Налейте рассчитанную массу/объем изотонического NaCl в бочку шприца и включите вакуум, чтобы позволить медленное капельное в стерильный флакон 10 мл.
- Запишите вес флакона и убедитесь, что создается рабочее решение стоимостью 0,1600 г/мл.
3. Определение состава тела больших коричневых летучих мышей (Eptesicus fucsus) с D2O
ПРИМЕЧАНИЕ: Складраствор D2O, используемый в протоколе, равен 0,1598 г/мл. Перед сбором крови убедитесь, что удаление до 200 л крови составит 10% от общего объема крови летучей мыши и находится в рамках Институционального комитета по уходу и использованию животных (IACUC) установленных руководящих принципов для сбора крови. Все животные должны быть поститься или живот пальпированные для обеспечения пустой желудок. Недавнее питание может изменить вес животного в результате confounded результаты, поскольку расчеты для определения жира полагаться на массу тела животного.
- Анестезируйте большую коричневую летучую мышь.
- Используйте 5,0% изолюран для индукции. Поддержание стабильной плоскости анестезии с использованием 0,5%-3,0% изолюран.
- Определите надлежащую глубину анестезии, испытав рефлектор отмены педали (защипывание ног летучей мыши). Летучая мышь не должна реагировать на ощущение и частота дыхания должна оставаться медленной и стабильной. Отрегулируйте изолюран по мере необходимости для поддержания стабильной плоскости анестезии.
- Запись изофруранового уровня, частота сердечных приступов, частота дыхания и другую информацию, как того требует IACUC.
- Взвесьте большую коричневую летучую мышь и запишите вес до 4 десятичных мест.
- Очистите уропатагиум (хвостовую мембрану) над межнравственной веной с помощью спиртовой подготовительной прокладки и дайте высохнуть. Нанесите тонкий слой вазелина на межнравственное вену.
- Используйте 29 G иглу, чтобы проколоть локальную часть межнравственной вены и собрать 100 л крови с помощью пластиковых натрия гепарина капиллярных труб. Обеспечить адекватное смешивание всей крови с гепарином натрия, аккуратно прокатки каждой трубки после сбора и этикетки трубки.
- Используя машину DXA, откалиброванный для мелких млекопитающих, получите три DXA-сканирования летучей мыши10.
- Определить массу (в г) D2O, чтобы впрыснуть путем умножения веса летучей мыши в кг на дозу D2O 0,75 г/кг. Определите объем рассчитанной дозы D2O (V) путем деления веса дозы D2O на концентрацию рабочего раствора.
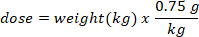
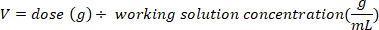
- Используйте инсулиновый шприц с иглой 29 G, прикрепленной для составления объема расчета D2O. Взвесьте D2O, инсулиновый шприц и иглу. Запись до 4 десятичных мест.
- Введите D2O подкожно над областью терпящих суставов бедра обезожданной летучей мыши.
- Разрешить летучей мыши, чтобы оправиться от анестезии и записывать время инъекции.
- Сразу же после инъекции, взвесить теперь пустой инсулин шприц с 29 G иглы прилагается. Запись веса до 4 десятичных мест.
- Определите дозу D2O вводят путем вычитания после инъекционного веса инсулина шприц из предварительной инъекции D2O заполнены инсулиншом. Запись до 4 десятичных мест.
- В течение 30 минут после сбора крови, использовать центрифугу гематокрита, чтобы спина каждой капиллярной трубки в течение 5 минут. Если центрифуга гематокрита позволяет на несколько скоростей, то установлена до 10 000 х г.
- Используйте острые ножницы, чтобы сократить пластиковые капиллярные трубки между всей крови и плазмы. Используйте пипетку объемом 200 л, чтобы изгнать плазму непосредственно в маркированную трубку для хранения 500 л.
- После периода равновесия соберите еще 100 л крови из интерфеморальной вены.
ПРИМЕЧАНИЕ: Период равновесия будет варьироваться в зависимости от вида, и если летучие мыши идут в оцепенение. Для больших коричневых летучих мышей, как правило, 2 ч достаточно для периода равновесия. - Разделите плазму на вторую маркированную, 500 микроцентрифуги винт верхней трубки, повторяя шаг 3.13. Храните образцы при -20 градусах Цельсия или холоднее до анализа.
4. Анализ инфракрасной спектрометрии Фурье-трансформер
- Установите температуру песочной ванны до 60 градусов по Цельсию, чтобы облегчить дистилляцию (позволяет отделить воду и D2O от других компонентов крови).
- Пипетка 50 л каждого образца плазмы и стандартные на внутренней стороне 1,5 мл конической микроцентрифуги трубки крышка. Включая стандарты, содержащие известные концентрации D2O в качестве контроля качества.
ПРИМЕЧАНИЕ: В идеале каждое животное будет иметь три реплики на образец и в среднем из трех реплик сообщили. Из-за ограниченного объема выборки и объема образцов, необходимых для оборудования FT-IR, использованного авторами, репликации не были выполнены для образцов летучих мышей. Если какой-либо образец содержит менее 50 кЛ плазмы, пипетка количество образца на конической микроцентрифуговой трубки крышка и записывать объем. - Держите крышку микроцентрифуги вверх дном и винт 1,5 мл конической микроцентрифуги трубки на крышку. Поместите перевернутую (вверх ногами) трубку с крышкой в контакте с песком в песчаной ванне минимум на 12 ч (ночь).
- После 12 ч снимите крышку и замените новой, чистой крышкой. Импульс микроцентрифуговой трубки в течение 10 с в центрифуге.
- Создайте следующие стандарты: 0 промилле (0 мг D2O в 1 л дистиллированной воды), 293 промилле (293 мг D2O в 1 L дистиллированной воды), 585 ppm (585 мг D2O в 1 L дистиллированной воды), 878 ppm (878 мг D2O в 1 L дистиллированной воды), и 1170 ppm D2O (1170 мг D2O в 1 L дистиллированной воды).
ПРИМЕЧАНИЕ: Значения выше предлагаются для стандартной кривой. Альтернативные значения, такие как 250 ppm, 500 ppm, 750 ppm, и так далее могут быть использованы. - Установите жидкую клетку передачи в спектрометр инфракрасного спектрометрии Фурье (FTIR)(Таблица материалов). Заполните ячейку метанолом и соедините порт инъекций. Медленно заполните клетку фоновой водой, тщательно удаляя метанол шприц, чтобы уменьшить риск пузырьков воздуха. Прикрепите трубку к выходному порту, чтобы позволить удалить образцы после анализа.
- Подготовьте программное обеспечение спектрометра FTIR(Таблица материалов) для анализа D2O в воде. Параметры параметров для программного обеспечения спектрометра, используемого в этом протоколе, перечислены в таблице 1.
- Соберите фоновый образец, используя разбавив, 0,22 мкм-фильтруется, дистиллированной воды. Это должна быть та же вода, которая используется для стандартов.
- Введите 40 qL 0 ppm D2O и запишите спектры. Сохранить спектры как запятую разделенных значений (CSV) файл.
- Продолжайте вводить и сохранять спектры всех стандартов, чтобы создать стандартную кривую.
- Повторите фон и стандартную кривую каждые 60–90 минут.
- Введите 40 л каждого дистиллированного образца в жидкую клетку передачи и сохраните спектры.
ПРИМЕЧАНИЕ: Изменить объем инъекций стандартов и дистиллированных образцов на основе объема жидкой клетки передачи. Используйте меньшую литую ячейку передачи жидкости, если объем образца ниже 40 л или разбавляйте 1:1 с фоновой дистиллированной водой. - Определите концентрацию D2O каждого образца из спектра FTIR с помощью программы электронных таблиц, описанной Дженнингсом и др.11 или спектральным программным обеспечением. Когда репликации выполняются, используйте среднюю концентрацию для расчета состава тела.
5. Расчет состава тела
- Преобразуйте обогащение дейтерия (ppm) в концентрацию атома в процентах для каждого образца, используя следующее уравнение12:
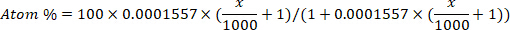
где х является измеренное дейтерия обогащения (ppm) образца и 0.0001557 является моль фракции дейтерия сообщили в Вене Стандартный средний океан воды (VSMOW)13. - Рассчитайте общую воду тела для каждого образца, используя следующее уравнение4,12,14:
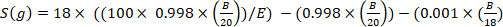 )
)
где E является измеренное обогащение (атом) дейтерия в образце после фоновой коррекции, B является инъекционной массой в г, и 0,998 является концентрацией инъекций D2O.
ПРИМЕЧАНИЕ: Deuterium обмен с лабильным водородом вызывает 2% завышение общей массы воды тела. Общая вода в организме должна быть исправлена за счет уменьшения общей массы воды тела на 2% от массы тела. - Оцените обезжиренное массу (мышечную массу тела и все другие обезжиренные компоненты) каждой летучей мыши, используя следующее уравнение:

ПРИМЕЧАНИЕ: Используйте условно принятое значение 0,732 для дробного содержания влаги мышечной массы тела для здоровых, эвгидратированных, не-лактирующих летучих мышей. Содержание дробной влаги в обезжиреновой массе может меняться в лактирующих больших коричневых на основе послеродовой недели15. Для других видов, использовать значения, опубликованные в литературе или определить содержание дробной влаги мышечной массы тела до выполнения расчетов мышечной массы тела. - Оцените жировую массу с помощью следующего уравнения:
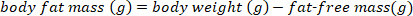
- Преобразуйте массу жировых отложений в г в процент жировой массы, используя следующее уравнение:

6. Определение состава воды у плотоядного(Felis catus,домашняя кошка)
- Подготовьте акционерное решение, описанное в разделе 1.
- Взвесьте каждую кошку до ближайших 3 десятичных мест и рекордный вес. Рассчитайте дозу для каждой кошки, как описано в шаге 3.6 с помощью дозы D2O 0,70 г/кг.
- Подготовьте каждую дозу, как описано в шагах 3.7'3.8. с помощью шприца 3 мл или 5 мл с иглой 22 G вместо инсулинового шприца.
- Соберите 500 л цельной крови и впоследствии вводят подкожно 0,7 г/кг D2O. Центрифуга цельной крови при 2000 х г в течение 15 мин и храните плазму в 1,5 мл микроцентрифуга винтовых верхних трубок при -20 градусов до анализа.
- Соберите 500 л цельной крови 4 ч после инъекции. Центрифуга цельной крови на 2000 х г в течение 15 минут и хранить плазму в 1,5 мл микроцентрифуга винт верхние трубы при -20 градусов по Цельсию до анализа.
- Соберите 500 л цельной крови 14 дней после инъекции. Центрифуга цельной крови на 2000 х г в течение 15 минут и хранить плазму в 1,5 мл микроцентрифуга винт верхние трубы при -20 градусов по Цельсию до анализа.
ПРИМЕЧАНИЕ: Количество дней между сбором крови может быть основано на экспериментальных потребностях и периоде после инъекции, в котором D2O может быть обнаружен выше фоновых уровней. Четырнадцать дней была продолжительность диетического лечения блоков от Хупер и др.9. - Выполняйте анализ FT-IR в соответствии с разделом 4 и вычисляйте состав тела в соответствии с разделом 5 этого протокола.
- Рассчитайте потребление воды в мл/день, используя следующие уравнения:
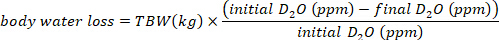
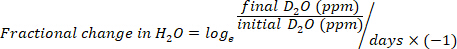
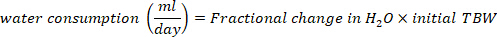
где TBW является общей воды тела, первоначальные D2O и окончательный D2O являются концентрации, измеренные в промилле в пост-инъекции D2O образцов.
Результаты
Техника разбавления оксида дейтерия может быть использована для оценки состава тела различных видов. Чтобы продемонстрировать приспособляемость, мы сообщаем о первом использовании техники разбавления оксида дейтерия в североамериканских насекомоядных видов летуч...
Обсуждение
Использование оксида дейтерия для определения TBW был использован с 1940-хгодов 17 и используется в организме человека и различных домашних и диких видов4,6,7. Были разработаны другие неразрушающие методы, включая биоэлектриче?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано MDC Кооперативное соглашение (#416), США Лесной службы кооперативного соглашения (16-СП-11242311-118), Американская академия ветеринарного питания и Waltham / Royal Canin, США Грант (грант номер: 00049049), NIH учебный грант (грант номер: T32OS011126), и Университет Миссури ветеринарных исследований программы. Авторы благодарят Шеннон Элерс за предварительное рассмотрение этой рукописи. Мы благодарим доктора Роберта Бэкуса за предоставление стандартов D2O и разрешение на использование его лаборатории.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
Ссылки
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены