Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de l’oxyde de deutérium comme outil non invasif et non létal pour évaluer la composition corporelle et la consommation d’eau chez les mammifères
Dans cet article
Résumé
Cet article décrit la technique de dilution d’oxyde de deutérium dans deux mammifères, un insectivore et un carnivore, pour déterminer l’eau totale de corps, la masse maigre de corps, la masse grasse de corps, et la consommation d’eau.
Résumé
Les systèmes de notation de l’état corporel et les indices de l’état corporel sont des techniques courantes utilisées pour évaluer l’état de santé ou l’aptitude d’une espèce. Les systèmes de notation de l’état corporel dépendent de l’évaluateur et ont le potentiel d’être très subjectifs. Les indices de l’état corporel peuvent être confondus par la recherche de nourriture, les effets du poids corporel, ainsi que les problèmes statistiques et inférants. Une alternative aux systèmes de notation de l’état du corps et aux indices de l’état corporel est l’utilisation d’un isotope stable comme l’oxyde de deutérium pour déterminer la composition corporelle. La méthode de dilution de l’oxyde de deutérium est une technique quantitative répétable utilisée pour estimer la composition corporelle chez les humains, la faune et les espèces domestiques. En outre, la technique de dilution de l’oxyde de deutérium peut être utilisée pour déterminer la consommation d’eau d’un animal individuel. Ici, nous décrivons l’adaptation de la technique de dilution d’oxyde de deutérium pour évaluer la composition corporelle chez les grandes chauves-souris brunes (Eptesicus fuscus) et pour évaluer la consommation d’eau chez les chats (Felis catis).
Introduction
Les systèmes de notation de l’état corporel et les indices de l’état corporel sont des techniques courantes utilisées pour évaluer l’état de santé ou l’aptitude d’une espèce1,2. Beaucoup d’espèces domestiques et zoologiques ont des systèmes uniques de notation de l’état corporel (BCS) qui sont utilisés pour évaluer le muscle d’un animal et le tissu adipeux superficiel3. Toutefois, l’évaluation de la SCB repose sur l’évaluateur, ce qui signifie que le SBC est une mesure objective ou semi-quantitative lorsqu’elle est évaluée par un évaluateur formé. Chez les espèces sauvages, les indices de l’état corporel sont couramment utilisés plutôt que le BCS et sont basés sur un rapport entre la masse corporelle et la taille corporelle ou la masse corporelle etl’avant-bras 2. Les indicis de condition de corps sont souvent confondus par les effets de la recherche de nourriture et peuvent être confondus par la taille du corps aussi bien que les problèmes statistiques et inferentiels4.
Une alternative aux systèmes de notation de l’état du corps et aux indices de l’état corporel consiste à utiliser un isotope stable pour déterminer la composition corporelle. Un isotope stable couramment utilisé est l’oxyde de deutérium (D2O), une forme d’eau non radioactive dans laquelle les atomes d’hydrogène sont des isotopes de deutérium. La méthode de dilution de l’oxyde de deutérium décrite dans cette étude peut être une technique non subjective, quantitative et reproductible utilisée pour estimer la composition corporelle chez l’homme5 et un large éventail d’espèces4,6,7. Cette technique peut être avantageuse pour l’étude de la composition corporelle de la faune. Par exemple, il peut être utilisé pour évaluer les changements longitudinals dans la composition du corps, comme avant et après une action de gestion. Cependant, chez certaines espèces sauvages, l’oxyde de deutérium peut surestimer la teneur réelle en eau8. Par conséquent, lors de l’adaptation de la technique pour une espèce, il est important de valider la méthode en comparant la méthode de l’oxyde de deutérium à l’analyse des carcasses pour les espèces non menacées. Pour les espèces menacées et en voie de disparition, une méthode non destructive comme l’absorptiométrie à rayons X double (DXA) devrait être considérée comme une méthode de comparaison alternative à la méthode destructrice de l’analyse complète des carcasses.
En plus de la composition du corps, la technique de dilution D2O peut être utilisée pour déterminer la consommation d’eau d’un animal individuel9. Cette application unique de D2O peut être utilisée pour répondre non seulement aux questions de recherche, mais peut être utile pour évaluer la consommation d’eau des animaux individuels hébergés dans de grands milieux sociaux.
Ici, nous décrivons l’adaptation de la technique de dilution D2O pour évaluer la composition corporelle chez un insectivore, grandes chauves-souris brunes (Eptesicus fuscus), et pour évaluer la consommation d’eau chez un carnivore, les chats (Felis catis).
Protocole
Toutes les expériences décrites ici ont été approuvées par le Comité des soins et de l’utilisation des animaux de l’Université du Missouri et menées en vertu du permis de collecte scientifique de la faune du Missouri Department of Conservation (MDC) (Permit #16409 et #17649).
1. Préparation de la solution stérile, isotonique, salinisée D2O stock
- Faire une solution de stock de 50 ml de 9,0 g/L salinated D2O.
- Peser 450 mg de NaCl de qualité pharmaceutique et transférer tous les NaCl dans un bécher stérilisé de 100 ml. Enregistrez la quantité exacte de NaCl à 4 décimales dans le cahier de laboratoire.
- À l’aide d’un cylindre gradué stérile, mesurez 50 g d’oxyde de deutérium de 99,8 % et transférez-le dans le bécher stérile contenant le NaCl. Enregistrez la quantité exacte d’oxyde de deutérium à 4 décimales dans le cahier de laboratoire ou la feuille de calcul.
- Filtrer 10 mL de force isosmotique NaCl (9,0 g/L) à travers un filtre à disque stérile non pyrogénique avec des pores submicrons (0,2 m).
- Fixez une aiguille de 20 G au filtre à disque stérile non pyrogénique avec des pores submicrons (0,2 m) mladants munis d’un baril de seringue de 10 ml. Insérer dans le septum d’un flacon stérile de 100 ml.
- Fixez un tube à vide à une aiguille de 22 G et insérez l’aiguille dans le septum du flacon vide stérile de 100 ml.
- Verser 10 ml de la solution de bouillon dans le baril de seringue. Allumez lentement le vide jusqu’à ce que la solution de stock D2O commence à filtrer lentement dans le flacon stérile. Continuer à verser la solution de bouillon D2O dans le baril de seringue jusqu’à ce que tous les 50 mL soient filtrés.
REMARQUE : La solution de stock peut devoir être diluée ou concentrée selon la dose requise. La dose de D2O variera en fonction de l’espèce et de la sensibilité de la méthode analytique. Pour les chats, la solution de travail a été utilisée pour administrer une dose de 0,7 g/kg D2O. La solution de stock décrite ci-dessus minimise la quantité de solution NaCl introduite sous-cutanée à l’animal tout en permettant une mesure précise de la dose. Pour les petits mammifères comme les chauves-souris, cette concentration doit être diluée à une solution de travail telle que 0,1600 g/mL. Cette concentration permet de mesurer et d’administrer avec précision la dose de 0,75 g/kg D2O dans une solution NaCl d’environ 100 L ou moins.
2. Préparation de la solution de travail stérile, isotonique, salinisée D2O pour les chauves-souris
- Peser une fiole stérile vide de 10 ml et enregistrer le poids aux 4 décimales les plus proches. Échelle de tare.
- Utilisez une seringue de 1,0 ml pour transférer 0,65 ml de la solution de stock D2O à la fiole stérile vide de 10 ml. Poids record de D2O à 4 décimales. Échelle de tare.
- Calculer le volume de D2O dans le flacon vide de 10 ml. Utilisez l’équation suivante.

où W est enregistré poids et D est la densité de 99,8% D2O (1.107 g/mL). - Utilisez le volume calculé et le poids connu du D2O pour déterminer le volume de solution saline isotonique nécessaire pour effectuer une solution de travail de 0,1600 g/mL.
- Insérer dans le septum du flacon stérile de 10 ml, l’aiguille de 22 G (attachée au tube à vide). Insert into the septum of the 10 mL sterile vial, the 20 G needle (attached to a 0.22 μm syringe filter fitted with a 10 mL syringe barrel).
- Verser la masse calculée/volume de NaCl isotonique dans le baril de seringue et allumer le vide pour permettre un goutte-à-goutte lent dans le flacon stérile de 10 ml.
- Enregistrez le poids de la fiole et assurez-vous de créer une solution de travail de 0,1600 g/mL.
3. Détermination de la composition corporelle des grosses chauves-souris brunes (Eptesicus fucsus) avec D2O
REMARQUE: La solution de stock de D2O utilisée dans le protocole est de 0,1598 g/mL. Avant de recueillir du sang, assurez-vous que l’élimination de jusqu’à 200 L de sang sera de 10 % du volume sanguin total de la chauve-souris et qu’elle fait partie des lignes directrices établies par le Comité institutionnel de soins et d’utilisation des animaux (CCIO) pour la collecte du sang. Tous les animaux doivent être jeûnés ou l’abdomen palpé pour assurer un estomac vide. Un repas récent pourrait modifier le poids de l’animal entraînant des résultats confus puisque les calculs pour déterminer la graisse corporelle reposent sur la masse corporelle de l’animal.
- Anesthésiez une grosse chauve-souris brune.
- Utilisez 5,0% isoflurane pour l’induction. Maintenir un plan stable d’anesthésie à l’aide de 0,5 % à 3,0 % d’isoflurane.
- Déterminer la profondeur d’anesthésie appropriée en testant le réflexe de sevrage de la pédale (pincement des orteils de la chauve-souris). La chauve-souris ne doit pas réagir à la sensation et le taux respiratoire doit rester lent et stable. Ajuster l’isoflurane au besoin pour maintenir un plan stable d’anesthésie.
- Enregistrez le niveau d’isoflurane, la fréquence cardiaque, la fréquence respiratoire, et d’autres informations comme exigé par IACUC.
- Peser la grosse chauve-souris brune et enregistrer le poids à 4 décimales.
- Nettoyer l’uropatagium (membrane de queue) sur la veine interfémorale avec un tampon de préparation à l’alcool et laisser sécher. Appliquer une fine couche de gelée de pétrole sur la veine interfémorale.
- Utilisez une aiguille de 29 G pour percer la partie dorsale de la veine interfémorale et recueillir 100 L de sang à l’aide de tubes capillaires en sodium plastique héparine. Assurer un mélange adéquat du sang entier avec l’héparine de sodium en roulant doucement chaque tube après la collecte et étiqueter le tube.
- À l’aide d’une machine DXA calibrée pour les petits mammifères, obtenir trois scans DXA de la chauve-souris10.
- Déterminer la masse (en g) de D2O à injecter en multipliant le poids de la chauve-souris en kg par la dose D2O de 0,75 g/kg. Déterminer le volume de la dose d’O D2O (V) calculée en divisant le poids de la dose D2O par la concentration de la solution de travail.
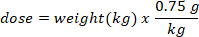
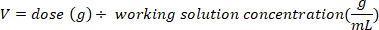
- Utilisez une seringue d’insuline avec une aiguille de 29 G attachée pour calculer le volume de D2O calculé. Pesez le D2O, la seringue à insuline et l’aiguille. Enregistrement à 4 décimales.
- Injecter le D2O sous-cutanée sur la région de la hanche dorsal de la chauve-souris anesthésié.
- Permettre à la chauve-souris de se remettre de l’anesthésie et enregistrer l’heure de l’injection.
- Immédiatement après l’injection, peser la seringue d’insuline maintenant vide avec l’aiguille de 29 G attachée. Enregistrez le poids à 4 décimales.
- Déterminer la dose de D2O injectée en soustrayant le poids post-injection de la seringue d’insuline de la seringue d’insuline remplie de pré-injection D2O. Enregistrement à 4 décimales.
- Dans un délai de 30 minutes après la collecte de sang, utilisez une centrifugeuse hématocrit pour faire tourner chaque tube capillaire pendant 5 min. Si la centrifugeuse hematocrit permet plusieurs vitesses, réglé à 10 000 x g.
- Utilisez un ciseaux pointus pour couper le tube capillaire en plastique entre le sang entier et le plasma. Utilisez une pipette de 200 l pour expulser le plasma directement dans un tube de stockage étiqueté de 500 l.
- Après la période d’équilibre, recueillir un autre 100 L de sang de la veine interfémorale.
REMARQUE : La période d’équilibre varie selon les espèces et si les chauves-souris entrent en torpeur. Pour les grosses chauves-souris brunes, généralement 2 h est suffisant pour la période d’équilibre. - Séparer le plasma en un deuxième tube de vis microcentrifuge de 500 l en répétant l’étape 3.13. Conserver les échantillons à -20 oC ou plus froid jusqu’à l’analyse.
4. Analyse de spectrophotométrie infrarouge à transformation Fourier
- Fixer la température d’un bain de sable à 60 oC pour faciliter la distillation (permettre la séparation de l’eau et D2O des autres composants sanguins).
- Pipette 50 l de chaque échantillon de plasma et standard à l’intérieur d’un bouchon conique de 1,5 ml de tube microcentrifuge. Y compris les normes contenant des concentrations connues de D2O comme contrôle de la qualité.
REMARQUE : Idéalement, chaque animal aura trois répliques par échantillon et la moyenne des trois répliques signalées. En raison du volume limité de l’échantillon et du volume d’échantillons requis pour l’équipement FT-IR utilisé par les auteurs, aucune réplique n’a été effectuée pour les échantillons de chauves-souris. Si un échantillon contient moins de 50 l de plasma, pipette l’échantillon s’élève sur le bouchon conique du tube microcentrifuge et enregistre le volume. - Gardez le bouchon de microcentrifuge à l’envers et vissez le tube conique de 1,5 ml sur le bouchon. Placez le tube inversé (à l’envers) avec le bouchon en contact avec le sable dans le bain de sable pendant un minimum de 12 h (nuit).
- Après 12 h, retirer le bouchon et le remplacer par un nouveau bouchon propre. Pulser le tube de microcentrifuge pendant 10 s dans une centrifugeuse.
- Créez les normes suivantes : 0 ppm (0 mg D2O en 1 L d’eau distillée), 293 ppm (293 mg D2O en 1 L d’eau distillée), 585 mg D2O en 1 L d’eau distillée), 878 ppm (878 mg D2O en 1 L d’eau distillée), et 1170 ppm D2O (1170 mg D2O en 1 L d’eau distillée).
REMARQUE : Les valeurs ci-dessus sont suggérées pour une courbe standard. Des valeurs alternatives telles que 250 ppm, 500 ppm, 750 ppm, et ainsi de suite peuvent être utilisées. - Installer une cellule de transmission liquide dans le spectrophotomètre spectrophotométry infrarouge de transformation Fourier (FTIR) (Tableau des matériaux). Remplissez la cellule de méthanol et connectez le port d’injection. Remplissez lentement la cellule d’eau de fond tout en enlevant soigneusement la seringue de méthanol pour réduire le risque de bulles d’air. Fixer le tube au port de sortie pour permettre l’enlèvement des échantillons après l’analyse.
- Préparer le logiciel de spectromètre FTIR (Table of Materials) pour l’analyse de D2O dans l’eau. Les paramètres du logiciel de spectromètre utilisé dans ce protocole sont énumérés dans le tableau 1.
- Recueillir un échantillon de fond à l’aide du diluant, de l’eau distillée filtrée à 0,22 m. Cela devrait être la même eau utilisée pour les normes.
- Injecter 40 oL du 0 ppm D2O et enregistrer les spectres. Enregistrer les spectres en tant que fichier de valeurs séparées par virgule (CSV).
- Continuez d’injecter et d’enregistrer les spectres de toutes les normes pour créer une courbe standard.
- Répétez l’arrière-plan et la courbe standard toutes les 60 à 90 min.
- Injecter 40 L de chaque échantillon distillé dans la cellule de transmission liquide et enregistrer les spectres.
REMARQUE : Modifier le volume d’injection des normes et des échantillons distillés en fonction du volume de la cellule de transmission liquide. Utilisez une cellule de transmission liquide à plus petit volume si le volume de l’échantillon est inférieur à 40 L ou diluez 1:1 avec de l’eau distillée de fond. - Déterminer la concentration de D2O de chaque échantillon à partir des spectres FTIR à l’aide d’un programme de feuilles de calcul tel que décrit par Jennings et coll.11 ou le logiciel spectral. Lorsque des répliques sont effectuées, utilisez la concentration moyenne pour calculer la composition du corps.
5. Calcul de la composition corporelle
- Convertir l’enrichissement du deutérium (ppm) en concentration en pourcentage d’atome pour chaque échantillon en utilisant l’équation suivante12:
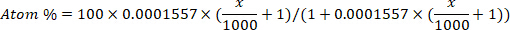
où x est l’enrichissement mesuré de deutérium (ppm) de l’échantillon et 0,0001557 est la fraction de taupe de deutérium rapportée dans Vienna Standard Mean Ocean Water (VSMOW)13. - Calculez l’eau corporelle totale pour chaque échantillon à l’aide de l’équation suivante4,12,14:
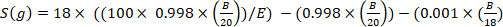 )
)
où E est l’enrichissement mesuré (atome%) de deutérium dans l’échantillon après correction de fond, B est la masse d’injection dans g, et 0,998 est la concentration de D2O injecté.
REMARQUE : L’échange de deutérium avec l’hydrogène labile provoque une surestimation de 2 % de la masse totale d’eau du corps. L’eau corporelle totale devrait être corrigée en réduisant l’estimation totale de la masse de l’eau corporelle de 2 % du poids corporel. - Estimer la masse sans gras (masse maigre du corps et tous les autres composants non gras) de chaque chauve-souris en utilisant l’équation suivante :

REMARQUE : Utilisez la valeur conventionnellement acceptée de 0,732 pour la teneur en humidité fractionnaire de la masse maigre du corps pour les chauves-souris saines, euhydrated, non-lactatantes. La teneur en humidité fractionnaire de la masse sans gras peut changer en lactant de gros bruns basés sur la semaine post-partum15. Pour d’autres espèces, utilisez les valeurs publiées dans la littérature ou déterminez la teneur en humidité fractionnaire de la masse maigre avant d’effectuer des calculs de la masse maigre du corps. - Estimer la masse grasse du corps à l’aide de l’équation suivante :
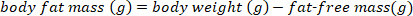
- Convertir la masse grasse du corps en g à pourcentage de masse grasse du corps en utilisant l’équation suivante:

6. Détermination de la composition de l’eau chez un carnivore (Felis catus, chat domestique)
- Préparer la solution de stock telle que décrite à la section 1.
- Pesez chaque chat aux 3 décimales les plus proches et enregistrez le poids. Calculez la dose pour chaque chat telle que décrite à l’étape 3.6 à l’aide d’une dose D2O de 0,70 g/kg.
- Préparer chaque dose telle que décrite dans les étapes 3.7-3.8. à l’aide d’une seringue de 3 ml ou 5 ml avec une aiguille de 22 G au lieu d’une seringue à insuline.
- Recueillir 500 l de sang entier et ensuite administrer sous-cutanée le 0,7 g/kg D2O. Centrifuge à 2 000 x g pendant 15 min et stocker le plasma dans des tubes de 1,5 mL de microcentrifuge à -20 oC jusqu’à l’analyse.
- Recueillir 500 l de sang entier 4 h après l’injection. Centrifuger le sang entier à 2 000 x g pendant 15 min et stocker le plasma dans des tubes de 1,5 mL de vis microcentrifuge à -20 oC jusqu’à analyse.
- Recueillir 500 l de sang entier 14 jours après l’injection. Centrifuger le sang entier à 2 000 x g pendant 15 min et stocker le plasma dans des tubes de 1,5 mL de vis microcentrifuge à -20 oC jusqu’à analyse.
REMARQUE : Le nombre de jours entre la collecte de sang peut être basé sur les besoins expérimentaux et la période post-injection au cours de laquelle D2O peut être détecté au-dessus des niveaux de fond. Quatorze jours était la longueur des blocs de traitement diététique de Hooper et autres9. - Effectuez une analyse FT-IR selon la section 4 et calculez la composition du corps en fonction de la section 5 de ce protocole.
- Calculez la consommation d’eau en mL/jour en utilisant les équations suivantes :
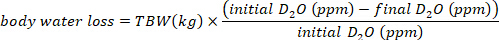
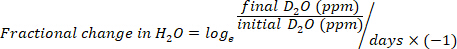
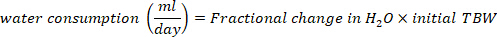
où le TBW est l’eau corporelle totale, le D2O initial et le D2O final sont les concentrations mesurées en ppm dans les échantillons post-injection D2O.
Résultats
La technique de dilution de l’oxyde de deutérium peut être utilisée pour évaluer la composition corporelle d’une variété d’espèces. Pour démontrer l’adaptabilité, nous rapportons la première utilisation de la technique de dilution d’oxyde de deutérium dans une espèce de chauve-souris insectivore nord-américaine, Eptesicus fuscus, la grande chauve-souris brune pour des résultats représentatifs. Un plateau de chronométrage a été complété en pré- et ap...
Discussion
L’utilisation de l’oxyde de deutérium pour déterminer TBW a été utilisé depuis les années 194017 et est utilisé chez l’homme et une variété d’espèces domestiques et sauvages4,6,7. D’autres techniques non destructives ont été développées, y compris l’analyse d’impédance bioélectrique (BIA), DXA, et la résonance magnétique quantitative (QMR). Chaque méthode présente des ava...
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Cette recherche a été appuyée par mDC Cooperative Agreement (#416), US Forest Service Cooperative Agreement (16-JV-11242311-118), American Academy of Veterinary Nutrition et Waltham/Royal Canin, USA Grant (numéro de subvention: 00049049), subvention de formation des NIH (numéro de subvention : T32OS011126), et University of Missouri Veterinary Research Scholars Program. Les auteurs remercient Shannon Ehlers d’avoir préexaminé ce manuscrit. Nous remercions le Dr Robert Backus d’avoir fourni les normes D2O et d’avoir permis l’utilisation de son laboratoire.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
Références
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon