È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzo dell'ossido di deuterio come strumento non invasivo e non letale per valutare la composizione corporea e il consumo di acqua nei mammiferi
In questo articolo
Riepilogo
Questo articolo descrive la tecnica di diluizione dell'ossido di deuterio in due mammiferi, un insettivoro e carnivoro, per determinare l'acqua totale del corpo, la massa magra del corpo, la massa grassa del corpo e il consumo di acqua.
Abstract
I sistemi di punteggio delle condizioni del corpo e gli indici delle condizioni del corpo sono tecniche comuni utilizzate per valutare lo stato di salute o l'idoneità di una specie. I sistemi di punteggio delle condizioni del corpo dipendono dal valutatore e hanno il potenziale per essere altamente soggettivi. Gli indici delle condizioni del corpo possono essere confusi dal foraggiamento, gli effetti del peso corporeo, nonché problemi statistici e inferenziali. Un'alternativa ai sistemi di punteggio condizione del corpo e gli indici delle condizioni del corpo sta usando un isotopo stabile come l'ossido di deuterio per determinare la composizione corporea. Il metodo di diluizione dell'ossido di deuterio è una tecnica quantitativa ripetibile utilizzata per stimare la composizione corporea negli esseri umani, nella fauna selvatica e nelle specie domestiche. Inoltre, la tecnica di diluizione dell'ossido di deuterio può essere utilizzata per determinare il consumo di acqua di un singolo animale. Qui, descriviamo l'adattamento della tecnica di diluizione dell'ossido di deuterio per valutare la composizione corporea in grandi pipistrelli marroni (Eptesicus fuscus) e per valutare il consumo di acqua nei gatti (Felis catis).
Introduzione
I sistemi di punteggio delle condizioni del corpo e gli indici delle condizioni del corpo sono tecniche comuni utilizzate per valutare lo stato di salute o l'idoneità di una specie1,2. Molte specie domestiche e zoologiche hanno sistemi unici di punteggio delle condizioni del corpo (BCS) che vengono utilizzati per valutare il muscolo di un animale e il tessuto adiposo superficiale3. Tuttavia, la valutazione BCS si basa sul valutatore, il che significa che il BCS è una misura oggettiva o semiquantitativa quando valutata da un valutatore addestrato. Nelle specie selvatiche, gli indici delle condizioni del corpo sono comunemente utilizzati piuttosto che BCS e si basano su un rapporto tra massa corporea e dimensione corporea o massa corporea e avambraccio2. Gli indici delle condizioni del corpo sono spesso confusi dagli effetti del foraggiamento e possono essere confusi in base alle dimensioni del corpo e ai problemi statistici e inferenziali4.
Un'alternativa ai sistemi di punteggio delle condizioni del corpo e agli indici delle condizioni del corpo sta usando un isotopo stabile per determinare la composizione corporea. Un isotopo stabile comunemente usato è l'ossido di deuterio (D2O), una forma non radioattiva di acqua in cui gli atomi di idrogeno sono isotopi di deuterio. Il metodo di diluizione dell'ossido di deuterio descritto in questo studio può essere una tecnica non soggettiva, quantitativa e ripetibile utilizzata per stimare la composizione corporea in esseri umani5 e una vasta gamma di specie4,6,7. Questa tecnica può essere vantaggiosa per studiare la composizione corporea nella fauna selvatica. Ad esempio, può essere utilizzato per valutare i cambiamenti longitudinali nella composizione corporea, ad esempio prima e dopo un'azione di gestione. Tuttavia, in alcune specie selvatiche l'ossido di deuterio può sopravvalutare il contenuto effettivo di acqua8. Pertanto, quando si adatta la tecnica per una specie, è importante convalidare il metodo confrontando il metodo dell'ossido di deuterio con l'analisi della carcassa per le specie non a rischio. Per le specie minacciate e in via di estinzione, un metodo non distruttivo come la doppia absorptiometria a raggi-X (DXA) dovrebbe essere considerato come un metodo di confronto alternativo al metodo distruttivo gold-standard dell'analisi completa della carcassa.
Oltre alla composizione corporea, la tecnica di diluizione D2O può essere utilizzata per determinare il consumo di acqua di un singolo animale9. Questa applicazione unica di D2O può essere utilizzata non solo per rispondere a domande di ricerca, ma può essere utile per valutare il consumo di acqua di singoli animali ospitati in grandi contesti sociali.
Qui, descriviamo l'adattamento della tecnica di diluizione D2O per valutare la composizione corporea in un insettivoro, grandi pipistrelli marroni (Eptesicus fuscus), e per valutare il consumo di acqua in un carnivoro, gatti (Felis catis).
Protocollo
Tutti gli esperimenti qui descritti sono stati approvati dal Comitato per la cura e l'uso degli animali dell'Università del Missouri e condotti nell'ambito del permesso di raccolta scientifica della fauna selvatica (Permesso #16409 e #17649 del Missouri Department of Conservation) (Permesso #16409 e #17649).
1. Preparazione della soluzione di stock sterile, isotonica, salinizzata D2O
- Crea una soluzione stock da 50 mL di 9,0 g/L salinated D2O.
- Pesare 450 mg di grado farmaceutico NaCl e trasferire tutti NaCl in un 100 mL, becher sterilizzato. Registrare l'esatta quantità di NaCl a 4 cifre decimali nel taccuino di laboratorio.
- Utilizzando un cilindro sterile graduato, misurare 50 g di ossido di deuterio del 99,8% e trasferire al becher sterile contenente il NaCl. Registrare l'esatta quantità di ossido di deuterio a 4 cifre decimali nel taccuino di laboratorio o nel foglio di calcolo.
- Filtrare 10 mL di resistenza isosmotica NaCl (9,0 g/L) attraverso un filtro a disco sterile non pirogenico con pori submicron (0,2 m).
- Fissare un ago da 20 G al filtro del disco sterile non pirogenico con pori submicron (0,2 m) dotati di un barile di siringa da 10 mL. Inserire nel setto di una fiala vuota sterile da 100 mL.
- Attaccare un tubo a vuoto a un ago da 22 G e inserire l'ago nel setto della fiala vuota sterile 100 mL.
- Versare 10 mL della soluzione di riserva nella canna della siringa. Accendere lentamente il vuoto fino a quando la soluzione di riserva D2O inizia a filtrare lentamente nella fiala sterile. Continuare a versare il supporto D2O nella canna della siringa fino a quando tutti i 50 mL non vengono filtrati.
NOTA: Potrebbe essere necessario diluire o concentrare la soluzione di stock a seconda della dose richiesta. La dose di D2O varia in base alla specie e alla sensibilità del metodo analitico. Per i gatti, la soluzione di lavoro è stata utilizzata per somministrare una dose di 0,7 g/kg D2O. La soluzione di stock descritta sopra riduce al minimo la quantità di soluzione NaCl introdotta sottocutaneamente all'animale, pur consentendo una misurazione accurata della dose. Per i piccoli mammiferi come i pipistrelli, questa concentrazione deve essere diluita in una soluzione funzionante come 0,1600 g/mL. Questa concentrazione permette di misurare e somministrare con precisione la dose di 0,75 g/kg D2O in circa 100 gradi centigradi o meno in una soluzione NaCl pari o inferiore a circa 100.
2. Preparazione della soluzione di lavoro per supporti sterili, isotonici, salinizzati D2O per pipistrelli
- Pesa una fiala sterile vuota da 10 mL e registra il peso alle 4 cifre decimali più vicine. Scala Tare.
- Utilizzare una siringa da 1,0 mL per trasferire 0,65 mL della soluzione di magazzino D2O alla fiala sterile vuota tared, 10 mL. Peso record di D2O a 4 cifre decimali. Scala Tare.
- Calcolare il volume di D2O nella fiala vuota da 10 mL. Utilizzare l'equazione seguente.

dove W è registrato il peso e D è la densità del 99,8% D2O (1,107 g/mL). - Utilizzare il volume calcolato e il peso noto del D2O per determinare il volume di salina isotonica necessaria per fare la soluzione di lavoro di 0,1600 g/mL.
- Inserire nel setto della fiala sterile da 10 mL, l'ago da 22 G (attaccato al tubo a vuoto). Inserire nel setto della fiala sterile da 10 mL, l'ago da 20 G (attaccato ad un filtro di siringa da 0,22 m dotato di una canna da 10 mL).
- Versare la massa/volume calcolato del NaCl isotonico nella canna della siringa e accendere il vuoto per consentire una goccia lenta nella fiala sterile da 10 mL.
- Registrare il peso della fiala e assicurarsi che venga creata una soluzione di lavoro da 0,1600 g/mL.
3. Determinazione della composizione corporea dei pipistrelli marroni grandi (Eptesicus fucsus) con D2O
NOTA: la soluzione di stock di D2O utilizzata nel protocollo è 0.1598 g/mL. Prima di raccogliere il sangue, assicurarsi che la rimozione fino a 200 l'l di sangue sia pari al 10% del volume totale di sangue del pipistrello e che rientri nelle linee guida stabilite dal Comitato istituzionale per la cura degli animali (IACUC). Tutti gli animali devono essere digiunati o palmeggiati dall'addome per garantire uno stomaco vuoto. Un pasto recente potrebbe alterare il peso dell'animale con conseguente risultati confusi poiché i calcoli per determinare il grasso corporeo si basano sulla massa corporea dell'animale.
- Anestesizza un grosso pipistrello marrone.
- Utilizzare 5.0% isoflurane per l'induzione. Mantenere un piano stabile di anestesia utilizzando 0,5%, 3,0% isoflurane.
- Determinare la corretta profondità di anestesia testando il riflesso di prelievo del pedale (pizzicando le dita dei pipistrelli). Il pipistrello non deve rispondere alla sensazione e la frequenza respiratoria deve rimanere lenta e stabile. Regolare l'isoflurane in base alle esigenze per mantenere un piano stabile di anestesia.
- Registrare il livello di isoflurane, la frequenza cardiaca, la frequenza respiratoria e altre informazioni come richiesto da IACUC.
- Pesare il grande pipistrello marrone e registrare il peso a 4 cifre decimali.
- Pulire l'uropatagium (membrana della coda) sulla vena interfemorale con un cuscinetto di preparazione alcolica e lasciare asciugare. Applicare un sottile strato di gelatina di petrolio sulla vena interfemorale.
- Utilizzare un ago da 29 G per forare la parte dorsale della vena interfemorale e raccogliere 100 l di sangue utilizzando tubi capillari di eparina di sodio di plastica. Assicurarsi un'adeguata miscelazione dell'intero sangue con l'eparina di sodio rotolando delicatamente ogni tubo dopo la raccolta ed etichettare il tubo.
- Utilizzando una macchina DXA calibrata per i piccoli mammiferi, ottenere tre scansioni DXA del pipistrello10.
- Determinare la massa (in g) di D2O per iniettare moltiplicando il peso del pipistrello in kg per la dose di D2O di 0,75 g/kg. Determinare il volume della dose calcolata D2O (V) dividendo il peso della dose D2O per la concentrazione della soluzione di lavoro.
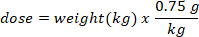
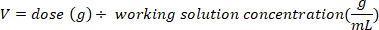
- Utilizzare una siringa di insulina con un ago da 29 G attaccato per redigere il volume di D2O calcolato. Pesare il D2O, siringa di insulina, e ago. Registrare a 4 cifre decimali.
- Iniettare il D2O sottocutaneo sulla regione dell'anca dorsale del pipistrello anestesizzato.
- Permettere al pipistrello di recuperare dall'anestesia e registrare il tempo di iniezione.
- Subito dopo l'iniezione, pesare la siringa di insulina ora vuota con l'ago da 29 G attaccato. Registrare il peso a 4 cifre decimali.
- Determinare la dose di D2O iniettata sottraendo il peso post-iniezione della siringa insulina dalla siringa di insulina riempita pre-iniezione D2O. Registrare a 4 cifre decimali.
- Entro 30 min dopo la raccolta del sangue, utilizzare una centrifuga ematocrita per far girare ogni tubo capillare per 5 min. Se la centrifuga ematocrita consente più velocità, impostare su 10.000 x g.
- Utilizzare una forbice affilata per tagliare il tubo capillare di plastica tra tutto il sangue e il plasma. Utilizzare una pipetta da 200 ll per espellere il plasma direttamente in un tubo di stoccaggio etichettato da 500.
- Dopo il periodo di equilibratore, raccogliere altri 100 l. di sangue dalla vena interfemorale.
NOTA: Il periodo di equilibratura varia a seconda delle specie e se i pipistrelli entrano nel torpore. Per i pipistrelli marroni grandi, in genere 2 h è sufficiente per il periodo di equilibratore. - Separare il plasma in un secondo tubo superiore con vite di microcentrifuga da 500 gradi ripetendo il passaggio 3.13. Conservare i campioni a -20 gradi centigradi o più freddi fino all'analisi.
4. Analisi spettrofotometria a infrarossi a trasformazione di Fourier
- Impostare la temperatura di un bagno di sabbia a 60 gradi centigradi per facilitare la distillazione (consentire la separazione dell'acqua e D2O da altri componenti del sangue).
- Pipetta 50 - L di ogni campione di plasma e standard all'interno di un tappo di tubo di microcentrifuga conicala da 1,5 ml. Compresi gli standard contenenti concentrazioni note di D2O come controllo di qualità.
NOTA: Idealmente ogni animale avrà tre repliche per campione e la media delle tre repliche segnalate. A causa del volume limitato del campione e del volume del campione richiesto per l'apparecchiatura FT-IR utilizzata dagli autori, non sono state eseguite repliche per i campioni di pipistrelli. Se un campione contiene meno di 50 l di plasma, pipetta la quantità di campione sul tappo del tubo del tubo di microcentrifuga conico e registra il volume. - Tenere il tappo della microcentrifuga a testa in giù e avvitare il tubo di microcentrifuga conica da 1,5 mL sul tappo. Posizionare il tubo invertito (a testa in giù) con il tappo a contatto con la sabbia nel bagno di sabbia per un minimo di 12 h (peruna pertita).
- Dopo 12 h, rimuovere il tappo e sostituirlo con un nuovo tappo pulito. Impulso recellare il tubo di microcentrifuga per 10 s in una centrifuga.
- Creare i seguenti standard: 0 ppm (0 mg D2O in 1 L di stilled water), 293 ppm (293 mg D2O in 1 L acqua distillata), 585 ppm (585 mg D2O in 1 L acqua distillata), 878 ppm (878 mg D2O in 1 L di acqua distillata) e 1170 ppm D2O (1170 mg D2O in 1 L di acqua distillata).
NOTA: i valori precedenti vengono suggeriti per una curva standard. È possibile utilizzare valori alternativi come 250 ppm, 500 ppm, 750 ppm e così via. - Installare una cella di trasmissione liquida nello spettrometro a infrarossi (FTIR) a trasformazione di Fourier (Tabella dei materiali). Riempire la cella con metanolo e collegare la porta di iniezione. Riempire lentamente la cella con acqua di fondo rimuovendo con attenzione la siringa di metanolo per ridurre il rischio di bolle d'aria. Collegare i tubi alla porta di uscita per consentire la rimozione dei campioni dopo l'analisi.
- Preparare il software dello spettrometro FTIR (Tabella dei materiali) per l'analisi di D2O in acqua. Le impostazioni dei parametri per il software spettrotrometro utilizzato in questo protocollo sono elencate nella Tabella 1.
- Raccogliere un campione di sfondo utilizzando l'acqua distillata filtrata da 0,22 m. Questa dovrebbe essere la stessa acqua utilizzata per le norme.
- Iniettare 40 L dello 0 ppm D2O e registrare gli spettri. Salvare gli spettri come file con valori delimitati da virgole (CSV).
- Continuare a iniettare e salvare gli spettri di tutti gli standard per creare una curva standard.
- Ripetere lo sfondo e la curva standard ogni 60-90 min.
- Iniettare 40 l di ogni campione distillato nella cella di trasmissione liquida e salvare gli spettri.
NOTA: Modificare il volume di iniezione degli standard e dei campioni distillati in base al volume della cella di trasmissione liquida. Utilizzare una cella di trasmissione liquida di volume più piccolo se il volume del campione è inferiore a 40 o diluire 1:1 con acqua distillata in background. - Determinare la concentrazione di D2O di ogni campione dagli spettri FTIR utilizzando un programma di foglio di calcolo come descritto da Jennings et al.11 o il software spettrale. Quando vengono eseguite repliche, utilizzare la concentrazione media per calcolare la composizione corporea.
5. Calcolo della composizione corporea
- Convertire l'arricchimento del deuterio (ppm) in concentrazione di atomo percentuale per ogni campione utilizzando la seguente equazione12:
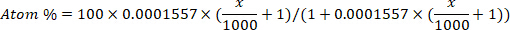
dove x è l'arricchimento del deuterio misurato (ppm) del campione e 0,0001557 è la frazione di talpa del deuterio riportata in Vienna Standard Mean Ocean Water (VSMOW)13. - Calcolare l'acqua totale del corpo per ogni campione utilizzando la seguente equazione4,12,14:
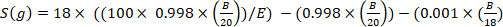 )
)
dove E è l'arricchimento misurato (atomo%) di deuterio nel campione dopo la correzione dello sfondo, B è la massa di iniezione in g e 0,998 è la concentrazione di D2O iniettato.
NOTA: Lo scambio di deuterio con idrogeno labile provoca una sopra5% della massa totale dell'acqua corporea. L'acqua totale del corpo deve essere corretta riducendo la stima totale della massa idrica del corpo del 2% del peso corporeo. - Stimare la massa senza grassi (massa magra del corpo e tutti gli altri componenti non grassi) di ogni pipistrello utilizzando la seguente equazione:

NOTA: Utilizzare il valore convenzionalmente accettato di 0,732 per il contenuto frazionario di umidità della massa magra del corpo per pipistrelli sani, euidratati e non lattaranti. Il contenuto frazionario di umidità di massa priva di grassi può cambiare nell'allattamento di grandi marroni in base alla settimana15post-partum. Per altre specie, utilizzare i valori pubblicati nella letteratura o determinare il contenuto frazionario di umidità della massa magra del corpo prima di eseguire calcoli della massa magra del corpo. - Stimare la massa grassa del corpo utilizzando la seguente equazione:
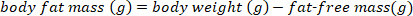
- Convertire la massa grassa del corpo in g a massa grassa del corpo per cento utilizzando la seguente equazione:

6. Determinazione della composizione dell'acqua in un carnivoro (Felis catus, gatto domestico)
- Preparare la soluzione stock come descritto nella sezione 1.
- Pesare ogni gatto ai 3 cifre decimali più vicine e dare un peso record. Calcolare la dose per ogni gatto come descritto al punto 3.6 utilizzando una dose di D2O di 0,70 g/kg.
- Preparare ogni dose come descritto nei passi 3.7.3.8. utilizzando una siringa da 3 mL o 5 mL con un ago da 22 G invece di una siringa di insulina.
- Raccogliere 500 l di sangue intero e successivamente somministrare sottocutaneamente il 0,7 g/kg D2O. Centrifugare tutto il sangue a 2.000 x g per 15 min e conservare il plasma in tubi superiori della vite di microcentrifuga da 1,5 ml a -20 gradi fino all'analisi.
- Raccogliere 500 l di sangue intero 4 ore dopo l'iniezione. Centrifugare il sangue intero a 2.000 x g per 15 min e conservare il plasma in tubi superiori di vite di microcentrifuga da 1,5 ml a -20 gradi centigradi fino all'analisi.
- Raccogliere 500 l di sangue intero 14 giorni dopo l'iniezione. Centrifugare il sangue intero a 2.000 x g per 15 min e conservare il plasma in tubi superiori di vite di microcentrifuga da 1,5 ml a -20 gradi centigradi fino all'analisi.
NOTA: Il numero di giorni tra la raccolta del sangue può essere basato sulle esigenze sperimentali e sul periodo di post-iniezione in cui D2O può essere rilevato al di sopra dei livelli di fondo. Quattordici giorni è stata la lunghezza dei blocchi di trattamento dietetico da Hooper et al.9. - Eseguire l'analisi FT-IR in base alla sezione 4 e calcolare la composizione corporea in base alla sezione 5 di questo protocollo.
- Calcolare il consumo di acqua in mL/giorno utilizzando le seguenti equazioni:
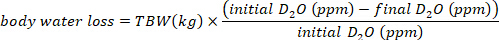
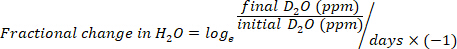
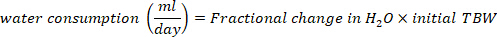
dove TBW è acqua totale del corpo, d2O iniziale e d2O finale sono le concentrazioni misurate in ppm nei campioni D2O post-iniezione.
Risultati
La tecnica di diluizione dell'ossido di deuterio può essere utilizzata per valutare la composizione corporea di una varietà di specie. Per dimostrare l'adattabilità, stiamo segnalando il primo uso della tecnica di diluizione dell'ossido di deuterio in una specie di pipistrello insettivoro nordamericano, Eptesicus fuscus, il grande pipistrello marrone per risultati rappresentativi. Un altopiano di cronometraggio è stato completato premettendo campioni di sangue pre e post-inie...
Discussione
L'uso di ossido di deuterio per determinare TBW è stato utilizzato fin dagli anni'40 17 ed è utilizzato negli esseri umani e in una varietà di specie domestiche e selvatiche4,6,7. Sono state sviluppate altre tecniche non distruttive, tra cui l'analisi dell'impedimento bioelettrico (BIA), il DXA e la risonanza magnetica quantitativa (QMR). Ogni metodo ha vantaggi e svantaggi che dovrebbero essere consid...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta da MDC Cooperative Agreement (#416), US Forest Service Cooperative Agreement (16-JV-11242311-118), American Academy of Veterinary Nutrition and Waltham/Royal Canin, USA Grant (numero di sovvenzione: 00049049), NIH training grant (numero di sovvenzione: T32OS011126), e l'Università del Missouri Veinteran Research Scholars Program. Gli autori ringraziano Shannon Ehlers per aver pre-esaminato questo manoscritto. Ringraziamo il Dr. Robert Backus per aver fornito gli standard D2O e per aver permesso l'uso del suo laboratorio.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
Riferimenti
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon