É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando óxido de utério como ferramenta não invasiva e não letal para avaliar composição corporal e consumo de água em mamíferos
Neste Artigo
Resumo
Este artigo descreve a técnica de diluição de óxido de deutério em dois mamíferos, um insetívoro e carnívoro, para determinar a água total do corpo, a massa corporal magra, a massa de gordura corporal e o consumo de água.
Resumo
Sistemas de pontuação de condições corporais e índices de condição corporal são técnicas comuns utilizadas para avaliar o estado de saúde ou aptidão de uma espécie. Os sistemas de pontuação de condições corporais são dependentes e têm potencial para serem altamente subjetivos. Os índices de condição corporal podem ser confundidos com forrageamento, os efeitos do peso corporal, bem como problemas estatísticos e inferenciais. Uma alternativa aos sistemas de pontuação de condição corporal e índices de condição corporal é usar um isótopo estável, como óxido de deutério para determinar a composição corporal. O método de diluição de óxido de deutério é uma técnica quantitativa repetível usada para estimar a composição corporal em humanos, vida selvagem e espécies domésticas. Além disso, a técnica de diluição de óxido de deutério pode ser usada para determinar o consumo de água de um animal individual. Aqui, descrevemos a adaptação da técnica de diluição de óxido de deutério para avaliação da composição corporal em morcegos marrons grandes (Eptesicus fuscus) e para avaliar o consumo de água em gatos (Felis catis).
Introdução
Sistemas de pontuação de condições corporais e índices de condição corporal são técnicas comuns utilizadas para avaliar o estado de saúde ou aptidão de uma espécie1,2. Muitas espécies domésticas e zoológicas possuem sistemas únicos de pontuação de condição corporal (BCS) que são usados para avaliar o tecido gorduroso muscular e superficial de um animal3. No entanto, a avaliação do BCS depende do avaliador — o que significa que o BCS é uma medida objetiva ou semiquantitativa quando avaliada por um avaliador treinado. Em espécies de animais selvagens, os índices de condição corporal são comumente usados em vez de BCS e são baseados em uma proporção de massa corporal ao tamanho do corpo ou massa corporal ao antebraço2. Os índices de condição corporal são muitas vezes confundidos com os efeitos da forrageamento e podem ser confundidos pelo tamanho do corpo, bem como problemas estatísticos e inferenciais4.
Uma alternativa aos sistemas de pontuação de condições corporais e índices de condição corporal é usar um isótopo estável para determinar a composição corporal. Um isótopo estável comumente usado é o óxido de deutério (D2O), uma forma não radioativa de água na qual os átomos de hidrogênio são isótopos de deutério. O método de diluição de óxido de deutério descrito neste estudo pode ser uma técnica não subjetiva, quantitativa e repetitiva usada para estimar a composição corporal em humanos5 e uma ampla gama de espécies4,6,7. Essa técnica pode ser vantajosa para estudar a composição corporal na vida selvagem. Por exemplo, pode ser usado para avaliar mudanças longitudinalnais na composição corporal, como antes e depois de uma ação de gestão. No entanto, em algumas espécies de animais selvagens o óxido de deutério pode superestimar o teor real de água8. Portanto, ao adaptar a técnica para uma espécie, é importante validar o método comparando o método de óxido de deutério à análise de carcaças para espécies não ameaçadas de extinção. Para espécies ameaçadas e ameaçadas, um método não destrutivo, como a absorção de raios-X duplo (DXA), deve ser considerado como um método alternativo de comparação ao método destrutivo padrão-ouro da análise completa da carcaça.
Além da composição corporal, a técnica d2O de diluição pode ser usada para determinar o consumo de água de um animal individual9. Essa aplicação única de D2O pode ser usada para responder não apenas perguntas de pesquisa, mas pode ser útil para avaliar o consumo de água de animais individuais abrigados em grandes ambientes sociais.
Aqui, descrevemos a adaptação da técnica de diluição D2O para avaliar a composição corporal em um insetoivore, grandesmorcegos marrons ( Eptesicus fuscus), e para avaliar o consumo de água em um carnívoro, gatos (Felis catis).
Protocolo
Todos os experimentos aqui descritos foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade do Missouri e conduzidos a permissão de coleta científica do Departamento de Conservação da Vida Selvagem (MDC) do Missouri (Permit #16409 e #17649).
1. Preparação da solução de estoque estéril, isotônica, salinada D2O
- Faça uma solução de estoque de 50 mL de 9,0 g/L salinado D2O.
- Pesar 450 mg de NaCl de grau farmacêutico e transferir toda a NaCl para um béquer esterilizado de 100 mL. Registre a quantidade exata de NaCl para 4 lugares decimais no caderno de laboratório.
- Utilizando um cilindro graduado estéril, meça 50 g de ≥ 99,8% de óxido de deutério e transfira para o béquer estéril contendo o NaCl. Registre a quantidade exata de óxido de deutério para 4 lugares decimais no caderno ou planilha do laboratório.
- Filtrar 10 mL de força isosmótica NaCl (9,0 g/L) através de um filtro de disco estéril não pirogênico com poros submicron (0,2 μm).
- Conecte uma agulha de 20 G ao filtro de disco estéril não pirogênico com poros submicron (0,2 μm) equipados com um barril de seringa de 10 mL. Insira no septo de um frasco vazio estéril de 100 mL.
- Conecte um tubo de vácuo a uma agulha de 22 G e insira a agulha no septo do frasco vazio estéril de 100 mL.
- Despeje 10 mL da solução de estoque no barril de seringa. Ligue lentamente o vácuo até que a solução de estoque D2O comece a filtrar lentamente o frasco estéril. Continue a derramar a solução de estoque D2O no barril de seringa até que todos os 50 mL sejam filtrados.
NOTA: A solução de estoque pode precisar ser diluída ou concentrada dependendo da dose necessária. A dose de D2O variará com base na espécie e na sensibilidade do método analítico. Para gatos, a solução de trabalho foi usada para administrar uma dose de 0,7 g/kg D2O. A solução de estoque descrita acima minimiza a quantidade de solução NaCl introduzida subcutâneamente ao animal, ao mesmo tempo em que permite medição precisa da dose. Para pequenos mamíferos, como morcegos, essa concentração deve ser diluída a uma solução de trabalho como 0,1600 g/mL. Esta concentração permite que a dose de 0,75 g/kg D2O seja medida com precisão e administrada em aproximadamente 100 μL ou menos solução NaCl.
2. Preparação de solução de trabalho de ações d2O estéril, isotônica e salinada para morcegos
- Pesar um frasco estéril vazio de 10 mL e registrar peso para 4 lugares decimais mais próximos. Escala de tare.
- Use uma seringa de 1,0 mL para transferir 0,65 mL da solução de estoque D2O para o frasco estéril vazio de 10 mL. Peso recorde de D2O a 4 lugares decimais. Escala de tare.
- Calcule o volume de D2O no frasco vazio de 10 mL. Use a seguinte equação.

onde W é registrado peso e D é a densidade de 99,8% D2O (1.107 g/mL). - Use o volume calculado e o peso conhecido do D2O para determinar o volume de sorolo isotônico necessário para fazer ~0,1600 g/mL solução de trabalho.
- Insira no septo do frasco estéril de 10 mL, a agulha de 22 G (anexada ao tubo de vácuo). Insira no septo do frasco estéril de 10 mL, a agulha de 20 G (anexada a um filtro de seringa de 0,22 μm equipado com um barril de seringa de 10 mL).
- Despeje a massa/volume calculado de NaCl isotônico no barril de seringa e ligue o vácuo para permitir um gotejamento lento no frasco estéril de 10 mL.
- Registre o peso do frasco e garanta que seja criada uma solução de trabalho de ~0,1600 g/mL.
3. Determinação da composição corporal de morcegos marrons grandes (Eptesicus fucsus) com D2O
NOTA: A solução de estoque de D2O utilizada no protocolo é de 0,1598 g/mL. Antes de coletar sangue, certifique-se de que a remoção de até 200 μL de sangue será ≤ 10% do volume sanguíneo total do morcego e está dentro das diretrizes estabelecidas pelo Comitê de Cuidados e Uso de Animais Institucionais (IACUC) para a coleta de sangue. Todos os animais devem ser presos ou abdômen empalideceu para garantir um estômago vazio. Uma refeição recente poderia alterar o peso do animal resultando em resultados confusos, uma vez que os cálculos para determinar a gordura corporal dependem da massa corporal do animal.
- Anestesiar um grande morcego marrom.
- Use 5,0% de isoflurano para indução. Mantenha um plano estável de anestesia utilizando 0,5%-3,0% isoflurane.
- Determine a profundidade adequada da anestesia testando o reflexo da retirada do pedal (beliscando os dedos dos dedos do morcego). O morcego não deve responder à sensação e a taxa respiratória deve permanecer lenta e estável. Ajuste isoflurano conforme necessário para manter um plano estável de anestesia.
- Nível de isoflurano recorde, frequência cardíaca, frequência respiratória e outras informações conforme exigido pela IACUC.
- Pesar o grande morcego marrom e registrar o peso para 4 lugares decimais.
- Limpe o uropatagium (membrana traseira) sobre a veia interfmoral com uma almofada de preparação de álcool e deixe secar. Aplique uma fina camada de geleia de petróleo sobre a veia interfmoral.
- Use uma agulha de 29 G para perfurar a porção dorsal da veia interfmoral e coletar 100 μL de sangue usando tubos capilares de heparina de sódio plástico. Certifique-se de misturar o sangue inteiro com a heparina de sódio, rolando suavemente cada tubo após a coleta e rotular o tubo.
- Usando uma máquina DXA calibrada para pequenos mamíferos, obtenha três varreduras DXA do morcego10.
- Determine a massa (em g) de D2O para injetar multiplicando o peso do morcego em kg pela dose D2O de 0,75 g/kg. Determine o volume da dose calculada D2O (V) dividindo o peso da dose D2O pela concentração da solução de trabalho.
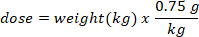
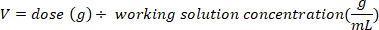
- Use uma seringa de insulina com uma agulha de 29 G presa para elaborar o volume de D2O calculado. Pesar o D2O, seringa de insulina e agulha. Registre para 4 lugares decimais.
- Injete o D2O subcutâneamente sobre a região do quadril dorsal do morcego anestesiado.
- Permita que o morcego se recupere da anestesia e registre o tempo de injeção.
- Imediatamente após a injeção, pesar a seringa de insulina agora vazia com a agulha de 29 G presa. Registre o peso para 4 lugares decimais.
- Determine a dose de D2O injetada subtraindo o peso pós-injeção da seringa de insulina da seringa de insulina D2O de pré-injeção. Registre para 4 lugares decimais.
- Dentro de 30 minutos após a coleta de sangue, use uma centrífuga hematocrita para girar cada tubo capilar por 5 minutos. Se a centrífuga hematocrita permitir múltiplas velocidades, definidas para 10.000 x g.
- Use uma tesoura afiada para cortar o tubo capilar plástico entre todo o sangue e o plasma. Use uma pipeta de 200 μL para expelir o plasma diretamente em um tubo de armazenamento rotulado de 500 μL.
- Após o período de equilíbrio, colete mais 100 μL de sangue da veia interfmoral.
NOTA: O período de equilíbrio variará de acordo com as espécies e se os morcegos entrarem no torpor. Para morcegos marrons grandes, normalmente 2 h é suficiente para o período de equilíbrio. - Separe o plasma em um segundo rotulado, tubo superior do parafuso de microcentrífuga de 500 μL repetindo a etapa 3.13. Guarde amostras a -20 °C ou mais frias até a análise.
4. Análise de espectrofotometria infravermelha de transformação de fourier
- Defina a temperatura de um banho de areia a 60 °C para facilitar a destilação (permitir a separação da água e D2O de outros componentes sanguíneos).
- Pipette 50 μL de cada amostra de plasma e padrão no interior de uma tampa de tubo de microcentrífuga cônica de 1,5 mL. Incluindo padrões contendo concentrações conhecidas de D2O como controle de qualidade.
NOTA: Idealmente cada animal terá três réplicas por amostra e a média das três réplicas relatadas. Devido ao volume amostral limitado e ao volume de amostra necessário para o equipamento FT-IR utilizado pelos autores, não foram realizadas réplicas para as amostras de morcegos. Se alguma amostra contiver menos de 50 μL de plasma, pipeta a quantidade de amostra na tampa do tubo de microcentrífuga cônica e registre o volume. - Mantenha a tampa de microcentrífuga de cabeça para baixo e aparafusar o tubo de microcentrífuga cônica de 1,5 mL na tampa. Coloque o tubo invertido (de cabeça para baixo) com a tampa em contato com a areia no banho de areia por um mínimo de 12 h (durante a noite).
- Após 12 h, retire a tampa e substitua por uma nova tampa limpa. Pulse o tubo de microcentrífuga por 10 s em uma centrífuga.
- Crie os seguintes padrões: 0 ppm (0 mg D2O em 1 L água destilada), 293 ppm (293 mg D2O em 1 L água destilada), 585 ppm (585 mgD2O em 1 L água destilada), 878 ppm (878 mg D2O em 1 L água destilada) e 1170 ppm D2O (1170 mg D2O em 1 L água destilada).
NOTA: Os valores acima são sugeridos para uma curva padrão. Valores alternativos como 250 ppm, 500 ppm, 750 ppm, e assim por diante podem ser utilizados. - Instale uma célula de transmissão líquida no espectrômetro infravermelho de transformação infravermelha (FTIR)(Tabela de Materiais). Encha a célula com metanol e conecte a porta de injeção. Lentamente encha a célula com água de fundo enquanto remove cuidadosamente a seringa de metanol para reduzir o risco de bolhas de ar. Anexar tubos à porta de saída para permitir a remoção das amostras após a análise.
- Prepare o software de espectrômetro FTIR (Tabela de Materiais) para análise de D2O na água. As configurações do parâmetro para o software espectrômetro utilizado neste protocolo estão listadas na Tabela 1.
- Colete uma amostra de fundo usando a água diluente, filtrada de 0,22 μm, destilada. Esta deve ser a mesma água usada para os padrões.
- Injete 40 μL do 0 ppm D2O e grave o espectro. Salve o espectro como um arquivo de valores separados (CSV) de comma.
- Continue injetando e salvar o espectro de todos os padrões para criar uma curva padrão.
- Repita o fundo e a curva padrão a cada 60-90 min.
- Injete 40 μL de cada amostra destilada na célula de transmissão líquida e salve o espectro.
NOTA: Altere o volume de injeção das normas e as amostras destiladas com base no volume da célula de transmissão líquida. Use uma célula de transmissão líquida de volume menor se o volume de amostra estiver abaixo de 40 μL ou diluir 1:1 com água destilada de fundo. - Determine a concentração de D2O de cada amostra do espectro FTIR usando um programa de planilha como descrito por Jennings et al.11 ou o software espectral. Quando as réplicas são realizadas, use a concentração média para calcular a composição corporal.
5. Cálculo da composição corporal
- Converta o enriquecimento de deutério (ppm) em concentração de átomo para cada amostra usando a seguinte equação12:
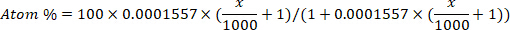
onde x é o enriquecimento de deuterium medido (ppm) da amostra e 0,0001557 é a fração mole do deutério relatada em Viena Standard Mean Ocean Water (VSMOW)13. - Calcule a água total do corpo para cada amostra usando a seguinte equação4,12,14:
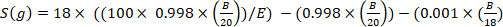 )
)
onde e é o enriquecimento medido (átomo%) de deutério na amostra após correção de fundo, B é a massa de injeção em g, e 0,998 é a concentração de D2O injetado.
NOTA: A troca de deutério com hidrogênio labile causa uma superestimação de 2% da massa total de água corporal. A água total do corpo deve ser corrigida reduzindo a estimativa total de massa de água corporal em 2% do peso corporal. - Estimar a massa sem gordura (massa magra do corpo e todos os outros componentes não gordos) de cada morcego usando a seguinte equação:

NOTA: Use o valor convencionalmente aceito de 0,732 para o teor de umidade fracionada da massa corporal magra para morcegos saudáveis, euhidratados, não lactantes. O teor de umidade fracionada de massa sem gordura pode mudar na lactação de grandes marrons com base na semana pós-parto15. Para outras espécies, use os valores publicados na literatura ou determine o teor de umidade fracionada da massa corporal magra antes de realizar cálculos da massa corporal magra. - Esquete a massa de gordura corporal usando a seguinte equação:
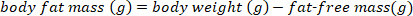
- Converta a massa de gordura corporal em g para por cento de massa de gordura corporal usando a seguinte equação:

6. Determinação da composição da água em um carnívoro (Felis catus, gato doméstico)
- Prepare a solução de estoque como descrito na seção 1.
- Pesar cada gato para os 3 lugares decimais mais próximos e registrar peso. Calcule a dose de cada gato conforme descrito na etapa 3.6 usando uma dose D2O de 0,70 g/kg.
- Prepare cada dose conforme descrito nos passos 3.7-3.8. usando uma seringa de 3 mL ou 5 mL com uma agulha de 22 G em vez de uma seringa de insulina.
- Colete 500 μL de sangue inteiro e, posteriormente, administre subcutâneamente os tubos de parafuso de 0,7 g/kg D2O. Centrífuga saem de 2.000 x g por 15 min e armazene plasma em tubos de parafuso de microcentrífuga de 1,5 mL a -20°C até a análise.
- Colete 500 μL de sangue inteiro 4 h após a injeção. Centrífuga de sangue inteiro a 2.000 x g por 15 min e armazenar plasma em tubos superiores de microcentrífugade de 1,5 mL a -20 °C até a análise.
- Colete 500 μL de sangue inteiro 14 dias após a injeção. Centrífuga de sangue inteiro a 2.000 x g por 15 min e armazenar plasma em tubos superiores de microcentrífugade de 1,5 mL a -20 °C até a análise.
NOTA: O número de dias entre a coleta de sangue pode ser baseado nas necessidades experimentais e no período pós-injeção em que o D2O pode ser detectado acima dos níveis de fundo. Quatorze dias foi a duração dos blocos de tratamento dietético de Hooper et al.9. - Realizar análises ft-ir de acordo com a seção 4 e calcular a composição corporal de acordo com a seção 5 deste protocolo.
- Calcule o consumo de água em mL/dia usando as seguintes equações:
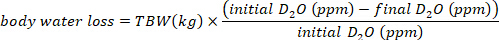
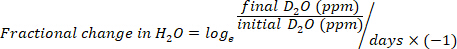
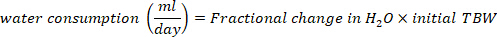
onde a TBW é água corporal total, D2O inicial e D2O final são as concentrações medidas em ppm nas amostras D2O pós-injeção.
Resultados
A técnica de diluição de óxido de deutério pode ser usada para avaliar a composição corporal de uma variedade de espécies. Para demonstrar a adaptabilidade, estamos relatando o primeiro uso da técnica de diluição de óxido de deutério em uma espécie de morcego insetívoro norte-americano, Eptesicus fuscus,o grande morcego marrom para resultados representativos. Um platô de cronometragem foi concluído tomando amostras de sangue de injeção pré e pós-D2...
Discussão
O uso de óxido de deutério para determinar a TBW tem sido usado desde a década de 1940e é usado em humanos e uma variedade de espécies domésticas e da vida selvagem4,6,7. Outras técnicas não destrutivas foram desenvolvidas, incluindo análise de impedância bioelétrica (BIA), DXA e ressonância magnética quantitativa (RQ). Cada método tem vantagens e desvantagens que devem ser consideradas ante...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo MDC Cooperative Agreement (#416), Us Forest Service Cooperative Agreement (16-JV-11242311-118), Academia Americana de Nutrição Veterinária e Waltham/Royal Canin, USA Grant (número de subvenção: 00049049), subsídio de treinamento do NIH (número de subvenção: T32OS011126) e o Programa de Estudiosos de Pesquisa Veterinária da Universidade do Missouri. Os autores agradecem a Shannon Ehlers por pré-revisar este manuscrito. Agradecemos ao Dr. Robert Backus por fornecer os padrões D2O e permitir o uso de seu laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 micron non-pyrogenic disk filter | Argos Technologies | FN32S | nylon, 30mm diameter, 0.22um, sterile |
| 1.5 mL conical microcentrifuge tubes | USA Scientific | 1415-9701 | 1.5 ml self-standing microcentrifuge tube, natural with blue cap |
| 10 mL sterile glass vial for injection | Mountainside Medical Equipment | MS-SEV10 | clear, sterile glass injection unit |
| 10 mL syringe | Becton Dickinson | 305219 | sterile 10 mL syringe individually wrapped |
| 100 mL sterile glass vial for injection | Mountainside Medical Equipment | AL-SV10020 | clear, sterile glass injection unit |
| 20 gauge needle | Exel | 26417 | needles hypodermic 20g x 1" plastic hub (yellow) / regular bevel |
| 22 gauge needle | Exel | 26411 | needles hypodermic 22g x 1" plastic hub (black) / regular bevel |
| deuterium oxide | Sigma-Aldrich | 151882-25G | 99.9 atom % D |
| isofluorane | Vetone | 3060 | fluriso isoflurane, USP |
| OMNIC Spectra Software | ThermoFisher Scientific | 833-036200 | FT-IR standard software |
| petroleum jelly | Vaseline | 305212311006 | Vaseline, 100% pure petroleum jelly, original, skin protectant |
| plastic capillary tubes | Innovative Med Tech | 100050 | sodium heparin anticoagulant, 50 μL capacity, 30 mm length |
| Sealed liquid spectrophotometer SL-3 FTIR CAF2 Cell | International Crystal Laboratory | 0005D-875 | 0.05 mm Pathlength |
| sodium chloride | EMD Millipore | 1.37017 | suitable for biopharmaceutical production |
| Thermo Electron Nicolet 380 FT-IR Spectrometer | ThermoFisher Scientific | 269-169400 | discontinued model, newer models available |
Referências
- Schiffmann, C., Clauss, M., Hoby, S., Hatt, J. M. Visual body condition scoring in zoo animals – composite, algorithm and overview approaches. Journal of Zoo Aquarium Research. 5 (1), (2017).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Bissell, H. . Body Condition Scoring Resource Center. , (2017).
- McWilliams, S. R., Whitman, M. Non-destructive techniques to assess body composition of birds: a review and validation study. Journal of Ornithology. 154 (3), 597-618 (2013).
- Lukaski, H. C., Johnson, P. E. A simple, inexpensive method of determining total body water using a tracer dose of D2O and infrared absorption of biological fluids. American Journal of Clinical Nutrition. 41 (2), 363-370 (1985).
- Chusyd, D. E., et al. Adiposity and Reproductive Cycling Status in Zoo African Elephants. Obesity (Silver Spring). 26 (1), 103-110 (2018).
- Kanchuk, M. L., Backus, R. C., Calvert, C. C., Morris, J. G., Rogers, Q. R. Neutering Induces Changes in Food Intake Body Weight, Plasma Insulin and Leptin Concentrations in Normal and Lipoprotein Lipase–Deficient Male Cats. The Journal of Nutrition. 132 (6), 1730S-1732S (2002).
- Eichhorn, G., Visser, G. H. Technical Comment: Evaluation of the Deuterium Dilution Method to Estimate Body Composition in the Barnacle Goose: Accuracy and Minimum Equilibration Time. Physiological and Biochemical Zoology. 81 (4), 508-518 (2008).
- Hooper, S. E., Backus, R., Amelon, S. Effects of dietary selenium and moisture on the physical activity and thyroid axis of cats. Journal of Animal Physiolgy and Animal Nutrition (Berl). 102 (2), 495-504 (2018).
- Stevenson, K. T., van Tets, I. G. Dual-Energy X-Ray Absorptiometry (DXA) Can Accurately and Nondestructively Measure the Body Composition of Small, Free-Living Rodents. Physiological and Biochemical Zoology. 81 (3), 373-382 (2008).
- Jennings, G., Bluck, L., Wright, A., Elia, M. The use of infrared spectrophotometry for measuring body water spaces. Clinical Chemistry. 45 (7), 1077-1081 (1999).
- Beuth, J. M. . Body Composition, movemement phenology and habitat use of common eider along the southern new england coast. Master of Science in Biological and Environmental Sciences (MSBES) thesis. , (2013).
- Coplen, T. B., Hopple, J., Peiser, H., Rieder, S. Compilation of minimum and maximum isotope ratios of selected elements in naturally occurring terrestrial materials and reagents. U.S. Geological Survey Water-Resources Investigations Report 01-4222. , (2002).
- Karasov, W. H., Pinshow, B. Changes in lean mass and in organs of nutrient assimilation in a long-distance passerine migrant at a springtime stopover site. Physiological Zoology. 71 (4), 435-448 (1998).
- Hood, W. R., Oftedal, O. T., Kunz, T. H. Variation in body composition of female big brown bats (Eptesicus fuscus.) during lactation. Journal of Comparative Physiology B. 176 (8), 807-819 (2006).
- Backus, R. C., Havel, P. J., Gingerich, R. L., Rogers, Q. R. Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. American Journal of Veterinary Research. 61 (7), 796-801 (2000).
- Moore, F. D. Determination of Total Body Water and Solids with Isotopes. Science. 104 (2694), 157-160 (1946).
- Voigt, C., Cruz-Neto, A., Parsons, S., Kunz, T. H. . Ecological and Behavioral Methods in the Study of Bats. , 621-645 (2009).
- International Atomic Energy Agency. . Assessment of Body Composition and Total Energy Expenditure in Humans Using Stable Isotope Techniques. , (2009).
- International Atomic Energy Agency. . Introduction to Body Composition Assessment Using the Deuterium Dilution Technique with Analysis of Saliva Samples by Fourier Transform Infrared Spectrometry. , (2011).
- Shimamoto, H., Komiya, S. The Turnover of Body Water as an Indicator of Health. Journal of Physiological Anthropology and Applied Human Science. 19 (5), 207-212 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados