Method Article
رسم خرائط التنظيم المكاني الناشئ للخلايا الثديية باستخدام الأنماط الدقيقة والتصوير الكمي
In This Article
Summary
تستخدم الطريقة المعروضة هنا النقش الدقيق مع التصوير الكمي للكشف عن التنظيم المكاني داخل الثقافات الثدييات. هذه التقنية من السهل تأسيسها في مختبر بيولوجيا الخلايا القياسية، ويوفر نظام قابل للبسط لدراسة النقش في المختبر.
Abstract
ويتمثل أحد الأهداف الأساسية في علم الأحياء في فهم كيفية ظهور الأنماط أثناء التنمية. وقد أظهرت عدة مجموعات أن النقش يمكن أن يتحقق في المختبر عندما تقتصر الخلايا الجذعية مكانيا على الأنماط الدقيقة، وبالتالي وضع نماذج تجريبية التي توفر فرصا فريدة لتحديد، في المختبر، المبادئ الأساسية للبيولوجية منظمه.
وهنا نوصف تنفيذنا للمنهجية. قمنا بتكييف تقنية نقش الصور لتقليل الحاجة إلى المعدات المتخصصة لتسهيل إنشاء هذه الطريقة في مختبر بيولوجيا الخلايا القياسي. كما قمنا بتطوير إطار مجاني مفتوح المصدر وسهل التركيب لتحليل الصور من أجل قياس الوضع التفضيلي للمجموعات الفرعية من الخلايا داخل مستعمرات الأشكال والأحجام القياسية. هذا الأسلوب يجعل من الممكن الكشف عن وجود أحداث النقش حتى في السكان غير المنظمة على ما يبدو من الخلايا. وتوفر هذه التقنية رؤى كمية ويمكن استخدامها لفصل تأثيرات البيئة (مثل الإشارات المادية أو الإشارات الذاتية)، على عملية نقش معينة.
Introduction
في أنظمة الثدييات، النقش هو خاصية ناشئة للسلوك الجماعي للخلايا وهكذا، يمكن أن تشكلأنماط في المختبر إذا تم توفير العظة المناسبة للخلايا 1،2،3،4، 5 , 6.إحدى الطرق للكشف عن القدرة الذاتية للخلايا على التنظيم الذاتي في المختبر هو إجبار الخلايا على تشكيل مجموعات / مستعمرات من الأشكال والأحجام المحددة7و8و9و10 . تقنية التي تمكن هذا هو micropatterning11. النقش الدقيق يجعل من الممكن تحديد الموقع بدقة حيث يتم إيداع جزيئات المصفوفة خارج الخلية (ECM) على سطح. وهذا بدوره يملي أين يمكن للخلايا الالتزام وبالتالي يتحكم في كيفية تنظيم الخلايا مكانياً.
التنقش الدقيق هو تقنية مع العديد من التطبيقات، على سبيل المثال، micropatterning تمكن توحيد الظروف الأولية قبل التمايز12. الأهم من ذلك، micropatterning يجعل من الممكن بسهولة السيطرة على حجم وشكل وتباعد مستعمرات الخلايا ويمكن استخدام هذه الخاصية لابتكار التجارب التي تهدف إلى التحقيق في الاستجابة الجماعية للخلايا لmorphogen أو إلى العظة المادية7 , 8 , 10 سنوات , 13 , 14 سنة , 15 , 16 سنة , 17.
وقد وضعت عدة طرق micropatterning11. تقنيات النقش الضوئي هي ربما أسهل الطرق لإنشاء18. هذه النهج لديها أيضا ميزة الدقة كما أنها يمكن استخدامها للسيطرة على شكل خلايا واحدة18،19،20. ومع ذلك، فإنها تتطلب أيضا معدات متخصصة باهظة الثمن بما في ذلك المغطي تدور، وغرفة البلازما ومنظف UVO (الأشعة فوق البنفسجية الأوزون) التي عموما ليست متاحة بسهولة في مختبرات البيولوجيا القياسية. ولتسهيل اعتماد هذه التقنية، قمنا بتكييف البروتوكول ليتطلب فقط مصباح UVO. نبدأ من الشرائح البلاستيكية المتاحة تجاريا والتي يمكن قطعها مع مقص أو مع لكمة حفرة إلى الشكل المطلوب.
إحدى المنافع الهامة للأنماط الدقيقة هي القدرة على توحيد المستعمرات من أجل مقارنة المستعمرات الفردية عبر عمليات تكرار متعددة. وهذا يجعل من الممكن أن نسأل إلى أي مدى يتم استنساخ تشكيل نمط داخل هذه المستعمرات، واستكشاف العوامل التي تؤثر على قوة عملية النقش. والأهم من ذلك أن التحديد الكمي للأنماط "المتوسطة" عبر مستعمرات موحدة متعددة يمكن أن يكشف أيضا عن عمليات النقش التي لن تكون واضحة لولا ذلك. ميزة القدرة على قياس النقش على المستعمرات الموحدة يعتمد على القدرة على قياس التعبير البروتين بدقة، من الناحية المثالية على مستوى خلية واحدة. ومع ذلك، غالباً ما تكون الخلايا على الأنماط الدقيقة معبأة بإحكام، مما يجعل من الصعب تقسيمها بدقة عالية. كما غالباً ما تنظم الخلايا نفسها في ثلاثة أبعاد بدلاً من بعدين، ويمكن أن يكون من الصعب الكشف عن المعلومات ثلاثية الأبعاد (ثلاثية الأبعاد) والحفاظ عليها أثناء التجزئة. بمجرد تقسيم الخلايا بنجاح، هناك حاجة إلى أساليب حسابية لاستخراج معلومات النقش من مجموعات البيانات الناتجة.
وقد طورنا أدوات للتجزئة وتحليل الصور للمساعدة في التغلب على هذه المشاكل. يستخدم أسلوب التحليل هذا البرامج الحرة والمفتوحة المصدر فقط ولا يتطلب معرفة سطر الأوامر أو البرمجة لتنفيذها. لتوضيح الطريقة هنا، ونحن نستخدم الماوس الخلايا الجذعية الجنينية (mES) التي تعبر تلقائيا علامة من التمايز المبكر البذيني (Tbra)21،22. وفي حين أنه لا يوجد ترتيب مكاني واضح يمكن اكتشافه بصرياً، فإن هذه الطريقة تسمح بوضع خريطة لتحديد المواقع التفضيلية لخلايا T+ في المستعمرات. كما نبين أن نمط Tbra يتناقض مع عدم وجود توطين تفضيلي للخلايا التي تعبر عن Id1، قراءة مباشرة للبروتين المورفوجيجيني للعظام (BMP) المسار23. كما نناقش القيود الحالية للطريقة وكيف يمكن تكييف هذه التقنية مع الأنظمة التجريبية الأخرى.
Protocol
ملاحظة: يتم توفير نظرة عامة على الأسلوب في الشكل 1.
1. قناع التصميم 2.
- تصميم قناع الصور وفقا للمبادئ التوجيهية الموصوفة في Azioune وآخرون18. راجع جدول المواد للحصول على مرجع إلى الشركة المصنعة للبرامج والقناع المستخدمة في هذه الدراسة.
ملاحظة: يمكن إنشاء هندسة متعددة أو أحجام أو تباعد بين الأشكال على قناع واحد. مصباح الأشعة فوق البنفسجية يمكن أن يصلح قناع ضوئي 15 سم التي قد تحتوي على ما يصل إلى 49 تصاميم مختلفة (على افتراض 2 سم × 2 سم رقائق).
2. إجراء تصنيع النمط الصغير
- إعداد المواد اللازمة.
- إعداد حل من 0.1٪ بولوإكسامر 407 (10 ملغ ل 10 مل) في الفوسفات المخزنة المالحة (PBS) وترك على شاكر في درجة حرارة الغرفة. سوف بولوكسامر 407 يستغرق حوالي 20 دقيقة لتذوب.
- وضع فيلم المختبر (انظر جدولالمواد) في الجزء السفلي من طبق بيتري مربع 10 سم. وسوف يستخدم هذا كغرفة لترسب المصفوفة.
- تنظيف سطح قناع الصور، أولا مع الأسيتون 100٪، ثم مع 100٪ isopropanol وأخيرا مع ddH2O. إذا كان ذلك ممكنا، والهواء الجاف قناع ضوئي أو تجفيف قناع خلاف ذلك مع منشفة ورقية نظيفة.
- إعداد قطعة مربعة، جامدة وغير شفافة من البلاستيك مع نفس حجم بالضبط كما قناع الصور (يشار في وقت لاحق باسم 'حامل').
ملاحظة: سيتم استخدام هذا للحفاظ على الأغطية البلاستيكية في اتصال مع قناع الصور أثناء خطوة الإضاءة. - قم بتشغيل مصباح UVO وتشغيل إضاءة دافئة لمدة 10 دقائق.
- إنشاء رقائق منقوشة ضوئيا.
ملاحظة: من الممكن تكييف الإجراء لإنشاء رقائق من أي حجم المطلوب. للبساطة، ونحن نصف هنا الإجراء لتوليد رقاقة مجهرية جولة 12 ملم.- باستخدام لكمة ثقب 12 ملم، وقطع الشرائح البلاستيكية الكارهة للماء لخلق 12 ملم الأغطية جولة ووضعها في طبق بيتري جديدة نظيفة.
تحذير: استخدام القفازات في كل وقت لتجنب ملامسة الجلد مع سطح البلاستيك لأن هذا قد يضر المعالجة السطحية. - قم بإزالة الفيلم الواقي بعناية من الأغطية مع ملاقط.
ملاحظة: تجنب إتلاف السطح البلاستيكي لأن هذا قد يؤثر على وضع الخلايا على الشريحة أثناء إجراء البذر (القسم 3). - ضع قناع الصور على سطح نظيف ومستقر (على سبيل المثال، مربع قناع ضوئي)، والجانب الكروم التي تواجه ما يصل، وإضافة قطرة 2 ميكرولتر من ddH2O في موقف تصميم رقاقة المطلوب.
- وضع غطاء على قطرة من ddH2O واضغط بلطف.
ملاحظة: تأكد من أن الجانب البلاستيكي الذي يواجه قناع الصور هو الجانب الذي كان محميا من قبل الفيلم الذي تمت إزالته في الخطوة السابقة. - وضع حامل على رأس الشرائح البلاستيكية وإصلاح بعناية هذا شطيرة مع المشابك من أجل الحفاظ على القطع البلاستيكية في اتصال مع قناع الصور.
ملاحظة: ضع المشابك أقرب ما يمكن إلى موقع الشرائح البلاستيكية من أجل التأكد من أن يتم الحفاظ على الشرائح البلاستيكية تماما في اتصال مع سطح قناع الصور. - ضع التجميع في مصباح UVO في حوالي 2 سم من مصدر الضوء ويضيء لمدة 10 دقائق.
ملاحظة: تقدر قوة الضوء بـ 6 م.م.م/سم2 عند 254 نانومتر من الطول الموجي عندما توضع الرقاقة على مسافة 2 سم من المصدر. - عقد شطيرة مع قناع الصور في الجزء السفلي وإزالة بعناية المشابك مع الحفاظ على الضغط بيد واحدة لمنع الشرائح من التحرك في حين تفكيك شطيرة. إزالة حامل، وضمان أن جميع القطع البلاستيكية لا تزال على القناع وليس عالقا إلى حامل.
- إضافة ddH2O على رأس رقائق وفصل بلطف رقائق من قناع الصور.
ملاحظة: إذا كانت رقاقة من البلاستيك عالقة في قناع الصور، فصل رقاقة باستخدام طرف ماصة بلاستيكية لدفع رقاقة في حين عقد ملاقط قليلا فوق رقاقة في حالة انفصال رقاقة فجأة. - وأخيرا، وضع رقائق photopatterned داخل غرفة الترسيب مصفوفة.
ملاحظة: تأكد من أن الجانب المضيء من الشريحة يواجه صعودا.
- باستخدام لكمة ثقب 12 ملم، وقطع الشرائح البلاستيكية الكارهة للماء لخلق 12 ملم الأغطية جولة ووضعها في طبق بيتري جديدة نظيفة.
- إيداع المصفوفة.
ملاحظة: يجب تنفيذ كافة الإجراءات في هذا القسم في غطاء محرك السيارة زراعة الأنسجة.- قم بتصفية حل بولوكسامر 407 من خلال فلتر بولي إيثيرسولفون (PES) بـ 0.22 ميكرو متر.
- إعداد حل طلاء ECM عن طريق خلط 500 ميكروغرام / مل من بولوإكسامر معقمة مصفاة 407 و 1 ملغ / مل من الجيلاتين.
ملاحظة: انظر أيضاً الجدول 1 للحصول على معلومات إضافية بشأن جزيئات ECM المحتملة الأخرى. - أضف 200 ميكرو لتر من محلول الطلاء على كل شريحة مضيئة. الفيلم المختبر يمنع الهبوط من السقوط خارج الشريحة.
- أضف طبق بيتري 3 سم مملوء بـ ddH2O من أجل الحد من التبخر ووضعه مع الرقاقة عند درجة حرارة 4 درجة مئوية بين عشية وضحاها.
3. إجراء البذر
ملاحظة: تم تحسين الخطوات الموضحة أدناه للخلايا الجذعية الجنينية للماوس CGR8 (mESC)24 باستخدام متوسط mESC القياسي (انظر أيضا جدولالمواد). ومع ذلك، فمن الممكن من حيث المبدأ لتكييف الإجراء لأي نوع الخلية. لاحظ أيضا أن ثقافة الخلايا التقليدية للخلايا الجذعية الجنينية الماوس لا يوصف هنا كما يمكن العثور على وثائق واسعة في مكان آخر25.
- يستنشق محلول الطلاء ويحتضن الرقائق مرتين لمدة 5 دقائق على الأقل مع PBS المعقمة.
- في هذه الأثناء، إعداد تعليق الخلية من 5.5 × 105 خلايا / مل في وسط دافئ.
- Pipet 200 درجة مئوية من تعليق الخلية على كل رقاقة (~100،000 خلية / سم 2).
- إغلاق غرفة البذر وترك الخلايا التمسك لمدة 1 ساعة في الحاضنة.
- بعد 1 ساعة، ملء الآبار من لوحة multiwell (4-جيدا أو 24-لوحة جيدا اعتمادا على عدد من رقائق) مع 500 درجة مئوية / جيدا من المتوسطة الدافئة ونقل رقائق في لوحة معملات معقمة.
- هز الصحن بقوة من أجل فصل الخلايا غير الملتصقة. يُستنسخ المتوسّطة ويُستبدل على الفور بوسط دافئ طازج. تحقق تحت المجهر لمعرفة ما إذا كان النقش مرئيا (الشكل2a).
ملاحظة: قد يحتاج وقت التصاق إلى تحسين عند استخدام خطوط الخلايا غير mESC أو بروتينات المصفوفة الأخرى (انظر أيضاً الجدول2). - كرر هذه الخطوة حتى تصبح الأنماط مرئية بوضوح كما هو موضح في الشكل 2a.
ملاحظة: هذه الخطوة هامة وتحديد نجاح الإجراء. قد يؤدي إجراء الغسيل الذي هو شديد جدا فصل الخلايا، وعلى النقيض من عدم كفاية الغسيل قد يؤدي إلى الخلايا المتبقية في بين الأنماط (الشكل2c،d).
4. التثبيت
ملاحظة: بعد 48 ساعة في الثقافة يجب أن تشكل الخلايا مستعمرات كثيفة تتبع بدقة شكل الأنماط (كما هو موضح في الشكل 2b).
- ترك رقائق في لوحة، وإزالة ~ 90٪ من المتوسط، وترك ما يكفي من المتوسطة لمنع رقائق من التجفيف.
ملاحظة: من المهم أن رقاقة يجف أبدا لتجنب تلطيخ القطع الأثرية ومنع انفصال الخلية من السطح. بسبب هيدروفوبيسيتيمن سطح رقاقة بين أنماط لاصقة، قد يكون رقاقة ميل إلى إزالة الرطب. في هذه المرحلة، قد يسبب المثبت مستعمرات مقببة كبيرة لفصل من رقاقة. يجب أن تكون الغسولات لطيفة جداً، يتم تنفيذها بشكل مثالي بواسطة سائل الأنابيب على جانب البئر وليس مباشرة على الشريحة. - إضافة ما لا يقل عن 500 درجة مئوية من البارافورمالهايد (PFA) القائم على حل التثبيت لكل بئر وحضانة لمدة 10 دقائق.
ملاحظة: إذا ظهرت المستعمرات سميكة بشكل خاص (أكثر من 5 طبقات الخلية) ، قد يكون من الضروري ضبط وقت التثبيت إلى 20 دقيقة. - بعد التثبيت، اغسل 3 مرات مع محلول الغسيل (PBS مع 0.01٪ بولوإكسامر 407). يمكن أن يتم تداخل غسل إضافي باستخدام 50 mM NH4Cl المخففة في محلول الغسيل لتبريد النشاط المتبقى للربط عبر PFA.
- احتضان العينات لمدة 30 دقيقة على الأقل في حل حظر.
ملاحظة: في هذه المرحلة، قد يتم تخزين العينات في 4 درجة مئوية لمدة أسبوع تقريبا قبل تلطيخ. إذا كان الأمر كذلك، ختم لوحة مع فيلم المختبر لمنع التبخر.
5. تلطيخ المناعة
- إعداد غرفة تلطيخ عن طريق وضع ورقة من فيلم المختبر في الجزء السفلي من طبق بيتري مربع 10 سم.
- إعداد حلول الأجسام المضادة (راجع الجدول 3 للحصول على قائمة بالأجسام المضادة والتخفيفات المستخدمة في هذه المقالة).
- ضع الرقاقة في غرفة تلطيخ مع الجانب دعم الخلايا التي تواجه صعودا وعلى الفور إضافة 100 درجة مئوية من محلول الأجسام المضادة الأولية على رقاقة.
تحذير: في هذه المرحلة، يجب أن رقائق ليس من السهل إزالة الرطب كما هو الحال في الخطوة 4.1. ومع ذلك، لا يزال ينبغي توخي الحذر لأنه من المهم أن رقائق لا تجف. إذا كان يجب معالجة رقائق متعددة، قم بتطبيق الخطوة 5.3 على كل شريحة بشكل تسلسلي. - الحضانة لمدة 1 ساعة على منصة دوارة في درجة حرارة الغرفة.
ملاحظة: إذا كانت الخلايا قد شكلت هياكل 3D كبيرة، قد تكون هناك حاجة إلى وقت حضانة أطول للسماح تلطيخ موحدة للعينة. يمكن زيادة وقت الحضانة حتى 24 ساعة. ومع ذلك، يجب أن تحتوي غرفة تلطيخ على طبق 3 سم مليئة بالماء ويجب أن تكون مختومة غرفة تلطيخ مع فيلم المختبر لمنع التبخر. - نقل رقائق في لوحة مئتاب جديدة وغسل 3 مرات مع محلول الغسيل.
- إجراء الحضانة مع الأجسام المضادة الثانوية كما هو موضح في الخطوتين 5.3 و 5.4.
- قم بتركيب الرقاقة على شريحة مجهرية باستخدام 20 ميكرولتر من أي وسيلة تركيب قياسية (على سبيل المثال، Mowiol).
6. التصوير
ملاحظة: يمكن إجراء التصوير على مجهر بؤري قياسي. هنا نقدم فقط توصيات لضمان جودة الصورة التي ستكون كافية للتحليل الكمي اللاحق.
تحذير: لتجنب أي تحيز المشغل، يجب اختيار المستعمرات إلى صورة فقط باستخدام إشارة المغلف النووي (لمعرفة ما إذا كانت مستعمرة تتبع بشكل صحيح شكل النمط). تجنب التحقق من إشارة علامات الفائدة إلا عند ضبط إعدادات المجهر.
- تأكد من أن عمق بت الاكتساب هو 12 أو 16 بت.
- حدد الإعدادات المناسبة لزيادة النطاق الديناميكي لكل قناة صورة إلى أقصى حد. على وجه الخصوص، تجنب لقطة الصورة.
- تضمين قناة لتصوير الفلورة الذاتية للنمط الدقيق (انظر الشكل3).
- ضبط حجم الصورة وعامل التكبير للحصول على أحجام voxel تتراوح بين 0.1 و 0.6 ميكرومتر في محاور x و y وتتراوح بين 0.2 و 2 ميكرومتر في محور z.
ملاحظة: على سبيل المثال، في هذه الدراسة، استخدمنا مجهر ًا ضوئيًا مقلوبًا مع هدف 40 x (فتحة رقمية تساوي 1.3)، وحجم صورة 1024 × 1024 بكسل بدون تكبير رقمي وحجم خطوة z بـ 0.5 ميكرومتر. وأدى ذلك إلى حجم فوكسل قدره 0.38 ميكرومتر × 0.38 ميكرومتر × 0.5 ميكرومتر. - لكل مستعمرة، حدد الحد الأدنى والحد الأقصى للموقف على طول محور z لضمان الحصول على المستعمرة بأكملها. وينبغي أن تدرج طائرة واحدة على الأقل مع إشارة منخفضة إلى أي إشارة تحت وفوق المستعمرة.
- تأكد من أن الاتجاهات z-كومة يتم الحصول عليها باستمرار (إما دائما من أعلى إلى أسفل أو دائما من أسفل إلى أعلى)
- اضبط سرعة المسح الضوئي، ودقة الصورة، ومتوسط الإطار، ومكاسب الكاشف لتحديد الأمثل بين جودة الصورة ووقت التصوير. وكمؤشر على ذلك، كان وقت التصوير لمستعمرة واحدة كما هو موضح في الشكل 3 حوالي 2-3 دقيقة.
تحذير: يجب الحصول على جميع الصور، لكي تكون قابلة للمقارنة، على نفس المجهر بنفس الهدف وإعدادات الاستحواذ. - في نهاية عملية الاكتساب، احفظ كافة الصور وحدّد اصطلاح تسمية فريد لتحديد الحالة التجريبية التي تمثلها كل صورة.
ملاحظة: راجع الشكل 4 كمثال، سيتم استخدام هذه الاتفاقية لاحقاً أثناء إجراء التحليل. لاحظ أنه قد يتم حفظ الصور إلى أي تنسيق معتمد من قبل BioFormats 26. إذا كانت المستعمرات أكبر من مجال الرؤية، يمكن استخدام البرنامج المساعد خياطة ImageJ27. لاحظ أيضا أنه في حالة خياطة، قد يكون من الضروري الإضاءة لفة قبالة التصحيح.
7. تحليل الصور
ملاحظة: مواصفات الكمبيوتر الموصى بها لهذا الإجراء: 16 غيغابايت من ذاكرة الوصول العشوائي وحدة المعالجة المركزية متعددة النواة 3.33 غيغاهرتز و 50 غيغابايت على الأقل من مساحة القرص (أو أكثر استناداً إلى عدد الشرائح التي تم تصويرها). وقد تم اختبار البرنامج على لينكس، ويندوز وماك. PickCells هو تطبيق تحليل الصور عبر منصة مع واجهة المستخدم الرسم مخصصة لتحليل التنظيم الجماعي للخلايا في الصور متعددة الأبعاد المعقدة (Blin وآخرون، في التحضير). لاحظ أنه يمكن العثور على مزيد من المعلومات حول PickCells بالإضافة إلى وثائق الوحدات النمطية المحددة المذكورة هنا عبر الإنترنت: https://pickcellslab.frama.io/docs/. لاحظ أيضًا أن الواجهة عرضة للتغيير مع استمرارنا في تحسين البرنامج. إذا كانت الواجهة تختلف عن ما هو موضح في الشكل أو الفيديو، يرجى الرجوع إلى دليل على الانترنت.
- تثبيت وتشغيل PickCells بعد الوثائق المتوفرة عبر الإنترنت.
- استيراد الصور والتحقق من دقة المعلوماتالمقدمة (الشكل4-1).
- توثيق اسم كل قناة.
- النوى القطاعية المستندة إلى إشارة المغلف النووي باستخداموحدة Nessys28 (الشكل4-2)وتوفير بادئة ("نوى" على سبيل المثال) والتي سيتم استخدامها لتسمية الصور المجزأة التي تم إنشاؤها.
ملاحظة: يمكن العثور على وثائق حول الاستخدام وتعديلات المعلمة في https://framagit.org/pickcellslab/nessys. - فحص الشرائح وتحريرها إذا لزم الأمر، باستخدام وحدة محرر التجزئة (الشكل 4-3)
ملاحظة: إذا لأي سبب من الأسباب لم توفر عملية التجزئة نتائج مرضية حذف الصور يدوياً في مجلد قاعدة البيانات وأيضاً حذف العقدة 'نتيجة التجزئة' في طريقة العرض MetaModel. ثم كرر الخطوة 7.4 و 7.5. إذا لم يوفر تجزئة مجموعة فرعية صغيرة فقط من الصور نتائج مرضية، ثم استخدم تطبيق Nessys المستقل (راجع الارتباط في 7.4)، حاول التجزئة على "الصور التالفة" واستبدال الملف المقابل في مجلد قاعدة البيانات). - تقسيم إشارة الفلورة الذاتية نمط باستخدام وحدة التجزئة الأساسية (الشكل 4-4)
- توفير بادئة ("نمط" على سبيل المثال) التي سيتم استخدامها لتسمية الصور المجزأة التي تم إنشاؤها.
- حدد القناة التي تحتوي على إشارة الفلورة الذاتية.
- تطبيق الحد من الضوضاء؛ عموما باستخدام مرشح غاوسي مع حجم نواة من 10 × 10 × 0.5 voxels يعطي نتائج مرضية.
- تعيين العتبة السفلى بحيث تظهر الخلفية باللون الأزرق بينما تظهر المقدمة باللون الأبيض. قم أيضًا بتعيين العتبة العليا إلى قيمتها القصوى لتجنب استبعاد الكثافات العالية من النتيجة النهائية (المناطق الحمراء).
- حدد تخطي للخطوة الأخيرة.
- انقر فوق النهاية وانتظر حتى تتم معالجة جميع الصور.
- أما بالنسبة للنوى، يمكن الآن فحص نتائج التجزئة بصريا وتصحيحها إذالزم الأمر باستخدام وحدة محرر التجزئة (الشكل4-5).
- إنشاء كائنات نواة وحساب ميزات الكائن الأساسي.
- قم بتشغيل وحدة الميزات المضمنة من شريط المهام على يسار الواجهة الرئيسية (الشكل4-6).
- أغلق لوحات فيتر وSurface Extractor من القطع الناقص للاحتفاظ بلوحة الميزات الأساسية مفتوحة فقط.
- اختر نواة كنوع كائن واختر البادئة الواردة في الخطوة 7.4 لـ "الصور المجزأة".
- اضغط على Compute وانتظر حتى تتم معالجة جميع الصور.
ملاحظة: بعد هذه الخطوة، لن يكون من الممكن تحرير تجزئة النوى مرة أخرى.
- إنشاء كائنات النقش وحساب ميزات الكائن الأساسي. كرر الخطوات 7.8.1 إلى 7.8.4، فقط هذه المرة اختر "نوع مخصص" كنوع كائن والبادئة المعطاة في الخطوة 7.6.1 للصورالمجزأة .
ملاحظة: بعد هذه الخطوة، لن يكون من الممكن تحرير تجزئة النقش مرة أخرى. - تخزين اسم الصورة التي تنتمي إليها كل نواة كسمة نواة.
- انقر على البيانات > سمة جديدة وحدد نواة في مربع الحوار المنبثق وانقر فوق موافق.
- حدد تجميع البيانات من كائنات أخرى متصلة بالعقدة وانقر فوق التالي.
- في اللوحة اليسرى، حدد صورة ثم انقر نقراً مزدوجاً فوق علامة الاستجواب تحت علامة إنهاء في لوحة تعريف المسار لتعيين عقدة الصورة كهدف للمسار.
- قم بتوسيع جزء السمات المتوفرة في اللوحة اليمنى وحدد سمة الاسم.
- قم بتوسيع جزء عملية التخفيض وحدد الحصول على واحد، ثم انقر على زر التغيير وانقر فوق التالي.
- اكتب "اسم الصورة"، اضغط على مفتاح علامة التبويب وانقر فوق موافق.
- إنشاء سمة "تنسيق عادي" في الكائنات النووية(الشكل4-7).
- قم بتكييف الخطوات 7.10.1 إلى 7.10.6 لتخزين إحداثيات centroid النمط كسمة نواة. اسم هذه السمة الجديدة "تنسيق النقش".
- ثم انقر على البيانات > سمة جديدة، حدد نواة وانقر فوق موافق.
- حدد تعريف دالة بين المتجهات المكانية أو الاتجاهية للعقدة وانقر فوق التالي.
- لنوع الدالة حدد عملية الصفيف، لV1 حدد ناقلات العنصر ثم Centroid، وبالنسبة لV2 حدد ناقلات العنصر ثم تنسيق نمطه.
- انقر فوق التاليواكتب "تنسيق معلّق" في الحقل الاسم ثم انقر فوق إنهاء.
- تصدير البيانات إلى ملف قيمة مفصول ة بعلامة تبويب.
8- تحليل R
- تحميل وتثبيت Rstudio.
ملاحظة: تتوفر معلومات البرامج وارتباطات التنزيل في https://www.rstudio.com/. - قم بتنزيل البرامج النصية R المطلوبة لهذا التحليل.
ملاحظة: يمكن تحميل البرامج النصية من مستودع GitLab: https://framagit.org/pickcellslab/hexmapr. - افتح (رستوديو)
ملاحظة: إذا تم تشغيل البرامج النصية للمرة الأولى تثبيت حزم R المطلوبة (ggplot2 والمقاييس). - من Rstudio، افتح قالب binnedmap_template. نص R.
- تعيين دليل العمل إلى موقع الملف المصدر.
- اتبع الإرشادات المتوفرة في البرنامج النصي لتكييف البرنامج النصي مع أي مجموعة بيانات معينة من أجل الحصول على الخرائط المكانية كما هو موضح في الشكل 5.
- تشغيل البرنامج النصي لإنشاء خرائط الكثافة.
النتائج
طريقة نقش الصور الموصوفة هنا تجعل من الممكن تنظيم الخلايا المستزرعة بدقة في مستعمرات من الأشكال والأحجام المحددة. وينبغي أن يكون نجاح هذا الإجراء واضحا ً على الفور بعد إجراء بذر الخلايا (الخطوة 3.7) حيث سيتم تجميع الخلايا الملتصقة وفقًا لتصميم قناع الصور كما هو موضح في الشكل 2أ. في 1 ساعة بعد البذر الخلية، قد لا تكون أنماط الفردية confluent تماما (فقط عدد قليل من الخلايا لكل نمط)، ومع ذلك، كما تنتشر الخلايا مع مرور الوقت، وسوف تصبح أنماط مستعمرة تماما مع عدد قليل جدا من الخلايا فقط خارج الأسطح اللاصقة (الشكل2ب). سيكون المظهر دقيقة من الثقافة خلية خطّ متدلّية. على سبيل المثال، mESC شكل المستعمرات على شكل مقبب10. رقاقة حيث النقش ليست واضحة 1-2 ساعة بعد زرع الخلية يشير إلى فشل الإجراء (الشكل2c،د).
المستعمرات الكبيرة وسميكة يمكن أن يكون في بعض الأحيان تحديا لوصمة عار متجانسة. نقترح إصلاح وpermeabilize الخلايا في خطوة واحدة (القسم 4) لأن هذا يمكن أن يحسن تغلغل الأجسام المضادة29. هذا هو السبب في أن الحل المثبت المختار يحتوي على المنظفات. ويبين الشكل 3 إشارة الفلورة التي يتوقع حدوثها بعد تلطيخ المناعة. لاحظ أنه تم العثور على الخلايا الإيجابية Id1 مشرق داخل المناطق الكثيفة (مناطق المجلس الوطني لنواب الشعب الصيني مشرق) من المستعمرات (الشكل3A). تلميحات مثل هذه مفيدة لتقييم نوعية إجراء تلطيخ الأجسام المضادة. لاحظ أيضًا أن الأنماط الدقيقة التي تم إنشاؤها باستخدام التقنية الحالية هي الفلورسنت التلقائي. هذه الإشارة (الشكل3A،B ترك معظم الصور) مفيدة خلال مرحلة التحليل لتسجيل المستعمرات مكانيا مع بعضها البعض وخلق النتائج المبينة في الشكل5. إشارة autofluorescence هو عموما ألمع عندما تكون العينة متحمس مع ليزر 405 نانومتر وينبغي ترك هذه القناة دون تلطيخ لهذا الغرض. ويبين الشكل 3 أيضاً كيفية تقييد الخلايا بدقة على أنماط الأشكال المختلفة.
يتم إجراء تحليل بيانات التصوير في PickCells، وهو برنامج حر ومفتوح المصدر تم تطويره في مختبرنا (Blin et al.، قيد الإعداد). يتضمن هذا البرنامج وحدات تحليل الصور لقراءة وفرز الصور البؤرية (الشكل4-1)،إلى قطعة (الشكل4-2،4-4)والكائنات المجزأة الخوري (الشكل4-3،4-5)،لحساب الكائن ميزات مثل الإحداثيات أومتوسط الكثافة (الشكل4-6)وتصدير البيانات (الشكل4-7،4-8). الأهم من ذلك، قمنا بتطوير طريقة تجزئة نووية قوية تسمى Nessys28 والتي هي مناسبة بشكل خاصلتجمعات كثيفة وغير متجانسة من الخلايا مثل الخلايا المزروعة على الأنماط الدقيقة (الشكل 3). الشكل 4 -2 يظهر إخراج تمثيلي للوحدة النمطية Nessys حيث يتم إعطاء كل خلية فردية بدقة هوية لون فريدة من نوعها. فقط الحد الأدنى من التحرير يجب أن يكون ضروريا، ولكن التحرير هو ممكن إذا قرر المستخدم ذلك (الشكل 4-3). وأخيرا ً يوفر PickCells عددًا من وحدات التصور لتصور البيانات. يتم إعطاء مثال في الشكل4-6: يتم تقديم مستعمرة على شكل حلقة في 3D حيث يتم ترميز النوى بالألوان وفقا لموقفهم على طول محور z. بمجرد التحقق من صحة التحليل في PickCells، يمكن تصدير البيانات لإنشاء الخرائط المكانية في R باستخدام البرامج النصية المتوفرة في (https://framagit.org/pickcellslab/hexmapr) كما هو موضح في الشكل 530.
لقد أظهرنا مؤخرا أن الحبس المكاني من mESC على صغيرة(30،000 ميكرومتر 2) القرص أو القطع الناقص الأنماط الدقيقة توجه نمط من السكان الفرعيين من الخلايا التي تعبر عن علامة mesodermal Tbra10. وهكذا، لتوضيح طريقتنا هنا، ونحن نسأل ما إذا كان النقش من Tbra قد تتأثر بإشارات BMP في مستعمرات أكبر (90،000 ميكرومتر2). ويبين الشكل 5A أنه عندما تزرع mESC على أنماط قرص ية كبيرة، تقتصر خلايا Tbra+ بشكل تفضيلي على محيط النمط (خريطة كثافة Tbra+)، حيث تكون كثافة الخلايا المحلية هي الأدنى (انظر الخريطة الزرقاء على يسار الشكل 5A) ). وأكد هذا النقش من Tbra من قبل خريطة متوسط كثافة Tbra.
توضح هذه البيانات أن الأسلوب يمكن أن تكشف عن معلومات مرئية فرعية. في الواقع، من الشكل 3، والتفتيش البصري لمستعمرة واحدة لا يكفي لتحديد أي شكل من أشكال التنظيم المكاني في التعبير Tbra. ويفسر هذا بشكل خاص من قبل المستعمرة الهامة لتقلب المستعمرة التي يتم قياسها كميا ومبينة في الفريق الأكثر يمينا من الشكل 5A.
وتبين هذه التقنية أيضاً أنه لا يوجد نقش قابل للكشف لـ Id1 (هدف إشارة BMP) مما قد يشير إلى أن النقش T لا يحركه إشارات BMP في هذا السياق.
التبذير يجعل من الممكن إجبار المستعمرات على اعتماد أي هندسة مرغوب ة تقريباً. وهذا مفيد بشكل خاص لاستجواب كيفية استجابة النظام لمختلف الجيومتريات. على سبيل المثال، قد نتسبب في أنه إذا تراكم تدرج مورفوجين في وسط المستعمرة، فإن خلق ثقب في المستعمرة من شأنه أن يعطل هذا التدرج. ومن المثير للاهتمام أننا لا تزال نلاحظ النقش على نمط دقيق حلقة وإن كان بطريقة أقل قوة (الشكل5B).
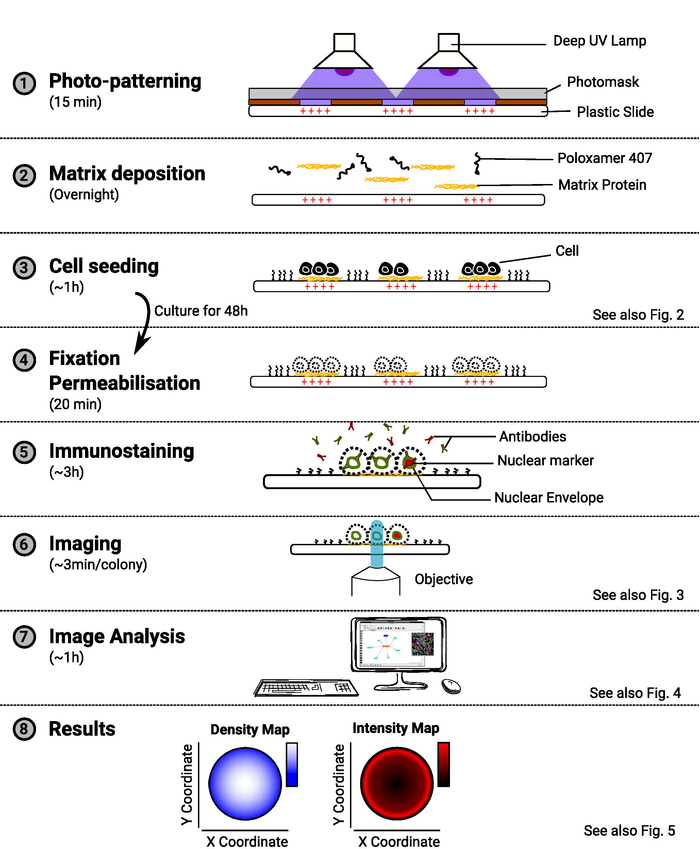
الشكل 1: نظرة عامة على الطريقة. الرسم التخطيطي الذي يعرض الخطوات الرئيسية للأسلوب. لكل خطوة، يتم الإشارة إلى مقدار الوقت المقدر تحت اسم المهمة ومخطط يوضح الغرض من الإجراء. وترد أيضا إشارة إلى رقم ذي صلة عندما تكون متاحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
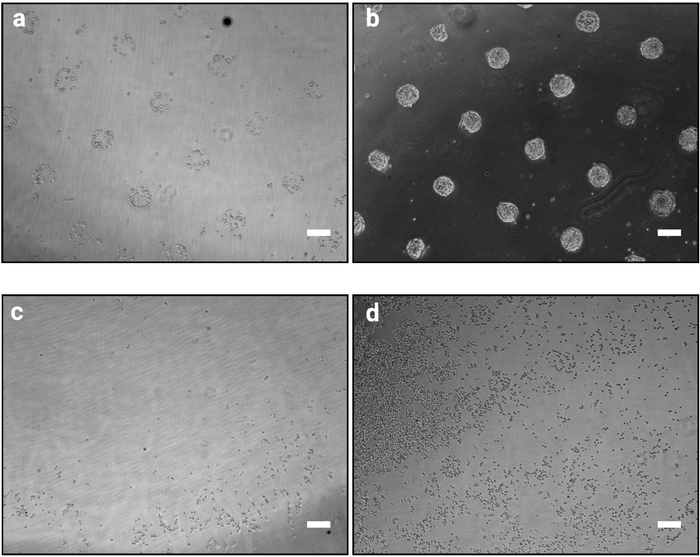
الشكل 2: مظهر الثقافة 1 ح و 48 ساعة بعد بذر الخلايا على الأنماط الدقيقة. صور برايتفيلد من mESC البذور على الأنماط الدقيقة. (أ) تنظيم الخلية المتوقع 1 ساعة بعد البذر، يجب أن تكون أنماط واضحة يمكن تحديدها. (ب) النتيجة المتوقعة بعد 48 ساعة من الثقافات. وقد انتشرت mESC ولا تزال تقتصر بدقة على الأشكال نمط. (ج-د) النتائج غير المثلى المحتملة، إما عدد قليل جدا من الخلايا التمسك البلاستيك إلا في محيط الشريحة (ج) أو الخلايا التمسك بين أنماط (د). راجع الجدول 2 للحصول على دليل استكشاف الأخطاء وإصلاحها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
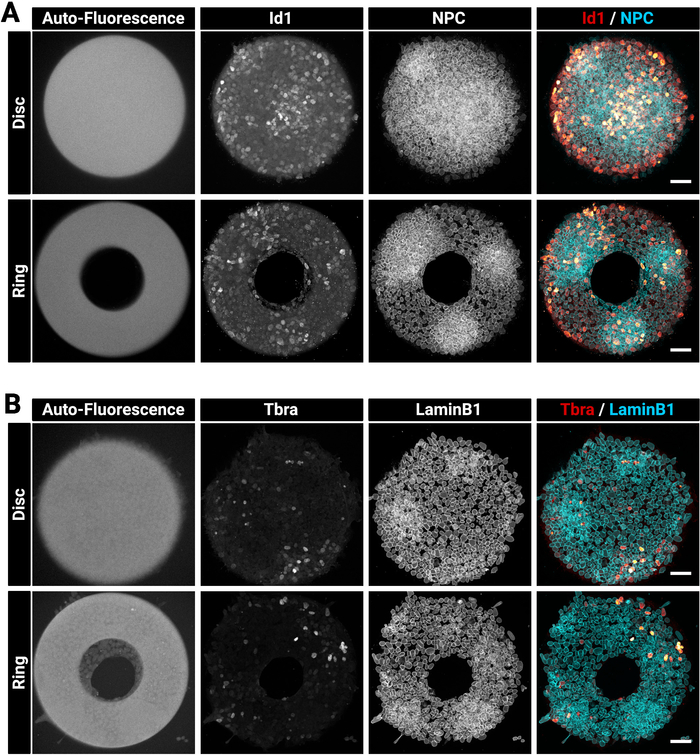
الشكل 3: الصور التمثيلية البؤرية للمستعمرات الملطخة بالمناعة المزروعة على الأنماط الدقيقة.
المستعمرات mESC ممثل بعد الفلورة المناعية ل (A) Id1 ومجمع المسام النووية أو (ب) Tbra و LaminB1. لكل تلطيخ، يتم عرض مستعمرة نمت على نمط قرص صغير ومستعمرة نمت على نمط دقيق حلقة. يتم توفير القنوات الفردية كصور ذات مقياس رمادي. لاحظ إشارة واضحة لصناعة السيارات في الفلورة من النمط الدقيق (405 نانومتر الإثارة الليزر). شريط مقياس يمثل 50 درجة.
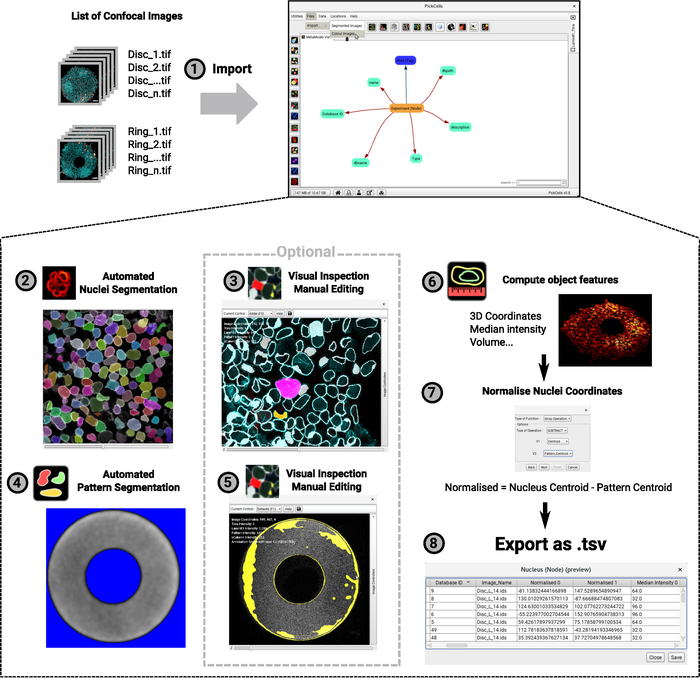
الشكل 4: مخطط تدفقي لإجراء تحليل الصورة. يتم استيراد قائمة من الصور البؤرية ثلاثية الأبعاد إلى PickCells لتحليلها (1). يظهر هذا المثال تجربة مع شكلين متميزين (الأقراص والحلقات كما هو الحال في الشكل2). يتم عرض اصطلاح تسمية الصورة على اليسار وواجهة PickCells على اليمين. ثم، يتم استخدام وحدة نيسيس لتجزئة النوى تلقائيا (2). في لقطة الشاشة، يتم إعطاء كل نواة فردية لون فريد يشير إلى تجزئة دقيقة. كما يتم تقسيم autofluorescence من نمط، وهذه المرة، وذلكباستخدام وحدة "التجزئة الأساسية" (4). تظهر الخلفية في إشارة زرقاء وبيضاء سيتم تعريفها على أنها شكل النمط. ثم يتم فحص الأشكال المجزأة بصرياً لضمان تجزئة دقيقة، ويتم تحريرها إذا لزم الأمر باستخدام وحدة محرر التجزئة(3-5). تعرض لقطات الشاشة المخطط التفصيلي للأشكال التي تم الكشف عنها. تم تحرير الأشكال الوردية والصفراء. وأخيراً، يتم حساب ميزات الكائنات وتصديرها إلى ملف ليتم معالجتها لاحقًا في R(6-7). يتم توفير لقطة من مستعمرة المقدمة كعرض 3D (6). للخطوات من 2 إلى 6 يتم إعطاء الرموز الموجودة في واجهة PickCells في وقت كتابة هذه المقالة بجانب فهرس الخطوة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
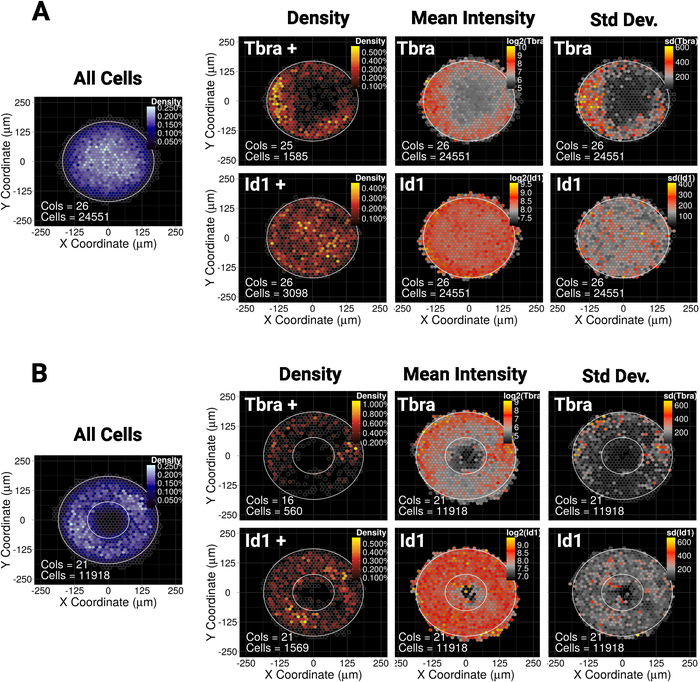
الشكل 5: النتائج التمثيلية لعوامل النسخ المختلفة وأشكال النمط الجزئي
خريطة مكانية معلبة لmESC نمت لمدة 48 ساعة على (أ) على شكل قرص الأنماط الدقيقة أو (ب) أنماط صغيرة على شكل حلقة. لكل شكل من أشكال الميكرونمط، تظهر خريطة كثافة الخلايا، بغض النظر عن النمط الظاهري للخلايا، على اليسار بمقياس لون أزرق. ثم لكل علامة (Tbra في الصف العلوي وId1 في الصف السفلي)، يتم توفير ثلاث خرائط متميزة، من اليسار إلى اليمين: خريطة كثافة الخلية من علامات التعبير عن الخلايا فقط (تحليل عتبة على أساس)، وخريطة لكثافة علامة متوسط (log2) وخريطة الانحراف المعياري لشدة العلامة. وتعطى الكثافات كوحدات الفلورة التعسفية. لكل خريطة، يتم إعطاء شكل النمط الدقيق كمخطط تفصيلي أبيض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نوع ECM | الجيلاتين | فيبرونيكتين | الطابق السفلي غشاء مصفوفة | |
| تركيز | تركيز ECM | 1 ملغ / مل | 20 ميكروغرام/مل | 200 ميكروغرام/مل |
| تركيز بولوكسامر 407 | 500 ميكروغرام/مل | 400 ميكروغرام/مل | 1 ملغ / مل | |
| تم اختباره مع | محمد الي | نعم | نعم | نعم |
| محمد النيفي لـ | لا | نعم | نعم | |
| مصل وسط مجاني | لا | نعم | نعم |
الجدول 1: تركيزات اختبار بولوإكسامر 407 وECM. يقدم هذا الجدول لمحة عامة عن تركيزات ECM وpoloxamer 407 التي اختبرناها في مختبرنا. لكل تركيبة ECM/poloxamer 407، يظهر نوع الخلية التي تم تحقيق النقش بنجاح لها، وكذلك ما إذا كانت الثقافة تحتوي على المصل أم لا. mESC = الخلايا الجذعية الجنينية الماوس، mEpiSC = الماوس الخلايا الجذعية إبيبلاست.
| الاجراء | المراقبه | عدد محتمل | حل |
| التنقش الدقيق | مرفق خلية منخفض | غير مناسبة ECM / poloxamer 307 نسبة التركيز | زيادة نسبة تركيز ECM/poloxamer 307 |
| وقت مرفق الخلية قصير جداً | زيادة وقت الحضانة لإعطاء ما يكفي من الوقت للخلايا للتقيد بشكل صحيح بالأنماط (الخطوة 3.4). لتحسين هذه الخطوة، يمكن أن يساعد فحص الخلايا تحت المجهر في الكشف عن تغيير في مورفولوجيا الخلايا مما يشير إلى أن الخلايا قد بدأت في الالتزام. | ||
| الإذاهي ة شديدة جدا (الخطوة 3.6) | عند استبدال المتوسطة، وتجنب الأنابيب المتوسطة مباشرة على رقائق. بدلا من ذلك، الأنابيب بلطف المتوسطة على جدران البئر بدلا من ذلك | ||
| الخلايا تلتزم بين الأنماط | غير مناسبة ECM / poloxamer 307 نسبة التركيز | تقليل نسبة تركيز ECM/poloxamer 407 | |
| وقت مرفق الخلية طويل جداً | تقليل وقت الحضانة (الخطوة 3.4). | ||
| الإذاهية النفيس (الخطوة 3-6) | هز لوحة بقوة عادة ما تكون كافية لفصل الخلايا في الزائدة. لأنواع الخلايا التي تميل إلى التمسك بقوة إلى رقاقة، pipetting مباشرة على رقاقة قد يحسن النتيجة. كما أن زيادة عدد عمليات غسل الشهي قد تساعد أيضاً، لا سيما لضمان عدم بقاء أي خلية عائمة في الوسط بعد هذه الخطوة. | ||
| الخلايا لا تتبع بدقة شكل نمط | نوع الخلية 'غير متوافق' وهندسة النقش | تخطيط/تصميم العديد من الجيومتريات/الأحجام التي سيتم إضافتها إلى قناع الصور لتكون قادرة على اختبار وتحديد حجم النمط الأمثل لشكل نمط معين ونوع الخلية. من فضلك، راجع قسم "القيود" في المناقشة | |
| غير الأمثل الصورة النقش، وهذا يمكن تشخيصه من خلال مراقبة حدة إشارة الفلورة الذاتية. يجب أن تبدو حدود النمط حادة كما هو الحال في الشكل 2. إذا كانت حدود الأنماط تبدو غير واضحة ثم خطوة نمط الصورة تحتاج إلى تحسين. | حواف نمط ضبابية تشير إلى أن الشريحة البلاستيكية لم تكن قريبة بما فيه الكفاية من سطح القناع أثناء خطوة الإضاءة. تأكد من أن القطع التي تحمل الشرائح إلى قناع الصورة متساوية وأن يتم تطبيق ضغط ثابت وكاف على التجميع أثناء إجراء الإضاءة. | ||
| تلطيخ | تلطيخ غير متجانس | الأجسام المضادة حضانة الوقت قصيرة جدا | زيادة وقت حضانة الأجسام المضادة (تصل إلى 24h في درجة حرارة الغرفة) |
| المستعمرات بالارض خلال عملية تصاعد | جبل الشرائح micropattern في غرفة مثل chamlide أو cytoo-غرف لأداء كل من تلطيخ المناعة والتصوير دون الحاجة إلى تركيب الخلايا. وهذا من شأنه أن يحافظ بشكل أفضل على المستعمرات 3D-هيكل. | ||
| فصل المستعمرات أثناء إجراء تلطيخ | إزالة الرقاقة | ترك ما يكفي من المتوسطة أو استخدام 2 ماصات، واحدة لإزالة المتوسطة والآخر لإضافة حل جديد | |
| المستعمرات تبدو مُتَرَكَّبة تحت المجهر | وقد تم إجراء المستعمرات في حين تصاعد رقاقة على الشريحة المجهرية | كن لطيفًا جدًا عند تركيب الرقائق. بدلا من ذلك، جبل micropatterns الشرائح في غرفة مثل chamlide أو cytoochambers لأداء كل من تلطيخ المناعة والتصوير دون الحاجة إلى تركيب الخلايا. هذا أيضا يحافظ على هيكل المستعمرة. |
الجدول 2: دليل استكشاف الأخطاء وإصلاحها. ويقدم هذا الجدول لمحة عامة عن النتائج غير المثلى الممكنة. كما ترد قائمة بالمصادر المحتملة للمشاكل إلى جانب الحلول الموصى بها.
Discussion
هنا نقوم بوصف طريقة لتحليل النقش الناشئ في ثقافات الخلايا. يتم استخدام نهج النقوش الدقيقة المبسطة لتوحيد شكل وحجم مستعمرات الخلايا، ونقدم أدوات تحليل الصور ونصوص R التي تمكن من الكشف عن الأنماط داخل هذه المستعمرات والتحديد الكمي لها.
خط الأنابيب نقترح مشابهة إلى حد ما مع الطريقة التي نشرت سابقا31 حيث يركز المؤلفون على ظروف الثقافة، وذلك باستخدام الأنماط الدقيقة المتاحة تجاريا، للحصول على تشكيل طبقة جرثومية قابلة للاستنساخ في مستعمرات ESC ل دراسة أحداث الغاز في وقت مبكر في المختبر. هدفنا هو أكثر تركيزا نحو توفير خط أنابيب قابل للتعميم لاكتشاف تشكيل نمط في المختبر حيث التنظيم الجماعي للخلايا قد تصبح واضحة فقط بعد التحليل الإحصائي. لهذا السبب، نحن نقدم سير عمل تحليل الصورة قوية التي تمكن من تحديد وتحليل دقيقة للموقف النووي في الفضاء 3D على مستعمرات متعددة (انظر أيضا "ميزة وقيود طريقة الكشف عن نمط" القسم من هذا المناقشة). كما قررنا وضع نهج بسيط في مجال الميكرونمط الذي يوفر بديلا أكثر مرونة وأرخص للحلول المتاحة تجاريا على المدى الطويل التي نأمل أن تكون مفيدة للمجتمع.
وأخيرا، نلاحظ أنه خلال مراجعة هذه المخطوطة، تم إصدار حزمة جديدة لتحليل النقش في المختبر مماثلة لنصوص R لدينا32. تقبل هذه الحزمة الجديدة جداول ميزات الخلايا كإدخال يمكن الحصول عليها من منصات التصوير عالية الإنتاجية. ونعتقد أن جدول السمات النووية الذي تم إنشاؤه في الخطوة 7 من بروتوكولنا يمكن أن يكون من حيث المبدأ بمثابة مدخل لهذه الحزمة الجديدة على الرغم من أننا لم نختبر هذه الإمكانية بأنفسنا.
قابلية هذه الطريقة للتكيف مع أنواع الخلايا الأخرى وهندسة المستعمرة
نقدم هذا النهج في سياق دراسة ظهور عوامل النسخ في الجلد الأوسط في ثقافات الخلايا متعددة القوى في وجود المصل. ومع ذلك، فإن هذه الطريقة قابلة للتكيف بسهولة مع أنواع الخلايا الأخرى ومع الثقافات الخالية من المصل على الرغم من أنه قد يكون من الضروري تحسين تركيزات ECM/poloxamer 407 (انظر الجدول 1 للاطلاع على التركيزات المختبرة والجدول 2 للاطلاع على دليل استكشاف الأخطاء وإصلاحها). ويمكن أيضا تكييف هذه الطريقة مع أحجام أكبر أو أصغر من الأنماط الدقيقة ومجموعة واسعة من الأشكال وفقا لاحتياجات المستخدم. ومع ذلك، أثناء تأسيس الأسلوب، من المهم أن تكون على علم بأن تركيبات نوع الشكل/الخلية ليست كلها الأمثل. على سبيل المثال، mESC التعبير عن مستويات عالية من E-الكادرين33،34 تمكين هذه الخلايا لتشكيل هياكل جماعية تمتد المناطق التي تخلو من ECM. هذه الخلايا لا تتبع بدقة الجيومتريات مع زوايا حادة أو التي تشمل ثقوب صغيرة في نمط. لاحظ على سبيل المثال أن على حلقة الشكل 3B، الخلايا هي في عملية استعمار المنطقة الوسطى. في أيدينا منطقة مركزية أصغر لم يجبر mESC لتشكيل مستعمرات على شكل حلقة. ولذلك فمن المستحسن للغاية لتشمل مجموعة متنوعة من الجيومتريات أثناء تصميم قناع ضوئي لتكون قادرة على اختبار وتحديد الأحجام المثلى وانحناءات التي سوف تكون مناسبة لنوع الخلية من الاختيار.
وثمة عامل هام آخر ينبغي أخذه في الاعتبار هو طول التجربة ومعدل انتشار الخلايا. بالنسبة لبعض أنواع الخلايا التي تتكاثر بسرعة (بما في ذلك الخلايا متعددة القوى) يمكن أن يكون من الصعب الحفاظ على الخلايا على الأنماط الدقيقة على مدى عدة أيام (لmESC ثلاثة أيام هو الحد الأقصى). أيضا، بذر الخلايا على الأنماط الدقيقة لا يحدث دائما على النحو الأمثل لكل مستعمرة، لذلك فمن المستحسن أن بذر فائض من المستعمرات من أجل الحصول على قطع الغيار.
ميزة وقيود طريقة الكشف عن النمط
وتتمثل إحدى المزايا الخاصة للطريقة في القدرة على الكشف عن الأنماط"المتوسطة" عن طريق الجمع بين نتائج تحليل الصور من مستعمرات متعددة تكرارية (الشكل 5). وهذا يمكن أن يكشف عن أحداث النقش التي لا تظهر من تفتيش المستعمرات الفردية. ومن عيوب هذا النهج "المتوسط" أنه قد يفتقد أنواعاً معينة من الأنماط المتكررة، مثل البقع الصغيرة أو الخطوط الضيقة. ومع ذلك، قد يتم الكشف عن هذه الأنواع من نمط بدلا من ذلك مع مزيج من أحجام نمط مختارة بعناية8. أيضا، خط أنابيب تحليل الصورة الموضحة هنا يوفر بيانات كمية في كل من خلية واحدةومستعمرة القرار يوفر إمكانية للتحقيق في مستوى التباين بين المستعمرة (الشكل 5) أو لإجراء تحليل الجيران في متعددة جداول10.
وثمة ميزة هامة أخرى لطريقة المتوسط هي أنها تتيح الفرصة لرسم خريطة للموقع التفضيلي للعديد من العلامات دون أن تكون محدودة بمركبات الفلوروفور المتاحة لقنوات الكشف. في الواقع، على الرغم من أننا الاستفادة من اثنين فقط من علامات التمايز في العمل المعروض هنا، والقدرة على توحيد المستعمرات واستخراج أنماط "متوسط" يجعل من الممكن مقارنة خرائط التوزيع من مجموعات مختلفة من المستعمرات معا من أجل للكشف عن العلاقات المكانية المعممة للعلامات لبعضها البعض.
وعلاوة على ذلك، وعلى الرغم من تركيزنا هنا على دراسة علامات التمايز، يمكن توسيع طريقة التحليل لدراسة العمليات البيولوجية الأخرى التي تتوفر بشأنها علامات نووية. على سبيل المثال، فإن النقش الدقيق لخط الخلية الذي يحتوي على مؤشر دورة الخلية الفلورية في كل مكان35 (FUCCI) من شأنه أن يجعل من الممكن دراسة كيفية تأثير هندسة مستوى المستعمرة على أحداث دورة الخلايا في المجموعة.
الاتجاهات المستقبلية
هذه الطريقة قابلة لتحليل الصورة الإنتاجية المتوسطة، ومع ذلك، فإن الحصول على الصور غير مؤتمت بالكامل في الوقت الحالي ويمكن أن يصبح مقيداً للتجارب الكبيرة جداً. الترتيبات العادية للمستعمرات ينبغي أن تجعل من الممكن إنشاء إجراءات اقتناء تلقائية بالكامل مماثلة لما تم تطويره لخلية واحدة في المتوسط20. ومع ذلك، لأن حجم الحقل المطلوب لتصوير مستعمرة كبير، وربما يتطلب الفسيفساء، ولأن المستعمرات ثلاثية الأبعاد، فمن المستحسن للغاية تقليل كل من حجم مجموعة البيانات ووقت الاقتناء عن طريق تصوير المستعمرات ذات الصلة فقط. ولذلك، قد تكرس الجهود المستقبلية لتطوير مجهر "ذكي" قادر على تحديد المستعمرات ذات الصلة وتكييف إحداثيات التصوير مع كل عينة. وهذا لن يقلل من الوقت والجهد فحسب، بل سيمنع أيضاً التحيزات المحتملة للمشغلين.
كما يمكن جعل خطوط أنابيب التحليل أكثر كفاءة عن طريق تقليل عدد الخطوات التي يحتاج المستخدم إلى اتخاذها. لدينا خطط لبناء آلية بناء خط أنابيب ودمج R مباشرة في برنامجنا (انظر أيضا القضايا pickcells-api # 3 وpickcells-rjava#1 في تعقب القضية من مستودعات التعليمات البرمجية لدينا [https://framagit.org/groups/pickcellslab/-/issues]). وسيؤدي التشغيل الآلي الكامل لإجراء التحليل إلى تقليل الوقت والجهد والحد من أخطاء المستعملين المحتملين.
وأخيرا، نلاحظ أن أسلوب التحليل لدينا لا يلتقط بعد تماما الطبيعة الدينامية للنقش الخلوي. يمكن استخراج بعض المعلومات الديناميكية المحدودة عن طريق فحص سلسلة زمنية من صور اللقطة8و10و36. ومع ذلك، فإن القدرة على تسجيل تاريخ سكان الخلايا أمر مرغوب فيه للغاية إذا أردنا أن نفهم بشكل أفضل كيف يظهر النقش. أحد القيود هو أن تتبع دقيق للخلايا الفردية في مجموعة خلايا كثيفة 3D لا يزال مهمة صعبة جدا37. لدينا طريقة الكشف عن الخلايا يستخدم المغلف النووي ويؤدي بشكل جيد بشكل خاص على كثافة وتداخل مجموعات الخلايا28. المراسلون المباشرون للغلاف النووي متاحون بسهولة28و38 وإحدى مزايا تقنية النقش الدقيق هي أنه يمكن استخدامه لمنع الخلايا من التحرك خارج مجال الرؤية أثناء التصوير على المدى الطويل. عموما، ونحن على ثقة من أن تتبع الآلي للخلايا يمكن تحقيقها باستخدام مزيج من الأدوات التي أنشئت مؤخرا28،39،40، وأن هذا ينبغي أن تجلب رؤى جديدة في الأساسية مبادئ التنظيم الذاتي.
Disclosures
أصحاب البلاغ ليس لديهم ما يكشفون عنه
Acknowledgements
تم تمويل هذا العمل من قبل زمالة السير هنري ويلكوم بعد الدكتوراه (WT100133 إلى G.B.)، وزمالة ويلكوم ترست العليا (WT103789AIA إلى S.L.)، وشهادة الدكتوراه في مؤسسة ويلكوم الاستئمانية إلى (108906/Z/15/Z إلى D.W.). ونحن ممتنون أيضا للدكتور مانويل تيري على نصيحته بشأن تكييف تقنية النقش الضوئي.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
References
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878(2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939(2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- Micropatterning in cell biology. Pt. A. , Elsevier. Amsterdam. (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), Dayton, Ohio. 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366(2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438(2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514(2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872(2018).
- Weiswald, L. -B., Guinebretière, J. -M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106(2010).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. Available from: http://www.R-project.org/ (2013).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384(2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839(2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141(2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved