Method Article
Картирование возобновительной пространственной организации клеток млекопитающих с использованием микрошаблонов и количественных изображений
В этой статье
Резюме
Представленный здесь метод использует микропаттернирование вместе с количественными изображениями для выявления пространственной организации в культурах млекопитающих. Техника легко установить в стандартной лаборатории биологии клеток и предлагает tractable систему для изучения узора in vitro.
Аннотация
Фундаментальная цель в биологии заключается в том, чтобы понять, как модели возникают во время развития. Несколько групп показали, что шаблонможет достичь в пробирке, когда стволовые клетки пространственно ограничиваются микрошаблонами, тем самым устанавливая экспериментальные модели, которые предлагают уникальные возможности для выявления, in vitro, основополагающих принципов биологического Организации.
Здесь мы описываем нашу собственную реализацию методологии. Мы адаптировали метод фотошаблонизации, чтобы уменьшить потребность в специализированном оборудовании, чтобы облегчить создание метода в стандартной лаборатории клеточной биологии. Мы также разработали свободный, с открытым исходным кодом и простой в установке системы анализа изображений для точного измерения преференциального позиционирования субпопуляций клеток в колониях стандартных форм и размеров. Этот метод позволяет выявить существование узорных событий даже в, казалось бы, дезорганизованных популяциях клеток. Этот метод обеспечивает количественную информацию и может быть использован для разъединения воздействий окружающей среды (например, физических сигналов или эндогенной сигнализации) на данный процесс шаблонирования.
Введение
В системах млекопитающих, узор является возникающим свойством коллективного поведения клеток и так, узоры могут образовываться в пробирке, если соответствующие сигналы предоставляются клеткам1,2,3,4, 5 , 6. Один из способов выявить внутреннюю способность клеток к самоорганизации in vitro заключается в том,чтобы заставить клетки формировать группы/колонии определенных форм и размеров 7,8,9,10 . Техника, которая позволяет это микропаттернирование11. Микропаттернирование позволяет точно определить место, где молекулы внеклеточной матрицы (ECM) откладываются на поверхности. Это, в свою очередь, диктует, где клетки могут придерживаться и, следовательно, контролирует, как клетки пространственно организовать.
Микропаттернирование является методом с многочисленными приложениями, например, микропаттернирование позволяет стандартизировать исходные условия до дифференциации12. Важно отметить, что микропаттернирование позволяет легко контролировать размер, форму и расстояние клеточных колоний, и это свойство может быть использовано для разработки экспериментов, направленных на допрос коллективной реакции клеток на морфоген или на физические сигналы7 , 8 , 10 Лет , 13 Год , 14 Год , 15 лет , 16 Год , 17.
Было разработано11методов микропаттернинга. Photopatterning методы, пожалуй, самые простые методы, чтобы установить18. Эти подходы также имеют преимущество точности, поскольку они могут быть использованы для управления формой одиночных ячеек18,19,20. Тем не менее, они также требуют дорогостоящего специализированного оборудования, включая спин пальто, плазменная камера и UVO (УФ-озон) очиститель, которые, как правило, не легко доступны в стандартных лабораториях биологии. Чтобы облегчить принятие методики, мы адаптировали протокол, чтобы потребовать только лампы UVO. Мы начинаем с коммерчески доступных пластиковых слайдов, которые могут быть вырезаны с ножницами или с отверстием удар в желаемый формат.
Одной из важных утилит микрошаблонов является способность стандартизировать колонии для сравнения отдельных колоний через несколько реплик. Это позволяет задать вопрос о том, в какой степени формирование шаблонов в этих колониях воспроизводится, и исследовать факторы, влияющие на надежность процесса шаблонирования. Важно отметить, что количественная оценка "усредненных" закономерностей в нескольких стандартизированных колониях может также выявить процессы шаблонирования, которые в противном случае не были бы очевидными. Преимущество возможности количественной оценки шаблонов на стандартизированных колониях зависит от возможности точно измерить экспрессию белка, в идеале на уровне одной клетки. Тем не менее, клетки на микрошаблонах часто плотно упакованы, что затрудняет их сегментс с высокой точностью. Клетки также часто организуются в трех, а не двух измерениях, и это может быть сложной задачей для обнаружения и сохранения трехмерной (3D) информации во время сегментации. После успешного сегментирования ячеек необходимы вычислительные методы для извлечения информации о шаблонах из полученных наборов данных.
Мы разработали инструменты сегментации и анализа изображений, чтобы помочь преодолеть эти проблемы. Этот метод анализа использует только свободное программное обеспечение с открытым исходным кодом и не требует знаний командной строки или программирования для реализации. Чтобы проиллюстрировать метод здесь, мы используем мыши эмбриональных стволовых (mES) клетки, которые спонтанно выразить маркер ранней дифференциации brachyury (Tbra)21,22. Хотя никакое очевидное пространственное расположение визуально не обнаруживается, метод позволяет создать карту преференциального позиционирования ТЗ-клеток в колониях. Мы также показываем, что Tbra узор контрастирует с отсутствием преференциальной локализации клеток, выражающих Id1, прямое считывание костной морфогенетического белка (BMP) путь23. Мы также обсуждаем текущие ограничения метода и то, как этот метод может быть адаптирован к другим экспериментальным системам.
протокол
ПРИМЕЧАНИЕ: Обзор метода представлен на рисунке 1.
1. Маска дизайн
- Дизайн фотомаски в соответствии с руководящими принципами, описанными в Azioune и др.18. См таблица материалов для ссылки на программное обеспечение и маски производителя, используемого для этого исследования.
ПРИМЕЧАНИЕ: Несколько геометрий, размеров или интервалмежду между фигурами могут быть созданы на одной маске. УФ-лампа может поместиться в фотомаску 15 см, которая может содержать до 49 различных конструкций (при условии, что 2 см х 2 см чипы).
2. Процедура производства микрошаблона
- Подготовьте необходимые материалы.
- Подготовьте раствор 0,1% полоксамера 407 (10 мг на 10 мл) в фосфатном буферном сольнике (PBS) и оставьте на шейкере при комнатной температуре. Полоксимер 407 займет около 20 минут, чтобы раствориться.
- Укладка лабораторной пленки (см. Таблица материалов) в нижней части 10 см квадратный Петри блюдо. Это будет использоваться в качестве камеры для осаждения матрицы.
- Очистите поверхность фотомаски, сначала 100% ацетоном, затем 100% изопропанол и, наконец, с ddH2O. Если возможно, воздух высушить фотомаску или иным образом высушить маску чистым бумажным полотенцем.
- Подготовьте квадратный, жесткий и непрозрачный кусок пластика точно такого же размера, как фотомаска (позже на называют "держатель").
ПРИМЕЧАНИЕ: Это будет использоваться для поддержания пластиковых крышки в контакте с фотомаской во время освещения шаг. - Включите лампу UVO и запустите согревающую подсветку в течение 10 минут.
- Создавайте фотошаблонированные фишки.
ПРИМЕЧАНИЕ: Можно адаптировать процедуру для создания чипов любого желаемого размера. Для простоты мы описываем здесь процедуру создания 12-мм круглого микрошаблонированного чипа.- Используя 12-мм отверстие удар, вырезать гидрофобных пластиковых слайдов для создания 12 мм круглые крышки и поместить их в чистую новую чашку Петри.
ВНИМАНИЕ: Используйте перчатки в любое время, чтобы избежать контакта кожи с поверхностью пластика, так как это может повредить обработку поверхности. - Аккуратно снимите защитную пленку с обложек с помощью пинцета.
ПРИМЕЧАНИЕ: Избегайте повреждения пластиковой поверхности, так как это может повлиять на размещение клеток на чипе во время процедуры посева (раздел 3). - Поместите фотомаску на чистую и стабильную поверхность (например, фотомаску), хромированную сторону вверх и добавьте каплю ddH2O на позиции желаемого дизайна чипа.
- Положите coverslip на падение ddH2O и нажмите осторожно.
ПРИМЕЧАНИЕ: Убедитесь, что пластиковая сторона, которая стоит перед фотомаской, является стороной, которая была защищена пленкой, которая была удалена на предыдущем этапе. - Поместите держатель поверх пластиковых слайдов и тщательно исправить этот бутерброд с зажимами для того, чтобы сохранить пластиковые куски в контакте с фотомаской.
ПРИМЕЧАНИЕ: Поместите зажимы как можно ближе к расположению пластиковых слайдов, чтобы гарантировать, что пластиковые слайды прекрасно поддерживаются в контакте с поверхностью фотомаски. - Поместите сборку в лампу UVO примерно на 2 см от источника света и осветите в течение 10 мин.
ПРИМЕЧАНИЕ: Мощность света оценивается в 6 мВт/см2 при длине волны 254 нм, когда чип находится на расстоянии 2 см от источника. - Держите бутерброд с фотома-маской внизу и осторожно удалите зажимы, сохраняя при этом давление одной рукой, чтобы не двигаться горками при разборке сэндвича. Удалите держатель, гарантируя, что все пластиковые части по-прежнему на маске и не прилипают к держателю.
- Добавьте ddH2O поверх фишек и аккуратно отсоедините чипсы от фотомаски.
ПРИМЕЧАНИЕ: Если пластиковый чип застрял в фотомаске, отсоедините чип с помощью пластикового наконечника пипетки, чтобы нажать на чип, удерживая пинцет немного выше чипа в случае внезапного отступления чипа. - Наконец, поместите фотошаблонированные фишки в камеру осаждения матрицы.
ПРИМЕЧАНИЕ: Убедитесь, что освещенная сторона чипа обращена вверх.
- Используя 12-мм отверстие удар, вырезать гидрофобных пластиковых слайдов для создания 12 мм круглые крышки и поместить их в чистую новую чашку Петри.
- Наденьте матрицу.
ПРИМЕЧАНИЕ: Все процедуры в этом разделе должны быть выполнены в ткани культуры капюшона.- Фильтр полоксамер 407 раствор через 0,22 мкм политетерсульфона (PES) фильтр.
- Подготовьте решение покрытия ECM путем смешивания 500 мкг/мл стерильного фильтрованного полоксамера 407 и 1 мг/мл желатина.
ПРИМЕЧАНИЕ: См. также Таблица 1 для получения дополнительной информации о других возможных молекул ECM. - Добавьте 200 злителк покрытия на каждый освещенный чип. Лабораторная пленка предотвратит падение за пределы чипа.
- Добавьте 3 см петри блюдо, наполненное ddH2O, чтобы ограничить испарение и поместить его с чипом на 4 градуса Цельсия на ночь.
3. Процедура посева
ПРИМЕЧАНИЕ: Шаги, описанные ниже, были оптимизированы для эмбриональных стволовых клеток мыши CGR8 (mESC)24 с использованием стандартной среды mESC (см. также Таблицаматериалов). Однако в принципе можно адаптировать процедуру к любому типу клеток. Обратите внимание также, что обычные клеточные культуры мыши эмбриональных стволовых клеток не описывается здесь, как обширная документация может быть найдена в другом месте25.
- Примачить покрытие раствора и инкубировать чипы дважды, по крайней мере 5 мин со стерильным PBS.
- В то же время, подготовить клеточной подвески 5,5 х 105 клеток / мл в теплой среде.
- Пипетка 200 л клеточной подвески на каждом чипе (100 000 ячеек/см2).
- Закройте посевную камеру и оставьте клетки придерживаться в течение 1 ч в инкубаторе.
- После 1 ч заполните колодцы многоцветной пластины (4-ну или 24-нубной пластиной в зависимости от количества чипсов) 500 л/колодец теплой среды и перенесите струйки в тарелку стерильным пинцетом.
- Встряхните пластину энергично, чтобы отделить неприсоединения клеток. Аспирируйте среду и сразу же заменить свежей теплой среде. Проверьте под микроскопом, чтобы увидеть, если узор виден(Рисунок 2a).
ПРИМЕЧАНИЕ: Время адгезии может быть оптимизировано при использовании клеточных линий, помимо mESC или других матричных белков (см. также таблицу2). - Повторите этот шаг до тех пор, пока шаблоны не станут четко видны, как показано на рисунке 2a.
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение и определяет успех процедуры. Процедура мытья, которая является слишком интенсивным может отделить клетки, в отличие от недостаточного мытья может привести к клеткам, оставшимся прилагается между шаблонами (Рисунок 2c,d).
4. Фиксация
ПРИМЕЧАНИЕ: После 48 ч в культуре клетки должны образовывать плотные колонии, которые строго следовать форме моделей (как показано на рисунке 2b).
- Оставив фишки в тарелке, удалите 90% среды, оставляя достаточно среднего, чтобы предотвратить сушки чипов.
ПРИМЕЧАНИЕ: Важно, чтобы чип никогда не высыхает, чтобы избежать окрашивания артефактов и предотвратить отслоение клеток от поверхности. Из-за гидрофобности поверхности чипа между клеевыми узорами, чип может иметь тенденцию к де-мокрым. На этом этапе, фиксатор может привести к большим куполообразных колоний отделиться от чипа. Смыв должен быть очень нежным, идеально выполняемым трубацией жидкости на стороне скважины, а не непосредственно на чипе. - Добавьте не менее 500 кЛ параформальдегида (PFA) на основе раствора фиксации на скважину и инкубировать в течение 10 мин.
ПРИМЕЧАНИЕ: Если колонии кажутся особенно толстыми (более 5 слоев клеток), может потребоваться отрегулировать время фиксации до 20 мин. - После фиксации 3 раза промойте стиральным раствором (PBS с 0,01% полоксамер омывается 407). Дополнительная стирка с использованием 50 мМ NH4Cl, разбавленная в стиральном растворе, может быть интеркалирована для утоления остаточной деятельности PFA.
- Инкубировать образцы в течение не менее 30 минут в блокирующем растворе.
ПРИМЕЧАНИЕ: На этом этапе образцы могут храниться при 4 градусах Цельсия в течение недели до окрашивания. Если это так, запечатать пластину с лабораторной пленкой, чтобы предотвратить испарение.
5. Иммуностогирование
- Приготовьте окрашивание камеры, поместив лист лабораторной пленки на дно 10 см квадратного блюда Петри.
- Подготовьте решения антител (см. таблицу 3 для списка антител и разбавлений, используемых в этой статье).
- Поместите чип в окрашивание камеры со стороны поддержки клеток, обращенных вверх и сразу же добавить 100 злицита первичного раствора антитела на чип.
ВНИМАНИЕ: На данном этапе, чипы не должны легко де-мокрый, как в шаге 4.1. Тем не менее, следует позаботиться, потому что важно, чтобы чипсы не высохли. Если необходимо обработать несколько микросхем, примените шаг 5.3 к каждому чипу последовательно. - Инкубировать 1 ч на вращающейся платформе при комнатной температуре.
ПРИМЕЧАНИЕ: Если клетки сформировали большие 3D структуры, может потребоваться более длительное время инкубации, чтобы обеспечить равномерное окрашивание образца. Время инкубации может быть увеличено до 24 ч. Тем не менее, камера окрашивания должна содержать 3 см блюдо заполнено водой и окрашивающей камеры должны быть запечатаны с лабораторной пленкой, чтобы предотвратить испарение. - Перенесите чипсы в свежую многоцветную тарелку и промойте 3 раза стиральным раствором.
- Выполните инкубацию со вторичными антителами, как описано в шаге 5.3 и 5.4.
- Установите чип на слайд микроскопии, используя 20 зл любой стандартной среды крепления (например, Mowiol).
6. Визуализация
ПРИМЕЧАНИЕ: Изображение может быть выполнено на стандартном конфокальном микроскопе. Здесь мы предоставляем только рекомендации по обеспечению качества изображения, которое будет достаточным для последующего количественного анализа.
ВНИМАНИЕ: Чтобы избежать любой предвзятости оператора, колонии для изображения должны быть выбраны только с помощью сигнала ядерного конверта (чтобы увидеть, если колония правильно следует форме шаблона). Избегайте проверки сигнала маркеров интереса, за исключением при настройке настроек микроскопа.
- Убедитесь, что глубина бита приобретения составляет 12 или 16 битов.
- Определите соответствующие настройки, чтобы максимизировать динамический диапазон для каждого канала изображения. В частности, избегайте отсечения изображений.
- Включите канал для изображения автофлюоресценции микрошаблона (см. рисунок3).
- Отрегулируйте размер изображения и коэффициент масштабирования для получения размеров вокселя в диапазоне от 0,1 до 0,6 мкм в x- и y-axs и в диапазоне от 0,2 до 2 мкм в оси z.
ПРИМЕЧАНИЕ: Например, в этом исследовании мы использовали перевернутый сканирование конфокального микроскопа с 40-кратным объективом (числовая диафрагма равна 1,3), размеризображения 1024 x 1024 пикселей без цифрового зума и размером z-шаг 0,5 мкм. Это привело к размеру вокселя 0,38 мкм х 0,38 мкм х 0,5 мкм. - Для каждой колонии определите минимальное и максимальное положение вдоль оси z, чтобы обеспечить получение всей колонии. По крайней мере один самолет с низким и без сигнала должны быть включены ниже и выше колонии.
- Убедитесь, что ориентации z-stack приобретаются последовательно (либо всегда сверху вниз, либо всегда снизу вверх)
- Отрегулируйте скорость сканирования, разрешение изображения, усреднение кадров и выгоды от детектора, чтобы определить оптимальное между качеством изображения и временем изображения. В качестве указания, время изображения для одной колонии, как показано на рисунке 3, составляло приблизительно 2-3 мин. Выполните приобретение изображения.
ВНИМАНИЕ: Все изображения, чтобы быть сопоставимыми, должны быть приобретены на том же микроскопе с той же целью и настройками приобретения. - В конце приобретения сохраните все изображения и назначьте уникальную конвенцию именования для определения экспериментального состояния, которое представляет каждое изображение.
ПРИМЕЧАНИЕ: См. Рисунок 4 в качестве примера, эта конвенция будет использоваться позже во время процедуры анализа. Обратите внимание, что изображения могут быть сохранены в любом формате, который поддерживается BioFormats 26. Если колонии больше, чем поле зрения, сшивание плагин ImageJ может быть использован27. Отметим также, что в случае сшивания может потребоваться коррекция освещения.
7. Анализ изображений
ПРИМЕЧАНИЕ: Рекомендуемые компьютерные спецификации для этой процедуры: 16 ГБ оперативной памяти, многоядерный процессор 3,33 ГГц, и по крайней мере 50 ГБ дискового пространства (или больше в зависимости от количества чипов, которые были изображены). Программное обеспечение было протестировано на Linux, Windows и MacOS. PickCells представляет собой кросс-платформенное приложение анализа изображений с графическим пользовательским интерфейсом, предназначенным для анализа коллективной организации ячеек в сложных многомерных изображениях (Blin et al, в процессе подготовки). Обратите внимание, что более подробную информацию о PickCells, а также документацию по конкретным модулям, упомянутым здесь, можно найти в Интернете: https://pickcellslab.frama.io/docs/. Обратите внимание также, что интерфейс может быть изменен, как мы продолжаем совершенствовать программное обеспечение. Если интерфейс отличается от того, что показано на рисунке или видео, пожалуйста, обратитесь к онлайн-руководству.
- Установите и запустите PickCells в соответствии с документацией, доступной в Интернете.
- Импорт изображения и проверить точность предоставленной информации(Рисунок 4-1).
- Документируйте название каждого канала.
- Сегментные ядра на основе сигнала ядерного конверта с помощью модуля Nessys28 (рисунок 4-2)и обеспечивают префикс ("ядра", например), который будет использоваться для обошись для обоснания сгенерированных изображений.
ПРИМЕЧАНИЕ: Документация об использовании и корректировках параметров можно найти в https://framagit.org/pickcellslab/nessys. - При необходимости проинспектируйте и отредугируйте сегментации, используя модуль редактора сегментации(рисунок 4-3)
ПРИМЕЧАНИЕ: Если по какой-либо причине процесс сегментации не дает удовлетворительных результатов, вручную удалите изображения в папке базы данных, а также удалите узел «результат сегментации» в представлении MetaModel. Затем повторите шаг 7.4 и 7.5. Если сегментация только небольшого подмноза изображений не дала удовлетворительных результатов, то используйте отдельное приложение Nessys (см. ссылку в 7.4), попытайтесь сегментации на «ошибочных изображениях» и замените соответствующий файл в папке базы данных). - Сегментный сигнал автофлюоресценции шаблона с помощью базового модуля сегментации(рисунок 4-4)
- Предоставьте префикс (например, шаблон), который будет использоваться для названия сгенерированных сегментированных изображений.
- Выберите канал, содержащий сигнал автофлюоресценции.
- Применить шумоподавления; как правило, с помощью гауссианского фильтра с размером ядра 10 х 10 х 0,5 вокселей дает удовлетворительные результаты.
- Установите нижний порог так, чтобы фон отосеваться синим цветом, в то время как передний план отображается белым. Установите также верхний порог до максимального значения, чтобы избежать исключения высокой интенсивности из конечного результата (красные области).
- Выберите пропуск для последнего шага.
- Нажмите закончить и ждать, пока все изображения обрабатываются.
- Что касается ядер, результаты сегментации теперь могут быть визуально проверены и исправлены при необходимости с помощью модуля редактора сегментации(рисунок 4-5).
- Создавайте объекты ядер и вычисляйте основные объекты.
- Запуск внутренней функции модуль из панели задач слева от основного интерфейса (Рисунок4-6).
- Закройте панели Ellipsoid Fitter и Surface Extractor, чтобы держать открытыми только панель Основных Функций.
- Выберите Nucleus в качестве типа объекта и выберите префикс, приведенный в шаге 7.4 для "сегментированных изображений".
- Нажмите вычислить и ждать, пока все изображения были обработаны.
ПРИМЕЧАНИЕ: После этого шага не будет возможности снова отсеить сегментации ядер.
- Создавайте объекты шаблонов и вычисляйте основные объекты. Повторите шаги от 7.8.1 до 7.8.4, только на этот раз выберите пользовательский тип в качестве типа объекта и префикс, приведенный в шаге 7.6.1 для сегментированныхизображений.
ПРИМЕЧАНИЕ: После этого шага не будет возможности повторно гостеобразовать сегментации шаблонов. - Храните название изображения, к которому каждое ядро принадлежит как атрибутя ядра.
- Нажмите на данные и новый атрибут и выбрать nucleus в всплывающем диалоге и нажмите Ok.
- Выберите Сбор данных с других объектов, подключенных к узелу, и нажмите далее.
- В левой панели выберите изображение, а затем дважды нажмите на знак допроса под флагом Финиша в панели определения Пути, чтобы установить узла изображения в качестве мишени пути.
- Расширьте панель доступных атрибутов на левой панели и выберите атрибут имени.
- Расширить панель операции сокращения и выберите GetOne, затем нажмите на кнопку изменения и нажмите далее.
- Введите "Имя изображения", нажмите клавишу вкладки и нажмите OK.
- Создайте атрибут "нормализуемых координат" в объектах ядер(рисунок 4-7).
- Адаптировать шаги 7.10.1 до 7.10.6 для хранения координат шаблона центроида в качестве атрибута ядра. Назовите этот новый атрибут "Координация шаблонов".
- Затем нажмите на данные ( новый атрибут, выберите Nucleus и нажмите Ok.
- Выберите Определить функцию между пространственными или направленными векторами узла и нажмите Далее.
- Для типа функции выберите ArrayOperation, для V1 выберите Вектор элемента, а затем Centroid,а для V2 выберите Вектору элемента, а затем координаторшаблона e.
- Нажмите далее,Введите "Нормализация координации" в поле имени и нажмите Закончить.
- Экспорт данных в разделянее файла значения вкладки.
8. R анализ
- Скачать и установить Rstudio.
ПРИМЕЧАНИЕ: Информация о программном обеспечении и ссылки на загрузку доступны по https://www.rstudio.com/. - Скачать R-скрипты, необходимые для этого анализа.
ПРИМЕЧАНИЕ: Скрипты можно загрузить из репозитория GitLab: https://framagit.org/pickcellslab/hexmapr. - Открыть Rstudio.
ПРИМЕЧАНИЕ: Если вы работаете скрипты в первый раз, установите необходимые пакеты R (ggplot2 и весы). - От Rstudio откройте binnedmap-template. R-скриптов.
- Установите рабочий каталог в месторасположение исходного файла.
- Следуйте инструкциям, указанным в скрипте, чтобы адаптировать сценарий к любому заданному набору данных для получения пространственных карт, как показано на рисунке 5.
- Запустите скрипт для генерации карт плотности.
Результаты
Описанный здесь метод фотоузоринга позволяет точно организовывать культивированные клетки в колонии определенных форм и размеров. Успех этой процедуры должен быть ясно очевидным сразу после процедуры посева клеток (шаг 3.7), как припасы клетки будут кластера в соответствии с дизайном фотомаски, как показано на рисунке 2a. На 1 ч после посева клеток, отдельные модели не могут быть полностью сливочным (только несколько клеток на шаблон), однако, как клетки размножаться с течением времени, модели станут полностью колонизированы только очень мало клеток за пределами клеевых поверхностей (Рисунок 2b). Точновозникновени культуры будет зависеть клеточной линии. Например, mESC образуют купольные колонии10. Чип, где узор не ясно, 1 до 2 ч после посева клеток указывает на провал процедуры(Рисунок 2c, d).
Большие и толстые колонии иногда может быть сложной задачей, чтобы пятно однородно. Мы предлагаем исправить и permeabilize клетки в один шаг (раздел 4), так как это может улучшить проникновение антител29. Именно по этой причине выбранное фиксаторное решение содержит моющее средство. На рисунке 3 показан флуоресценционный сигнал, который ожидается после иммунодефицита. Обратите внимание, что яркие идентификаторы Id1 положительные клетки находятся в плотных регионах (яркие регионы NPC) колоний(рисунок 3A). Подсказки, такие как это полезно для оценки качества процедуры окрашивания антител. Обратите внимание также, что микрошаблоны, созданные с помощью настоящей техники, являются автофлуоресцентными. Этот сигнал(Рисунок 3A, B оставил большинство изображений) полезен на этапе анализа, чтобы пространственно регистрировать колонии друг с другом и создавать результаты, показанные на рисунке 5. Сигнал автофлюоресценции, как правило, самый яркий, когда образец возбужденных с 405 нм лазера и этот канал должен быть оставлен без окрашивания для этой цели. На рисунке 3 также показано, как клетки точно ограничены на шаблонах различных форм.
Анализ данных изображений проводится в PickCells, свободном программном обеспечении с открытым исходным кодом, разработанном в нашей лаборатории (Blin et al., в процессе подготовки). Это программное обеспечение включает в себя модули анализа изображений для чтения и сортировки конфокальных изображений(рисунок 4-1), сегмент (рисунок4-2,4-4) и курировать сегментированные объекты (рисунок4-3,4-5), чтобы вычислить объект такие функции, как координаты или средняя интенсивность(рисунок 4-6) и экспортировать данные (рисунок4-7,4-8). Важно отметить, что мы разработали надежный метод ядерной сегментации под названием Nessys28, который особенно подходит для плотных и неоднородных популяций клеток, таких как клетки, выращенные на микропатонах (рисунок3). Рисунок 4 -2 показывает репрезентативную выход модуля Nessys, где каждой отдельной ячейке точно дается уникальная цветовая идентичность. Только минимальное редактирование должно быть необходимо, однако редактирование возможно, если пользователь решит так(Рисунок 4-3). Наконец, PickCells предоставляет ряд модулей визуализации для визуализации данных. Пример приводится на рисунке 4-6: кольцеобразная колония отображается в 3D, где ядра закодированы в соответствии с их положением вдоль оси z. После проверки анализа в PickCells данные могут быть экспортированы для создания пространственных карт в R с использованием скриптов, доступных на (https://framagit.org/pickcellslab/hexmapr), как показано на рисунке 530.
Недавно мы показали, что пространственное заточение mESC на небольшой (30000 мкм2) диск или эллипс микрошаблоны направляет узор субпопуляции клеток, выражающих мезодермальный маркер Tbra10. Таким образом, чтобы проиллюстрировать наш метод здесь, мы спрашиваем, если узор Tbra может быть под влиянием BMP сигнализации в больших колониях (90000 мкм2). Рисунок 5A показывает, что, когда mESC выращиваются на больших микрошаблонах диска, клетки Тбраи преимущественно ограничены периферией шаблона (карта плотности Tbra), где плотность локальной ячейки является самой низкой (см. синюю карту слева от рисунка 5A ). Этот узор Tbra подтверждается картой средней интенсивности Tbra.
Эти данные свидетельствуют о том, что метод может выявить подвизуальную информацию. Действительно, с рисунка 3, визуальный осмотр одной колонии не является достаточным для выявления какой-либо форме пространственной организации в выражении Tbra. Это, в частности, объясняется важной колонией для изменчивости колоний, которая количественно и показана в самой правильной панели рисунка 5A.
Метод также показывает, что для Id1 (цель сигнализации БМП) не существует обнаруживаемого шаблона, который может свидетельствовать о том, что шаблон T не определяется bMP сигнализацией в этом контексте.
Микропаттернирование позволяет заставить колонии принять практически любую желаемую геометрию. Это особенно полезно для изучения того, как система реагирует на различные геометрии. Например, мы можем рассуждать о том, что если градиент морфогена накапляется в центре колонии, создание дыры в колонии нарушит этот градиент. Интересно, что мы по-прежнему наблюдать узор на кольцо микрошаблон, хотя и в менее надежным образом(рисунок 5B).
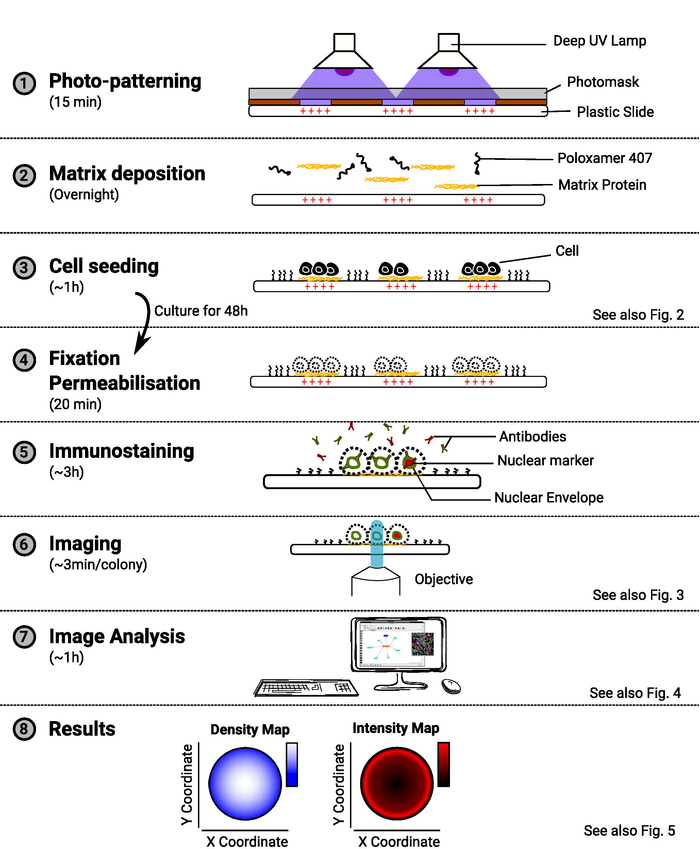
Рисунок 1: Обзор метода. Диаграмма, показывающая основные этапы метода. Для каждого шага предполагаемое количество времени указывается под названием задачи, а схема иллюстрирует цель процедуры. Ссылка на соответствующую цифру также предоставляется по мере их поступления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
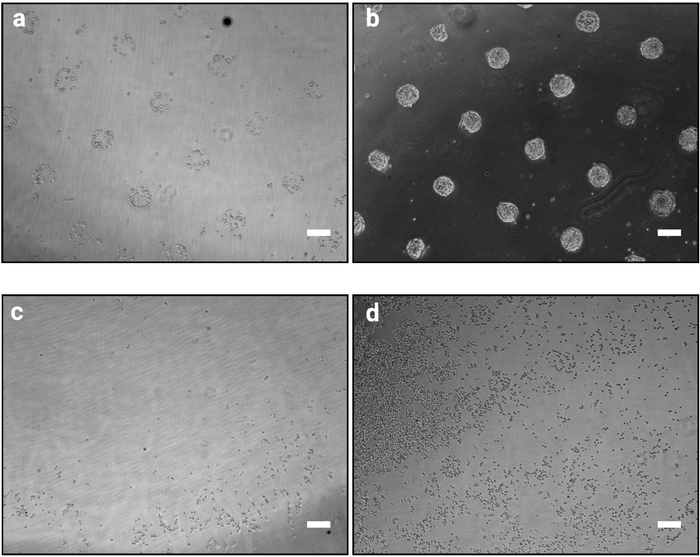
Рисунок 2: Культура появление 1 ч и 48 ч после посева клеток на микрошаблоны. Яркие изображения mESC, посеянные на микрошаблонах. ()Ожидаемая организация ячейки 1 ч после посева, модели должны быть четко идентифицируемы. (b) Ожидаемый результат после 48 ч культур. mESC распространились и до сих пор строго ограничены формами шаблонов. (c-d) Возможные неоптимальные исходы, либо очень немногие клетки придерживаются пластика, за исключением на периферии слайда (с) или клетки придерживаются между шаблонами (d). См таблица 2 для руководства по устранению неполадок. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
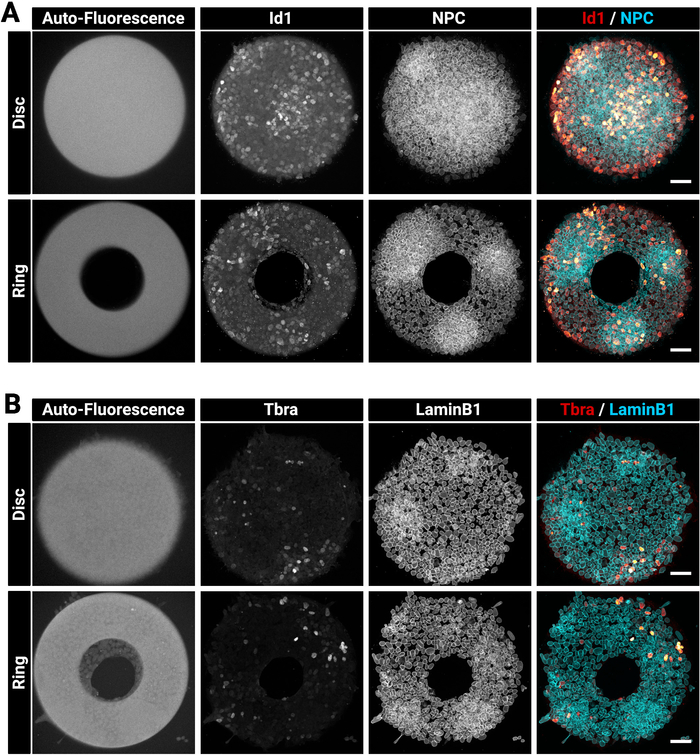
Рисунок 3: Представитель конфокальных изображений иммуноокрашенных колоний, выращенных на микрошаблонах.
Представитель mESC колоний после иммунофлуоресценции для (A) Id1 и ядерного порового комплекса или (B) Tbra и LaminB1. Для каждого окрашивания показана колония, выращенная на диске микропаттерн, и колония, выращенная на микропатее кольца. Отдельные каналы предоставляются в виде изображений серого масштаба. Обратите внимание на четкий сигнал автофлуоресценции микропаттерна (405 нм лазерного возбуждения). Панель шкалы составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
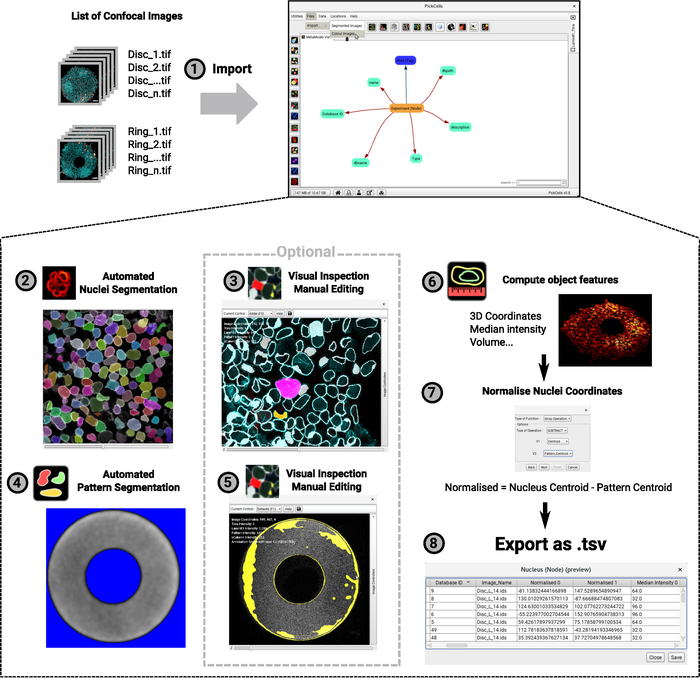
Рисунок 4: Диаграмма потока процедуры анализа изображений. Список 3D конфокальных изображений импортируется в PickCells для анализа (1). Этот пример показывает эксперимент с двумя различными формами (диски и кольца, как на рисунке 2). Конвенция именования изображений отображается слева, а интерфейс PickCells справа. Затем модуль Nessys используется для автоматического сегмента ядер (2). На скриншоте каждому отдельному ядру дается уникальный цвет, указывающий на точную сегментацию. Автофлюоресценция шаблона также сегментирована, на этот раз, используя модуль «основной сегментации» (4). Фон отображается в синем и белом сигнале будет определяться как форма шаблона. Сегментированные фигуры затем визуально проверяются для обеспечения точной сегментации и при необходимости редактируются с помощью модуля редактора сегментации(3-5). На скриншотах показан контур обнаруженных форм. Розовые и желтые формы были отредактированы. Наконец, объекты объекты вычисляются и экспортируются для файла для последующей обработки в R(6-7). Скриншот колонии, отображаемой как 3D-представление (6). Для шагов от 2 до 6 значки, найденные в интерфейсе PickCells на момент написания этой статьи, приведены рядом с индексом шага. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
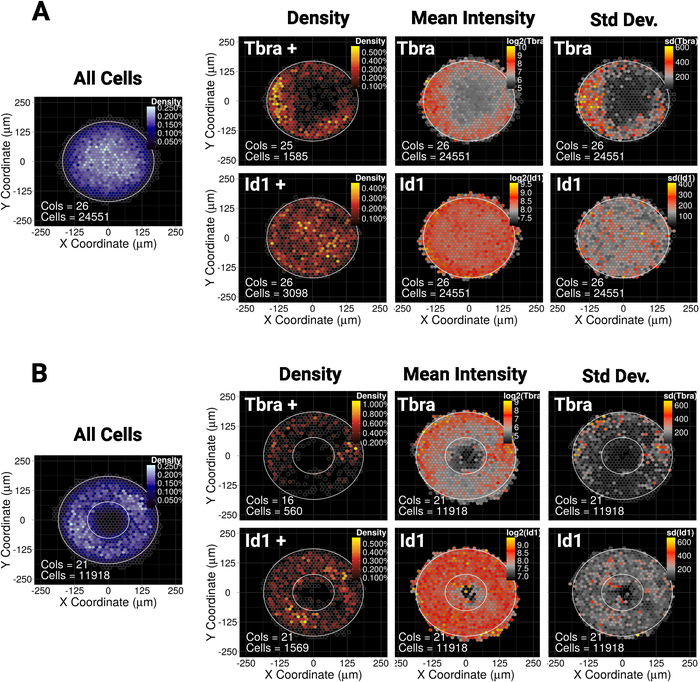
Рисунок 5: Представитель результаты для двух различных факторов транскрипции и микрошаблон формы
Binned пространственная карта для mESC выросли за 48 ч на (A) диск формы микропатонов или (B) кольцо формы микропатонов. Для каждой формы микрошаблона карта плотности клеток, независимо от клеточного фенотипа, показана слева с синей цветовой шкалой. Затем для каждого маркера (Tbra на верхнем ряду и Id1 в нижнем ряду) предусмотрены три различные карты слева направо: карта плотности ячейки только маркерных ячеек (анализ на основе порога), карта средней интенсивности маркера (log2) и карта стандартное отклонение интенсивности маркера. Интенсивность дается как произвольные флуоресценции единиц. Для каждой карты форма микрошаблона дается в виде белого контура. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Тип ECM | Желатин | Фибронектин | Подвал Мембраны Матрица | |
| Концентрации | Концентрация ECM | 1 мг/мл | 20 мкг/мл | 200 мкг/мл |
| Концентрация полоксамера 407 | 500 мкг/мл | 400 мкг/мл | 1 мг/мл | |
| Проверено с | mESC | Да | Да | Да |
| mEpiSC | Нет | Да | Да | |
| Сыворотка бесплатно среды | Нет | Да | Да |
Таблица 1: Проверенные концентрации полоксамера 407 и ECM. В этой таблице представлен обзор концентраций ECM и poloxamer 407, которые мы тестировали в нашей лаборатории. Для каждой комбинации ECM/poloxamer 407 показан тип клеток, для которого был успешно достигнут узор, а также то, содержала ли культура сыворотку или нет. mESC - мышь эмбриональной стволовых клеток, mEpiSC и мыши эпибласт стволовых клеток.
| Процедуры | Наблюдения | Возможная проблема | Решение |
| Микропаттернирование | Низкое вложение ячеек | неуместное соотношение концентрации ECM/poloxamer 307 | Увеличьте коэффициент концентрации ECM/poloxamer 307 |
| Время вложения ячеек слишком короткое | Увеличьте время инкубации, чтобы дать достаточно времени клеткам, чтобы должным образом придерживаться шаблонов (шаг 3.4). Чтобы оптимизировать этот шаг, проверка клеток под микроскопом может помочь обнаружить изменения в морфологии клеток, указывающие на то, что клетки начали придерживаться. | ||
| Столькок слишком интенсивный (шаг 3.6) | При замене среды, избегать пайпеттинг средних непосредственно на фишки. Вместо этого, осторожно pipet среды на стенах колодца вместо | ||
| Клетки придерживаются между шаблонами | неуместное соотношение концентрации ECM/poloxamer 307 | Снижение соотношения концентрации ECM/poloxamer 407 | |
| Время вложения ячеек слишком долго | Уменьшение времени инкубации (шаг 3.4). | ||
| Совки неэффективны (шаг 3.6) | Встряхивая пластины энергично, как правило, достаточно, чтобы отделить клетки в избытке. Для типов клеток, которые, как правило, придерживаются сильно чип, pipetting непосредственно на чип может улучшить результат. Увеличение количества стиельных веществ также может помочь, в частности, чтобы гарантировать, что ни одна ячейка не остается плавающей в среде после этого шага. | ||
| Клетки не строго следуют форме шаблона | «Несовместимый» тип ячейки и геометрия узора | План/дизайн нескольких геометрий/размеров, которые должны быть добавлены на фотомаску, чтобы иметь возможность проверить и определить оптимальный размер шаблона для данной формы шаблона и типа ячейки. Пожалуйста, смотрите раздел «Ограничения» в обсуждении | |
| Неоптимальный фотошаблонинг, это можно диагностировать, наблюдая за резкостью сигнала автофлюоресценции. Границы шаблонов должны выглядеть острыми, как в рис. 2. Если границы шаблонов кажутся размытыми, то шаг фотошаблонирования нуждается в улучшении. | Размытые края узора указывают на то, что пластиковый слайд не был достаточно близко к поверхности маски во время ступени освещения. Убедитесь, что части, держащие горки к фотомаске, ровны и что постоянное и достаточное давление применяется к сборке во время процедуры освещения. | ||
| Окрашивания | Неоднородные окрашивания | время инкубации антител слишком короткое | Увеличьте время инкубации антител (до 24h при комнатной температуре) |
| колонии сплющены во время процедуры монтажа | Гора микрошаблон слайдов в камере, таких как chamlide или cytoo-камер для выполнения как иммуно-стинеризм и визуализации без необходимости монтажа клеток. Это позволит лучше сохранить колонии 3D-структуры. | ||
| Отсеивание колоний во время процедуры окрашивания | Девелопме чипа | Оставьте достаточно ежесредних или используйте 2 пипетки, один для удаления среды, а другой, чтобы добавить свежее решение | |
| Колонии появляются сдвили под микроскопом | колонии были сровнены при монтаже чипа на слайде микроскопии | Будьте очень нежны при монтаже фишек. Кроме того, монтировать микрошаблоны слайды в камере, таких как chamlide или cytoochambers для выполнения как иммуносохранения и визуализации без необходимости монтажа клеток. Это также сохраняет колонии ультраструктуры. |
Таблица 2: Руководство по устранению неполадок. В этой таблице содержится обзор возможных неоптимальных результатов. Потенциальные источники проблем также перечислены вместе с рекомендуемыми решениями.
Обсуждение
Здесь мы описываем метод анализа возникающих моделей в культурах клеток. Упрощенный подход к микропаттернированию используется для стандартизации формы и размера клеточных колоний, и мы представляем инструменты анализа изображений и R-скрипты, позволяющие выявлять и количественно определять закономерности в этих колониях.
Трубопровод, который мы предлагаем, в некоторой степени аналогичен ранее опубликованному методу31, где авторы сосредотачиваются на культурных условиях, используя коммерчески доступные микрошаблоны, для получения воспроизводимого образования зародышевого слоя в колониях ESC для изучение ранних событий гастрирования in vitro. Наша цель в большей степени направлена на обеспечение обобщаемый трубопровод для обнаружения формирования шаблонов в пробирке, где коллективная организация клеток может стать очевидной только после статистического анализа. По этой причине мы предоставляем надежный рабочий процесс анализа изображений, который позволяет точно идентифицировать и анализ ядерного положения в 3D пространстве над несколькими колониями (см. также раздел «Преимущество и ограничения метода обнаружения шаблонов» обсуждения). Мы также решили разработать простой внутренний подход к микропаттернов, который предлагает более гибкую и более дешевую альтернативу коммерчески доступным решениям в долгосрочной перспективе, которые, как мы надеемся, будут полезны для общества.
Наконец, мы отмечаем, что во время пересмотра этой рукописи, новый пакет для анализа шаблонов in vitro похож на наши R скрипты был выпущен32. Этот новый пакет принимает таблицы функций ячейки в качестве входных данных, которые могут быть получены с высокой пропускной связи платформ. Мы считаем, что таблица функций ядер, созданная на седьмом этапе нашего протокола, в принципе могла бы послужить вкладом в этот новый пакет, хотя мы сами не проверяли эту возможность.
Адаптация метода к другим типам клеток и геометриям колоний
Мы представляем этот подход в контексте изучения появления мезодермальных транскрипционных факторов в культурах плюрипотентных клеток в присутствии сыворотки. Тем не менее, метод легко адаптируется к другим типам клеток и к культурам, свободным от сыворотки, хотя может потребоваться оптимизация концентраций ECM/poloxamer 407 (см. таблицу 1 для проверенных концентраций и таблицу 2 для руководства по устранению неполадок). Метод также может быть адаптирован к более крупным или меньшим размерам микрошаблонов и широкому диапазону форм в соответствии с потребностями пользователя. Однако при создании метода важно знать, что не все комбинации типа формы/ячейки являются оптимальными. Например, mESC выражает высокий уровень E-cadherin33,34, что позволяет этим ячейкам формировать коллективные структуры, охватывающие области, лишенные ECM. Эти клетки не строго следуют геометрии с острыми углами или которые включают небольшие отверстия в шаблоне. Обратите внимание, например, что на кольце Рисунок 3B,клетки находятся в процессе колонизации центральной области. В наших руках меньшая центральная область не заставляла мЭСК формировать кольцеобразные колонии. Поэтому настоятельно рекомендуется включить разнообразие геометрий при проектировании фотомаски, чтобы иметь возможность проверить и определить оптимальные размеры и кривизны, которые будут подходить для типа ячейки выбора.
Другим важным фактором, который следует принимать во внимание, является продолжительность эксперимента и скорость пролиферации клеток. Для некоторых быстро размножающихся типов клеток (в том числе плюрипотентных клеток) это может быть трудно поддерживать клетки на микропаттернов в течение многих дней (Для mESC три дня является максимумом). Кроме того, посев клеток на микропатонах не всегда происходит оптимально для каждой колонии, поэтому желательно сеять избыток колоний, чтобы иметь запасные части.
Преимущество и ограничения метода обнаружения шаблонов
Одним из конкретных преимуществ метода является способность обнаруживать "средние" закономерности путем объединения результатов анализа изображений из нескольких повторяючих колоний(рисунок 5). Это может выявить закономерность событий, которые не являются очевидными из инспекции отдельных колоний. Недостатком такого подхода «усреднения» является то, что он может упустить определенные типы повторяющихся шаблонов, например небольшие пятна или узкие полосы. Тем не менее, эти типы шаблона могут быть выявлены с сочетанием тщательно подобранных размеров шаблона8. Кроме того, анализ изображений трубопровода, описанного здесь предоставляет количественные данные как в одной ячейке и колонии резолюции, предлагая возможность исследовать уровень межколониевой изменчивости (Рисунок 5) или для выполнения анализа соседа на несколько весы10.
Еще одним важным преимуществом метода усреднения является то, что он дает возможность сопоставить преференциальное расположение многих маркеров, не ограничиваясь имеющимися флюорофорами каналов обнаружения. Действительно, хотя мы используем только два маркера дифференциации в представленной здесь работе, возможность стандартизации колоний и извлечения «средних» моделей позволяет сравнивать карты распределения из разных наборов колоний вместе, чтобы выявить обобщенные пространственные отношения маркеров друг с другом.
Кроме того, хотя наше внимание здесь было сосредоточено на изучении маркеров дифференциации, метод анализа может быть расширен для изучения других биологических процессов, для которых имеются ядерные маркеры. Например, микропаттернирование клеточной линии, содержащей индикатор убиквитинирования флуоресценции35 (FUCCI), позволит изучить, как геометрия уровня колонии может влиять на события клеточного цикла в группе.
Будущие направления
Метод поддается среднему анализу изображений пропускной всей пролимки, однако приобретение изображения в настоящее время не полностью автоматизировано и может стать ограничением для очень больших экспериментов. Регулярные договоренности колоний должны сделать возможным создать полностью автоматизированные процедуры приобретения похож на то, что было разработано для одной клетки в среднем20. Однако, поскольку размер поля, необходимого для изображения колонии, велик, что, возможно, требует мозаики, и поскольку колонии являются трехмерными, крайне желательно уменьшить как размер набора данных, так и время приобретения, спомощьив только соответствующие колонии. Поэтому будущие усилия могут быть направлены на разработку «интеллектуального» микроскопа, способного идентифицировать соответствующие колонии и адаптировать координаты изображений к каждому образцу. Это не только сократит время и усилия, но и предотвратит потенциальные предубеждения оператора.
Конвейеры анализа также могут быть более эффективными за счет сокращения количества шагов, которые необходимо предпринять пользователю. У нас есть планы по созданию механизма построения трубопроводов и интеграции R непосредственно в наше программное обеспечение (см. также выпуски pickcells-api-3 и pickcells-rjava No1 в трекере наших репозиторий кода (https://framagit.org/groups/pickcellslab/-/issues). Полная автоматизация процедуры анализа сократит время и усилия и ограничит потенциальные ошибки пользователей.
Наконец, мы отмечаем, что наш метод анализа еще не полностью отражает динамический характер клеточного шаблонирования. Некоторая ограниченная динамическая информация может быть извлечена путем изучения временной серии снимков8,10,36. Тем не менее, возможность записывать историю популяции клеток очень желательно, если мы хотим лучше понять, как образец возникает. Одним из ограничений является то, что точное отслеживание отдельных клеток в 3D плотной популяции клеток остается очень сложной задачей37. Наш метод обнаружения клеток использует ядерную оболочку и особенно хорошо работает на плотных и перекрывающихся популяциях клеток28. Репортеры в реальном маштабе времени ядерной конверте охотно доступны28,38 и одно преимущество метода микропаттернинга что оно может быть использовано для того чтобы предотвратить клетки от двигать вне поля зрения во время долгосрочного изображения. В целом, мы уверены, что автоматизированное отслеживание ячеек будет достижимо с помощью комбинации недавно созданных инструментов28,39,40 ичто это должно принести новые идеи в фундаментальные принципов самоорганизации.
Раскрытие информации
Авторам нечего раскрывать
Благодарности
Эта работа была профинансирована сэром Генри Wellcome после докторской стипендий (WT100133 г. Г.Б.), Wellcome Trust senior Fellowship (WT103789AIA к S.L.), и Wellcome Trust PhD студентов (108906/ No /15 / 15 / Д.В.). Мы также признательны д-ру Мануэлю Тери за его советы по адаптации методики фотопаттернинга.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
Ссылки
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878(2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939(2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- Micropatterning in cell biology. Pt. A. , Elsevier. Amsterdam. (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), Dayton, Ohio. 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366(2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438(2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514(2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872(2018).
- Weiswald, L. -B., Guinebretière, J. -M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106(2010).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. Available from: http://www.R-project.org/ (2013).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384(2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839(2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141(2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены