Method Article
מיפוי הארגון המרחבי של תאי היונקים באמצעות מיקרודפוסים והדמיה כמותית
In This Article
Summary
השיטה המוצגת כאן משתמשת במיקרוגרף יחד עם הדמיה כמותית לחשיפת הארגון המרחבי בתוך תרבויות היונקים. הטכניקה היא קלה להקים מעבדה סטנדרטית בביולוגיה התא והוא מציע מערכת צייתן לחקור מבחנה בפריפרייה.
Abstract
מטרה בסיסית בביולוגיה היא להבין כיצד מופיעים דפוסים במהלך הפיתוח. כמה קבוצות הראו כי הדפוס ניתן להשיג באופן מתורבת כאשר תאי גזע מוגבלים על מיקרודפוסים, ובכך להגדיר מודלים ניסיוניים המציעים הזדמנויות ייחודיות לזהות, באופן מתורבת, עקרונות היסוד של ביולוגי ארגון.
כאן אנו מתארים את ההטמעה שלנו של המתודולוגיה. התאמתי את הטכניקה צילום-מניפולציה כדי להפחית את הצורך בציוד מיוחד כדי להקל על הקמת השיטה במעבדה סטנדרטית ביולוגיה תא. פיתחנו גם בחינם, מקור פתוח וקל להתקין מסגרת ניתוח תמונה כדי למדוד במדויק את המיקום המוועדף של אוכלוסיות תת של תאים בתוך מושבות של צורות סטנדרטיות גדלים. שיטה זו מאפשרת לחשוף את קיומם של אירועים מסוימים גם באוכלוסיות בלתי מאורגנת לכאורה של תאים. הטכניקה מספקת תובנות כמותיים ויכולה לשמש לזיווג השפעות הסביבה (למשל, רמזים פיזיים או איתות אנדוגני), בתהליך מסוים.
Introduction
במערכות היונקים, הדפוס הוא תכונה מתהווה של התנהגות קולקטיבית של תאים ולכן, דפוסים יכולים ליצור מבחנה אם רמזים מתאימים מסופקים לתאים1,2,3,4, מיכל 5 , 6. אחת הדרכים לחשוף את היכולת הפנימית של התאים לארגן את עצמו ב-"מבחנה" היא לאלץ את התאים ליצור קבוצות/מושבות של צורות וגדלים מוגדרים7,8,9,10 . טכניקה המאפשרת זאת היא מיקרומניפולציה11. מיקרומטנינג מאפשר להגדיר במדויק את המיקום שבו מולקולות המכפלה (ECM) מיופקדו על משטח. זה, בתורו מכתיב היכן התאים יכולים לדבוק ולכן שולט כיצד תאים לארגן.
מיקרומניפולציה היא טכניקה עם מספר רב של יישומים, למשל, מיקרו, מאפשרת סטנדרטיזציה של תנאים ראשוניים לפני בידול12. חשוב לעשות זאת, המיקרו-מיקרוסקופ מאפשר לשלוט בקלות בגודל, בצורה ובריווח של מושבות תאים ובמאפיין זה ניתן להשתמש כדי לתכנן ניסויים המיועדים לחקור את התגובה הקולקטיבית של התאים כדי מורפוגן או לסימנים פיזיים7 , בן שמונה , מיכל עשור , מיכל בן 13 , מיכל בן 14 , מיכל בן 15 , מיכל בן 16 , . שבע עשרה
מספר שיטות מיקרוטונינג פותחו11. טכניקות photopatterning הן אולי השיטות הקלות ביותר להקמת18. גישות אלה יש גם את היתרון של דיוק כפי שהם יכולים לשמש כדי לשלוט על הצורה של תאים בודדים18,19,20. עם זאת, הם דורשים גם ציוד יקר מיוחדים כולל מסתובב ספין, תא פלזמה ו UVO (UV-אוזון) ניקוי אשר בדרך כלל לא זמין במעבדות ביולוגיה סטנדרטית. כדי להקל על אימוץ הטכניקה, התאמתי את הפרוטוקול כדי לאפשר רק את מנורת ה-UVO. אנחנו מתחילים מתוך שקופיות פלסטיק זמין מסחרית אשר ניתן לגזור עם מספריים או עם ניקוב חור לפורמט הרצוי.
כלי חשוב אחד של מיקרודפוסים הוא היכולת לתקנן מושבות כדי להשוות בין מושבות בודדות לבין מספר משכפל. זה מאפשר לשאול לאיזה מידה היווצרות התבנית בתוך מושבות אלה הוא להיות מיוצר, ולחקור גורמים המשפיעים על החוסן של תהליך הדפוס. וחשוב מכך, הכמת של דפוסי "ממוצעים" על פני מושבות סטנדרטיות מרובות יכולים גם לחשוף את תהליכי המדידה שאחרת לא היו גלויים לעין. היתרון של היכולת לכמת את המדידה על המושבות מתוקננת תלוי ביכולת למדוד במדויק את ביטוי החלבון, באופן אידיאלי במפלס התא היחיד. עם זאת, תאים על מיקרודפוסים הם לעתים קרובות ארוזים הדוק, מה שהופך אותם קשה פלח עם דיוק גבוהה. תאים גם לעתים קרובות לארגן את עצמם בשלושה ולא בשני ממדים, וזה יכול להיות מאתגר לזהות ולשמר תלת מימדי (3D) מידע במהלך פילוח. לאחר שתאים מחולקים בהצלחה, נדרשות שיטות חישוביות לחילוץ מידע מתוך ערכות הנתונים שיתקבלו.
פיתחנו פילוח וניתוח תמונה כלי כדי לסייע להתגבר על בעיות אלה. שיטת ניתוח זו משתמשת רק בתוכנה חופשית ובקוד פתוח ואינה דורשת ידע על שורת הפקודה או על תיכנות ליישום. כדי להמחיש את השיטה כאן, אנו משתמשים גזע מעובריים של העכבר (mES) תאים אשר באופן ספונטני לבטא סמן של בידול מוקדם brachyury (tbra)21,22. בעוד שאין הסדר מרחבי גלוי לעין חזותית, השיטה מאפשרת יצירת מפה של מיקום מועדף של תאי T + במושבות. כמו כן, אנו מראים כי Tbra המ, ניגודים עם העדר לוקליזציה מועדפים של התאים המבטאים Id1, הבדיקה הישירה של חלבון מורמורגנטי העצם (BMP) בנתיב23. אנו דנים גם במגבלות הנוכחיות של השיטה וכיצד ניתן להתאים טכניקה זו למערכות נסיוניות אחרות.
Protocol
הערה: מבט כולל על השיטה מסופק באיור 1.
1. עיצוב מסכה
- עיצוב הפושאול לפי ההנחיות המתוארות באזימוט ואח '18. עיין בטבלת החומרים לעיון ביצרן התוכנה והמסיכה המשמש למחקר זה.
הערה: ניתן ליצור במסיכה אחת מספר גאומטריות, גדלים או מרווחים בין צורות. מנורת UV יכול להתאים 15 ס מ פושבשאל אשר עשוי להכיל עד 49 עיצובים שונים (בהנחה 2 ס"מ x 2 צ ' יפס).
2. הליך הייצור של מיקרותבנית
- הכינו את החומרים הנחוצים.
- הכינו פתרון של 0.1% poloxamer 407 (10 מ"ג עבור 10 מ ל) ב פוספט מתכלה באגירה (PBS) ולהשאיר על שייקר בטמפרטורת החדר. The poloxamer 407 ייקח בערך 20 דקות להתמוסס.
- שכב הסרט מעבדה (לראות את הטבלה של חומרים) בתחתית צלחת 10 ס מ מרובע פטרי. . זה ישמש כחדר התצהיר של המטריקס
- נקו את פני השטח של הפושאול, הראשון עם 100% אצטון, ולאחר מכן עם 100% איזופנול ולבסוף עם ddH2O. אם הדבר אפשרי, לייבש את המזגן או לייבש באופן אחר את המסכה עם מגבת נייר נקייה.
- הכן ריבוע, פיסת פלסטיק נוקשה ואטומה עם אותו גודל בדיוק כמו הפושאול (מאוחר יותר המכונה ' המחזיק ').
הערה: הדבר ישמש לשמירת שמיכות פלסטיק במגע עם הפושאול במהלך שלב התאורה. - הפעל את מנורת ה-UVO והפעל תאורה מחממת במשך 10 דקות.
- צור שבבי פוטואטנד.
הערה: ניתן להתאים את ההליך ליצירת אסימונים בגודל הרצוי. למען הפשטות, אנו מתארים כאן את ההליך כדי ליצור שבב מיקרותבנית של 12 מ"מ עגול.- באמצעות אגרוף חור 12 מ"מ, לחתוך שקופיות פלסטיק הידרופובי כדי ליצור 12 מילימטר שמיכות עגול ולמקם אותם בצלחת פטרי חדשה ונקייה.
התראה: השתמש בכפפות בכל עת כדי להימנע ממגע העור עם פני השטח של הפלסטיק כמו זה עלול לפגוע בטיפול פני השטח. - הסר בזהירות את הסרט מגן מתוך שמיכות עם מספריים.
הערה: הימנע מפגיעה במשטח הפלסטיק משום שזה עשוי להשפיע על מיקום התאים על השבב במהלך הזריעה (סעיף 3). - מניחים את הפושאל על משטח נקי ויציב (למשל, תיבת פוטובוקס), צד כרום פונה כלפי מעלה, ומוסיפים 2 μL ירידה של ddH2O במיקום של עיצוב השבב הרצוי.
- הניחו שמיכות על הטיפה של ddH2O ולחץ בעדינות.
הערה: לוודא שהצד הפלסטי שפונה לפושאול הוא הצד שהיה מוגן על ידי הסרט שהוסר בשלב הקודם. - מניחים את המחזיק על גבי שקופיות פלסטיק ובזהירות לתקן את הכריך הזה עם התפסים כדי לשמור על חתיכות פלסטיק במגע עם הפושאול.
הערה: מניחים את התפסים כקרובים ככל האפשר למיקום מגלשות הפלסטיק כדי להבטיח שהשקופיות הפלסטיות יישמרו באופן מושלם במגע עם פני השטח של הפושאול. - מניחים את ההרכבה במנורה UVO בערך 2 ס מ ממקור האור ומאירים במשך 10 דקות.
הערה: כוחה של האור מוערך כ-6 mW/cm2 ב 254 ננומטר של אורך הגל כאשר השבב ממוקם במרחק של 2 ס מ מהמקור. - החזיקו את הכריך עם הפושאול בתחתית והסירו בזהירות את התפסים תוך שמירה על הלחץ ביד אחת כדי למנוע מהשקופיות לנוע בזמן הפירוק של הכריך. הסר את המחזיק, להבטיח כי כל חתיכות פלסטיק עדיין על המסכה ולא נדבק המחזיק.
- הוסף ddH2O על גבי האסימונים ולנתק בעדינות את האסימונים מתוך הפושאול.
הערה: אם שבב הפלסטיק נתקע לתוך הפושאול, לנתק את השבב באמצעות מארז פלסטיק לדחוף את השבב תוך החזקת מלקחיים מעט מעל השבב במקרה השבב מתנתק לפתע. - לבסוף, מניחים את שבבי פוטואטנד. בתוך חדר התצהיר של המטריקס
הערה: ודא שהצד המואר של השבב פונה כלפי מעלה.
- באמצעות אגרוף חור 12 מ"מ, לחתוך שקופיות פלסטיק הידרופובי כדי ליצור 12 מילימטר שמיכות עגול ולמקם אותם בצלחת פטרי חדשה ונקייה.
- . הפקיד את המטריקס
הערה: יש לבצע את כל ההליכים בסעיף זה במכסה של תרבות הרקמה.- לסנן את poloxamer 407 פתרון באמצעות מסנן 0.22 יקרומטר polyethersulfone (PES).
- להכין את הפתרון ציפוי ECM על ידי ערבוב 500 μg/mL של מסוננים סטרילי poloxamer 407 ו 1 מ"ג/mL של ג'לטין.
הערה: ראה גם טבלה 1 לקבלת מידע נוסף אודות מולקולות ecm אפשריות אחרות. - הוסף 200 μL של פתרון ציפוי על כל שבב מואר. סרט המעבדה ימנע את נפילת השבב מבחוץ.
- להוסיף צלחת פטרי 3 ס"מ מלא ddH2O כדי להגביל את האידוי ולמקם אותו עם השבב ב 4 ° c בלילה.
3. זריעת הליך
הערה: השלבים המתוארים להלן ממוטבים עבור תאי גזע CGR8 העכבר העובריים (mESC)24 באמצעות תקן mesc בינונית (ראה גם את הטבלה של חומרים). עם זאת, ניתן בעיקרון להתאים את ההליך עבור כל סוג תא. הערה גם כי תרבות התא קונבנציונאלי של תאים גזע מעובריים העכבר אינו מתואר כאן כתיעוד נרחב ניתן למצוא במקום אחר25.
- מנושף את התמיסה ואת השבבים הללו פעמיים עבור לפחות 5 דקות עם ה-PBS סטרילי.
- בינתיים, להכין השעיית תא של 5.5 x 105 תאים/mL במדיום חם.
- Pipet 200 μL של השעיית התא על כל שבב (~ 100,000 תאים/cm2).
- סגור את תא הזריעה ולהשאיר את התאים לדבוק 1 h בחממה.
- אחרי 1 h, למלא את הבארות של צלחת multiwell באר (4-היטב או הצלחת 24-באר בהתאם למספר של צ ' יפס) עם 500 μL/טוב של בינוני חם להעביר את האסימונים לתוך הצלחת עם פינצטה סטרילית.
- טלטל את הצלחת במרץ כדי לנתק תאים שאינם מחסיד. מתיף את המדיום ומיד להחליף עם מדיום טרי חם. בדקו מתחת למיקרוסקופ כדי לראות אם הבדיקה גלויה (איור 2a).
הערה: זמן הדבקה עשוי להיות ממוטב בעת שימוש בקווי תאים שאינם מתוצרת mESC או באמצעות חלבונים אחרים של מטריצה (ראה גם טבלה 2). - חזור על שלב זה עד שתבניות יהפכו לגלויות בבהירות כפי שמוצג באיור 2a.
הערה: שלב זה קריטי וקובע את הצלחת השגרה. הליך כביסה אינטנסיבי מדי עלול לנתק את התאים, בניגוד מספיק כביסה עלולה לגרום לתאים הנותרים מחוברים בין הדפוסים (איור 2c, d).
4. קיבעון
הערה: לאחר 48 h בתרבות התאים צריכים ליצור מושבות צפופות אשר בקפדנות לעקוב אחר צורת הדפוסים (כפי שמוצג באיור 2b).
- להשאיר את האסימונים בצלחת, להסיר ~ 90% של המדיום, משאיר מספיק בינונית כדי למנוע את האסימונים מייבוש.
הערה: חשוב שהשבב לעולם לא יתייבש כדי להימנע מצביעת חפצים ולמנוע ניתוק תאים מפני השטח. בגלל ההידרופוטביטי של משטח השבב בין דפוסי הדבקה, ייתכן שלשבב יש נטייה להיטב. בשלב זה, הקיבעון עלול לגרום מושבות כיפה גדולה להתנתק מן השבב. שוטף צריך להיות עדין מאוד, ביצוע באופן אידיאלי על ידי ליטוף נוזלי בצד הבאר ולא ישירות על השבב. - הוסף לפחות 500 μL של פאראפורמלדהיד (בתחתית) פתרון קיבעון מבוסס על היטב ו מודאט עבור 10 דקות.
הערה: אם מושבות מופיעות עבות במיוחד (יותר מ-5 שכבות תא), ייתכן שיהיה צורך לכוונן את זמן הקיבוע ל-20 דקות. - לאחר קיבעון, לשטוף 3 פעמים עם פתרון כביסה (PBS עם 0.01% poloxamer 407). כביסה נוספת באמצעות 50 mM NH4Cl מדולל בפתרון כביסה יכול להיות משולבת כדי להרוות את הפעילות הצולבת צולבות לחצות שיורית.
- מודטה את הדגימות עבור לפחות 30 דקות בפתרון חסימת.
הערה: בשלב זה ניתן לאחסן דגימות ב-4 ° צ' למשך כשבוע לפני כתמים. אם כן, לאטום את הצלחת עם סרט מעבדה כדי למנוע אידוי.
5. מכתים חיסוני
- הכינו תא מכתים על ידי הצבת גיליון של סרט מעבדה בתחתית צלחת פטרי בגודל 10 ס מ.
- הכן פתרונות נוגדנים (ראה שולחן 3 לרשימת נוגדנים ומדלל בשימוש במאמר זה).
- מניחים את השבב לתוך חדר מכתים עם הצד תומך התאים הפונים כלפי מעלה ומיד להוסיף 100 μL של פתרון הנוגדן העיקרי על השבב.
התראה: בשלב זה, צ'יפס לא צריך בקלות לרדת מהרטוב כמו בשלב 4.1. עם זאת, הטיפול עדיין צריך להילקח כי חשוב כי האסימונים לא יבשים. אם יש לעבד אסימונים מרובים, החל את שלב 5.3 לכל שבב ברצף. - מודטה עבור 1 h על פלטפורמה מסתובבת בטמפרטורת החדר.
הערה: אם התאים יצרו מבנים תלת-ממדיים גדולים, זמן דגירה ארוך יותר עשוי להידרש לאפשר כתמים אחידים של המדגם. זמן דגירה יכול להיות גדל עד 24 שעות. עם זאת, החדר מכתים חייב להכיל צלחת 3 ס מ מלא מים החדר מכתים חייב להיות אטום עם סרט מעבדה כדי למנוע אידוי. - העבר את האסימונים לצלחת מרובת היטב ושטוף 3 פעמים עם פתרון הכביסה.
- לבצע דגירה עם נוגדנים משניים כמתואר בשלב 5.3 ו 5.4.
- הר את השבב על שקופית מיקרוסקופ באמצעות 20 μL של כל מדיום הרכבה סטנדרטית (למשל, מהאיויול).
6. הדמיה
הערה: ניתן לבצע הדמיה בעזרת מיקרוסקופ קונמוקד סטנדרטי. כאן אנו מספקים רק המלצות על מנת להבטיח איכות תמונה שתספיק לניתוח הכמותי העוקב.
התראה: כדי למנוע הטיית מרכזיה, יש לבחור במושבות לתמונה רק באמצעות אות המעטפה הגרעינית (כדי לראות אם המושבה מתבצעת כהלכה בעקבות צורת התבנית). הימנע מבדיקת האות של סמני הריבית, למעט בשעת התאמת הגדרות המיקרוסקופ.
- ודא שעומק סיביות הרכישה הוא 12 או 16 סיביות.
- זהה את ההגדרות המתאימות כדי למקסם את הטווח הדינמי עבור כל ערוץ תמונה. בפרט, הימנע מגזירת תמונה.
- כלול ערוץ לתמונה של המיקרו-פלואורסצנטית האוטומטי (ראה איור 3).
- להתאים את גודל התמונה ואת פקטור מרחק מתצוגה כדי לקבל גדלים voxel הנע בין 0.1 ו 0.6 יקרומטר ב-x ו-y צירים, החל בין 0.2 ו-2 יקרומטר ב-z-ציר.
הערה: לדוגמה, במחקר זה, השתמשנו מיקרוסקופ קונפוקלית יקוד הפוך עם מטרה 40x (הצמצם המספרי שווה 1.3), גודל תמונה של 1024 x 1024 פיקסלים ללא זום דיגיטלי ו-z-צעד גודל של 0.5 μm. זה הביא בגודל voxel של 0.38 יקרומטר x 0.38 יקרומטר x 0.5 יקרומטר. - עבור כל מושבה, הגדר את המיקום המינימלי והמקסימלי לאורך ציר z כדי להבטיח שהמושבה כולה נרכשה. יש לכלול לפחות מטוס אחד עם מחסור נמוך באות מתחת ומעל למושבה.
- ודא שכיוונים של מחסנית z נרכשים בעקביות (או תמיד מלמעלה למטה או מלמטה תמיד למעלה)
- כוונן את מהירות הסריקה, רזולוציית התמונה, חישוב המסגרת בממוצע ורווחי הגלאי כדי לזהות אופטימלי בין איכות תמונה וזמן הדמיה. כאינדיקציה, זמן הדמיה עבור מושבה אחת כפי שמוצג באיור 3 היה כ 2 – 3 דקות. בצע את רכישת התמונה.
התראה: כל התמונות, כדי להיות דומות, יש לרכוש על אותו מיקרוסקופ עם הגדרות מטרה ורכישה זהה. - בתום הרכישה, שמור את כל התמונות והקצה מוסכמה ייחודית למתן שמות כדי לזהות את התנאי הניסיוני שכל תמונה מייצגת.
הערה: ראה איור 4 כדוגמה, הועידה הזאת תהיה בשימוש מאוחר יותר במהלך הליך הניתוח. שים לב שניתן לשמור תמונות בתבנית כלשהי הנתמכת על-ידי BioFormats 26. אם המושבות גדולות יותר משדה הראייה, תוסף התפרים של ImageJ עשוי לשמש27. שים לב גם כי במקרה של תפרים, תיקון האור מתנתק עשוי להיות הכרחי.
7. ניתוח תמונה
הערה: מפרט המחשב המומלץ עבור הליך זה הוא: 16 GB זיכרון RAM, multi-core 3.33 GHz CPU, ו לפחות 50 GB של שטח דיסק (או יותר בהתאם למספר של אסימונים שכבר התמונה). התוכנה נבדקה על לינוקס, Windows ו MacOS. בייתאים הוא יישום לניתוח תמונה חוצת פלטפורמות עם ממשק משתמש גרפי המוקדש לניתוח הארגון הקולקטיבי של התאים בתמונות רב-ממדיים מורכבות (בלין ואח ', כהכנה). שים לב כי מידע נוסף על בתאי בסדר, כמו גם תיעוד עבור המודולים הספציפיים שהוזכרו כאן ניתן למצוא באינטרנט: https://pickcellslab.frama.io/docs/. שים לב גם כי הממשק כפוף לשנות כפי שאנו ממשיכים לשפר את התוכנה. אם הממשק שונה ממה שמוצג באיור או בווידאו, עיין במדריך המקוון.
- התקן והפעל את תאים בעקבות התיעוד הזמין באינטרנט.
- יבא תמונות ובדוק את הדיוק של המידע המסופק (איור 4-1).
- תעד את השם של כל אחד מהערוצים.
- גרעין הפלח מבוסס על אות המעטפה הגרעינית באמצעות מודול מודל28 (איור 4-2) ולספק קידומת ("גרעינים" למשל) אשר ישמשו לשם התמונות שנוצרו מקוטע.
הערה: תיעוד אודות שימוש והתאמות פרמטרים ניתן למצוא בhttps://framagit.org/pickcellslab/nessys. - בדוק וערוך segmentations במידת הצורך, באמצעות מודול עורך פילוח (איור 4-3)
הערה: אם מסיבה כלשהי, תהליך הפילוח לא סיפק תוצאות משביעות רצון, מחק באופן ידני תמונות בתיקיית מסד הנתונים וגם מחק את הצומת ' תוצאת פילוח ' בתצוגת Metamodel . לאחר מכן, חזור על שלב 7.4 ו-7.5. אם הפילוח של קבוצת משנה קטנה בלבד של תמונות לא סיפק תוצאות מספקות, השתמש ביישום העצמאי (ראה את הקישור ב-7.4), נסה לבצע פילוח על ' תמונות פגומות ' ולהחליף את הקובץ המתאים בתיקיית מסד הנתונים). - פלח את האות באמצעות מודול הפילוח הבסיסי (איור 4-4)
- הוסף קידומת ("תבנית" לדוגמה) שישמשו ליצירת שם התמונות המקומות שנוצרו.
- בחר את הערוץ המכיל את האות עם הזריחה האוטומטית.
- החלת הפחתת רעש; בדרך כלל באמצעות מסנן גאוסיאני עם גודל ליבה של 10 x 10 x 0.5 voxels נותן תוצאות משביעות רצון.
- הגדר את הסף התחתון כך שהרקע יופיע בכחול בזמן שהקידמה נראית לבנה. הגדר גם את הסף העליון לערך המירבי שלו כדי להימנע מהעוצמות הגבוהות שאינן נכללות בתוצאה הסופית (אזורים אדומים).
- בחר באפשרות ' דלג ' לשלב האחרון.
- לחץ על סיום והמתן עד שכל התמונות יעובדו.
- באשר גרעיני, התוצאות פילוח יכול כעת להיבדק ותוקנו במידת הצורך באמצעות מודול עורך פילוח (איור 4-5).
- צור אובייקטי גרעין וחשב תכונות של אובייקט בסיסי.
- הפעל את מודול התכונות הפנימיות משורת המשימות שמשמאל לממשק הראשי (איור 4-6).
- סגור את מחלץ האליפסואיד והמשטח של חולץ חלוניות כדי לשמור רק את החלונית ' תכונות בסיסיות ' פתוח.
- בחר בגרעין כסוג האובייקט ובחר את הקידומת הנתונה בשלב 7.4 עבור "תמונות מקוטע".
- לחץ על חשב והמתן עד שכל התמונות יעובדו.
הערה: לאחר שלב זה, לא ניתן יהיה לערוך את הגרעין segmentations שוב.
- יצירת אובייקטי דוגמת מילוי וחישוב תכונות של אובייקט בסיסי. חזור על שלבים ה7.8.1 ל7.8.4, רק הפעם בחר סוג מותאם אישית כסוג אובייקט והקידומת הנתונה בשלב 7.6.1 עבור תמונות מקוטעת.
הערה: לאחר שלב זה, לא תהיה אפשרות לערוך את תבנית הsegmentations שוב. - אחסן את שם התמונה שכל גרעין שייך לו כתכונת גרעין.
- לחץ על נתונים ≫ תכונה חדשה ובחר בגרעין בתיבת הדו המוקפץ ולחץ על אישור.
- בחר באפשרות איסוף נתונים מאובייקטים אחרים המחוברים לצומת ולחץ על הבא.
- בחלונית הימנית, בחרו תמונה ולחצו פעמיים על סימון החקירה מתחת לדגל הסיום בחלונית ' הגדרות נתיב ' כדי להגדיר את צומת התמונה כיעד לנתיב.
- הרחיבו את החלונית ' תכונות זמינות ' בחלונית הימנית ובחרו בתכונה ' שם '.
- הרחיבו את חלונית הפעולות הפחתת ובחרו ' קבל אחד' ולחצו על הלחצן ' שינוי ' ולחצו על ' הבא'.
- הקלד "שם תמונה", הקש על מקש tab ולחץ על אישור.
- צור מאפיין "קואורדינטות מסוימות" באובייקטי גרעין (איור 4-7).
- להתאים את הצעדים 7.10.1 כדי 7.10.6 לאחסן את הקואורדינטות של מרכז הדפוס כתכונה גרעין. נקוב בשם התכונה החדשה "קואורדינטת דוגמת מילוי".
- לאחר מכן, לחץ על נתונים ≫ תכונה חדשה, בחר בגרעין ולחץ על אישור.
- בחר באפשרות הגדר פונקציה בין וקטורים מרחביים או כיוונים של הצומת ולחץ על הבא.
- עבור סוג הפונקציה בחר מערך פעולה, עבור פריט בחירה V1 וקטור ולאחר מכן Centroidו עבור V2 בחירת פריט וקטור ולאחר מכן תבנית Coordinate.
- לחצו על ' הבא', הקלידו ' קואורדינטות מסוג ' בשדה ' שם ' ולחצו על ' סיום'.
- יצא את הנתונים לקובץ ערך מופרד באמצעות טאבים.
8. R ניתוח
- הורד והתקן Rstudio.
הערה: פרטי תוכנה וקישורי הורדה זמינים ב-https://www.rstudio.com/. - הורד את סקריפטים R הדרושים לניתוח זה.
הערה: ניתן להוריד סקריפטים ממאגר גילאב: https://framagit.org/pickcellslab/hexmapr. - פתח Rstudio.
הערה: אם הפעלת קבצי ה-script בפעם הראשונה, התקן את חבילות ה-R הנדרשות (ggplot2 וסולמות). - . מרוסטודיו, פתח את הbinnedmap_template . התסריט של אר.
- הגדר את ספריית העבודה למיקום קובץ המקור.
- בצע את ההוראות המופיעות בקובץ ה-script כדי להתאים את הסקריפט לכל ערכת נתונים נתונה על מנת להשיג מפות מרחבית כמוצג באיור 5.
- הפעל את קובץ ה-script כדי ליצור מפות דחיסות.
תוצאות
שיטת הצילום שתוארה כאן מאפשרת לארגן במדויק תאים מתורבתים למושבות של צורות וגדלים מוגדרים. ההצלחה של הליך זה צריך להיות ברור בבירור מיד לאחר הליך זריעת התאים (שלב 3.7) כמו תאים הקפדה יהיה אשכול בהתאם לעיצוב פוקשו כפי שמוצג באיור 2a. ב 1 h לאחר זריעת תאים, דפוסים בודדים לא יכול להיות מלאה באופן מלא (רק תאים מעטים לכל תבנית), עם זאת, כמו התאים מתרבים לאורך זמן, דפוסים יהפכו להיות הקולוניה במלואה עם רק מעט מאוד תאים מחוץ דבק משטחים (איור 2b). המראה המדויק של התרבות תהיה תלויה בקו התאים. לדוגמה, כיפת הצורת של mESC מושבות10. שבב שבו הפינינג אינו ברור 1 עד 2 h לאחר זריעת התאים מציין כשל של ההליך (איור 2 ג, d).
מושבות גדולות ועבות יכולות לפעמים להיות מאתגרות לכתמים הומוגנתים. אנו ממליצים לתקן ולחלחל את התאים בשלב אחד (סעיף 4) כמו זה יכול לשפר את החדירה נוגדן29. זוהי הסיבה מדוע הפתרון הקבוע הנבחר מכיל כביסה. איור 3 מציג את האות הפלואורסצנטית אשר צפוי לאחר כתמים חיסוני. שים לב כי התאים הבהירים Id1 חיוביים נמצאים בתוך אזורים צפופים (האזורים NPC בהיר) של המושבות (איור 3A). רמזים כגון זה שימושיים כדי להעריך את האיכות של הליך מכתים נוגדנים. שים לב גם שהמיקרודפוסים שנוצרו עם הטכניקה הנוכחית הם פלורסנט אוטומטית. אות זה (איור 3a, B השמאלי ביותר תמונות) הוא שימושי בשלב הניתוח כדי מרחב לרשום מושבות אחד עם השני וליצור את התוצאות המוצגות באיור 5. האות פלואורסצנטית אוטומטי הוא בדרך כלל המבריקים ביותר כאשר המדגם הוא נרגש עם 405 ננומטר לייזר וערוץ זה צריך להיות שמאל ללא כתמים למטרה זו. איור 3 מראה גם כיצד התאים מוגבלת בדיוק בתבניות של צורות שונות.
ניתוח נתוני ההדמיה מבוצע בפיטלתאי, תוכנה חופשית ומקור פתוח שפותחה במעבדה שלנו (בלין ואח ', כהכנה). תוכנה זו כוללת את מודולים ניתוח תמונה לקרוא ולמיין תמונות קונפוקלית וקד (איור 4-1), על פלח (איור 4-2,4-4) ו האובייקטים מקוטע מקוטעת (איור 4-3, 4-5), לחשב אובייקט תכונות כגון קואורדינטות או עוצמה ממוצעת (איור 4-6) ולייצא את הנתונים (איור 4-7, 4-8). חשוב לעשות זאת, פיתחנו שיטת מפלח גרעיני חזק בשם הקבוצה "נסון28 " אשר מתאימה במיוחד לאוכלוסיות צפופות והטרוגניות של תאים כגון תאים הגדלים על מיקרודפוסים (איור 3). איור 4 -2 מראה פלט מייצג של מודול מייניס שבו כל תא בודד ניתנת במדויק זהות צבעונית ייחודית. רק עריכה מינימלית צריכה להיות נחוצה, אולם העריכה אפשרית אם המשתמש יחליט כך (איור 4-3). לבסוף, בפיתאים מספק מספר מודולים חזותיים כדי להמחיש את הנתונים. דוגמה ניתנת באיור 4-6: טבעת בצורת המושבה מעובד ב-3d שבו הגרעינים מסומנים בצבע על פי מיקומם לאורך ציר z. לאחר הניתוח מאומת ב-התאים, ניתן לייצא את הנתונים כדי ליצור את המפות המרחבית ב-R באמצעות קבצי ה-script הזמינים ב (https://framagit.org/pickcellslab/hexmapr) כפי שמוצג באיור 530.
הצגנו לאחרונה כי הכליאה המרחבית של mesc על קטן (30,000 יקרומטר2) דיסק או מיקרותבניות אליפסה מדריכים את הדפוס של אוכלוסיית משנה של תאים ביטוי סמן מזותת העורי tbra10. לכן, כדי להמחיש את השיטה שלנו כאן, אנו שואלים אם המנופח של tbra עשוי להיות מושפע על ידי איתות BMP במושבות גדולות (90,000 יקרומטר2). איור 5A מראה כי בעת גדלו mesc על דיסק גדול מיקרותבניות, tbra + תאים מוגבלים בצורה מוגבלת הפריפריה של התבנית (tbra + צפיפות מפה), שם צפיפות התא המקומי הוא הנמוך ביותר (לראות את המפה הכחולה משמאל איור 5a ). . המפה של עוצמת טברה מרושעת
נתונים אלה מדגימים שהשיטה יכולה לחשוף מידע תת-חזותי. ואכן, מתוך איור 3, בדיקה חזותית של מושבה אחת אינה מספיקה כדי לזהות כל צורה של ארגון מרחבי בביטוי tbra. הדבר מוסבר בעיקר על ידי המושבה החשובה לשינויי המושבה שבקוונה ומוצג בלוח הימני של האיור 5A.
הטכניקה גם מראה כי לא ניתן לראות מפרט קיים עבור Id1 (יעד של איתות BMP) אשר עשוי להצביע על כך T מונע באמצעות איתות BMP בהקשר זה.
מיקרוהנינג מאפשר לכפות על מושבות לאמץ כמעט כל גאומטריה רצויה. זה שימושי במיוחד כדי לחקור כיצד המערכת מגיבה גאומטריות שונות. לדוגמה, אנו עשויים להיות מרוצים כי אם מעבר מורפוגן מצטבר במרכז המושבה, יצירת חור במושבה משבש את המעבר. מעניין שאנחנו עדיין מתבוננים בדפוס על מיקרותבנית הטבעת, אם כי בצורה פחות איתנה (איור 5B).
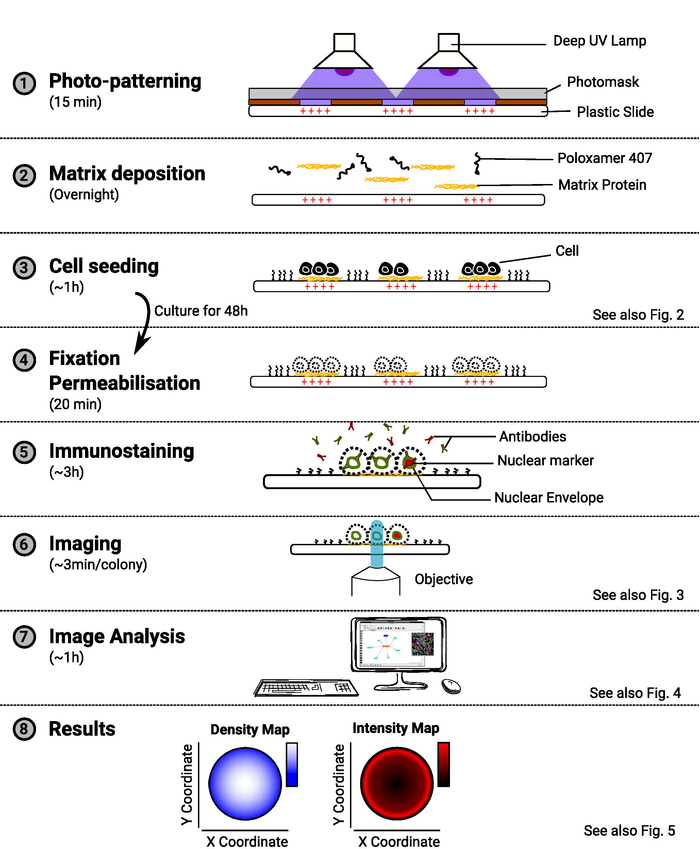
איור 1: מבט כולל על השיטה. הדיאגרמה המציגה את השלבים העיקריים של השיטה. עבור כל שלב, כמות הזמן המשוערת מצוינת תחת שם המשימה והסכמטי ממחיש את מטרת הפרוצדורה. התייחסות לדמות רלוונטית מסופקת גם כאשר היא זמינה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
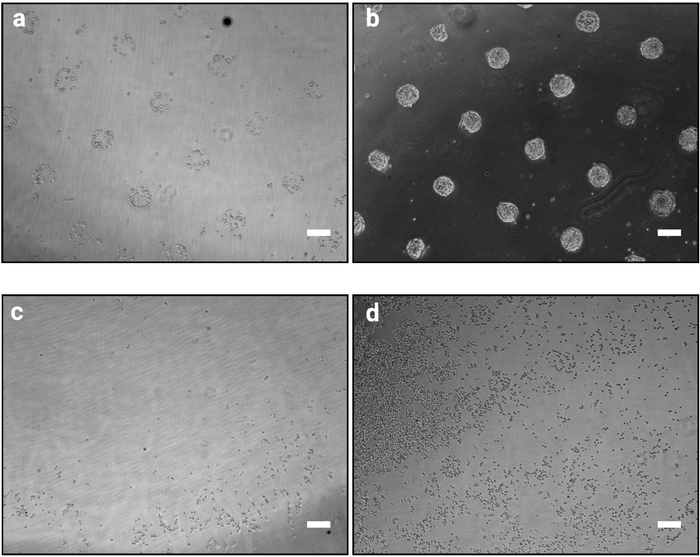
איור 2: הופעת התרבות 1 h ו-48 h לאחר זריעת התאים במיקרודפוסים. ברייטפילד דימויים של mESC שופרה על מיקרודפוסים. (א) ארגון התא הצפוי 1 h לאחר זריעה, יש לאפשר זיהוי ברור של דפוסים. (ב) צפוי התוצאה לאחר 48 h של תרבויות. mESC יש מתרבים והם עדיין מוגבלים לחלוטין צורות דפוס. (ג – ד) תוצאות אפשריות שאינן אופטימליות, תאים מעטים מאוד לדבוק פלסטיק למעט בפריפריה של השקופית (c) או תאים לדבוק בין דפוסי (d). ראה טבלה 2 עבור מדריך לפתרון בעיות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
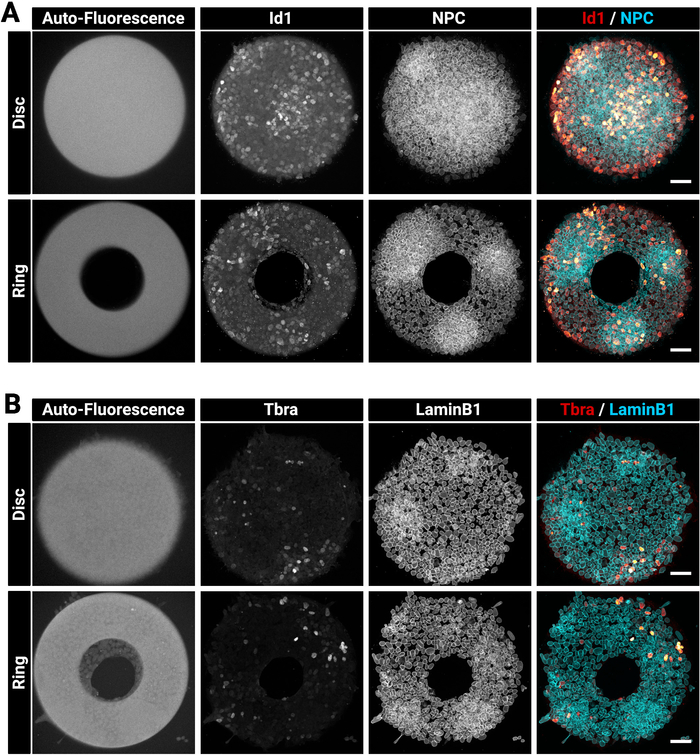
איור 3: הנציגה הייצוגית של המושבות המוכתמים של מושבות האימונוגלוורימיות שגדלו במיקרודפוסים.
נציג מושבות mESC לאחר immunofluorescence (א) Id1 ומורכבות נקבוביות גרעינית או (ב) tbra ו LaminB1. עבור כל כתמים, מושבה גדל על מיקרותבנית דיסק ומושבה גדל על מיקרודפוס טבעת מוצג. ערוצים נפרדים מסופקים כתמונות בקנה מידה אפור. שימו לב לאיתות הבהיר לגבי הזריחה האוטומטית של המיקרו-תבנית (405 לייזר nm). סרגל קנה מידה מייצג 50 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
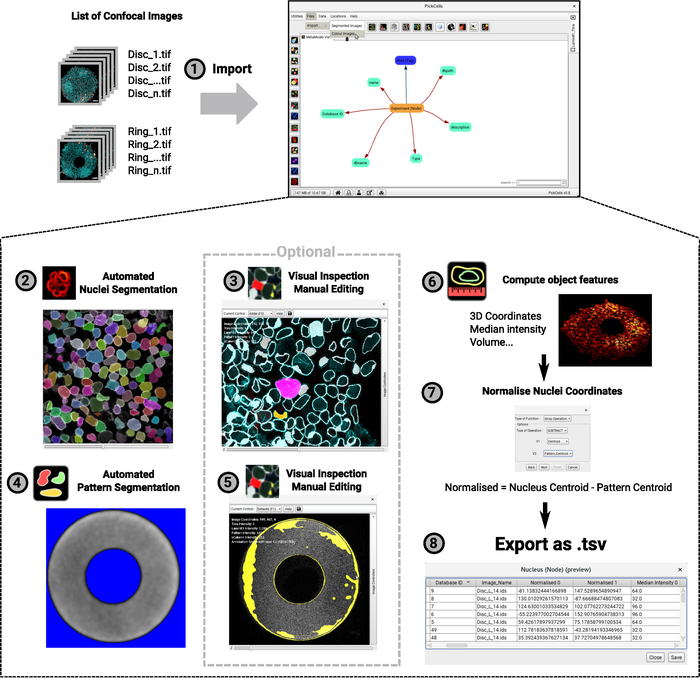
איור 4: תרשים זרימה של הליך ניתוח התמונה. רשימה של תמונות מיקוד תלת-ממד מיובאת לניתוח (1). דוגמה זו מציגה ניסוי עם שתי צורות שונות (דיסקים וצלצולים כמו באיור 2). המוסכמה למתן שמות לתמונות מוצגת בממשק השמאלי והתאים מימין. לאחר מכן, המודול משמש לפלח גרעינים באופן אוטומטי (2). במסך, כל גרעין בודד מוענק צבע ייחודי המציין פילוח מדויק. הקרינה האוטומטית של התבנית מחולקת גם כן, הפעם, באמצעות מודול "פילוח בסיסי" (4). הרקע מופיע באות כחול ולבן, יוגדר כצורת דוגמת המילוי. לאחר מכן, צורות מקוטע נבדקו כדי להבטיח פילוח מדויק, ונערך אם נדרש באמצעות מודול עורך פילוח (3 – 5). צילומי המסך מציגים את קווי המתאר של הצורות שזוהו. הצורות הוורוד והצהוב נערכו. לבסוף, תכונות אובייקטים מחושבות ומיוצאות לקובץ שיעובדו במועד מאוחר יותר ל-R (6 – 7). צילום מסך של מושבה שנוצרה כתצוגה תלת-ממדית מסופקת (6). עבור שלבים 2 עד 6 הסמלים שנמצאו בממשק בתאי הכרטיסים בעת כתיבת מאמר זה ניתנים בסמוך לאינדקס השלבים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
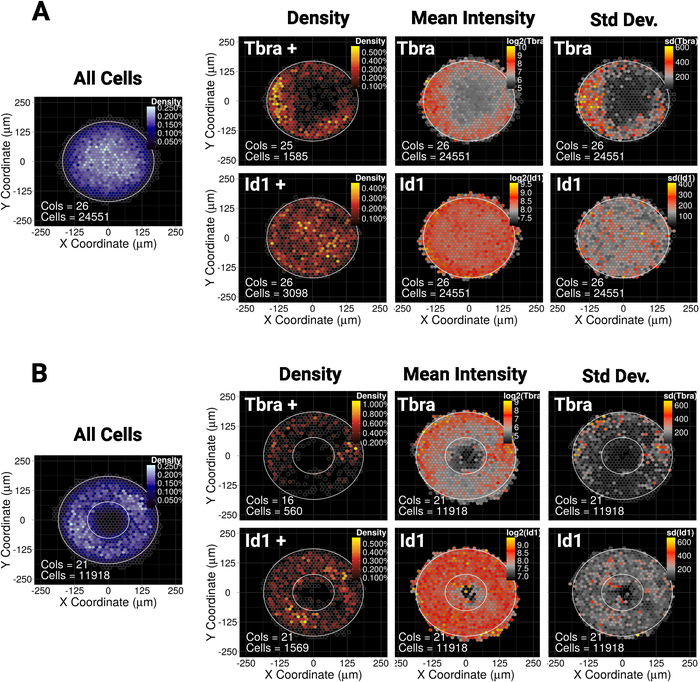
איור 5: התוצאות הייצוגיות לשני גורמי שעתוק וצורות מיקרו-תבניות
מפת מרחבי binned עבור mESC גדל עבור 48 h על (A) דיסק בצורת מיקרותבניות או (ב) מיקרודפוסים בצורת טבעת. עבור כל צורה מיקרותבנית, המפה של צפיפות התא, ללא קשר לפנוטיפ של התא, מוצגת בצד שמאל עם קנה מידה צבע כחול. לאחר מכן עבור כל סמן (tbra בשורה העליונה ו Id1 בשורה התחתונה), שלוש מפות נפרדות מסופקים, משמאל לימין: מפת צפיפות התא של סמן ביטוי תאים בלבד (ניתוח מבוסס הסף), המפה של עוצמת סמן הממוצע (log2) ואת מפת ה סטיית התקן של עוצמת הסמן. הכוונות ניתנות כיחידות זריחה שרירותיות. עבור כל מפה, צורת המיקרו-תבנית ניתנת כמיתאר לבן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| סוג ECM | ג'לטין | פיברוטין | מרתף ממברנה מטריצות | |
| ריכוז | ריכוז ECM | 1 מ"ג/mL | 20 μg/mL | 200 μg/mL |
| Poloxamer 407 ריכוז | 500 μg/mL | 400 μg/mL | 1 מ"ג/mL | |
| נבדק באמצעות | מייסק | כן | כן | כן |
| מפיסק | לא | כן | כן | |
| סרום בינוני חופשי | לא | כן | כן |
טבלה 1: ריכוזים נבדק של poloxamer 407 ו-ECM. טבלה זו מספקת סקירה של ריכוזי ECM ו-poloxamer 407 שבדקנו במעבדה שלנו. עבור כל שילוב ECM/poloxamer 407, סוג התא עבורו הושג בהצלחה מוצג, כמו גם אם התרבות הכילה סרום או לא. mESC = תא גזע מעובריים של העכבר, mEpiSC = תא גזע של העכבר הפיצוץ.
| הליך | תצפית | בעיה אפשרית | פתרון |
| מיקרוזנינג | מצורף לתא נמוך | לא הולם ECM/poloxamer 307 יחס הריכוז | הגברת יחס הריכוז ECM/poloxamer 307 |
| זמן ההחזקה הסלולרית קצר מדי | הגדל את זמן הדגירה כדי לתת מספיק זמן לתאים כדי לדבוק כראוי דפוסים (שלב 3.4). כדי למטב את השלב הזה, בדיקת התאים תחת מיקרוסקופ יכול לעזור לזהות שינוי במבנה התא המציין כי התאים החלו לדבוק. | ||
| שוטף אינטנסיבי מדי (שלב 3.6) | בעת החלפת בינונית, הימנע מליטוף בינוני ישירות על האסימונים. במקום זאת, בעדינות ללטף את המדיום על קירות הבאר במקום | ||
| תאים מתדבקים בין הדפוסים | לא הולם ECM/poloxamer 307 יחס הריכוז | הפחת את יחס הריכוז ECM/poloxamer 407 | |
| זמן הקובץ המצורף לתא ארוך מדי | הקטנת זמן הדגירה (שלב 3.4). | ||
| שוטף לא יעיל (שלב 3.6) | לנענע את הצלחת במרץ הוא בדרך כלל מספיק כדי לנתק את התאים העודפים. עבור סוגי תאים הנוטים לדבוק בשבב בחוזקה, ליטוף ישירות על השבב עשוי לשפר את התוצאה. הגדלת מספר שוטף עשוי גם לעזור, בעיקר כדי להבטיח כי אף תא לא להישאר צף במדיום לאחר שלב זה. | ||
| תאים אינם מתבצע בקפדנות אחר צורת התבנית | סוג תא וגיאומטריית דוגמת מילוי לא תואמות | תכנון/עיצוב מספר גאומטריות/גדלים להוספה לתוך הפושאול כדי להיות מסוגל לבדוק ולזהות את גודל התבנית האופטימלי עבור צורת תבנית וסוג תא מסוים. נא עיין בסעיף ' מגבלות ' בדיון | |
| צילום לא אופטימלי, זה יכול להיות מאובחן על ידי התבוננות החדות של האות הפלואורסצנטית אוטומטי. גבולות הדפוסים צריכים להיראות חדים כמו באיור 2. אם הגבולות של הדפוסים נראים מטושטשים אז את הצעד צילום התמונה צריך להיות משופר. | קצוות דוגמת מילוי מטושטשים מצביעים על כך ששקופית הפלסטיק לא הייתה קרובה מספיק למשטח המסיכה במהלך שלב התאורה. ודא כי החלקים המחזיקים את השקופיות לתוך הפושאול הם אפילו ושלחץ קבוע ומספיק מוחל על ההרכבה במהלך הליך התאורה. | ||
| צביעת | מכתים לא הומוגניות | הדגירה הנוגדן זמן קצר מדי | הגדל את זמן דגירה הנוגדן (עד 24 שעות בטמפרטורת החדר) |
| המושבות ששוטחו במהלך הליך ההרכבה | הר מיקרודוגמת מילוי שקופיות בחדר כגון שאמלידים או cytoo-צ'יימברס לבצע הן מכתים והדמיה ללא צורך בטעינת התאים. זה יהיה טוב יותר לשמר את המושבות 3D-מבנה. | ||
| ניתוק מושבות במהלך הליך ההכתמים | הרטבה של השבב | השאר מספיק בינוני או השתמש ב-2 פיפטות, אחד כדי להסיר את המדיום והשני כדי להוסיף את הפתרון הטרי | |
| . המושבות מופיעות במיקרוסקופ | בזמן שהרכבת את השבב על שקופית המיקרוסקופיה | להיות עדין מאוד כאשר לשאת את האסימונים. לחילופין, הר מיקרודפוסים שקופיות בחדר כגון שללידים או ציטוטוצ'יימברס כדי לבצע הן את העיבוד החיסוני והן את ההדמיה ללא צורך בטעינת התאים. זה גם שומר על מבנה האולטרהמושבה. |
טבלה 2: מדריך לפתרון בעיות. טבלה זו מספקת סקירה של תוצאות משנה מיטביות אפשריות. המקורות הפוטנציאליים לבעיות מפורטים גם יחד עם פתרונות מומלצים.
Discussion
כאן אנו מתארים שיטה לניתוח מתהווה בתרבויות של תאים. גישה מיקרופינינג פשוטה משמשת לסטנדרטיזציה של הצורה והגודל של מושבות התא, ואנו מציגים כלי ניתוח תמונה וסקריפטים R המאפשרים איתור וכימות של דפוסים בתוך המושבות האלה.
הצינור שאנו מציעים דומה במידה מסוימת עם שיטה שפורסמה קודם לכן31 שבו המחברים מתמקדים בתנאי התרבות, באמצעות מיקרודפוסים זמינים מסחרית, כדי לקבל היווצרות שכבת הנבט להתרבות במושבות ESC ל חקר של אירועים מוקדמים בתחומי החוץ. המטרה שלנו היא ממוקדת יותר כלפי מתן צינור הניתן להכליל לגילוי של תבנית היווצרות מבחנה שבה הארגון הקולקטיבי של התאים עשוי להיות גלוי רק לאחר ניתוח סטטיסטי. מסיבה זו, אנו מספקים זרימת עבודה חזקה התמונה המאפשרת זיהוי מדויק וניתוח של מיקום גרעיני בחלל תלת-ממדי על מושבות מרובות (ראה גם ' יתרון ומגבלות של שיטת זיהוי דוגמת מילוי ' בסעיף זה דיון). כמו כן החלטנו לפתח גישה פשוטה בתוך הבית, המציעה חלופה גמישה וזולה יותר לפתרונות מסחריים בטווח הארוך, שאנו מקווים שיהיו שימושיים לקהילה.
לבסוף, אנו מודעים לכך שבמהלך התיקון של כתב היד הזה, חבילה חדשה לניתוח המיון באופן מתורבת בדומה לסקריפטים שלנו R שוחררה32. חבילה חדשה זו מקבלת טבלאות של תכונות תא כקלט הניתן להשגה מפלטפורמות הדמיה גבוהה של תפוקה. אנו מאמינים כי הטבלה של תכונות גרעין שנוצרו בשלב 7 של הפרוטוקול שלנו יכול עקרונית לשמש כקלט לחבילה חדשה זו למרות שלא בדקנו את האפשרות הזאת בעצמנו.
הסתגלות של השיטה לסוגי תאים אחרים וגאומטריות מושבה
אנו מציגים גישה זו בהקשר של לימוד הופעתה של גורמים שעתוק מזועורי בתרבויות התאים החזקים ביותר בנוכחות של סרום. עם זאת, השיטה ניתנת להתאמה בקלות לסוגי תאים אחרים ולתרבויות ללא סרום למרות שייתכן שיהיה צורך למטב את ECM/poloxamer 407 ריכוזי (ראה טבלה 1 עבור ריכוזי נבדק ושולחן 2 עבור מדריך לפתרון בעיות). ניתן גם להתאים את השיטה לגדלים גדולים או קטנים יותר של מיקרודפוסים ולמגוון רחב של צורות בהתאם לצורכי המשתמש. עם זאת, בזמן שאתה מבסס את השיטה, חשוב להיות מודע לכך שלא כל שילובי הצורה/סוג התא הם אופטימליים. לדוגמה, רמות גבוהות של mesc express של E-קדהרין33,34 המאפשרות לתאים אלה ליצור מבנים קיבוציים המשתרעים על פני אזורים נטולי ecm. תאים אלה אינם מתבצע בקפדנות גאומטריות עם זוויות חדות או הכוללות חורים קטנים בתבנית. הודעה לדוגמה כי על הטבעת של איור 3B, התאים נמצאים בתהליך של הנכבש האזור המרכזי. בידינו, אזור מרכזי קטן יותר, לא כפה את הכוחות ליצור מושבות בצורת טבעת. לכן מומלץ מאוד לכלול מגוון של גיאומטריות בזמן עיצוב הפושאול כדי להיות מסוגל לבחון ולזהות את הגדלים והעקמומיות האופטימליים שיתאימו לסוג התא של בחירה.
גורם חשוב נוסף שיש לקחת בחשבון הוא אורך הניסוי ושיעור ההתפשטות של התאים. עבור כמה סוגי תאים מתרבים במהירות (כולל תאים pluriפוטנטי) זה יכול להיות קשה לשמור על התאים על מיקרודפוסים במשך ימים רבים (עבור mESC שלושה ימים הוא מקסימום). כמו כן, זריעת תאים על מיקרודפוסים לא תמיד מתרחשת בצורה אופטימלית עבור כל מושבה, ולכן מומלץ לזרע עודף של מושבות כדי לקבל רזרבי.
היתרון והמגבלות של שיטת זיהוי התבנית
יתרון אחד מסוים של השיטה הוא היכולת לזהות דפוסי "ממוצעים" על ידי שילוב תוצאות ניתוח תמונה ממספר מושבות שכפול (איור 5). זה יכול לחשוף את האירועים שאינם גלויים מתוך בדיקה של מושבות נפרדות. חסרון בגישה זו של ' חישוב ממוצע ' הוא שהוא עלול להחמיץ סוגים מסוימים של דפוסים חוזרים, למשל כתמים קטנים או פסים צרים. עם זאת, סוגי דפוס אלה עשויים להתגלות במקום זאת עם שילוב של גדלים שנבחרו בקפידה גודל8. כמו כן, צינור ניתוח התמונה המתואר כאן מספק נתונים כמותיים בשני תאים בודדים ורזולוציית המושבה המציעה את האפשרות לחקור את רמת ההשתנות הבין-מושבה (איור 5) או לבצע ניתוח שכנים במספר מאזניים10.
יתרון חשוב נוסף של השיטה בממוצע הוא שהוא מציע את ההזדמנות למפות את המיקום האידיאלי של סמנים רבים מבלי להיות מוגבל על ידי fluorophores זמין של ערוצי זיהוי. אכן, למרות שאנו עושים שימוש רק בשני סמנים של בידול בעבודה המוצגת כאן, היכולת לתקנן מושבות ולחלץ "ממוצעים" דפוסים מאפשר להשוות את מפות ההפצה מקבוצות שונות של מושבות יחד על מנת לחשוף את הקשרים המרחביים הללו של סמנים זה לזה.
יתר על כן, למרות ההתמקדות שלנו כאן היה ללמוד סמנים של בידול, שיטת הניתוח ניתן להרחיב כדי ללמוד תהליכים ביולוגיים אחרים שעבורם סמנים גרעיניים זמינים. לדוגמה מיקרופאנינג של קו תא המכיל מחוון מחזור תאים פלואורסצנטית35 (fucci) תאפשר ללמוד כיצד גיאומטריה רמת המושבה עלולה להשפיע על אירועי מחזור התא בקבוצה.
כיוונים לעתיד
השיטה היא קלה לניתוח תמונה תפוקה בינונית, עם זאת, רכישת תמונה אינה אוטומטית לחלוטין והוא יכול להיות הגבלת ניסויים גדולים מאוד. הסדרים קבועים של מושבות צריך לאפשר ליצור באופן מלא שגרות רכישה מלאה דומה למה שפותחה עבור תא בודד בממוצע20. עם זאת, מכיוון שגודל השדה הנדרש לדימוי המושבה גדול, ייתכן שהוא זקוק לmosaicking, ומכיוון שמושבות הן תלת-ממדיות, רצוי מאוד להפחית הן את גודל הנתונים והן את זמן הרכישה באמצעות הדמיה של מושבות רלוונטיות בלבד. לכן, מאמצים עתידיים יכולים להיות מוקדשים לפתח ' אינטליגנטי ' מיקרוסקופ מסוגל לזהות מושבות רלוונטיות ולהתאים קואורדינטות הדמיה לכל מדגם. זה לא רק להפחית את הזמן והמאמץ אלא גם למנוע הטיות המפעיל פוטנציאליים.
גם צינורות הניתוח עשויים להיות יעילים יותר על-ידי הפחתת מספר הצעדים שהמשתמש צריך לנקוט. יש לנו תוכניות לבנות מנגנון בניית צינור ולשלב R ישירות לתוך התוכנה שלנו (ראה גם בעיות בפיתאים-api 3 ו-כדוריות-rjava 1 בגשש הנושא של מאגרי הקוד שלנו [https://framagit.org/groups/pickcellslab/-/issues]). האוטומציה המלאה של הליך הניתוח תפחית את הזמן והמאמץ ותגביל את שגיאות המשתמש הפוטנציאליות.
לבסוף, אנו מודעים לכך ששיטת הניתוח שלנו עדיין לא לוכד במלואה את האופי הדינאמי של הפענוח התאי. מידע דינמי מוגבל ניתן לחילוץ על ידי בחינת סדרת זמן של תמונות תמונה8,10,36. עם זאת, להיות מסוגל להקליט את ההיסטוריה של אוכלוסיית התאים הוא מאוד רצוי אם אנחנו רוצים להבין טוב יותר איך מתגלה הסדר. מגבלה אחת היא כי מעקב מדויק של תאים בודדים באוכלוסיית תא צפופה 3D נשאר משימה מאתגרת מאוד37. שיטת זיהוי התאים שלנו משתמשת במעטפה הגרעינית ומבצעת היטב במיוחד על אוכלוסיית תאים צפופים וחופפים28. כתבים חיים של המעטפה הגרעינית הם זמינים28,38 ואחד היתרונות של הטכניקה מיקרומניפולציה היא שזה יכול לשמש כדי למנוע את התאים מחוץ לשדה הראייה במהלך הדמיה ארוכת טווח. בסך הכל, אנחנו בטוחים כי מעקב אוטומטי של תאים יהיה השגה באמצעות שילוב של כלים שהוקמו לאחרונה28,39,40 וכי זה צריך להביא תובנות חדשות לתוך היסוד עקרונות של ארגון-עצמי.
Disclosures
למחברים אין מה לחשוף
Acknowledgements
העבודה הזאת ממומנת על ידי מלגת סר הנרי ברוך פוסט-דוקטורט (WT100133 to G.B.), מלגת בכירה מבית-הנאמנות (WT103789AIA ל-ס), וברוכים ה לאמון ברוך הבא (108906/Z/15/Z עד D.W.). אנחנו גם אסירי תודה ד ר מנואל Thery עבור עצתו על התאמת הטכניקה photopatterning.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
References
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878(2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939(2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- Micropatterning in cell biology. Pt. A. , Elsevier. Amsterdam. (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), Dayton, Ohio. 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366(2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438(2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514(2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872(2018).
- Weiswald, L. -B., Guinebretière, J. -M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106(2010).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. Available from: http://www.R-project.org/ (2013).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384(2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839(2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141(2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved