Method Article
Cartographier l'organisation spatiale émergente des cellules mammifères à l'aide de micromodèles et d'imagerie quantitative
Dans cet article
Résumé
La méthode présentée ici utilise le micromodèle avec l'imagerie quantitative pour révéler l'organisation spatiale au sein des cultures mammifères. La technique est facile à établir dans un laboratoire standard de biologie cellulaire et offre un système tractable pour étudier le modelage in vitro.
Résumé
Un objectif fondamental en biologie est de comprendre comment les modèles émergent au cours du développement. Plusieurs groupes ont montré que le modelage peut être réalisé in vitro lorsque les cellules souches sont confinées spatialement sur des micromodèles, mettant ainsi en place des modèles expérimentaux qui offrent des possibilités uniques d'identifier, in vitro, les principes fondamentaux de la biologie organisation.
Ici, nous décrivons notre propre mise en œuvre de la méthodologie. Nous avons adapté une technique de photo-modèle pour réduire le besoin d'équipement spécialisé pour faciliter l'établissement de la méthode dans un laboratoire standard de biologie cellulaire. Nous avons également développé un cadre d'analyse d'image gratuit, open-source et facile à installer afin de mesurer précisément le positionnement préférentiel des sous-populations de cellules dans des colonies de formes et de tailles standard. Cette méthode permet de révéler l'existence d'événements de modelage même dans des populations apparemment désorganisées de cellules. La technique fournit des informations quantitatives et peut être utilisée pour découpler les influences de l'environnement (p. ex., indices physiques ou signalisation endogène), sur un processus de modelage donné.
Introduction
Dans les systèmes mammifères, le modelage est une propriété émergente du comportement collectif des cellules et ainsi, les modèles peuvent se former in vitro si des indices appropriés sont fournis aux cellules1,2,3,4, 5 Annonces , 6. Une façon de révéler la capacité intrinsèque des cellules à s'auto-organiser in vitro est de forcer les cellules à former des groupes/colonies d'une forme et d'une taille définies7,8,9,10 . Une technique qui permet cela est micropatterning11. Le micro-patterning permet de définir avec précision l'emplacement où les molécules de matrice extracellulaire (ECM) sont déposées sur une surface. Ceci, à son tour dicte où les cellules peuvent adhérer et contrôle donc la façon dont les cellules s'organisent spatialement.
Le micropatterning est une technique avec de nombreuses applications, par exemple, le micropatterning permet la normalisation des conditions initiales avant la différenciation12. Fait important, le micro-modèle permet de contrôler facilement la taille, la forme et l'espacement des colonies cellulaires et cette propriété peut être utilisée pour concevoir des expériences visant à interroger la réponse collective des cellules à la morphogène ou aux indices physiques7 , 8 Annonces , 10 Ans et plus , 13 (en) , 14 (en) , 15 Annonces , 16 Annonces , 17.
Plusieurs méthodes de micro-patterning ont été développées11. Les techniques de photopatterning sont peut-être les méthodes les plus faciles à établir18. Ces approches ont également l'avantage de la précision car elles peuvent être utilisées pour contrôler la forme des cellules simples18,19,20. Cependant, ils ont également besoin d'équipement spécialisé coûteux, y compris un spin coater, une chambre à plasma et un UVO (UV-Ozone) nettoyant qui ne sont généralement pas facilement disponibles dans les laboratoires de biologie standard. Pour faciliter l'adoption de la technique, nous avons adapté le protocole pour ne nécessiter que la lampe UVO. Nous commençons à partir de diapositives en plastique disponibles dans le commerce qui peuvent être coupés avec des ciseaux ou avec un poinçon de trou au format désiré.
Une utilité importante des micromodèles est la capacité de normaliser les colonies afin de comparer les colonies individuelles à travers de multiples répliques. Cela permet de se demander dans quelle mesure la formation des motifs au sein de ces colonies est reproductible, et d'explorer les facteurs qui influencent la robustesse du processus de modelage. Fait important, la quantification des modèles « moyens » dans plusieurs colonies normalisées peut également révéler des processus de modelage qui ne seraient pas apparents autrement. L'avantage de pouvoir quantifier le modelage sur des colonies normalisées dépend de la mesure de mesurer avec précision l'expression des protéines, idéalement au niveau des cellules uniques. Cependant, les cellules sur les micromodèles sont souvent serrées, ce qui les rend difficiles à segmenter avec une grande précision. Les cellules s'organisent souvent en trois dimensions plutôt qu'en deux dimensions, et il peut être difficile de détecter et de préserver l'information tridimensionnelle (3D) pendant la segmentation. Une fois que les cellules ont été segmentées avec succès, des méthodes de calcul sont nécessaires pour extraire l'information de modèle des ensembles de données résultants.
Nous avons développé des outils de segmentation et d'analyse d'images pour aider à surmonter ces problèmes. Cette méthode d'analyse n'utilise que des logiciels libres et open-source et ne nécessite pas de connaissance de la ligne de commande ou de la programmation pour la mise en œuvre. Pour illustrer la méthode ici, nous utilisons des cellules de tige embryonnaire de souris (MES) qui expriment spontanément un marqueur de brachyury de différenciation tôt (Tbra)21,22. Bien qu'aucun arrangement spatial apparent ne soit visuellement détectable, la méthode permet la création d'une carte du positionnement préférentiel des cellules Tdans les colonies. Nous montrons également que le modelage de Tbra contraste avec l'absence d'une localisation préférentielle des cellules exprimant Id1, une lecture directe de la protéine morphogénétique osseuse (BMP) voie23. Nous discutons également des limites actuelles de la méthode et de la façon dont cette technique peut être adaptée à d'autres systèmes expérimentaux.
Protocole
REMARQUE : Un aperçu de la méthode est fourni à la figure 1.
1. Conception de masque
- Concevoir le photomask selon les lignes directrices décrites dans Azioune et al.18. Consultez le Tableau des matériaux pour une référence au fabricant de logiciels et de masques utilisé pour cette étude.
REMARQUE : Plusieurs géométries, tailles ou espacements entre les formes peuvent être créés sur un masque. La lampe UV peut s'adapter à un photomasque de 15 cm qui peut contenir jusqu'à 49 conceptions différentes (en supposant 2 cm x 2 cm de copeaux).
2. Procédure de fabrication de micropattern
- Préparer les matériaux nécessaires.
- Préparer une solution de 0,1 % de poloxamer 407 (10 mg pour 10 ml) en salin tamponné par phosphate (PBS) et laisser sur un shaker à température ambiante. Le poloxamer 407 prendra environ 20 min pour se dissoudre.
- Poser un film de laboratoire (voir la Table des Matériaux) au fond d'un plat Petri carré de 10 cm. Ceci sera utilisé comme chambre pour le dépôt de matrice.
- Nettoyer la surface du photomask, d'abord avec 100% d'acétone, puis avec 100% isopropanol et enfin avec ddH2O. Si possible, séchez le photomask à l'air ou séchez le masque avec du papier essuie-tout propre.
- Préparer un morceau de plastique carré, rigide et opaque de la même taille que le photomask (plus tard appelé «titulaire»).
REMARQUE : Ceci sera utilisé pour maintenir des couvertures en plastique en contact avec le photomask pendant l'étape d'illumination. - Allumez la lampe UVO et exécutez un éclairage réchauffant pendant 10 min.
- Créez des puces photopatterned.
REMARQUE: Il est possible d'adapter la procédure pour créer des puces de n'importe quelle taille désirée. Pour plus de simplicité, nous décrivons ici la procédure pour générer une puce micropatterned ronde de 12 mm.- À l'aide d'un poinçon trou de 12 mm, couper les glissières en plastique hydrophobes pour créer des résilles rondes de 12 mm et les placer dans un nouveau plat Petri propre.
CAUTION: Utilisez des gants en tout temps pour éviter tout contact avec la peau avec la surface du plastique car cela peut endommager le traitement de surface. - Retirez soigneusement le film protecteur des couvercles à l'œil plit.
REMARQUE : Évitez d'endommager la surface plastique, car cela peut influencer le placement des cellules sur la puce pendant la procédure d'ensemencement (section 3). - Placez le photomasque sur une surface propre et stable (p. ex. boîte photomasque), côté chrome vers le haut, et ajoutez une goutte de 2 ll de ddH2O à la position de la conception de la puce désirée.
- Poser un slip sur la goutte de ddH2O et presser doucement.
REMARQUE : Assurez-vous que le côté en plastique qui fait face au photomasque est le côté qui a été protégé par le film qui a été enlevé dans l'étape antérieure. - Placez le support sur les lames en plastique et fixez soigneusement ce sandwich avec des pinces afin de maintenir les morceaux en plastique en contact avec le photomask.
REMARQUE : Placez les pinces aussi près que possible de l'emplacement des lames en plastique afin de s'assurer que les lames en plastique sont parfaitement maintenues en contact avec la surface du masque photomasque. - Placez l'assemblage dans la lampe UVO à environ 2 cm de la source lumineuse et illuminez pendant 10 min.
REMARQUE : La puissance de la lumière est estimée à 6 mW/cm2 à 254 nm de longueur d'onde lorsque la puce est placée à une distance de 2 cm de la source. - Tenez le sandwich avec le photomasque au fond et retirez soigneusement les pinces tout en maintenant la pression d'une main pour empêcher les diapositives de se déplacer tout en démontant le sandwich. Retirez le support, en veillant à ce que tous les morceaux de plastique sont toujours sur le masque et non collés au support.
- Ajouter ddH2O sur le dessus des jetons et détacher délicatement les copeaux du photomask.
REMARQUE : Si la puce en plastique est collée au photomasque, détachez la puce à l'aide d'une pointe de pipette en plastique pour pousser la puce tout en tenant des pinces légèrement au-dessus de la puce au cas où la puce se détache soudainement. - Enfin, placez les puces photopatterned dans la chambre de déposition de matrice.
REMARQUE : Assurez-vous que le côté éclairé de la puce est orienté vers le haut.
- À l'aide d'un poinçon trou de 12 mm, couper les glissières en plastique hydrophobes pour créer des résilles rondes de 12 mm et les placer dans un nouveau plat Petri propre.
- Déposez la matrice.
REMARQUE : Toute la procédure dans cette section devrait être exécutée dans une hotte de culture de tissu.- Filtrer la solution poloxamer 407 à l'intermédiaire d'un filtre en polyéthersulfone (PES) de 0,22 m.
- Préparer la solution de revêtement ECM en mélangeant 500 g/mL de poloxamer filtré stérile 407 et 1 mg/ml de gélatine.
REMARQUE : Voir également le tableau 1 pour obtenir des informations supplémentaires sur d'autres molécules d'ECM possibles. - Ajouter 200 l de la solution de revêtement sur chaque puce illuminée. Le film de laboratoire empêchera la goutte de tomber à l'extérieur de la puce.
- Ajouter un plat Petri de 3 cm rempli de ddH2O afin de limiter l'évaporation et le placer avec la puce à 4 oC pendant la nuit.
3. Procédure d'ensemencement
REMARQUE : Les étapes décrites ci-dessous ont été optimisées pour les cellules souches embryonnaires de souris CGR8 (MESC)24 à l'aide du milieu mESC standard (voir aussi le Tableau des matériaux). Cependant, il est possible en principe d'adapter la procédure pour n'importe quel type de cellule. Notez également que la culture cellulaire conventionnelle des cellules souches embryonnaires de souris n'est pas décrite ici car une documentation étendue peut être trouvée ailleurs25.
- Aspirer la solution de revêtement et incuber les copeaux deux fois pendant au moins 5 min avec du PBS stérile.
- Pendant ce temps, préparer une suspension cellulaire de 5,5 x 105 cellules/mL dans un milieu chaud.
- Pipet 200 l de suspension cellulaire sur chaque puce (100 000 cellules/cm2).
- Fermer la chambre d'ensemencement et laisser les cellules adhérer pendant 1 h dans l'incubateur.
- Après 1 h, remplir les puits d'une plaque multipuits (4-bien ou 24-bien assiette selon le nombre de copeaux) avec 500 l /puits de milieu chaud et transférer les copeaux dans la plaque avec une pince stérile.
- Secouez la plaque vigoureusement afin de détacher les cellules non adhérentes. Aspirer le milieu et remplacer immédiatement par un milieu frais et chaud. Vérifiez sous le microscope si les motifs sont visibles (Figure 2a).
REMARQUE : Le temps d'adhérence peut devoir être optimisé lors de l'utilisation de lignées cellulaires autres que le MESC ou d'autres protéines matricielles (voir aussi tableau 2). - Répétez cette étape jusqu'à ce que les motifs deviennent clairement visibles comme le montre la figure 2a.
REMARQUE : Cette étape est critique et détermine le succès de la procédure. Une procédure de lavage trop intense peut détacher les cellules, en revanche un lavage insuffisant peut entraîner le maintien des cellules entre les modèles (Figure 2c,d).
4. Fixation
REMARQUE: Après 48 h en culture, les cellules doivent former des colonies denses qui suivent rigoureusement la forme des motifs (comme le montre la figure 2b).
- En laissant les copeaux dans l'assiette, retirer 90 % du milieu, en laissant juste assez de milieu pour empêcher les croustilles de sécher.
REMARQUE : Il est important que la puce ne sèche jamais pour éviter les artefacts de coloration et pour empêcher le détachement cellulaire de la surface. En raison de l'hydrophobicité de la surface de la puce entre les modèles adhésifs, la puce peut avoir tendance à se démouiller. À ce stade, le fixatif peut faire se détacher de grandes colonies en forme de dôme de la puce. Les lavages doivent être très doux, idéalement exécutés par le liquide de pipetting sur le côté du puits et pas directement sur la puce. - Ajouter au moins 500 l de solution de fixation à base de paraformaldéhyde (PFA) par puits et incuber pendant 10 min.
REMARQUE : Si les colonies semblent particulièrement épaisses (plus de 5 couches cellulaires), il peut être nécessaire d'ajuster le temps de fixation à 20 min. - Après fixation, laver 3 fois avec la solution de lavage (PBS avec 0.01% poloxamer 407). Un lavage supplémentaire à l'aide de 50 m NH4Cl dilué dans la solution de lavage peut être intercalé pour éteindre l'activité résiduelle de liaison transversale PFA.
- Incuber les échantillons pendant au moins 30 min dans la solution de blocage.
REMARQUE : À ce stade, les échantillons peuvent être conservés à 4 oC pendant environ une semaine avant la coloration. Si c'est le cas, sceller la plaque avec du film de laboratoire pour éviter l'évaporation.
5. Immunostaining
- Préparer une chambre de coloration en plaçant une feuille de film de laboratoire au fond d'un plat Petri carré de 10 cm.
- Préparer des solutions d'anticorps (Voir tableau 3 pour une liste d'anticorps et de dilutions utilisées dans cet article).
- Placez la puce dans la chambre de coloration avec le côté soutenant les cellules orientées vers le haut et ajoutez immédiatement 100 L de solution d'anticorps primaire sur la puce.
CAUTION: À ce stade, les puces ne devraient pas facilement démouiller comme dans l'étape 4.1. Cependant, il faut quand même faire attention car il est important que les copeaux ne sèchent pas. Si plusieurs puces doivent être traitées, appliquez l'étape 5.3 à chaque puce de façon séquentielle. - Incuber pendant 1 h sur une plate-forme rotative à température ambiante.
REMARQUE : Si les cellules ont formé de grandes structures 3D, un temps d'incubation plus long peut être nécessaire pour permettre la coloration uniforme de l'échantillon. Le temps d'incubation peut être augmenté jusqu'à 24 h. Cependant, la chambre de coloration doit contenir un plat de 3 cm rempli d'eau et la chambre de coloration doit être scellée avec du film de laboratoire pour empêcher l'évaporation. - Transférer les croustilles dans une assiette multipuits fraîche et laver 3 fois avec la solution de lavage.
- Effectuer l'incubation avec des anticorps secondaires tels que décrits à l'étape 5.3 et 5.4.
- Montez la puce sur une diapositive de microscopie à l'aide de 20 l de n'importe quel support de montage standard (p. ex. Mowiol).
6. Imagerie
REMARQUE : L'imagerie peut être réalisée sur un microscope confocal standard. Ici, nous ne fournissons que des recommandations pour assurer une qualité d'image qui sera suffisante pour l'analyse quantitative ultérieure.
CAUTION : Pour éviter tout biais d'opérateur, les colonies à l'image ne doivent être choisies qu'à l'aide du signal de l'enveloppe nucléaire (pour voir si une colonie suit correctement la forme du modèle). Évitez de vérifier le signal des marqueurs d'intérêt, sauf lors de l'ajustement des réglages du microscope.
- Assurez-vous que la profondeur du bit d'acquisition est de 12 ou 16 bits.
- Identifiez les paramètres appropriés pour maximiser la plage dynamique de chaque canal d'image. En particulier, évitez les coupures d'image.
- Inclure un canal pour imager l'autofluorescence du micromotif (voir Figure 3).
- Ajuster la taille de l'image et le facteur de zoom pour obtenir des tailles de voxel allant de 0,1 à 0,6 m dans les axes x et y et allant de 0,2 à 2 m dans l'axe Z.
REMARQUE : Par exemple, dans cette étude, nous avons utilisé un microscope confocal à balayage inversé avec un objectif 40x (ouverture numérique égale à 1,3), une taille d'image de 1024 x 1024 pixels sans zoom numérique et une taille z-étape de 0,5 m. Il en est résulté une taille de voxel de 0,38 m x 0,38 m x 0,5 m. - Pour chaque colonie, définissez la position minimale et maximale le long de l'axe Z pour s'assurer que toute la colonie est acquise. Au moins un avion avec un signal faible ou nul doit être inclus au-dessous et au-dessus de la colonie.
- Assurez-vous que les orientations z-stack sont acquises de façon cohérente (soit toujours de haut en bas ou toujours de bas en haut)
- Ajuster la vitesse de numérisation, la résolution de l'image, la moyenne des images et les gains de détecteur pour identifier un optimum entre la qualité de l'image et le temps d'imagerie. À titre indicatif, le temps d'imagerie d'une colonie, comme le montre la figure 3, était d'environ 2 à 3 min. Effectuer l'acquisition d'image.
CAUTION: Toutes les images, pour être comparables, doivent être acquises sur le même microscope avec les mêmes paramètres d'objectif et d'acquisition. - À la fin de l'acquisition, enregistrez toutes les images et attribuez une convention de nommage unique pour identifier la condition expérimentale que chaque image représente.
REMARQUE : Voir la figure 4 à titre d'exemple, cette convention sera utilisée plus tard au cours de la procédure d'analyse. Notez que les images peuvent être enregistrées dans n'importe quel format pris en charge par BioFormats 26. Si les colonies sont plus grandes que le champ de vision, le plugin de couture de ImageJ peut être utilisé27. Notez également qu'en cas de couture, la correction de rouleau d'éclairage peut être nécessaire.
7. Analyse d'image
REMARQUE: Les spécifications informatiques recommandées pour cette procédure sont: 16 Go de RAM, un processeur multi-cœur 3,33 GHz, et au moins 50 Go d'espace disque (ou plus en fonction du nombre de puces qui ont été photographiés). Le logiciel a été testé sur Linux, Windows et MacOS. PickCells est une application d'analyse d'images multiplateforme avec une interface utilisateur graphique dédiée à l'analyse de l'organisation collective des cellules dans des images multidimensionnelles complexes (Blin et al, en préparation). Notez que plus d'informations sur PickCells ainsi que la documentation pour les modules spécifiques mentionnés ici peuvent être trouvés en ligne: https://pickcellslab.frama.io/docs/. Notez également que l'interface est sujette à changement que nous continuons à améliorer le logiciel. Si l'interface diffère de ce qui est indiqué dans la figure ou la vidéo, veuillez consulter le manuel en ligne.
- Installez et exécutez PickCells en suivant la documentation disponible en ligne.
- Importer des images et vérifier l'exactitude des informations fournies (Figure 4-1).
- Documentez le nom de chaque canal.
- Les noyaux de segment en fonction du signal de l'enveloppe nucléaire à l'aide du module Nessys28 (figure4-2) et fournissent un préfixe (« noyaux » par exemple) qui sera utilisé pour nommer les images segmentées générées.
REMARQUE : Des documentations sur l'utilisation et les ajustements de paramètres peuvent être trouvées à https://framagit.org/pickcellslab/nessys. - Inspecter et modifier les segmentations si nécessaire, à l'aide du module d'éditeur de segmentation (Figure 4-3)
REMARQUE : Si, pour quelque raison que ce soit, le processus de segmentation n'a pas fourni de résultats satisfaisants, supprimez manuellement les images dans le dossier de base de données et supprimez également le nœud « résultat de segmentation » dans la vue MetaModel. Ensuite, répétez l'étape 7.4 et 7.5. Si la segmentation d'un petit sous-ensemble d'images n'a pas donné de résultats satisfaisants, utilisez l'application autonome Nessys (voir le lien en 7.4), essayez la segmentation des « images défectueuses » et remplacez le fichier correspondant dans le dossier de base de données). - Segmenter le signal d'autofluorescence du modèle à l'aide du module de segmentation de base (Figure 4-4)
- Fournir un préfixe (" modèle " par exemple) qui sera utilisé pour nommer les images segmentées générées.
- Sélectionnez le canal contenant le signal d'autofluorescence.
- Appliquer la réduction du bruit; généralement à l'aide d'un filtre gaussien avec une taille de noyau de 10 x 10 x 0,5 voxels donne des résultats satisfaisants.
- Définir le seuil inférieur de sorte que l'arrière-plan apparaît en bleu tandis que le premier plan apparaît blanc. Fixer également le seuil supérieur à sa valeur maximale pour éviter que des intensités élevées ne soient exclues du résultat final (zones rouges).
- Sélectionnez sauter pour la dernière étape.
- Cliquez sur finition et attendez que toutes les images soient traitées.
- En ce qui concerne les noyaux, les résultats de segmentation peuvent maintenant être inspectés visuellement et corrigés si nécessaire à l'aide du module d'éditeur de segmentation (Figure 4-5).
- Créez des objets noyaux et calculez les caractéristiques de base de l'objet.
- Lancer le module de fonctionnalités intrinsèques à partir de la barre de tâche à gauche de l'interface principale (Figure 4-6).
- Fermez les panneaux Ellipsoid Fitter et Surface Extractor pour ne garder que le panneau Caractéristiques de base ouvert.
- Choisissez Nucleus comme type d'objet et choisissez le préfixe donné à l'étape 7.4 pour les « images segmentées ».
- Appuyez sur Compute et attendez que toutes les images aient été traitées.
REMARQUE : Après cette étape, il ne sera plus possible d'éditer à nouveau les segmentations des noyaux.
- Créez des objets de motif et calculez les fonctionnalités de base de l'objet. Répétez les étapes 7.8.1 à 7.8.4, seulement cette fois choisissez le type personnalisé comme type d'objet et le préfixe donné dans l'étape 7.6.1 pour les images segmentées.
REMARQUE : Après cette étape, il ne sera pas possible de modifier à nouveau les segmentations de motifs. - Stockez le nom de l'image à laquelle chaque noyau appartient en tant qu'attribut de noyau.
- Cliquez sur Les données de l'actualité et sélectionnez Nucleus dans le dialogue popup et cliquez sur Ok.
- Sélectionnez Collecter des données à partir d'autres objets connectés au nœud et cliquez sur Suivant.
- Dans le panneau de gauche, sélectionnez Image, puis double cliquez sur la marque d'interrogation sous le drapeau Finish dans le panneau de définition du chemin pour définir le nœud d'image comme cible du chemin.
- Élargissez le volet Attributs disponibles sur le panneau de gauche et sélectionnez l'attribut de nom.
- Élargissez le volet d'opération de réduction et sélectionnez Get One, puis cliquez sur le bouton de changement et cliquez sur Suivant.
- Tapez "Nom d'image", appuyez sur la touche de l'onglet et cliquez sur OK.
- Créez un attribut de « coordonnées normalisées » dans les objets noyaux (figure 4-7).
- Adapter les étapes 7.10.1 à 7.10.6 pour stocker les coordonnées du modèle centroïde comme attribut de noyau. Nommez ce nouvel attribut "Pattern Coordinate".
- Ensuite, cliquez sur Les données del'équipe , sélectionnez Nucleus et cliquez sur Ok.
- Sélectionnez Définir une fonction entre les vecteurs spatiaux ou directionnels du nœud et cliquez sur Suivant.
- Pour le type de fonction sélectionnez Array Operation, pour V1 sélectionnez Item Vector, puis Centroid, et pour V2 sélectionnez Item Vector, puis Pattern Coordinate.
- Cliquez ensuite, Tapez "Normalised Coordinate" dans le champ Nom et cliquez sur Finish.
- Exportez les données vers un fichier de valeur séparé d'onglet.
8. Analyse R
- Téléchargez et installez Rstudio.
REMARQUE : Des informations logicielles et des liens de téléchargement sont disponibles à https://www.rstudio.com/. - Téléchargez les scripts R requis pour cette analyse.
REMARQUE : Les scripts peuvent être téléchargés à partir du référentiel GitLab : https://framagit.org/pickcellslab/hexmapr. - Ouvrez Rstudio.
REMARQUE : Si vous exécutez les scripts pour la première fois, installez les paquets R requis (ggplot2 et balances). - De Rstudio, ouvrez le binnedmap-template. R script.
- Définir l'annuaire de travail à l'emplacement du fichier source.
- Suivez les instructions fournies dans le script pour adapter le script à un jeu de données donné afin d'obtenir des cartes spatiales comme indiqué dans la figure 5.
- Exécutez le script pour générer des cartes de densité.
Résultats
La méthode de photo-modèle décrite ici permet d'organiser précisément les cellules cultivées en colonies de formes et de tailles définies. Le succès de cette procédure devrait être clairement évident immédiatement après la procédure d'ensemencement cellulaire (étape 3.7) que les cellules adhérants se regroupera selon la conception du photomasque comme indiqué dans la figure 2a. À 1 h après l'ensemencement cellulaire, les modèles individuels peuvent ne pas être entièrement confluents (seulement quelques cellules par modèle), cependant, comme les cellules prolifèrent au fil du temps, les modèles deviendront entièrement colonisés avec seulement très peu de cellules en dehors des surfaces adhésives (Figure 2b). L'aspect exact de la culture dépendra de la lignée cellulaire. Par exemple, le MESC forme des colonies en forme de dôme10. Une puce dont le modelage n'est pas clair 1 à 2 h après l'ensemencement cellulaire indique l'échec de la procédure (Figure 2c,d).
Les grandes colonies épaisses peuvent parfois être difficiles à tacher de façon homogène. Nous suggérons de fixer et de perméabilize les cellules en une seule étape (section 4) car cela peut améliorer la pénétration des anticorps29. C'est la raison pour laquelle la solution fixative choisie contient un détergent. La figure 3 montre le signal de fluorescence qui est attendu après l'immunostaining. Notez que les cellules positives Id1 brillantes se trouvent dans les régions denses (régions brillantes des PNJ) des colonies (figure 3A). Des conseils comme celui-ci sont utiles pour évaluer la qualité de la procédure de coloration des anticorps. Notez également que les micromodèles créés avec la technique actuelle sont autofluorescents. Ce signal (figure3A, B à gauche la plupart des images) est utile au cours de l'étape d'analyse pour enregistrer spatialement les colonies les unes avec les autres et créer les résultats indiqués dans la figure 5. Le signal d'autofluorescence est généralement le plus brillant lorsque l'échantillon est excité avec un laser de 405 nm et ce canal doit être laissé sans coloration à cet effet. La figure 3 montre également comment les cellules sont précisément limitées sur des motifs de différentes formes.
L'analyse des données d'imagerie est effectuée dans PickCells, un logiciel libre et open-source développé dans notre laboratoire (Blin et al., en préparation). Ce logiciel comprend les modules d'analyse d'images pour lire et trier les images confocales (Figure 4-1), pour segmenter ( Figure4-4-4) et curatez les objets segmentés (figure 4-3,4-5), pour calculer l'objet caractéristiques telles que les coordonnées ou l'intensité moyenne (figure 4-6) et d'exporter les données (figure4,4-8). Fait important, nous avons mis au point une méthode robuste de segmentation nucléaire appelée Nessys28, qui convient particulièrement aux populations denses et hétérogènes de cellules telles que les cellules cultivées sur des micromodèles (Figure 3). Figure 4 -2 montre une sortie représentative du module Nessys où chaque cellule est donnée avec précision une identité de couleur unique. Seule une édition minimale devrait être nécessaire, mais l'édition est faisable si l'utilisateur le décide (Figure 4-3). Enfin PickCells fournit un certain nombre de modules de visualisation pour visualiser les données. Un exemple est donné dans la figure 4-6: une colonie en forme d'anneau est rendue en 3D où les noyaux sont codés en couleur en fonction de leur position le long de l'axe z. Une fois l'analyse validée dans PickCells, les données peuvent être exportées pour créer les cartes spatiales en R en utilisant les scripts disponibles à (https://framagit.org/pickcellslab/hexmapr) comme indiqué dans la figure 530.
Nous avons montré récemment que le confinement spatial du MESC sur de petits (30 000 m2) de micropatterns de disque ou d'ellipse guide le modelage d'une sous-population de cellules exprimant le marqueur mésodermal Tbra10. Ainsi, pour illustrer notre méthode ici, nous demandons si le modelage de Tbra peut être influencé par la signalisation BMP dans les grandes colonies (90 000 m2). La figure 5A montre que lorsque le MESC est cultivé sur de grands micropatterns à disques, les cellules TbraMD sont préférentiellesment limitées à la périphérie du motif (carte de densité de Tbra), où la densité cellulaire locale est la plus faible (voir la carte bleue à gauche de la figure 5A ). Ce modelage de Tbra est confirmé par la carte de l'intensité moyenne de Tbra.
Ces données démontrent que la méthode peut révéler des informations sous-visuelles. En effet, à partir de la figure 3, l'inspection visuelle d'une colonie n'est pas suffisante pour identifier toute forme d'organisation spatiale dans l'expression De Tbra. Cela s'explique notamment par l'importante variabilité de la colonie à la colonie qui est quantifiée et montrée dans le panneau le plus à droite de la figure 5A.
La technique montre également qu'il n'existe pas de modèle détectable pour Id1 (une cible de signalisation BMP) qui peut indiquer que le modelage T n'est pas entraîné par la signalisation BMP dans ce contexte.
Le micro-patterning permet de forcer les colonies à adopter presque n'importe quelle géométrie désirée. Ceci est particulièrement utile pour interroger la façon dont le système réagit à diverses géométries. Par exemple, nous pouvons raisonner que si un gradient morphogène s'accumule au centre de la colonie, la création d'un trou dans la colonie perturberait ce gradient. Fait intéressant, nous observons toujours le modelage sur un micromotif d'anneau, mais d'une manière moins robuste (Figure 5B).
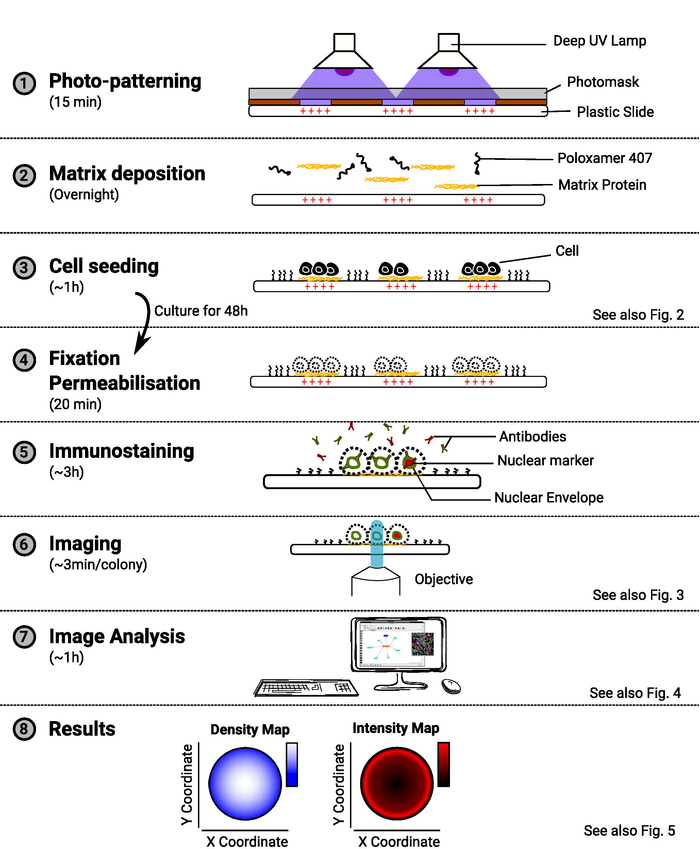
Figure 1 : Aperçu de la méthode. Le diagramme montrant les principales étapes de la méthode. Pour chaque étape, le temps estimé est indiqué sous le nom de la tâche et un schéma illustre le but de la procédure. Une référence à un chiffre pertinent est également fournie lorsqu'elle est disponible. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
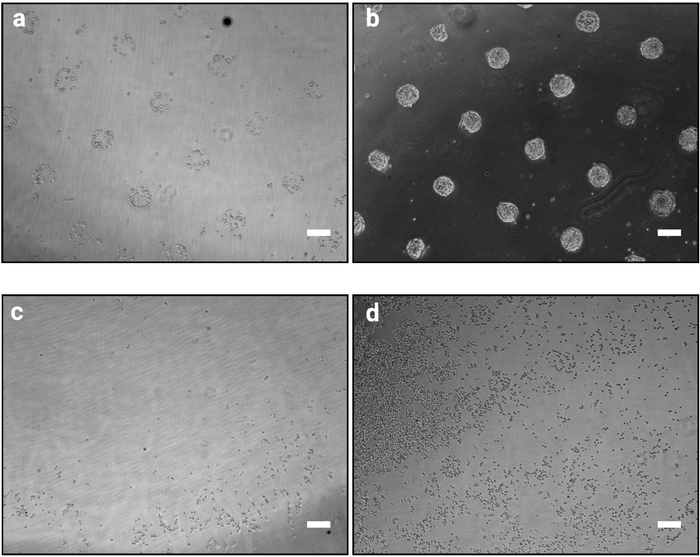
Figure 2 : Aspect culturel 1 h et 48 h après l'ensemencement des cellules sur des micromodèles. Images brightfield de mESC ensemoir sur des micromodèles. (a) Organisation cellulaire prévue 1 h après l'ensemencement, les modèles doivent être clairement identifiables. (b) Résultat attendu après 48 h de cultures. mESC ont proliféré et sont encore strictement confinés aux formes de modèle. (cd) Les résultats non optimaux possibles, soit très peu de cellules adhèrent au plastique, sauf à la périphérie de la diapositive (c) ou les cellules adhèrent entre les modèles (d). Voir le tableau 2 pour un guide de dépannage. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
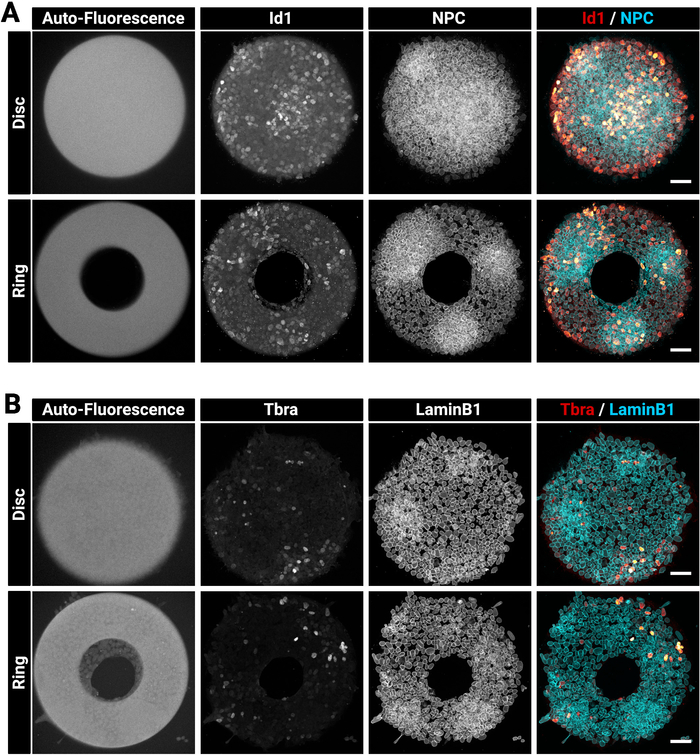
Figure 3 : Images confocales représentatives de colonies immunostained cultivées sur des micromodèles.
Colonies mESC représentatives après immunofluorescence pour (A) Id1 et Nuclear Pore Complex ou (B) Tbra et LaminB1. Pour chaque coloration, une colonie cultivée sur un micromodèle de disque et une colonie cultivée sur un micromotif d'anneau est montrée. Les canaux individuels sont fournis sous forme d'images à l'échelle grise. Notez le signal clair d'autofluorescence du micromotif (excitation laser de 405 nm). La barre d'échelle représente 50 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
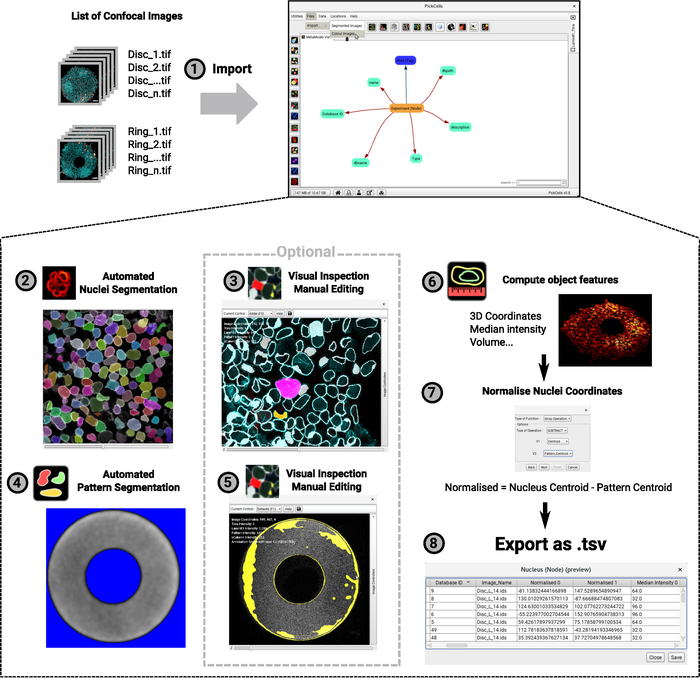
Figure 4 : Graphique de flux de la procédure d'analyse d'image. Une liste d'images confocales 3D est importée dans PickCells pour analyse (1). Cet exemple montre une expérience avec deux formes distinctes (disques et anneaux comme dans la figure 2). La convention de nommage d'image s'affiche sur la gauche et l'interface PickCells à droite. Ensuite, le module Nessys est utilisé pour segmenter automatiquement les noyaux (2). Dans la capture d'écran, chaque noyau individuel reçoit une couleur unique indiquant une segmentation précise. L'autofluorescence du motif est également segmentée, cette fois, à l'aide du module de segmentation de base (4). L'arrière-plan apparaît en bleu et le signal blanc sera défini comme la forme du motif. Les formes segmentées sont ensuite inspectées visuellement pour assurer une segmentation précise, et éditées si nécessaire à l'aide du module d'éditeur de segmentation (3-5). Les captures d'écran montrent le contour des formes détectées. Les formes roses et jaunes ont été modifiées. Enfin, les entités d'objets sont calculées et exportées vers le fichier pour être ensuite traitées en R (6-7). Une capture d'écran d'une colonie rendue en 3D est fournie (6). Pour les étapes 2 à 6, les icônes trouvées dans l'interface PickCells au moment de la rédaction de cet article sont données à côté de l'index d'étape. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
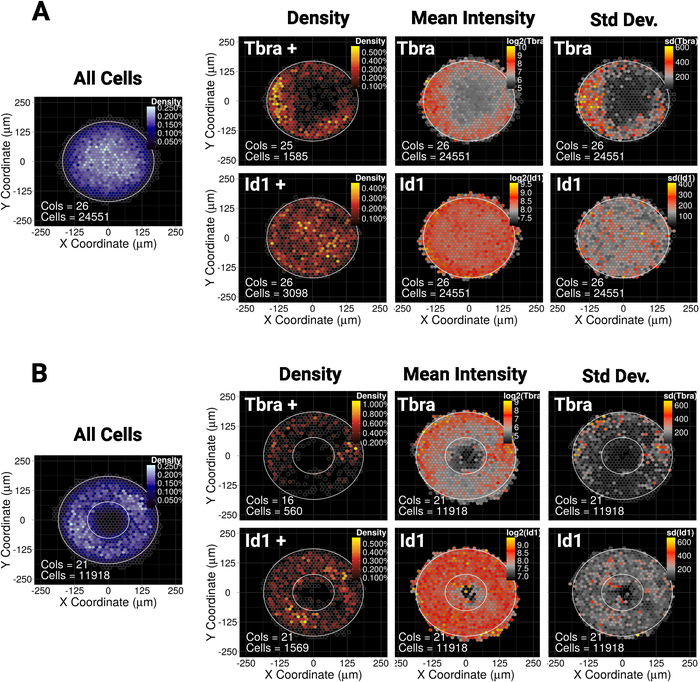
Figure 5 : Résultats représentatifs de deux facteurs de transcription et de formes de micro-modèles différents
Carte spatiale binée pour le MESC cultivé pendant 48 h sur (A) micropatterns en forme de disque ou (B) micropatterns en forme d'anneau. Pour chaque forme de micromodèle, la carte de la densité cellulaire, quel que soit le phénotype cellulaire, est montrée sur la gauche avec une échelle de couleur bleue. Ensuite, pour chaque marqueur (Tbra sur la rangée supérieure et Id1 sur la rangée inférieure), trois cartes distinctes sont fournies, de gauche à droite: carte de densité cellulaire des cellules exprimant des marqueurs seulement (analyse basée sur le seuil), la carte de l'intensité moyenne du marqueur (log2) et la carte de la déviation standard de l'intensité du marqueur. Les intensités sont données en tant qu'unités de fluorescence arbitraires. Pour chaque carte, la forme du micromotif est donnée sous forme de contour blanc. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Type ECM | Gélatine | Fibronectine | Matrice de membrane de sous-sol | |
| concentration | Concentration d'ECM | 1 mg/ml | 20 g/mL | 200 g/mL |
| Concentration de Poloxamer 407 | 500 g/mL | 400 g/mL | 1 mg/ml | |
| Testé avec | MESC (en) | ouais | ouais | ouais |
| mEpiSC (en) | non | ouais | ouais | |
| Milieu sans sérum | non | ouais | ouais |
Tableau 1 : Concentrations testées de poloxamer 407 et d'ECM. Ce tableau donne un aperçu des concentrations d'ECM et de poloxamer 407 que nous avons testées dans notre laboratoire. Pour chaque combinaison ECM/poloxamer 407, le type de cellule pour lequel le modelage a été atteint avec succès est montré ainsi que si la culture contenait du sérum ou non. mESC - cellule souche embryonnaire de souris, mEpiSC - cellule souche d'épiblaste de souris.
| procédure | observation | Question possible | solution |
| Micropatterning | Faible attachement cellulaire | inapproprié ECM/poloxamer 307 concentration ratio | Augmenter le ratio de concentration ECM/poloxamer 307 |
| Temps d'attachement cellulaire trop court | Augmentez le temps d'incubation pour donner suffisamment de temps aux cellules pour qu'elles adhèrent correctement aux modèles (étape 3.4). Pour optimiser cette étape, la vérification des cellules au microscope peut aider à détecter un changement dans la morphologie cellulaire indiquant que les cellules ont commencé à adhérer. | ||
| Lavages trop intenses (étape 3.6) | Lors du remplacement du milieu, évitez de faire du tuyauterie directement sur les copeaux. Au lieu de cela, légèrement pipet le milieu sur les murs du puits à la place | ||
| Les cellules adhèrent entre les modèles | inapproprié ECM/poloxamer 307 concentration ratio | Diminuer le ratio de concentration ECM/poloxamer 407 | |
| Temps d'attachement cellulaire trop long | Diminuer le temps d'incubation (étape 3.4). | ||
| Lavages inefficaces (étape 3.6) | Secouer la plaque vigoureusement est généralement suffisant pour détacher les cellules en excès. Pour les types de cellules qui ont tendance à adhérer fortement à la puce, pipetting directement sur la puce peut améliorer les résultats. L'augmentation du nombre de lavages peut également aider, notamment pour s'assurer qu'aucune cellule ne reste flottante dans le milieu après cette étape. | ||
| Les cellules ne suivent pas strictement la forme du modèle | Géométrie du type de cellule et du motif 'Incompatibles' | Planifiez/concevez plusieurs géométries/tailles à ajouter au photomasque pour être en mesure de tester et d'identifier la taille optimale du modèle pour une forme de modèle et un type de cellule donnés. S'il vous plaît, voir la section «Limitations» dans la discussion | |
| Photo-patterning non-optimal, ceci peut être diagnostiqué en observant la netteté du signal d'autofluorescence. Les limites des motifs devraient être nettes comme dans la fig. 2. Si les bordures des motifs semblent floues, l'étape de photo-modèle doit être améliorée. | Les bords flous du motif indiquent que la glissière en plastique n'était pas assez proche de la surface du masque pendant l'étape d'éclairage. Assurez-vous que les pièces qui tiennent les diapositives sur le photomask sont uniformes et qu'une pression constante et suffisante est appliquée à l'assemblage pendant la procédure d'illumination. | ||
| Coloration | Coloration non homogène | temps d'incubation des anticorps trop court | Augmenter le temps d'incubation des anticorps (jusqu'à 24h à température ambiante) |
| colonies aplaties pendant la procédure de montage | Le micromotif de montage glisse dans une chambre telle que le chamlide ou le cytoo-chambres pour exécuter l'immunostaining et l'imagerie sans avoir besoin de monter les cellules. Cela permettra de mieux préserver les colonies 3D-structure. | ||
| Détachement des colonies pendant la procédure de coloration | Dewetting de la puce | Laisser assez moyen ou utiliser 2 pipettes, l'une pour enlever le milieu et l'autre pour ajouter la solution fraîche | |
| Les colonies apparaissent cisaises sous le microscope | colonies ont été cisaises tout en montant la puce sur la diapositive de microscopie | Soyez très doux lors du montage des copeaux. Alternativement, montez des diapositives de micropatterns dans une chambre telle que le chamlide ou les cytoochambers pour exécuter l'immunostaining et l'imagerie sans avoir besoin de monter les cellules. Cela préserve également l'ultrastructure de la colonie. |
Tableau 2 : Guide de dépannage. Ce tableau donne un aperçu des résultats sous-optimaux possibles. Les sources potentielles des problèmes sont également énumérées ainsi que les solutions recommandées.
Discussion
Ici nous décrivons une méthode pour analyser le modelage émergent dans les cultures des cellules. Une approche simplifiée de micropatterning est utilisée pour normaliser la forme et la taille des colonies cellulaires, et nous présentons des outils d'analyse d'image et des scripts R qui permettent la détection et la quantification des modèles au sein de ces colonies.
Le pipeline que nous proposons est similaire dans une certaine mesure avec une méthode31 publiée précédemment où les auteurs se concentrent sur les conditions de culture, en utilisant des micromodèles disponibles dans le commerce, pour obtenir la formation reproductible de couche germinale dans les colonies esC pour le l'étude des événements précoces de gastrulation in vitro. Notre objectif est plus axé sur la fourniture d'un pipeline généralisable pour la découverte de la formation de modèles in vitro où l'organisation collective des cellules ne peut devenir apparente qu'après analyse statistique. Pour cette raison, nous fournissons un workflow d'analyse d'image robuste qui permet l'identification et l'analyse précises de la position nucléaire dans l'espace 3D sur plusieurs colonies (voir aussi la section « Avantage et limitations de la méthode de détection des motifs » de cette discussion). Nous avons également décidé de développer une approche simple de micropatterning interne qui offre une alternative plus flexible et moins chère aux solutions disponibles dans le commerce à long terme qui, nous l'espérons, seront utiles à la communauté.
Enfin, nous notons que lors de la révision de ce manuscrit, un nouveau paquet pour l'analyse des motifs in vitro similaire à nos scripts R a été publié32. Ce nouveau paquet accepte les tables de caractéristiques cellulaires comme entrée qui peuvent être obtenues à partir de plates-formes d'imagerie à haut débit. Nous croyons que la table des caractéristiques des noyaux générées à l'étape 7 de notre protocole pourrait en principe servir d'entrée à ce nouveau paquet, bien que nous n'ayons pas testé cette possibilité nous-mêmes.
Adaptabilité de la méthode à d'autres types de cellules et géométries de colonies
Nous présentons cette approche dans le contexte d'étudier l'émergence des facteurs de transcription mésodermales dans les cultures des cellules pluripotentes en présence du sérum. Cependant, la méthode est facilement adaptable à d'autres types de cellules et aux cultures sans sérum, bien qu'il puisse être nécessaire d'optimiser les concentrations d'ECM/poloxamer 407 (voir le tableau 1 pour les concentrations testées et le tableau 2 pour un guide de dépannage). La méthode peut également être adaptée à des tailles plus ou moins grandes de micromodèles et à un large éventail de formes en fonction des besoins de l'utilisateur. Cependant, tout en établissant la méthode, il est important d'être conscient que toutes les combinaisons de forme /type cellulaire ne sont pas optimales. Par exemple, le MESC exprime des niveaux élevés d'E-cadherin33,34 permettant à ces cellules de former des structures collectives couvrant des zones dépourvues d'ECM. Ces cellules ne suivent pas strictement les géométries avec des angles pointus ou qui incluent de petits trous dans le modèle. Notez par exemple que sur l'anneau de la figure 3B, les cellules sont en train de coloniser la zone centrale. Dans nos mains, une zone centrale plus petite n'a pas forcé le MESC à former des colonies en forme d'anneau. Il est donc fortement recommandé d'inclure une diversité de géométries lors de la conception du photomask pour être en mesure de tester et d'identifier les tailles optimales et les courbures qui seront adaptés pour le type de cellule de choix.
Un autre facteur important à prendre en considération est la durée de l'expérience et le taux de prolifération des cellules. Pour certains types de cellules qui prolifèrent rapidement (y compris les cellules pluripotentes), il peut être difficile de maintenir les cellules sur des micromodèles sur plusieurs jours (Pour mESC trois jours est un maximum). En outre, l'ensemencement des cellules sur les micromodèles ne se produit pas toujours de manière optimale pour chaque colonie, il est donc conseillé de semer un excès de colonies afin d'avoir des pièces de rechange.
Avantage et limitations de la méthode de détection des modèles
Un avantage particulier de la méthode est la capacité de détecter les modèles « moyens » en combinant les résultats de l'analyse d'image provenant de colonies de repli multiples (figure 5). Cela peut révéler des événements de modelage qui ne sont pas apparents de l'inspection des colonies individuelles. Un inconvénient de cette approche de « moyenne » est qu'elle peut manquer certains types de modèles répétitifs, par exemple de petites taches ou des bandes étroites. Cependant, ces types de modèle peuvent plutôt être révélés avec une combinaison de tailles de modèle soigneusement choisies8. De plus, le pipeline d'analyse d'images décrit ici fournit des données quantitatives à la fois à une seule cellule et à la résolution de la colonie, offrant la possibilité d'étudier le niveau de variabilité intercoloniale (figure 5) ou d'effectuer l'analyse des voisins à plusieurs échelles10.
Un autre avantage important de la méthode de la moyenne est qu'elle offre la possibilité de cartographier l'emplacement préférentiel de nombreux marqueurs sans être limité par les fluorophores disponibles des canaux de détection. En effet, bien que nous n'utilisions que deux marqueurs de différenciation dans les travaux présentés ici, la capacité de normaliser les colonies et d'extraire des modèles « moyens » permet de comparer les cartes de distribution de différents ensembles de colonies afin de pour révéler les relations spatiales généralisées des marqueurs les uns aux autres.
En outre, bien que notre objectif ici ait été d'étudier des marqueurs de différenciation, la méthode d'analyse peut être étendue pour étudier d'autres processus biologiques pour lesquels des marqueurs nucléaires sont disponibles. Par exemple, le micromodelage d'une lignée cellulaire contenant un indicateur de cycle cellulaire d'ubiquitination de fluorescence35 (FUCCI) permettrait d'étudier comment la géométrie du niveau des colonies peut influencer les événements du cycle cellulaire dans le groupe.
Orientations futures
La méthode est favorable à l'analyse d'image de débit moyen, cependant, l'acquisition d'image n'est actuellement pas entièrement automatisée et peut devenir limitante pour les expériences très grandes. Les arrangements réguliers des colonies devraient permettre de créer des routines d'acquisition entièrement automatisées semblables à ce qui a été développé pour une cellule unique en moyenne20. Cependant, parce que la taille du champ nécessaire pour l'image d'une colonie est grande, nécessitant peut-être mosaïque, et parce que les colonies sont tridimensionnelles, il est hautement souhaitable de réduire à la fois la taille des ensembles de données et le temps d'acquisition par l'imagerie que les colonies pertinentes. Par conséquent, des efforts futurs pourraient être consacrés à la mise au point d'un microscope « intelligent » capable d'identifier les colonies pertinentes et d'adapter les coordonnées d'imagerie à chaque échantillon. Cela permettra non seulement de réduire le temps et les efforts, mais aussi d'éviter les biais potentiels de l'opérateur.
Les pipelines d'analyse peuvent également être rendus plus efficaces en réduisant le nombre de mesures que l'utilisateur doit prendre. Nous avons l'intention de construire un mécanisme de construction de pipelines et d'intégrer R directement dans notre logiciel (voir aussi les questions pickcells-api-3 et pickcells-rjava-1 dans le tracker d'émission de nos référentiels de code [https://framagit.org/groups/pickcellslab/-/issues]). L'automatisation complète de la procédure d'analyse réduira le temps et l'effort et limitera les erreurs potentielles de l'utilisateur.
Enfin, nous notons que notre méthode d'analyse ne saisit pas encore pleinement la nature dynamique du modelage cellulaire. Certaines informations dynamiques limitées peuvent être extraites en examinant une série chronologique d'images instantanées8,10,36. Cependant, être en mesure d'enregistrer l'histoire de la population cellulaire est hautement souhaitable si nous voulons mieux comprendre comment le modèle émerge. Une limitation est que le suivi précis des cellules individuelles dans une population de cellules denses 3D reste une tâche très difficile37. Notre méthode de détection cellulaire utilise l'enveloppe nucléaire et fonctionne particulièrement bien sur les populations cellulaires denses et qui se chevauchent28. Les journalistes en direct de l'enveloppe nucléaire sont facilement disponibles28,38 et un avantage de la technique de micro-patterning est qu'il peut être utilisé pour empêcher les cellules de se déplacer en dehors du champ de vision pendant l'imagerie à long terme. Dans l'ensemble, nous sommes convaincus que le suivi automatisé des cellules sera réalisable à l'aide d'une combinaison d'outils récemment mis en place28,39,40 et que cela devrait apporter de nouvelles idées dans le fondamental principes d'auto-organisation.
Déclarations de divulgation
Les auteurs n'ont rien à révéler
Remerciements
Ce travail a été financé par une bourse postdoctorale Sir Henry Wellcome (WT100133 à G.B.), une bourse d'études supérieures Wellcome Trust (WT103789AIa à S.L.), et un doctorat de Wellcome Trust à (108906/Z/15/Z à D.W.). Nous sommes également reconnaissants au Dr Manuel Thery pour ses conseils sur l'adaptation de la technique de photopatterning.
matériels
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
Références
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878 (2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939 (2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- . . Micropatterning in cell biology. Pt. A. , (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366 (2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438 (2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514 (2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872 (2018).
- Weiswald, L. -. B., Guinebretière, J. -. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106 (2010).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384 (2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -. K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839 (2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141 (2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon