Method Article
마이크로패턴과 정량적 이미징을 사용하여 포유류 세포의 응급 공간 조직 매핑
요약
여기에 제시된 방법은 포유류 문화 내에서 공간 조직을 드러내기 위하여 양적 화상 진찰과 함께 마이크로 패터닝을 이용합니다. 이 기술은 표준 세포 생물학 실험실에서 확립하기 쉽고 시험관 내에서 패터닝을 연구할 수있는 견인 시스템을 제공합니다.
초록
생물학의 근본적인 목표는 개발 중에 패턴이 어떻게 나타나는지 이해하는 것입니다. 몇몇 단은 줄기 세포가 공간적으로 마이크로 패턴에 국한될 때 시험관에서 패터닝이 달성될 수 있다는 것을 보여주었습니다, 따라서 생물학의 근본적인 원리를, 시험관에서, 확인하는 유일한 기회를 제안하는 실험적인 모형을 설치합니다 조직.
여기서는 방법론에 대한 자체 구현에 대해 설명합니다. 우리는 표준 세포 생물학 실험실에서 방법을 쉽게 확립 할 수 있도록 특수 장비의 필요성을 줄이기 위해 사진 패터닝 기술을 적용했습니다. 우리는 또한 표준 모양과 크기의 식민지 내에서 세포의 하위 집단의 우대 위치를 정확하게 측정하기 위해 무료 오픈 소스 및 설치하기 쉬운 이미지 분석 프레임 워크를 개발했습니다. 이 방법을 사용하면 겉보기에 무질서한 세포 집단에서도 패터닝 이벤트의 존재를 밝힐 수 있습니다. 이 기술은 정량적 통찰력을 제공하며 주어진 패터닝 프로세스에서 환경의 영향(예: 물리적 단서 또는 내인성 신호)을 분리하는 데 사용할 수 있습니다.
서문
포유류 시스템에서, 패터닝은 세포의 집단 행동의 출현 특성이므로, 적절한 단서가 세포 1,2,3,4에제공되면 패턴이 시험관 내에서 형성 될 수있습니다. 5개 , 6. 시험관 내에서 자가 구성하는 세포의 본질적인 능력을 드러내는 한 가지 방법은 세포가 정의 된 모양과크기의 그룹 / 식민지를 형성하도록 강요하는 것입니다 7,8,9,10 . 이를 가능하게 하는 기술은 마이크로패킹11이다. 마이크로 패터닝을 통해 세포외 매트릭스(ECM) 분자가 표면에 증착되는 위치를 정확하게 정의할 수 있습니다. 이것은, 차례차례로 세포가 밀착할 수 있는 곳에 지시하고 그러므로 세포가 공간적으로 구성하는 방법을 통제합니다.
마이크로 패터닝은 다양한 응용 분야, 예를 들어, 마이크로 패터닝을 통해 분화12전에 초기 조건의 표준화를 가능하게 하는 기술이다. 중요한 것은, 마이크로 패터닝은 세포 콜로니의 크기, 모양 및 간격을 쉽게 제어 할 수 있게 하며,이 속성은 모르포겐 또는 물리적 단서에 대한 세포의 집단 반응을 심문하기위한 실험을 고안하는 데 사용할 수 있습니다7 , 8개 , 10개 , 13세 , 14세 , 15세 , 16세 , 17.
몇 가지 마이크로 패터닝 방법이 개발되었습니다11. 포토 패킹 기술은 아마도18을설정하는 가장 쉬운 방법입니다. 이들 접근법은 또한 단일 세포18,19,20의형상을 제어하는데 사용될 수 있기 때문에 정밀도의 장점을 갖는다. 그러나, 그들은 또한 표준 생물학 실험실에서 일반적으로 쉽게 사용할 수없는 스핀 코터, 플라즈마 챔버 및 UVO (UV-오존) 클리너를 포함한 고가의 특수 장비를 필요로합니다. 이 기술의 채택을 용이하게 하기 위해, 우리는 UVO 램프만을 필요로 하는 프로토콜을 적용했습니다. 우리는 가위로 또는 원하는 형식으로 구멍 펀치로 절단 할 수있는 상업적으로 사용할 수있는 플라스틱 슬라이드에서 시작합니다.
마이크로 패턴의 한 가지 중요한 유틸리티는 여러 복제에 걸쳐 개별 식민지를 비교하기 위해 식민지를 표준화하는 기능입니다. 이를 통해 이러한 식민지 내의 패턴 형성이 어느 정도까지 재현 가능한지 물어보고 패터닝 프로세스의 견고성에 영향을 미치는 요인을 탐색할 수 있습니다. 중요한 것은, 여러 표준화 된 식민지에 걸쳐 "평균"패턴의 정량화는 그렇지 않으면 명백하지 않을 패터닝 프로세스를 나타낼 수 있습니다. 표준화된 식민지에서 패터닝을 정량화할 수 있다는 장점은 단일 세포 수준에서 단백질 발현을 정확하게 측정할 수 있다는 점에 달려 있습니다. 그러나 마이크로 패턴의 셀은 종종 단단히 포장되어 높은 정확도로 분류하기가 어렵습니다. 세포는 또한 종종 2차원이 아닌 3차원으로 구성되며, 세분화 하는 동안 3차원(3D) 정보를 감지하고 보존하는 것이 어려울 수 있습니다. 셀이 성공적으로 분할되면 결과 데이터 집합에서 패터닝 정보를 추출하는 데 계산 방법이 필요합니다.
우리는 이러한 문제를 극복하는 데 도움이 되는 세분화 및 이미지 분석 도구를 개발했습니다. 이 분석 방법은 무료 및 오픈 소스 소프트웨어만 사용하며 구현하기 위해 명령줄이나 프로그래밍에 대한 지식이 필요하지 않습니다. 여기서 방법을 설명하기 위해, 우리는 초기 분화 brachyury (Tbra)21,22의마커를 자발적으로 발현하는 마우스 배아 줄기 (mES) 세포를 사용한다. 명백한 공간 배열은 시각적으로 감지할 수 없지만 이 방법을 사용하면 식민지에서 T+ 셀의 우선 위치 맵을 만들 수 있습니다. 우리는 또한 Tbra 패터닝이 Id1을 발현하는 세포의 우대 국소화의 부재와 대조되는 것을 보여 주며, 골형태유전학적 단백질(BMP) 경로(23)의 직접적인 판독을 보여준다. 또한 이 방법의 현재 한계와 이 기술이 다른 실험 시스템에 어떻게 적용될 수 있는지에 대해서도 논의합니다.
프로토콜
참고: 메서드의 개요는 그림 1에제공됩니다.
1. 마스크 디자인
- Azioune 외18에설명 된 지침에 따라 포토 마스크를 디자인합니다. 이 연구에 사용된 소프트웨어 및 마스크 제조업체에 대한 참조는 재료 표를 참조하십시오.
주: 하나의 마스크에 여러 형상, 크기 또는 셰이프 사이의 간격을 만들 수 있습니다. UV 램프는 최대 49개의 다른 디자인을 포함할 수 있는 15cm 포토마스크에 맞을 수 있습니다(2cm x 2cm 칩가정).
2. 마이크로 패턴 제조 절차
- 필요한 자료를 준비합니다.
- 인산염 완충 식염수(PBS)에서 0.1% 폴록사머 407(10 mL의 경우 10 mg)의 용액을 준비하고 실온에서 셰이커에 둡니다. 폴록사머(407)는 용해하는 데 약 20분이 소요된다.
- 10cm 정사각형 페트리 접시의 바닥에 실험실 필름 (재료 표참조)을 놓습니다. 이것은 매트릭스 증착을 위한 챔버로서 사용될 것이다.
- 포토마스크의 표면을 먼저 100% 아세톤으로 닦은 다음 100% 이소프로판올을, 마지막으로 ddH 2O로 청소합니다. 가능하면 포토마스크를 말리거나 깨끗한 종이 타월로 마스크를 말립니다.
- 포토마스크와 정확히 동일한 크기의 정사각형, 단단하고 불투명한 플라스틱 조각을 준비합니다(나중에 '홀더'라고 함).
참고: 조명 단계에서 포토마스크와 접촉하는 플라스틱 커버립을 유지하는 데 사용됩니다. - UVO 램프를 켜고 10분 동안 온난화 조명을 실행합니다.
- 포토패턴 칩을 만듭니다.
참고 : 원하는 크기의 칩을 만들기 위해 절차를 조정할 수 있습니다. 간단히 하기 위해 12mm 원형 마이크로패턴 칩을 생성하는 절차를 여기에 설명합니다.- 12mm 구멍 펀치를 사용하여 소수성 플라스틱 슬라이드를 잘라 12mm 둥근 커버슬립을 만들고 깨끗한 새 페트리 접시에 넣습니다.
주의: 표면 처리가 손상될 수 있기 때문에 항상 장갑을 착용하여 플라스틱 표면과 피부가 접촉하지 않도록 하십시오. - 조심스럽게 핀셋으로 덮개에서 보호 필름을 제거합니다.
참고: 파종 절차(섹션 3)에서 칩에 셀이 배치되는 데 영향을 줄 수 있기 때문에 플라스틱 표면을 손상시키지 마십시오. - 포토마스크를 깨끗하고 안정적인 표면(예: 포토마스크 박스), 크롬 면에 올려놓고 원하는 칩 설계의 위치에ddH 2O 의 2μL 드롭을 추가합니다.
- 덮개를 ddH2O 의 한 방울에 놓고 부드럽게 누릅니다.
참고: 포토마스크를 마주보고 있는 플라스틱 면이 이전 단계에서 제거된 필름으로 보호된 측면인지 확인합니다. - 플라스틱 슬라이드 위에 홀더를 놓고 조심스럽게 이 샌드위치를 클램프로 고정하여 포토마스크와 접촉하는 플라스틱 조각을 유지합니다.
참고: 플라스틱 슬라이드가 포토마스크 표면과 완벽하게 접촉하여 유지되도록 하려면 플라스틱 슬라이드의 위치에 가능한 한 가깝게 클램프를 놓습니다. - 광원에서 약 2cm 떨어진 UVO 램프에 어셈블리를 놓고 10분 동안 조명합니다.
참고: 칩이 소스에서 2cm 떨어진 거리에 배치될 때 빛의 힘은 파장의 254nm에서 6mW/cm2로 추정됩니다. - 샌드위치를 바닥에 있는 포토마스크로 잡고 한 손으로 압력을 유지하면서 클램프를 조심스럽게 제거하여 샌드위치를 분해하는 동안 슬라이드가 움직이지 않도록 합니다. 홀더를 분리하여 모든 플라스틱 조각이 마스크에 남아 있고 홀더에 달라붙지 않도록 합니다.
- 칩 위에 ddH2O를 추가하고 포토마스크에서 칩을 부드럽게 분리합니다.
참고: 플라스틱 칩이 포토마스크에 붙어 있는 경우, 칩이 갑자기 분리될 경우핀셋을 칩 위에 약간 유지하면서 플라스틱 파이펫 팁을 사용하여 칩을 분리합니다. - 마지막으로, 매트릭스 증착 챔버 내에 포토패턴 칩을 놓습니다.
참고: 칩의 조명이 위쪽을 향하고 있는지 확인합니다.
- 12mm 구멍 펀치를 사용하여 소수성 플라스틱 슬라이드를 잘라 12mm 둥근 커버슬립을 만들고 깨끗한 새 페트리 접시에 넣습니다.
- 매트릭스를 입금합니다.
참고 :이 섹션의 모든 절차는 조직 배양 후드에서 수행해야합니다.- 0.22 μm 폴리에테설포온(PES) 필터를 통해 폴록사머 407 용액을 걸러.
- 멸균 여과 된 폴록사머 407 및 젤라틴 1 mg / mL의 500 μg / mL을 혼합하여 ECM 코팅 솔루션을 준비하십시오.
참고: 다른 가능한 ECM 분자에 대한 추가 정보는 표 1을 참조하십시오. - 각 조명 칩에 코팅 용액 200 μL을 추가합니다. 실험실 필름은 낙하가 칩 외부로 떨어지는 것을 방지합니다.
- 증발을 제한하고 하룻밤 4 °C에서 칩으로 배치하기 위해 ddH2O로 채워진 3cm 페트리 접시를 추가합니다.
3. 시종 절차
참고: 아래에 설명된 단계는 표준 mESC 배지를 사용하여 CGR8 마우스 배아 줄기 세포(mESC)24에 최적화되었습니다(재료 표참조). 그러나, 원칙적으로 임의의 세포 유형에 대한 절차를 적응시킬 수 있다. 또한 마우스 배아 줄기 세포의 종래의 세포 배양은 여기서 설명되지 않는 광범위한 문서화가 다른 곳에서 도25에서발견될 수 있다.
- 코팅 용액을 흡인하고 멸균 PBS로 칩을 최소 5분 동안 2회 배양합니다.
- 그 동안, 따뜻한 배지에서 5.5 x 105 세포/mL의 세포 현탁액을 준비한다.
- 각 칩에 셀 현탁액의 파이펫 200 μL (~ 100,000 셀 / cm 2).
- 파종 챔버를 닫고 인큐베이터에서 1 시간 동안 부착하는 세포를 둡니다.
- 1 시간 후, 멀티 웰 플레이트 (칩의 수에 따라 4 웰 또는 24 웰 플레이트)의 우물을 따뜻한 매체의 500 μL / well로 채우고 멸균 핀셋으로 칩을 플레이트에 옮김하십시오.
- 부착되지 않은 세포를 분리하기 위해 플레이트를 힘차게 흔들어 줍니다. 매체를 흡인하고 즉시 신선한 따뜻한 매체로 교체하십시오. 현미경 아래에서 패터닝이 보이는지 확인합니다(그림2a).
참고: mESC 또는 다른 매트릭스 단백질 이외의 세포주를 사용할 때 접착 시간을 최적화해야 할 수 있습니다(표 2참조). - 그림 2a와같이 패턴이 명확하게 표시될 때까지 이 단계를 반복합니다.
참고: 이 단계는 중요하며 절차의 성공 여부를 결정합니다. 너무 강렬한 세척 절차는 세포를 분리 할 수 있습니다, 대조적으로 불충분한 세척패턴 사이에 부착 된 세포가 발생할 수 있습니다 (그림2c,d).
4. 고정
참고 : 배양 시 48 시간 후에 세포는 패턴의 모양을 엄격하게 따르는 조밀한 식민지를 형성해야합니다 (그림 2b와같이).
- 접시에 칩을 두고, 배지의 ~ 90 %를 제거하고 칩이 건조되는 것을 방지하기에 충분한 매체를 남겨 둡습니다.
참고: 칩이 건조되지 않도록 유물염색을 피하고 표면에서 세포 분리를 방지하는 것이 중요합니다. 접착제 패턴 사이의 칩 표면의 소수성으로 인해, 칩은 탈습하는 경향을 가질 수 있다. 이 단계에서, 고정은 칩에서 분리하는 큰 돔 식민지를 일으킬 수 있습니다. 와세는 이상적으로 칩에 직접하지 우물의 측면에 액체를 피펫에 의해 수행, 매우 부드러운해야한다. - 웰당 적어도 500 μL의 파라포름알데히드(PFA) 기반 고정 액을 넣고 10분 동안 배양합니다.
참고: 콜로니가 특히 두껍게 나타나는 경우(5개 이상의 세포 층), 고정 시간을 20분으로 조정해야 할 수 있습니다. - 고정 후 세척 용액 (0.01 % 폴록사머 407이있는 PBS)으로 3 회 씻으하십시오. 세척 용액에서 희석된 50 mM NH4Cl을 이용한 엑스트라 워시는 잔류 PFA 가교 활성을 담금질하기 위해 인터클로징될 수 있다.
- 차단 용액에서 적어도 30 분 동안 샘플을 인큐베이션합니다.
참고: 이 단계에서, 샘플은 염색 하기 전에 약 1 주일 동안 4 °C에서 저장 될 수 있습니다. 그렇다면 증발을 방지하기 위해 실험실 필름으로 플레이트를 밀봉하십시오.
5. 면역 염색
- 10cm 정사각형 페트리 접시의 바닥에 실험실 필름 시트를 배치하여 염색 챔버를 준비합니다.
- 항체 용액을 준비하십시오(이 문서에서 사용되는 항체 및 희석 목록은 표 3을 참조하십시오).
- 칩을 위쪽을 향한 세포를 지지하는 쪽으로 염색 챔버에 넣고 즉시 100 μL의 1차 항체 용액을 칩에 추가합니다.
주의: 이 단계에서는 4.1단계에서와 같이 칩이 쉽게 젖지 않아야 합니다. 그러나 칩이 마르지 않는 것이 중요하기 때문에 주의해야 합니다. 여러 칩을 처리해야 하는 경우 각 칩에 5.3 단계를 순차적으로 적용합니다. - 실온에서 회전 플랫폼에서 1 시간 동안 인큐베이팅하십시오.
참고 : 세포가 큰 3D 구조를 형성 한 경우, 샘플의 균일 한 염색을 허용하기 위해 더 긴 배양 시간이 필요할 수 있습니다. 배양 시간은 최대 24시간까지 증가할 수 있다. 그러나 염색 챔버는 물로 채워진 3cm 접시를 포함해야하며 염색 챔버는 증발을 방지하기 위해 실험실 필름으로 밀봉해야합니다. - 칩을 신선한 멀티웰 플레이트에 옮기고 세척 용액으로 3회 세척합니다.
- 단계 5.3 및 5.4에 기재된 바와 같이 이차 항체로 인큐베이션을 수행한다.
- 표준 장착 매체(예: Mowiol)의 20 μL을 사용하여 현미경 슬라이드에 칩을 장착합니다.
6. 이미징
참고: 화상 진찰은 표준 공초점 현미경에 수행될 수 있습니다. 여기서는 후속 정량 분석에 충분한 이미지 품질을 보장하기 위한 권장 사항만 제공합니다.
주의: 작업자 편향을 피하려면 이미지에 대한 콜로니를 핵 봉투 신호를 사용하여만 선택해야 합니다(콜로니가 패턴의 모양을 제대로 따르는지 확인하려면). 현미경 설정을 조정할 때를 제외하고 관심 있는 마커의 신호를 확인하지 마십시오.
- 수집 비트 깊이가 12 비트 또는 16비트인지 확인합니다.
- 각 이미지 채널의 동적 범위를 최대화하기 위해 적절한 설정을 식별합니다. 특히 이미지 클리핑을 피하십시오.
- 마이크로패턴 자가형광을 이미지화하는 채널을 포함합니다(그림 3참조).
- 이미지 크기와 확대/축소 계수를 조정하여 x 축과 y 축에서 0.1~0.6μm 범위의 복셀 크기를 얻고 z축에서는 0.2~2μm 범위의 복셀 크기를 얻을 수 있습니다.
참고: 예를 들어, 이 연구에서는 40배 의 목표(숫자 조리개 1.3과 같음), 디지털 줌없이 1024 x 1024 픽셀의 이미지 크기 및 0.5 μm의 z-step 크기로 반전된 스캐닝 공초점 현미경을 사용했습니다. 그 결과 복셀 크기는 0.38 μm x 0.38 μm x 0.5 μm입니다. - 각 콜로니에 대해 z축을 따라 최소 및 최대 위치를 정의하여 전체 콜로니가 획득되도록 합니다. 신호가 낮음에서 신호가 없는 평면이 하나 이상 포함되어야 합니다.
- z 스택 방향이 일관되게 획득되었는지 확인합니다(항상 위에서 아래로 또는 항상 아래에서 위로)
- 스캔 속도, 이미지 해상도, 프레임 평균화 및 검출기 이득을 조정하여 이미지 품질과 이미징 시간 사이의 최적의 속도를 식별합니다. 도 3에 도시된 바와 같이, 하나의 콜로니에 대한 이미징 시간은 약 2-3분이었다.
주의: 모든 이미지는 비교할 수 있도록 동일한 목표 및 수집 설정을 가진 동일한 현미경으로 획득해야 합니다. - 수집이 끝나면 모든 이미지를 저장하고 고유한 명명 규칙을 할당하여 각 이미지가 나타내는 실험 조건을 식별합니다.
참고: 그림 4를 예로 들어, 이 규칙은 분석 절차 중에 나중에 사용됩니다. 이미지는 BioFormats 26에서지원하는 모든 형식으로 저장될 수 있습니다. 콜로니가 시야보다 큰 경우 ImageJ의 스티치플러그인(27)을사용할 수 있습니다. 또한 바느질의 경우 조명 롤오프 보정이 필요할 수 있습니다.
7. 이미지 분석
참고: 이 절차에 권장되는 컴퓨터 사양은 16GB RAM, 멀티 코어 3.33GHz CPU 및 최소 50GB의 디스크 공간(또는 이미지된 칩 수에 따라 다름)입니다. 이 소프트웨어는 리눅스에서 테스트되었습니다, 윈도우와 맥 OS. PickCells은 복잡한 다차원 이미지에서 세포의 집단 조직의 분석에 전념그래픽 사용자 인터페이스와 크로스 플랫폼 이미지 분석 응용 프로그램입니다 (블린 외, 준비). PickCells에 대한 자세한 정보와 여기에 언급된 특정 모듈에 대한 설명서는 온라인에서 확인할 수 있습니다: https://pickcellslab.frama.io/docs/. 또한 소프트웨어를 계속 개선함에 따라 인터페이스가 변경될 수 있습니다. 인터페이스가 그림이나 비디오에 표시된 것과 다른 경우 온라인 설명서를 참조하십시오.
- 온라인으로 사용할 수 있는 설명서에 따라 PickCells을 설치하고 실행합니다.
- 이미지를 가져오고 제공된 정보의 정확성을확인합니다(그림 4-1).
- 각 채널의 이름을 문서화합니다.
- 네시모듈(28)을 이용하여 핵엔벨벌브 신호에 기초한 핵을 분할하고(도 4-2) 생성된 분절된 이미지의 이름을 지정하는데 사용될 접두사("핵") 등을 제공한다.
참고: 사용량 및 매개 변수 조정에 대한 설명서는 https://framagit.org/pickcellslab/nessys 확인할 수 있습니다. - 세분화 편집기 모듈(그림 4-3)을 사용하여필요한 경우 세분화검사 및 편집
참고: 어떤 이유로든 세분화 프로세스가 만족스러운 결과를 제공하지 못하면 데이터베이스 폴더에서 이미지를 수동으로 삭제하고 MetaModel 보기에서 '분할 결과' 노드를 삭제합니다. 그런 다음 7.4 단계 및 7.5단계를 반복합니다. 작은 부분의 이미지만 분할하여 만족스러운 결과를 제공하지 못한 경우 Nessys 독립 실행형 응용 프로그램을 사용하고 (7.4의 링크 참조), '결함이 있는 이미지'에서 분할을 시도하고 데이터베이스 폴더의 해당 파일을 교체합니다. - 기본 세분화 모듈을 사용하여 패턴 자가형광 신호를분할(그림4-4)
- 생성된 세그먼트이미지의 이름을 지정하는 데 사용할 접두사(예: "패턴")를 제공합니다.
- 자동 형광 신호를 포함하는 채널을 선택합니다.
- 노이즈 감소를 적용; 일반적으로 10 x 10 x 0.5 복셀의 커널 크기의 가우시안 필터를 사용하면 만족스러운 결과를 제공합니다.
- 전경이 흰색으로 나타나는 동안 배경이 파란색으로 표시되도록 하부 임계값을 설정합니다. 또한 상위 임계값을 최대값으로 설정하여 최종 결과(빨간색 영역)에서 높은 강도가 제외되지 않도록 합니다.
- 마지막 단계에 대해 건너뛰기(건너뛰기)를 선택합니다.
- 완료를 클릭하고 모든 이미지가 처리될 때까지 기다립니다.
- 핵에 관해서는, 세분화 편집기 모듈(그림 4-5)을 사용하여 필요한 경우세분화 결과를 육안으로 검사하고 수정할 수 있습니다.
- 핵 오브젝트를 작성하고 기본 오브젝트 피처를 계산합니다.
- 기본 인터페이스 왼쪽의 작업 표시줄에서 내장 기능 모듈을 시작합니다(그림4-6).
- 기본 피쳐 패널만 열어 두도록 타원 맞춤 및 표면 추출기 패널을 닫습니다.
- Nucleus를 개체 유형으로 선택하고 "분할된 이미지"에 대해 7.4단계에서 제공된 접두사를 선택합니다.
- 계산을 누르고 모든 이미지가 처리될 때까지 기다립니다.
참고: 이 단계 후에는 핵 세분화를 다시 편집할 수 없습니다.
- 패턴 객체를 작성하고 기본 객체 피쳐를 계산합니다. 7.8.1에서 7.8.4 단계반복, 이번에는 사용자 지정 유형을 개체 유형으로 선택하고 분할된이미지의 경우 7.6.1 단계에 지정된 접두사를 선택합니다.
참고: 이 단계 후에는 패턴 세분화를 다시 편집할 수 없습니다. - 각 핵이 속하는 이미지의 이름을 핵 속성으로 저장합니다.
- 데이터 > 새 속성을 클릭하고 팝업 대화 상자에서 핵을 선택하고 확인을클릭합니다.
- 노드에 연결된 다른 개체에서 데이터 수집을 선택하고 다음을 클릭합니다.
- 왼쪽 패널에서 이미지를 선택한 다음 경로 정의 패널의 끝 표시 아래의 심문 표시를 두 번 클릭하여 이미지 노드를 경로의 대상으로 설정합니다.
- 왼쪽 패널에서 사용 가능한 특성 창을 확장하고 이름 특성을 선택합니다.
- 축소 작업 창을 확장하고 하나받기를 선택한 다음 변경 단추를 클릭하고 다음을 클릭합니다.
- "이미지 이름"을 입력하고 탭 키를 누르고 확인을 클릭합니다.
- 핵 오브젝트에 "정규화 된 좌표"특성을 만듭니다(그림 4-7).
- 7.10.1에서 7.10.6단계로 조정하여 패턴 중심의 좌표를 핵 속성으로 저장합니다. 이 새 특성의 이름을 "패턴 좌표"로 지정합니다.
- 그런 다음 데이터 > 새 속성을클릭하고 핵을 선택하고 확인을클릭합니다.
- 노드의 공간 또는 방향 벡터 사이의 함수 정의를 선택하고 다음을 클릭합니다.
- 함수 유형의 경우 배열 작업을선택합니다.
- 다음을클릭하여 이름 필드에 "정규화 좌표"를 입력하고 완료를클릭합니다.
- 데이터를 분리된 값 파일 탭으로 내보냅니다.
8. R 분석
- Rstudio를 다운로드하여 설치합니다.
참고: 소프트웨어 정보 및 다운로드 링크는 https://www.rstudio.com/. - 이 분석에 필요한 R 스크립트를 다운로드합니다.
참고: 스크립트는 GitLab 리포지토리: https://framagit.org/pickcellslab/hexmapr 다운로드할 수 있습니다. - Rstudio를 엽니다.
참고: 스크립트를 처음 실행하는 경우 필요한 R 패키지(ggplot2 및 축척)를 설치합니다. - Rstudio에서 binnedmap_템플릿을 엽니다. R 스크립트.
- 작업 디렉토리를 원본 파일 위치로 설정합니다.
- 그림5와 같이 공간 맵을 얻기 위해 스크립트에 제공된 지침을 따라 주어진 데이터 집합에 스크립트를 적용합니다.
- 스크립트를 실행하여 밀도 맵을 생성합니다.
결과
여기에 설명된 사진 패터닝 방법을 사용하면 배양된 세포를 정의된 모양과 크기의 콜로니로 정확하게 구성할 수 있습니다. 이 절차의 성공은 도 2a에도시된 바와 같이 포마스크 설계에 따라 부착 세포가 클러스터되는 바와 같이 세포 시딩 절차(단계 3.7) 직후에 명확하게 명백히 드러나야 한다. 세포 파종 후 1 시간에서, 개별 패턴은 완전히 결합되지 않을 수 있습니다 (패턴 당 몇 세포), 그러나, 세포가 시간이 지남에 증식으로, 패턴은 접착제 표면 외부의 극소수의 세포로 완전히 식민지화 될 것이다 (그림2b). 배양의 정확한 외관은 세포주 의존적일 것이다. 예를 들어, mESC 형태 돔형 콜로니10. 셀 파종 후 패터닝이 1~2시간 명확하지 않은 칩은 시술의 실패를 나타낸다(도2c,d).
크고 두꺼운 식민지는 때때로 균일하게 염색하는 도전이 될 수 있습니다. 우리는 항체 침투(29)를향상시킬 수 있으므로 세포를 한 단계 (섹션 4)로 수정하고 투과시키는 것이 좋습니다. 이것이 선택한 고정 용액에 세제를 함유하는 이유입니다. 도 3은 면역 염색 후 예상되는 형광 신호를 나타낸다. 밝은 Id1 양성 세포는 콜로니의 조밀한 영역(밝은 NPC 영역) 내에서 발견됩니다(그림3A). 이와 같은 힌트는 항체 염색 절차의 품질을 평가하는 데 유용하다. 또한 현재 기술로 생성된 마이크로 패턴은 자동 형광입니다. 이 신호(그림3A,B 왼쪽 대부분의 이미지)는 분석 단계에서 서로 콜로니를 공간적으로 등록하고 도5에 도시된 결과를 생성하는 데 유용하다. 자동 형광 신호는 일반적으로 샘플이 405 nm 레이저로 흥분할 때 가장 밝으며이 채널은이 목적을 위해 염색하지 않고 방치해야합니다. 그림 3은 또한 셀이 서로 다른 모양의 패턴에 정확하게 구속되는 방법을 보여줍니다.
이미징 데이터의 분석은 당사의 실험실에서 개발된 무료 오픈 소스 소프트웨어인 PickCells에서 수행됩니다(준비 중 Blin et al.). 이 소프트웨어는 공초점 이미지를 읽고 정렬하는 이미지 분석 모듈(그림4-1),세그먼트(그림4-2,4-4)및 큐레이트 세그먼트 객체(그림4-3,4-5)를포함하고, 객체를 계산하기 위해 좌표 또는 평균 강도(그림 4-6)와 같은 기능을내보내고(그림4-7,4-8). 중요한 것은, 우리는 특히 마이크로 패턴에 성장한 세포와 같은 세포의 조밀하고 이질적인 인구에 적합한 Nessys28에게 불린 강력한 핵 분할 방법을 개발했습니다 (그림 3). 그림 4 -2는 각 개별 셀에 고유한 색상 ID가 정확하게 부여되는 네시스 모듈의 대표적인 출력을 보여줍니다. 최소한의 편집만 필요하지만 사용자가 그렇게 결정할 경우 편집이 가능합니다(그림 4-3). 마지막으로 PickCells은 데이터를 시각화하는 여러 시각화 모듈을 제공합니다. 그림4-6에서예를 들자면 고리 모양의 콜로니는 z축을 따라 자신의 위치에 따라 핵이 색으로 구분되는 3D로 렌더링됩니다. PickCells에서 분석의 유효성이 확인되면 그림 530과같이 (https://framagit.org/pickcellslab/hexmapr)에서 사용할 수 있는 스크립트를 사용하여 R에서 공간 맵을 만들기 위해 데이터를 내보낼 수 있습니다.
우리는 최근에 작은 (30,000 μm 2) 디스크 또는타원 미세 패턴에 mESC의 공간 감금이 중피 마커 Tbra10을발현하는 세포의 소집단의 패터닝을 안내한다는 것을 보여주었다. 따라서, 여기에서 우리의 방법을 설명하기 위하여는, 우리는 Tbra의 패터닝이 더 큰 식민지에 있는 BMP신호에 의해 영향을 받을 수 있는지 물어 (90,000 μm 2). 그림 5A는 mESC가 큰 디스크 마이크로 패턴에서 성장될 때, Tbra+ 세포가 우선적으로 패턴의 주변부로 제한된다는 것을 보여줍니다(Tbra+ 밀도 맵), 여기서 로컬 셀 밀도가 가장 낮습니다(그림 5A의 왼쪽에 있는 파란색 맵 참조) ). Tbra의 이 패터닝은 평균 Tbra 강도의 지도에 의해 확인됩니다.
이러한 데이터는 메서드가 하위 시각적 정보를 표시할 수 있음을 보여 줍니다. 실제로, 도3에서, 하나의 콜로니의 육안 검사는 Tbra 발현에서 공간 조직의 임의의 형태를 식별하기에 충분하지 않다. 이는 특히 도 5A의오른쪽 패널에 정량화되고 도시되는 콜로니 가변성에 대한 중요한 콜로니에 의해 설명된다.
이 기술은 또한 T 패터닝이 이 컨텍스트에서 BMP 시그널링에 의해 구동되지 않음을 나타낼 수 있는 Id1(BMP 시그널링의 대상)에 대해 검출 가능한 패터닝이 존재하지 않음을 보여줍니다.
마이크로 패터닝을 사용하면 식민지가 원하는 거의 모든 형상을 채택하도록 강제할 수 있습니다. 이는 시스템이 다양한 형상에 응답하는 방식을 심문하는 데 특히 유용합니다. 예를 들어, 우리는 모포겐 그라데이션이 식민지의 중심에 쌓이면 식민지에 구멍을 뚫어이 그라데이션을 방해할 수 있다고 추론할 수 있습니다. 흥미롭게도 우리는 여전히 덜 견고한 방식으로 링 마이크로 패턴에 패터닝을 관찰 (그림5B).
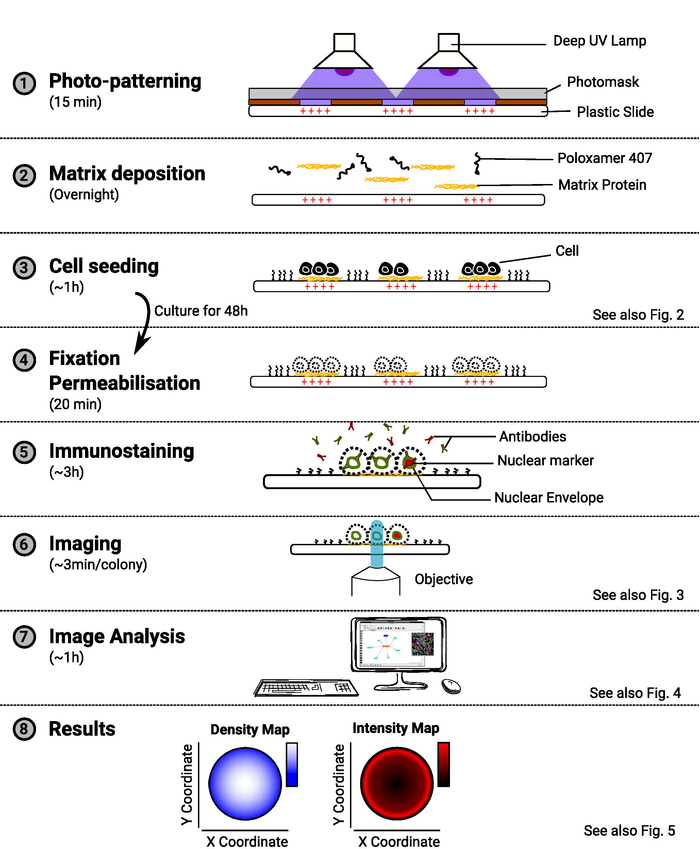
그림 1: 메서드 개요입니다. 메서드의 주요 단계를 보여 주면 다이어그램입니다. 각 단계에 대해 예상 시간은 작업의 이름으로 표시되고 회로도는 절차의 목적을 보여 줍니다. 사용 가능한 경우 관련 그림에 대한 참조도 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
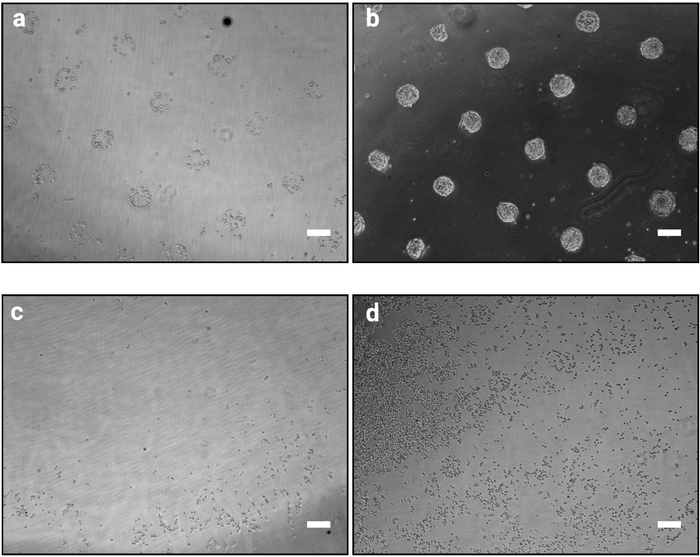
도 2: 마이크로패턴상에서 세포를 시드한 후 배양외관 1시간 및 48시간. 마이크로 패턴에 시드 mESC의 밝은 필드 이미지. (a) 시드 후 예상 세포 조직 1 시간, 패턴을 명확하게 식별 할 수 있어야합니다. (b) 48시간 이후에 예상되는 결과. mESC는 확산되어 여전히 패턴 모양에 엄격하게 국한되어 있습니다. (c-d) 가능한 비 최적 결과, 슬라이드 (c)의 주변을 제외하고 플라스틱에 부착하는 셀이 거의 없거나 패턴 (d) 사이에 세포가 부착됩니다. 문제 해결 가이드는 표 2를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
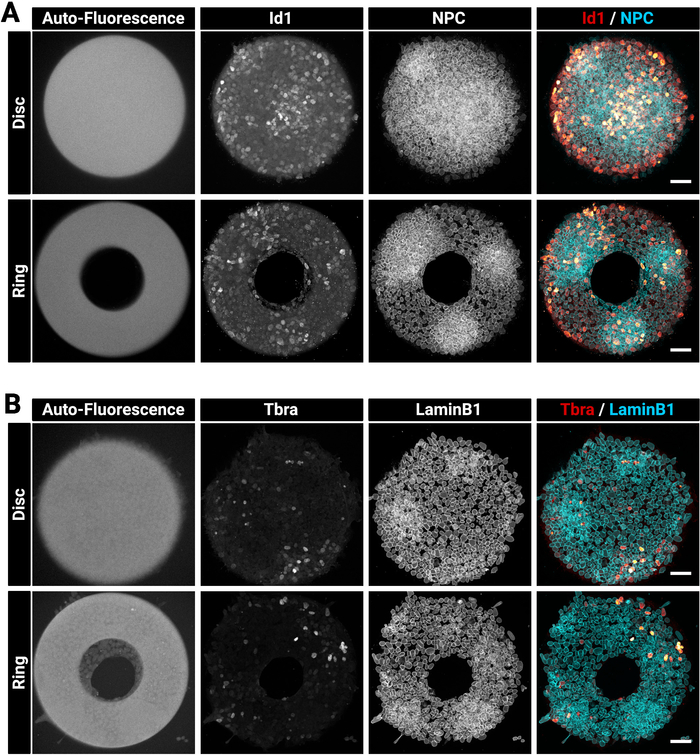
그림 3: 마이크로패턴에서 자란 면역 염색 콜로니의 대표적인 공초점 이미지.
대표적인 mESC 콜로니 (A) Id1및 핵 기공 복합체 또는 (B) 트브라 및 라민B1에 대한 면역형광 후. 각 염색에 대해, 디스크 마이크로패턴상에서 성장한 콜로니와 고리 마이크로패턴상에서 성장한 콜로니가 도시된다. 개별 채널은 회색 축척 이미지로 제공됩니다. 마이크로패턴(405 nm 레이저 여기)의 명확한 자동 형광 신호를 주목한다. 배율 막대는 50 μm을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
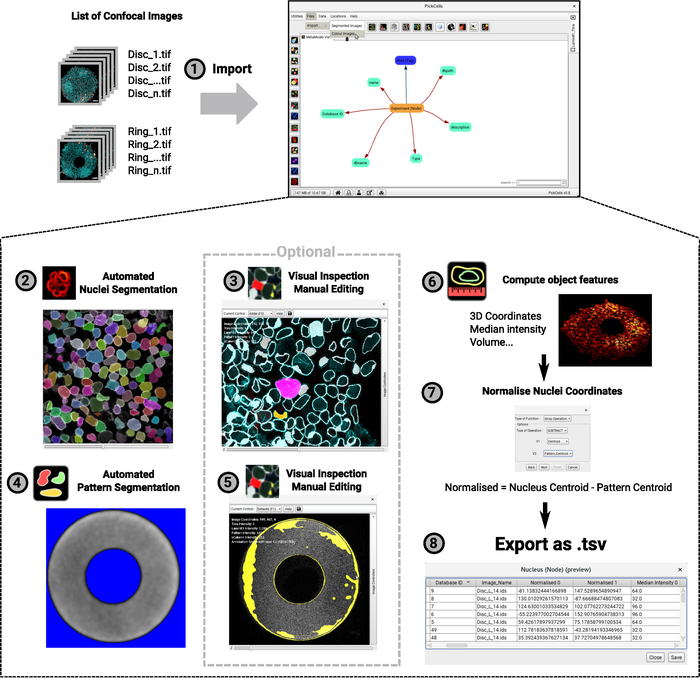
그림 4: 이미지 분석 절차의 흐름도입니다. 3D 공초점 이미지 목록은 분석을 위해 PickCells로가져옵니다(1). 이 예제에서는 두 개의 서로 다른 모양(그림 2에서와 같이 디스크 및 링)이 있는 실험을 보여 주십니다. 이미지 명명 규칙은 왼쪽에 표시되고 오른쪽에 PickCells 인터페이스가 표시됩니다. 그런 다음, 네시스 모듈은 자동으로 핵을분할하는 데 사용된다 (2). 스크린샷에서 각 개별 핵에는 정확한 세분화를 나타내는 고유한 색상이 주어집니다. 패턴의 자가형광도 '기본 세분화' 모듈(4)을 사용하여, 이번에는 세분화된다. 배경은 파란색으로 나타나고 흰색 신호는 패턴 모양으로 정의됩니다. 그런 다음 세분화된 셰이프를 시각적으로 검사하여 정확한 세분화를 보장하고 세분화편집기 모듈(3-5)을 사용하여 필요한 경우 편집합니다. 스크린샷은 검색된 셰이프의 윤곽을 보여줍니다. 분홍색과 노란색 모양이 편집되었습니다. 마지막으로 객체 피쳐가 계산되어 파일로 내보내져 나중에R(6-7)으로 처리됩니다. 3D 뷰로 렌더링된 콜로니의 스크린샷이 제공됩니다(6). 2단계에서 6단계의 경우 이 문서를 작성할 때 PickCells 인터페이스에 있는 아이콘이 단계 인덱스 옆에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
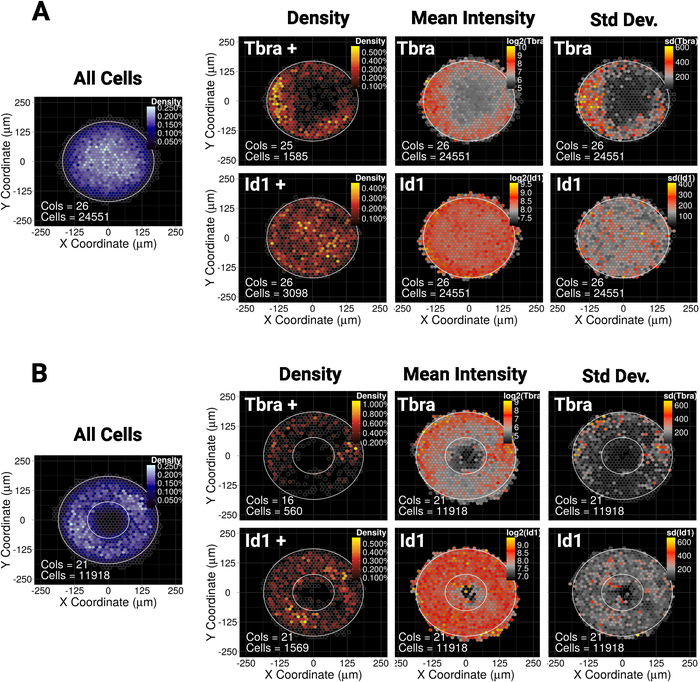
그림 5: 두 가지 전사 인자 및 마이크로패턴 모양에 대한 대표적인 결과
mESC에 대한 비닝 공간 맵은48 시간 동안 성장 (A) 디스크 모양의 마이크로 패턴 또는 (B) 링 모양의 마이크로 패턴. 각 마이크로 패턴 모양에 대해 셀 표현형에 관계없이 셀 밀도 맵이 파란색 눈금으로 왼쪽에 표시됩니다. 그런 다음 각 마커(상단 행의 Tbra 및 맨 아래 행의 Id1)에 대해 왼쪽에서 오른쪽으로 세 개의 별개의 맵이 제공됩니다: 셀만 을 표현하는 마커의 셀 밀도 맵(임계값 기반 분석), 평균 마커 강도(log2)의 맵 및 마커 강도의 표준 편차. 강도는 임의형광 단위로 제공됩니다. 각 맵에 대해 미세 패턴 모양은 흰색 윤곽선으로 지정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| ECM 타입 | 젤라틴 | 피브로넥틴 | 지하 멤브레인 매트릭스 | |
| 농도 | ECM 농도 | 1 mg/mL | 20 μg/mL | 200 μg/mL |
| 폴록사머 407 농도 | 500 μg/mL | 400 μg/mL | 1 mg/mL | |
| 테스트를 거친 경우 | 미시 (미국) | 예 | 예 | 예 |
| 미피시 | 아니요 | 예 | 예 | |
| 세럼 프리 미디엄 | 아니요 | 예 | 예 |
표 1: 폴록사머 407 및 ECM의 시험 농도. 이 표는 실험실에서 테스트한 ECM 및 폴록사머 407의 농도에 대한 개요를 제공합니다. 각 ECM/폴록사머 407 조합에 대해, 패터닝이 성공적으로 달성된 세포 유형은 배양이 혈청을 함유하는지 여부뿐만 아니라 도시된다. mESC = 마우스 배아 줄기 세포, mEpiSC = 마우스 에피블라스트 줄기 세포.
| 절차 | 관찰 | 가능한 문제 | 솔루션 |
| 마이크로 패터닝 | 낮은 셀 부착 | 부적절한 ECM/폴록사머 307 농도 비율 | ECM/폴록사머 307 농도 비율 증가 |
| 셀 부착 시간이 너무 짧습니다. | 세포가 패턴을 적절하게 부착할 수 있는 충분한 시간을 주기 위해 배양 시간을 늘립니다(단계 3.4). 이 단계를 최적화하기 위해 현미경으로 세포를 검사하면 세포가 부착되기 시작했음을 나타내는 세포 형태학의 변화를 감지하는 데 도움이 될 수 있습니다. | ||
| 너무 강렬한 서스로서(3.6단계) | 매체를 교체할 때는 칩에 직접 파이펫팅을 하지 마십시오. 대신, 부드럽게 대신 우물의 벽에 매체를 피펫 | ||
| 세포는 패턴 사이에 부착 | 부적절한 ECM/폴록사머 307 농도 비율 | ECM/폴록사머 407 농도 비율 감소 | |
| 셀 부착 시간이 너무 깁니다. | 인큐베이션 시간 감소(3.4단계). | ||
| 비효율적 인 세서 (3.6 단계) | 격렬 하 게 플레이트를 흔들어 일반적으로 초과 세포를 분리 하기에 충분 하다. 칩에 강하게 부착되는 경향이 있는 셀 유형의 경우 칩에 직접 피펫팅하면 결과가 향상될 수 있습니다. 세안 횟수를 늘리면 이 단계 이후에 배지에 세포가 떠 있지 않도록 하는 데 도움이 될 수 있습니다. | ||
| 셀은 패턴 모양을 엄격하게 따르지 않습니다. | '호환되지 않는' 셀 유형 및 패턴 형상 | 지정된 패턴 모양 및 셀 유형에 대한 최적의 패턴 크기를 테스트하고 식별할 수 있도록 포토마스크에 추가할 여러 형상/크기를 계획/설계합니다. 토론에서 '제한 사항' 섹션을 참조하십시오. | |
| 비최적 광 패터닝은, 자가형광 신호의 선명도를 관찰함으로써 진단될 수 있다. 패턴 경계는 그림 2에서와 같이 선명해 보입니다. 패턴의 테두리가 흐리게 나타나면 사진 패턴 단계를 개선해야 합니다. | 흐린 패턴 가장자리는 조명 단계에서 플라스틱 슬라이드가 마스크 표면에 충분히 가까이 있지 않음을 나타냅니다. 포토마스크에 슬라이드를 들고 있는 조각이 균일하고 조명 절차 중에 어셈블리에 일정하고 충분한 압력이 가해지도록 하십시오. | ||
| 얼룩 | 비균질 염색 | 항체 배양 시간이 너무 짧습니다. | 항체 배양 시간 증가 (실온에서 최대 24 시간) |
| 장착 절차 중에 평평한 식민지 | 세포를 장착할 필요 없이 면역 염색 및 이미징을 모두 수행하기 위해 chamlide 또는 cytoo-chamber과 같은 챔버에 마이크로패턴 슬라이드를 장착합니다. 이렇게 하면 식민지 3D 구조를 더 잘 보존할 수 있습니다. | ||
| 염색 절차 도중 식민지를 분리 | 칩의 데우팅 | 충분한 매체를 남겨두거나 2 개의 파이펫을 사용하고 하나는 매체를 제거하고 다른 하나는 신선한 용액을 추가하십시오. | |
| 식민지는 현미경의 밑에 전조나타납니다 | 현미경 슬라이드에 칩을 장착하는 동안 식민지가 전조되었습니다. | 칩을 장착할 때는 매우 부드럽게 하십시오. 양자택일로, 세포를 장착할 필요 없이 면역 염색 및 화상 진찰을 둘 다 능력을 발휘하기 위하여 chamlide cytoochambers와 같은 챔버에 마이크로패턴 슬라이드를 설치합니다. 이것은 또한 식민지 울트라 구조를 보존합니다. |
표 2: 문제 해결 가이드. 이 표에서는 가능한 최적이 아닌 결과에 대한 개요를 제공합니다. 문제의 잠재적인 원인도 권장 솔루션과 함께 나열됩니다.
토론
여기에서 우리는 세포의 배양에서 출현 패터닝을 분석하는 방법을 기술한다. 단순화된 마이크로패터닝 접근법은 세포 콜로니의 모양과 크기를 표준화하는 데 사용되며, 이러한 콜로니 내에서 패턴을 감지하고 정량화할 수 있는 이미지 분석 도구와 R 스크립트를 제공합니다.
우리가 제안하는 파이프라인은 저자가 상업적으로 이용 가능한 마이크로 패턴을 사용하여 ESC 식민지에서 재현 가능한 세균 층 형성을 얻기 위해 배양 조건에 초점을 맞추는 이전에 출판 된 방법31과 어느 정도 유사합니다. 시험관 내 조기 위도 발생 에 대한 연구. 우리의 목표는 세포의 집합적인 조직이 통계적인 분석 후에 명백하게 될 수 있는 시험관에서 패턴 대형의 발견을 위한 일반화 가능한 파이프라인을 제공하는 쪽으로 더 집중됩니다. 이러한 이유로, 우리는 여러 식민지에 걸쳐 3D 공간에서 핵 위치를 정확하게 식별하고 분석 할 수있는 강력한 이미지 분석 워크플로우를 제공합니다 (이 방법의 '이점 및 한계'섹션을 참조하십시오. 토론)을 참조하십시오. 우리는 또한 우리가 지역 사회에 도움이 될 것입니다 희망 장기적으로 상업적으로 사용할 수있는 솔루션에 대한 보다 유연하고 저렴한 대안을 제공하는 간단한 사내 마이크로 패턴 화 접근 방식을 개발하기로 결정했다.
마지막으로, 이 원고의 개정 과정에서 R 스크립트와 유사한 시험관 내 패터닝 분석을 위한 새로운 패키지가32로출시되었습니다. 이 새로운 패키지는 높은 처리량 이미징 플랫폼에서 얻을 수 있는 입력으로 셀 기능 테이블을 허용합니다. 우리는 우리가 이 가능성을 스스로 시험하지 는 않았지만 우리의 프로토콜의 7 단계에서 생성된 핵 기능의 표가 원칙적으로 이 새로운 패키지에 대한 입력으로 작용할 수 있다고 믿습니다.
다른 셀 유형 및 콜로니 형상에 대한 방법의 적응성
우리는 혈청의 존재에 있는 만능 세포의 배양에 있는 중피 전사 요인의 출현을 공부의 맥락에서 이 접근을 제시합니다. 그러나 이 방법은 ECM/poloxamer 407 농도를 최적화하는 것이 필요할 수 있지만 다른 세포 유형 및 무혈청 배양에 쉽게 적응할 수 있습니다(문제 해결 가이드의 경우 테스트된 농도에 대해서는 표 1 및 표 2 참조). 이 방법은 또한 사용자의 요구에 따라 더 크거나 작은 크기의 마이크로 패턴과 다양한 모양에 적응할 수 있습니다. 그러나 메서드를 설정하는 동안 모든 모양/셀 유형 조합이 최적이 아님을 유의하는 것이 중요합니다. 예를 들어, mESC는 E-cadherin33,34의 높은 수준을 표현하여 이러한 세포가 ECM이 없는 영역에 걸쳐 집단 구조를 형성할 수 있게 합니다. 이러한 셀은 날카로운 각도로 형상을 엄격하게 따르지 않거나 패턴에 작은 구멍이 포함되어 있지 않습니다. 예를 들어 그림 3B의링에서 세포가 중앙 영역을 식민지화하는 과정에 있음을 알 수 있습니다. 우리의 손에 작은 중앙 영역은 고리 모양의 식민지를 형성하는 mESC를 강제하지 않았다. 따라서 셀 유형에 적합한 최적의 크기와 곡률을 테스트하고 식별할 수 있도록 포토마스크를 설계하는 동안 다양한 형상을 포함하는 것이 좋습니다.
고려해야 할 또 다른 중요한 요소는 실험의 길이 및 세포의 증식 속도입니다. 일부 급속하게 증식하는 세포 유형(다능성 세포 포함)의 경우 며칠 동안 미세 패턴에서 세포를 유지하기어려울 수 있습니다(mESC의 경우 3일은 최대입니다). 또한, 마이크로 패턴에 세포의 파종은 항상 모든 식민지에 대해 최적으로 발생하지 않습니다, 그래서 여분의 식민지를 종자하는 것이 좋습니다.
패턴 감지 방법의 장점과 한계
이 방법의 한 가지 특별한 장점은 여러 복제 콜로니에서 이미지 분석 결과를 결합하여"평균" 패턴을 감지하는 기능입니다(그림 5). 이것은 개별 식민지의 검사에서 명백하지 않은 패터닝 이벤트를 나타낼 수 있습니다. 이 '평균화' 접근 방식의 단점은 작은 반점이나 좁은 줄무늬와 같은 특정 유형의 반복적 패턴을 놓칠 수 있다는 것입니다. 그러나 이러한 유형의 패턴은 신중하게 선택된 패턴 크기8의조합으로 대신 밝혀질 수 있습니다. 또한, 여기에 설명된 이미지 분석 파이프라인은 단일 셀 및 콜로니 해상도 모두에서 정량적데이터를 제공하여 식민지 간 가변성의 수준을 조사하거나 여러 개의 개체간 분석을 수행할 수 있는 가능성을 제공합니다(그림 5). 저울10.
평균화 방법의 또 다른 중요한 장점은 검출 채널의 사용 가능한 형광단에 의해 제한되지 않고 많은 마커의 우대 위치를 매핑할 수 있는 기회를 제공한다는 것입니다. 실제로, 우리는 여기에 제시 된 작품에서 차별화의 두 마커를 사용하지만, 식민지를 표준화하고 "평균"패턴을 추출 할 수있는 기능을 사용하면 순서대로 함께 식민지의 다른 세트에서 분포지도를 비교 할 수 있습니다 마커의 일반화된 공간 관계를 서로 드러낸다.
또한, 여기에서 우리의 초점은 분화의 마커를 공부하는 것이었지만, 분석 방법은 핵 마커가 유효한 그밖 생물학 프로세스를 공부하기 위하여 확장될 수 있습니다. 예를 들어 형광 유비퀴틴세포 주기 표시기 35(FUCCI)를 포함하는 세포주들의 미세패킹은 콜로니 레벨 지오메트리가 그룹의 세포 주기 사건에 어떻게 영향을 미칠 수 있는지 연구할 수 있게 한다.
향후 방향
이 방법은 중간 처리량 이미지 분석에 적합하지만 이미지 수집은 현재 완전히 자동화되지 않았으며 매우 큰 실험에 제한이 될 수 있습니다. 식민지의 정기적 인 배열은 가능한 가능한 단일 세포 평균20에대해 개발 된 것과 유사한 완전히 자동화 된 수집 루틴을 만들 수 있어야합니다. 그러나 식민지를 이미지화하는 데 필요한 필드의 크기가 크기 때문에 모자이크킹이 필요할 수 있으며, 식민지가 3차원이기 때문에 관련 콜로니만 이미징하여 데이터 집합 크기와 수집 시간을 모두 줄이는 것이 매우 바람직합니다. 따라서, 미래의 노력은 관련 식민지를 확인하고 각 견본에 화상 진찰 좌표를 적응할 수 있는 '지능형' 현미경을 개발하기 위하여 전념할 수 있습니다. 이렇게 하면 시간과 노력이 줄어들뿐만 아니라 잠재적인 작업자 편향을 방지할 수 있습니다.
분석 파이프라인은 사용자가 수행해야 하는 단계 수를 줄여 효율성을 높일 수도 있습니다. 우리는 파이프 라인 구축 메커니즘을 구축하고 우리의 소프트웨어에 직접 R을 통합 할 계획이있다 (또한 문제 pickcells-api #3 및 우리의 코드 리포지토리의 문제 추적기에서 pickcells-rjava #1 참조 [https://framagit.org/groups/pickcellslab/-/issues]). 분석 절차를 완전히 자동화하면 시간과 노력이 줄어들고 잠재적인 사용자 오류가 제한됩니다.
마지막으로, 분석 방법은 아직 셀룰러 패터닝의 동적 특성을 완전히 포착하지 못합니다. 일부 제한된 동적 정보는 스냅샷 이미지8,10,36의타임시리즈를 검사하여 추출할 수 있습니다. 그러나, 우리가 패터닝이 어떻게 나타나는지 더 잘 이해하길 원한다면 세포 집단의 역사를 기록할 수 있다는 것은 매우 바람직하다. 한 가지 제한은 3D 조밀한 세포 집단에 있는 개별세포의 정확한 추적이 37의 매우 도전적인 작업 남아 있다는 것입니다. 우리의 세포 검출 방법은 핵 봉투를 사용하고 조밀하고 중첩된 세포 집단28에서특히 잘 수행한다. 핵 봉투의 라이브 리포터는28,38 및 마이크로패터닝 기술의 한 가지 장점은 장기간 이미징 동안 세포가 시야 밖에서 이동하는 것을 방지하는 데 사용될 수 있다는 것이다. 전반적으로, 우리는 세포의 자동화 된 추적이 최근에 설립 된 도구28,39,40의 조합을 사용하여 달성 될 것이라고 확신하고이 기본에 새로운 통찰력을 가져와야한다 자기 조직의 원칙.
공개
저자는 공개 할 것이 없다
감사의 말
이 작품은 헨리 웰컴 박사 후 펠로우십 (WT100133에서 G.B.), 웰컴 트러스트 수석 펠로우십 (WT103789AIA to S.L.), 웰컴 트러스트 박사 과정 학생십 (108906 /Z/ Z / Z - D.W.)에 의해 지원되었습니다. 우리는 또한 마누엘 테리 박사가 포토패킹 기법에 대한 조언을 해주신 것에 대해 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
참고문헌
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878(2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939(2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- Micropatterning in cell biology. Pt. A. , Elsevier. Amsterdam. (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), Dayton, Ohio. 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366(2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438(2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514(2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872(2018).
- Weiswald, L. -B., Guinebretière, J. -M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106(2010).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. Available from: http://www.R-project.org/ (2013).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384(2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839(2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141(2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유