Method Article
使用微模式和定量成像绘制哺乳动物细胞的新兴空间组织图
摘要
这里介绍的方法使用微模式和定量成像来揭示哺乳动物文化内的空间组织。该技术在标准细胞生物学实验室中易于建立,为体外研究模式提供了一个可操作的系统。
摘要
生物学的一个基本目标是了解模式在发育过程中是如何出现的。几个小组已经表明,当干细胞在空间上被限制在微模式上时,可以在体外实现模式化,从而建立了实验模型,为在体外识别生物学的基本原理提供了独特的机会组织。
在这里,我们介绍我们自己的方法实现。我们采用了照片图案技术,以减少对专用设备的需求,以便更轻松地在标准细胞生物学实验室中建立该方法。我们还开发了一个免费、开源且易于安装的图像分析框架,以便精确测量标准形状和尺寸的细胞群中细胞亚群的优先定位。这种方法使得即使在看似混乱的细胞群中,也能揭示模式事件的存在。该技术提供定量见解,可用于分离环境的影响(例如,物理提示或内源信号),对给定模式处理过程的影响。
引言
在哺乳动物系统中,模式是细胞集体行为的一个紧急属性,因此,如果向细胞1、2、3、4提供适当的线索,模式可以在体外形成。5,6.揭示细胞在体外自我组织的内在能力的一种方法是强迫细胞形成定义的形状和大小的7、8、9、10的组/组群.实现这一点的技术是微模式11。通过微模式化,可以精确定义细胞外基质 (ECM) 分子沉积在表面上的位置。这反过来又决定了细胞可以粘附的位置,因此控制细胞在空间上组织的方式。
微模式化是一种具有多种应用的技术,例如,微模式化使微分12之前的初始条件标准化。重要的是,微模式使得很容易控制细胞群落的大小、形状和间距成为可能,这一特性可用于设计旨在询问细胞对形态原或物理线索的集体反应的实验7,8,10,13,14,15,16,17.
已经开发出几种微模式化方法。照片图案技术也许是建立18的最简单方法。这些方法也具有精度的优点,因为它们可以用来控制单细胞18,19,20的形状。然而,它们还需要昂贵的专用设备,包括旋转涂层、等离子室和UVO(UV-臭氧)清洁剂,这在标准生物学实验室中通常不容易买到。为了便于采用该技术,我们调整了协议,仅需要 UVO 灯。我们从市售塑料滑梯开始,可以使用剪刀或打孔切割到所需的格式。
微模式的一个重要用途是能够标准化殖民地,以便比较多个复制体的单个殖民地。这使得可以询问这些菌落内的模式形成在多大程度上是可重现的,并探讨影响模式处理过程鲁棒性的因素。重要的是,对多个标准化殖民地的"平均"模式进行量化,也可以揭示出模式化过程,否则这些过程不会很明显。能够量化标准化菌落上的模式的优点取决于能否准确测量蛋白质表达,最好是在单细胞水平上。然而,微图案上的细胞通常紧密包装,使其难以高精度分割。细胞通常也以三维而不是两维进行组织,在分段期间检测和保存三维 (3D) 信息可能具有挑战性。成功分割单元格后,需要计算方法从生成的数据集中提取模式信息。
我们开发了细分和图像分析工具,以帮助克服这些问题。此分析方法仅使用自由和开源软件,不需要实现命令行或编程知识。为了说明这种方法,我们使用小鼠胚胎干细胞(mES)细胞,它们自发地表示早期分化的标记物(Tbra)21、22。虽然没有明显的空间排列是视觉上可检测的,但该方法允许创建在菌落中优先定位T+细胞的地图。我们还表明,Tbra模式与表达Id1的细胞缺乏优先定位形成对比,这是骨形态遗传蛋白(BMP)通路23的直接读出。我们还讨论了该方法的当前局限性,以及该技术如何适应其他实验系统。
研究方案
注:图1提供了该方法的概述。
1. 面罩设计
- 根据Azioune等人18中描述的准则设计照片蒙版。有关本研究所使用的软件和掩膜制造商的参考,请参阅材料表。
注: 可以在一个蒙版上创建多个几何形状、形状大小或形状间距。UV 灯可以安装一个 15 厘米的相框,其中最多可包含 49 种不同的设计(假设 2 厘米 x 2 厘米芯片)。
2. 微型制造程序
- 准备必要的材料。
- 在磷酸盐缓冲盐水 (PBS) 中制备 0.1% 的波罗沙默 407 (10 mg 10 mL) 溶液,并在室温下留在摇摇器上。407号球形器需要大约20分钟才能溶解。
- 在10厘米见方的培养皿底部放置实验室薄膜(见材料表)。这将用作矩阵沉积的腔室。
- 清洁光掩膜的表面,首先使用100%丙酮,然后用100%异丙醇,最后用ddH2O。如果可能,请用干净的纸巾干燥照片蒙膜或以其他方式擦干面罩。
- 准备一块方形、坚硬和不透明的塑料片,其尺寸与照片蒙版大小完全相同(后来称为"支架")。
注:这将用于在照明步骤期间保持塑料盖玻片与照片蒙版接触。 - 打开 UVO 灯并运行加热照明 10 分钟。
- 创建照片图案芯片。
注: 可以调整程序以创建任何所需尺寸的芯片。为简单起见,我们在此处介绍了生成 12 mm 圆形微阵列芯片的过程。- 使用 12 mm 孔冲床,切割疏水性塑料滑片,以创建 12 mm 圆形盖玻片,并将其放入干净的新培养皿中。
注意:请时刻使用手套,避免皮肤接触塑料表面,因为这可能会损坏表面处理。 - 小心地用钳子从护盖上取下保护膜。
注:避免损坏塑料表面,因为在播种过程中可能会影响细胞在芯片上的位置(第 3 节)。 - 将照片蒙版放在干净稳定的表面上(例如,照片掩码盒),镀铬面朝上,并在所需芯片设计的位置添加 2 μL ddH2O 的滴。
- 将盖玻片放在 ddH2O 的掉落物上,然后轻轻按压。
注:确保面朝照罩的塑料侧是受前一步中移除的胶片保护的一侧。 - 将支架放在塑料滑梯上,用夹子小心地固定此三明治,以保持塑料件与照片蒙版接触。
注:将夹子尽可能靠近塑料玻片的位置,以确保塑料玻片与照片遮罩表面完全保持接触。 - 将组件放在距光源约 2 厘米的 UVO 灯中,并亮起 10 分钟。
注:当芯片放置在距离光源 2 厘米的距离时,在254 nm 波长下,光的功率估计为 6 mW/cm 2。 - 握住底部带有照片蒙版的三明治,小心地取下夹子,同时用一只手保持压力,以防止滑轨在拆卸三明治时移动。拆下支架,确保所有塑料件仍位于面罩上,且未卡在支架上。
- 在芯片上添加 ddH2O,然后轻轻地从照片蒙版上分离芯片。
注:如果塑料芯片粘在光掩膜上,请使用塑料移液器尖端分离芯片以推动芯片,同时将钳子稍稍保持在芯片上方,以防芯片突然脱落。 - 最后,将光图案芯片放置在基质沉积室中。
注:确保芯片的发光侧朝上。
- 使用 12 mm 孔冲床,切割疏水性塑料滑片,以创建 12 mm 圆形盖玻片,并将其放入干净的新培养皿中。
- 将矩阵存入。
注:本节中的所有程序都应在组织培养罩中执行。- 通过 0.22 μm 聚醚素 (PES) 过滤器过滤波罗沙默 407 溶液。
- 通过混合 500 μg/mL 无菌过滤球菌 407 和 1 mg/mL 明胶来制备 ECM 涂层溶液。
注:有关其他可能的ECM分子的其他信息,请参阅表1。 - 在每个发光芯片上加入200 μL的涂层溶液。实验膜将防止跌落到芯片外。
- 加入一个3厘米的培养皿,里面装满了ddH2O,以限制蒸发,并将其与芯片放在4°C过夜。
3. 播种程序
注:下面描述的步骤已针对CGR8小鼠胚胎干细胞(mESC)24使用标准mESC培养基进行了优化(另见材料表)。但是,原则上可以针对任何细胞类型调整该过程。另请注意,传统的小鼠胚胎干细胞的细胞培养在这里没有描述,因为广泛的文献可以在其他地方找到25。
- 吸气涂层溶液,用无菌PBS孵育芯片至少5分钟。
- 同时,在温暖的培养基中制备5.5 x 105细胞/mL的细胞悬浮液。
- 将200 μL的细胞悬浮液放在每个芯片上(+100,000个细胞/cm2)。
- 关闭播种室,使细胞在孵化器中粘附1小时。
- 1 小时后,用 500 μL/孔暖介质填充多孔板(4 孔或 24 孔板,取决于芯片数量),并将芯片用无菌钳子输送到板中。
- 大力摇动板,以分离非粘附细胞。吸气介质并立即更换为新鲜的加热介质。在显微镜下检查是否可见图案(图2a)。
注:使用mESC或其他基质蛋白以外的细胞系时,可能需要优化粘附时间(另见表2)。 - 重复此步骤,直到模式变得清晰可见,如图2a所示。
注: 此步骤至关重要,决定了该过程的成功。过于剧烈的洗涤过程可能会分离细胞,相反,洗涤不足可能导致细胞残留在模式之间(图2c,d)。
4. 固定
注:在培养48小时后,细胞应形成密集菌落,严格遵循图案的形状(如图2b所示)。
- 将芯片留在板中,取出约 90% 的介质,留下足够的介质以防止芯片干燥。
注:芯片切勿干燥,以避免污渍,并防止细胞脱离表面,这一点很重要。由于粘合图案之间的芯片表面疏水性,芯片可能有脱湿的倾向。在此阶段,固定剂可能导致大型圆顶菌落从芯片分离。砂液应该非常温和,最好通过在井侧移液来执行,而不是直接输送到芯片上。 - 每口井加入至少500μL的甲醛(PFA)基固定溶液,孵育10分钟。
注:如果菌落显得特别厚(超过5个细胞层),可能需要将固定时间调整到20分钟。 - 固定后,用洗涤液清洗3次(PBS,带0.01%的波罗夏默407)。在洗涤溶液中稀释50mM NH4Cl的额外洗涤可相互阻隔,以淬火残留的PFA交联活性。
- 在阻断溶液中孵育样品至少30分钟。
注:在此阶段,样品可在4°C下储存约一周,才能染色。如果是,用实验室薄膜密封板,以防止蒸发。
5. 免疫染色
- 在 10 厘米见方的培养皿底部放置一张实验膜,准备染色室。
- 制备抗体溶液(有关本文中使用的抗体和稀释液的列表,见表3)。
- 将芯片放入染色室,侧侧朝上支撑细胞,并立即将 100 μL 的初级抗体溶液添加到芯片上。
注意:在此阶段,芯片不应像步骤 4.1 中那样轻易去湿。然而,仍然应该小心,因为芯片不干燥是很重要的。如果需要处理多个芯片,请按顺序将步骤 5.3 应用于每个芯片。 - 在室温下在旋转平台上孵育1小时。
注:如果细胞已形成大型3D结构,则可能需要更长的孵育时间,以便对样品进行均匀染色。孵育时间可增加到24小时。然而,染色室必须包含一个3厘米的盘子,里面装满了水,染色室必须用实验室薄膜密封,以防止蒸发。 - 将芯片转移到新鲜的多孔板中,用洗涤液洗涤 3 次。
- 如步骤 5.3 和 5.4 所述,使用二级抗体进行孵育。
- 使用任何标准安装介质(例如 Mowiol)的 20 μL 将芯片安装在显微镜幻灯片上。
6. 成像
注:可在标准共聚焦显微镜上进行成像。在这里,我们只提供建议,以确保图像质量,这将足以进行后续的定量分析。
注意:为了避免任何操作员的偏见,只能使用核包络信号选择对图像的殖民地(以查看殖民地是否正确遵循图案的形状)。除非调整显微镜设置,否则应避免检查感兴趣的标记信号。
- 确保采集位深度为 12 位或 16 位。
- 确定适当的设置,以最大化每个图像通道的动态范围。特别是,避免图像剪切。
- 包括一个通道来成像微模式自荧光(参见图3)。
- 调整图像大小和缩放系数,以获得在 x 轴和 y 轴中介于 0.1 和 0.6 μm 之间的体素大小,在 z 轴中,其范围在 0.2 到 2 μm 之间。
注:例如,在这项研究中,我们使用的是一个反扫描共聚焦显微镜,其物镜为40倍(数值光圈等于1.3),图像大小为1024 x 1024像素,没有数字变焦,z步长大小为0.5 μm。这导致体素大小为0.38 μm x 0.38 μm x 0.5 μm。 - 对于每个殖民地,定义沿 z 轴的最小和最大位置,以确保获得整个殖民地。殖民地下方和上方应至少包括一个低到无信号的平面。
- 确保一致地获取 z 堆栈方向(始终从上到下或始终从下到上)
- 调整扫描速度、图像分辨率、帧平均和探测器增益,以确定图像质量和成像时间之间的最佳效果。作为指示,如图3所示,一个菌群的成像时间约为2~3分钟。
注意:所有图像,为了具有可比性,必须在相同的显微镜上采集相同的目标和采集设置。 - 在采集结束时,保存所有图像并分配一个唯一的命名约定,以标识每个图像表示的实验条件。
注:参见图 4作为示例,此约定将在分析过程中稍后使用。请注意,图像可以保存到任何格式,由生物Formats 26。如果菌落大于视野,可以使用ImageJ的拼接插件27。另请注意,在缝合的情况下,可能需要照明滚降校正。
7. 图像分析
注: 此过程的建议计算机规格为:16 GB RAM、多核 3.33 GHz CPU 和至少 50 GB 的磁盘空间(或更多,具体取决于已映像的芯片数)。该软件已在 Linux、Windows 和 MacOS 上进行了测试。PickCells 是一个跨平台图像分析应用程序,具有图形用户界面,专用于分析复杂多维图像中单元的集体组织(Blin 等人正在准备中)。请注意,有关 PickCells 的更多信息以及此处提及的特定模块的文档可在线找到:https://pickcellslab.frama.io/docs/。另请注意,随着我们不断改进软件,界面可能会发生变化。如果界面与图或视频显示的内容不同,请参阅在线手册。
- 按照联机提供的文档安装并运行 PickCells。
- 导入图像并验证所提供信息的准确性 (图4-1)。
- 记录每个通道的名称。
- 使用Nessys模块28(图4-2)基于核包络信号的分段核,并提供前缀(例如"核"),用于命名生成的分段图像。
注:有关使用情况和参数调整的文档可在https://framagit.org/pickcellslab/nessys找到。 - 如有必要,使用分段编辑器模块检查和编辑分段(图4-3)
注: 如果由于任何原因分段过程没有提供令人满意的结果,请手动删除数据库文件夹中的图像,并删除MetaModel视图中的"分段结果"节点。然后,重复步骤 7.4 和 7.5。如果仅对一小部分图像进行分段未提供令人满意的结果,则使用 Nessys 独立应用程序(请参阅 7.4 中的链接),尝试对"错误映像"进行分段,并替换数据库文件夹中的相应文件。 - 使用基本分段模块对模式自荧光信号进行分段 (图 4-4)
- 提供前缀(例如"模式"),用于命名生成的分段图像。
- 选择包含自荧光信号的通道。
- 应用降噪;通常使用内核大小为 10 x 10 x 0.5 体素的高斯滤波器可产生令人满意的结果。
- 设置较低的阈值,使背景显示为蓝色,而前景显示为白色。还将上阈值设置为最大值,以避免从最终结果(红色区域)中排除高强度。
- 选择跳过最后一步。
- 单击完成并等待,直到处理所有图像。
- 至于核,分割结果现在可以目视检查和纠正,如果需要,使用分段编辑器模块(图4-5)。
- 创建原子核对象并计算基本对象特征。
- 从主接口左侧的任务栏启动内部功能模块(图 4-6)。
- 关闭椭圆体拟合仪和曲面提取器面板,仅使"基本特征"面板保持打开状态。
- 选择Nucleus作为对象类型,并选择步骤 7.4 中为"分段图像"提供的前缀。
- 按计算并等待,直到处理所有图像。
注: 此步骤后,无法再次编辑核分割。
- 创建图案对象并计算基本对象要素。重复步骤 7.8.1 到 7.8.4,只有这一次选择自定义类型作为对象类型,步骤 7.6.1 中给出的前缀对于分段图像。
注: 此步骤后,无法再次编辑模式分段。 - 将每个原子核所属的图像的名称存储为核心属性。
- 单击"数据 > 新属性",并在弹出对话框中选择Nucleus,然后单击"确定"。
- 选择从连接到节点的其他对象收集数据,然后单击"下一步"。
- 在左侧面板中,选择"图像",然后双击"路径定义"面板中的"完成"标志下的询问标记,将图像节点设置为路径的目标。
- 展开左侧面板上的"可用属性"窗格并选择名称属性。
- 展开"减少操作"窗格并选择"获取一个",然后单击"更改"按钮并单击"下一步"。
- 键入"图像名称",按制表键,然后单击"确定"。
- 在原子核对象中创建一个"标准化坐标"属性(图4-7)。
- 调整步骤 7.10.1 到 7.10.6,将图案质心的坐标存储为核心属性。命名此新属性"模式坐标"。
- 然后,单击数据 > 新属性,选择"核心",然后单击"确定"。
- 选择在节点的空间或方向矢量之间定义函数,然后单击"下一步"。
- 对于函数类型,选择数组操作,对于 V1 选择"项矢量",然后选择"中心";对于 V2选择"项矢量",然后选择"模式协调e"。
- 单击"下一步",在"名称"字段中键入"标准化坐标",然后单击"完成"。
- 将数据导出到选项卡分隔的值文件中。
8. R 分析
- 下载并安装 Rstudio。
注:软件信息和下载链接可在https://www.rstudio.com/。 - 下载此分析所需的 R 脚本。
注:脚本可以从 GitLab 存储库下载:https://framagit.org/pickcellslab/hexmapr。 - 打开 Rstudio。
注: 如果首次运行脚本,请安装所需的 R 包(ggplot2 和缩放)。 - 从 Rstudio 中,打开 binnedmap_模板。R 脚本。
- 将工作目录设置为源文件位置。
- 按照脚本中提供的说明将脚本调整到任何给定的数据集,以便获取空间地图,如图5所示。
- 运行脚本以生成密度图。
结果
此处描述的照片图案方法使得将培养的细胞精确组织成已定义的形状和大小的菌群成为可能。这个过程的成功应该在细胞播种过程(步骤3.7)之后立即明显显示,因为粘附细胞将按照光掩膜设计聚集,如图2a所示。在细胞播种后1小时,单个模式可能无法完全结合(每个模式只有几个细胞),但是,随着细胞随时间的增殖,模式将完全殖民化,只有很少的细胞在粘合表面之外(图2b)。区域性的确切外观将依赖于单元格线。例如,mESC 形成圆顶形状的殖民地10。在细胞播种后1至2小时未清除图案的芯片表示该过程失败(图2c,d)。
大而厚的菌落有时很难均匀染色。我们建议修复和渗透细胞在一个步骤(第4节),因为这可以提高抗体渗透29。这就是为什么所选择的固定溶液含有洗涤剂的原因。图3显示了免疫染色后预期的荧光信号。请注意,明亮的Id1阳性细胞在菌落的密集区域(明亮的NPC区域)内发现(图3A)。诸如此类的提示有助于评估抗体染色程序的质量。另请注意,使用本技术创建的微模式是自荧光的。此信号(图 3A,B留下大多数图像)在分析阶段非常有用,可以彼此在空间上注册菌落并创建如图5所示的结果。当样品使用 405 nm 激光激发时,自荧光信号通常是最亮的,因此该通道应不留下染色。图 3还显示了细胞如何精确约束不同形状的图案。
成像数据分析在 PickCells 中执行,这是一个在我们的实验室开发的免费开源软件(Blin 等人,正在准备中)。该软件包括图像分析模块,用于读取和排序共聚焦图像(图4-1),以分段(图4-2,4-4)和整理分段对象(图4-3,4-5),以计算对象坐标或平均强度等特征(图4-6)和导出数据(图4-7,4-8)。重要的是,我们开发了一种强大的核分割方法,称为Nessys28,它特别适用于密集和异质的细胞群,如在微模式上生长的细胞(图3)。图 4-2显示了 Nessys 模块的代表性输出,其中每个单独的单元格都准确地被赋予了唯一的颜色标识。只需要最少的编辑,但是编辑是可行的,如果用户决定这样做(图4-3)。最后,PickCells 提供了许多可视化模块来可视化数据。图4-6给出了一个例子:一个环形菌群在3D中呈现,其中核根据其沿z轴的位置进行颜色编码。在 PickCells 中验证分析后,可以导出数据,使用 (https://framagit.org/pickcellslab/hexmapr) 处可用的脚本在 R 中创建空间地图,如图530所示。
我们最近已经表明,在小(30,000μm 2)圆盘或椭圆微图案上,mESC的空间限制指导表达中皮标记Tbra10的细胞亚群的图案。因此,为了说明我们的方法,我们询问Tbra的图案是否会受到较大菌落(90,000 μm2)中的BMP信号的影响。图 5A显示,当 mESC 在大型光盘微阵列上生长时,Tbra+ 细胞优先限制在图案的外围(Tbra+ 密度图),其中局部单元密度最低(参见图 5A左侧的蓝色地图)).Tbra 的这种图案由平均 Tbra 强度图确认。
这些数据表明,该方法可以揭示子视觉信息。事实上,从图3开始,对一个殖民地的目视检查不足以识别Tbra表达式中任何形式的空间组织。这一点被重要的殖民地对殖民地变异性的解释,这是量化的,并显示在图5A的最右侧面板。
该技术还表明,Id1(BMP 信令的目标)不存在可检测的模式,这可能表明 T 模式化不是由此上下文中的 BMP 信令驱动的。
微观图案使得迫使菌落采用几乎任何所需的几何形状成为可能。这对于询问系统如何响应各种几何形状特别有用。例如,我们可能会推断,如果形态梯度在殖民地的中心堆积,在殖民地中创建一个洞会破坏这个梯度。有趣的是,我们仍然观察到环微图案上的图案,尽管其方式不太健壮(图5B)。
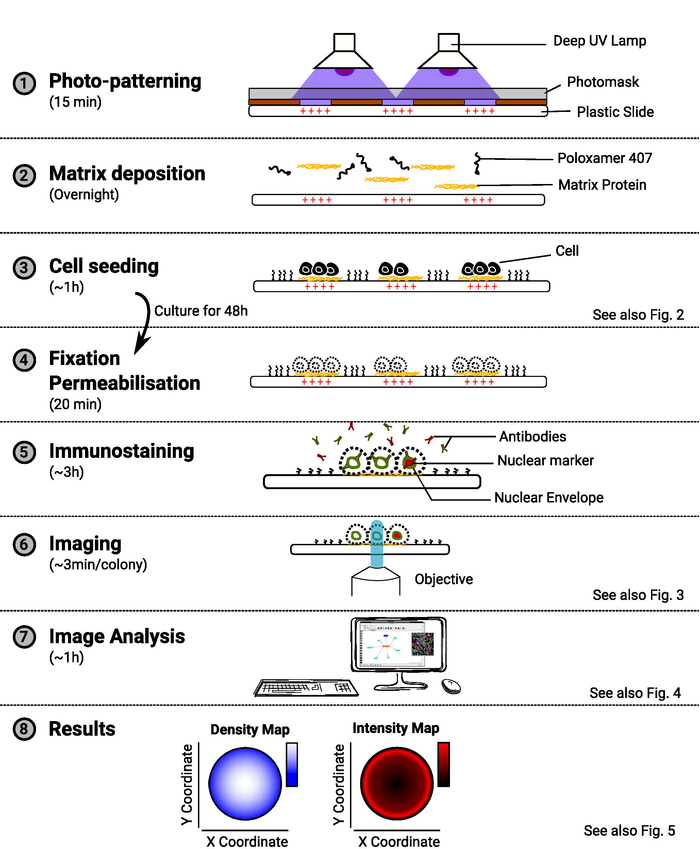
图 1:方法概述。显示方法主要步骤的图表。对于每个步骤,估计的时间量以任务名称表示,并且原理图说明了该过程的用途。如有参考,也可提及相关数字。请点击此处查看此图的较大版本。
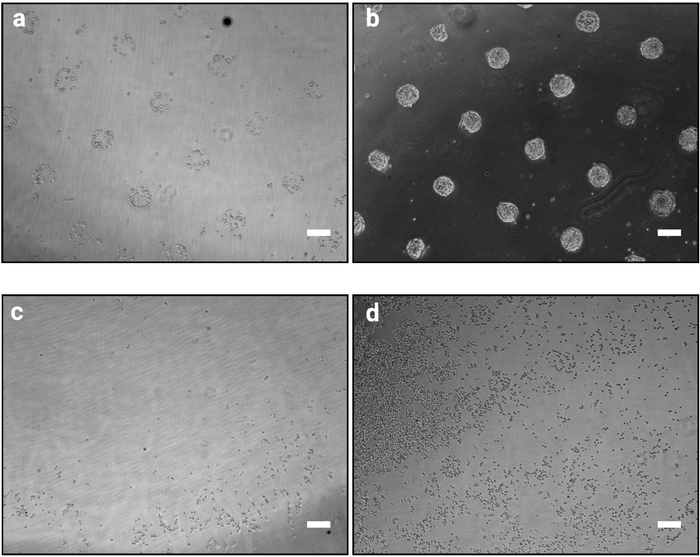
图2:在微模式上播种细胞后,培养外观为1小时和48小时。在微阵列上播种的 mESC 的明亮场图像。(a) 种子播种后,预期细胞组织1小时,模式应清晰识别。(b) 48小时文化后的预期结果.mESC 已经扩散,并且仍然严格限于图案形状。(c_d)可能的非最佳结果,除了在幻灯片(c)的外围,只有极少数细胞附着在塑料上,或者细胞附着在模式(d)之间。有关故障排除指南,请参阅表2。请点击此处查看此图的较大版本。
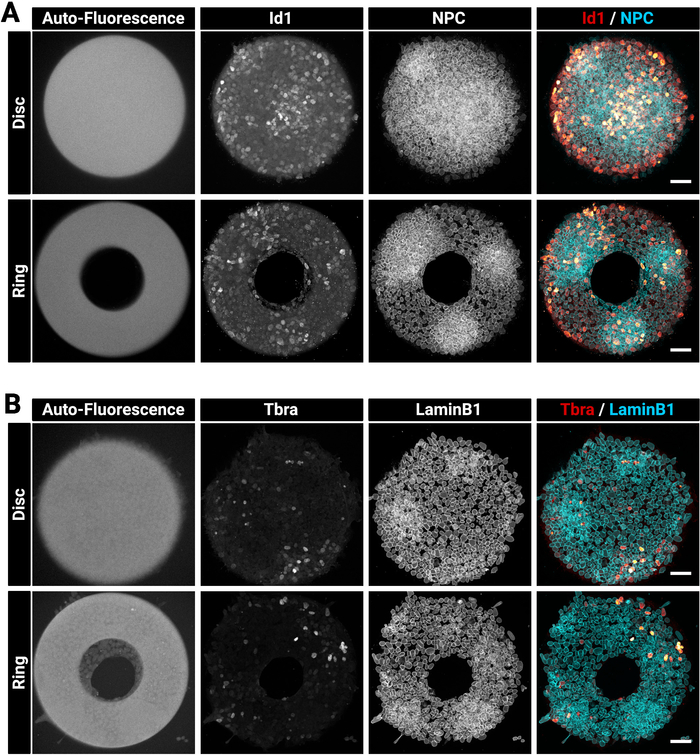
图3:在微模式上生长的免疫染色菌落的代表性共聚焦图像。
(A ) Id1 和核孔复合物或 (B) Tbra 和 LaminB1 的免疫荧光后代表性的 mESC 菌落.对于每个染色,显示一个在圆盘微图案上生长的菌落和在环微图案上生长的菌群。单个通道以灰度图像提供。请注意微阵列(405 nm 激光激发)的透明自动荧光信号。比例尺表示50μm。请点击此处查看此图的较大版本。
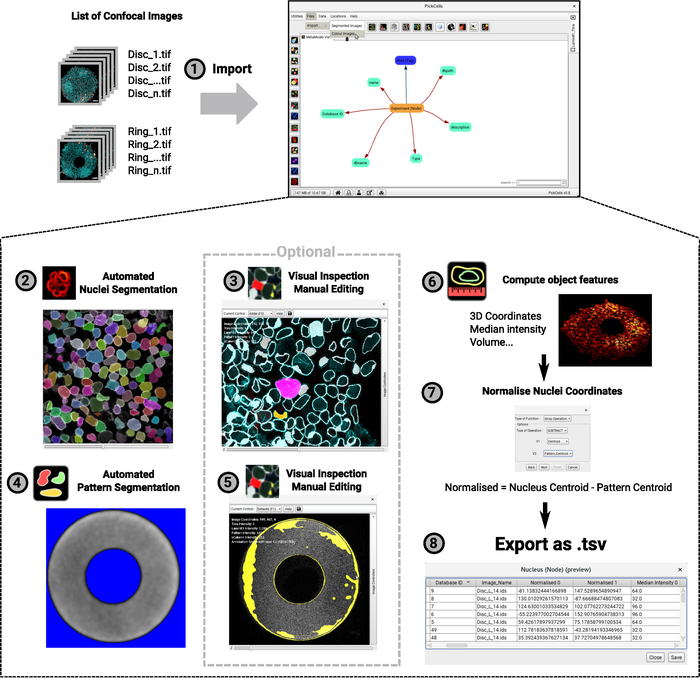
图 4:图像分析过程的流程图。3D 共聚焦图像的列表将导入 PickCells 进行分析 (1)。此示例显示了具有两个不同形状的实验(如图 2所示的圆盘和圆环)。图像命名约定显示在左侧,PickCells 界面显示在右侧。然后,Nessys模块用于自动分割原子核 (2)。在屏幕截图中,每个单独的细胞核都被赋予一个独特的颜色,指示准确的分割。模式的自荧光也分段,这一次,使用"基本分割"模块(4)。背景以蓝色和白色信号形式出现,将定义为图案形状。然后目视检查分割形状,以确保准确的分割,如果需要,请使用分段编辑器模块 (3⁄5) 进行编辑。屏幕截图显示检测到的形状的轮廓。粉红色和黄色的形状已经过编辑。最后,计算对象要素并将其导出到文件中,以便稍后处理到 R (6+7)。提供作为 3D 视图呈现的殖民地的屏幕截图 (6)。对于步骤 2 到 6,在撰写本文时在 PickCells 界面中找到的图标位于步骤索引旁边。请点击此处查看此图的较大版本。
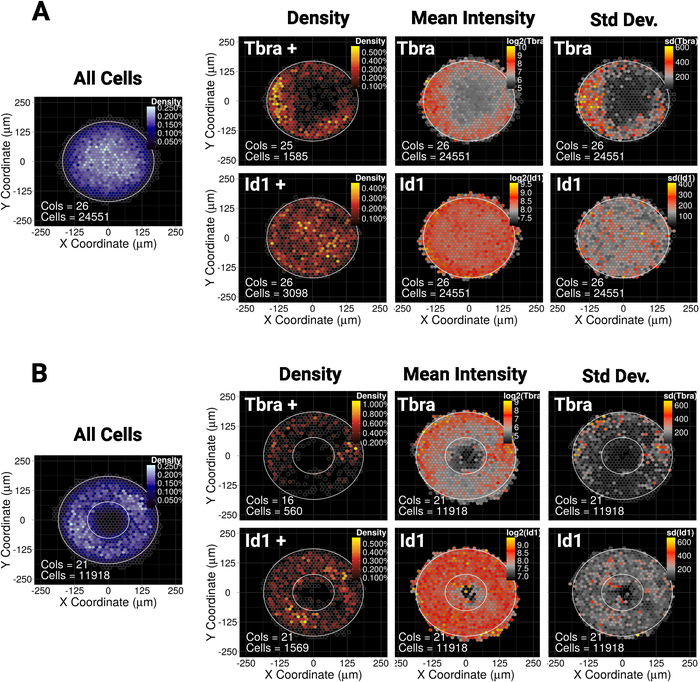
图 5:两个不同转录因子和微图案形状的代表性结果
在 (A) 圆盘形微图案或 (B) 环形微图案上生长 48 h 的 mESC 的 Binned 空间图。对于每个微图案形状,单元格密度图(无论细胞表型如何)在左侧以蓝色比例显示。然后,对于每个标记(顶行上的 Tbra 和底行上的 Id1),提供了三个不同的映射,从左到右:仅表示单元格的标记的单元格密度图(基于阈值的分析)、平均标记强度的映射 (log2) 和标记强度的标准偏差。强度作为任意荧光单位给出。对于每个贴图,微图案形状以白色轮廓形式给出。请点击此处查看此图的较大版本。
| ECM 类型 | 明 胶 | 纤维 | 地下室膜矩阵 | |
| 浓度 | ECM 浓度 | 1毫克/升 | 20 μg/mL | 200 μg/mL |
| 波洛夏默 407 浓度 | 500 μg/mL | 400 μg/mL | 1毫克/升 | |
| 测试后 | mESC | 是的 | 是的 | 是的 |
| mEpiSC | 不 | 是的 | 是的 | |
| 无血清介质 | 不 | 是的 | 是的 |
表1:测试的球形沙默407和ECM浓度。下表概述了我们在实验室中测试的 ECM 和 poloxamer 407 的浓度。对于每个 ECM/poloxamer 407 组合,将显示成功实现模式化的细胞类型,以及培养物是否包含血清。mESC = 小鼠胚胎干细胞,mEpiSC = 小鼠表位细胞。
| 程序 | 观察 | 可能的问题 | 解决 方案 |
| 微模式化 | 低细胞附件 | 不当 ECM/poloxamer 307 浓度比 | 提高 ECM/poloxamer 307 浓度比 |
| 细胞连接时间太短 | 增加孵育时间,给细胞足够的时间,以正确粘附模式(步骤3.4)。为了优化此步骤,在显微镜下检查细胞有助于检测细胞形态的变化,表明细胞已开始粘附。 | ||
| 瓦赫太紧张(步骤 3.6) | 更换介质时,避免将介质直接移液到芯片上。相反,轻轻地移液在井壁上的介质,而不是 | ||
| 细胞在模式之间粘附 | 不当 ECM/poloxamer 307 浓度比 | 降低 ECM/poloxamer 407 浓度比 | |
| 细胞连接时间过长 | 减少孵育时间(步骤3.4)。 | ||
| 瓦赫无效(步骤 3.6) | 大力摇动板通常足以分离多余的细胞。对于倾向于强烈粘附在芯片上的细胞类型,直接移液到芯片上可以改善结果。增加分压次数也会有所帮助,特别是确保在这一步之后,没有细胞在介质中保持浮动。 | ||
| 单元格不严格遵循图案形状 | "不兼容"单元格类型和阵列几何体 | 计划/设计要添加到照片蒙版中的多个几何/尺寸,以便能够测试和识别给定阵列形状和像元类型的最佳阵列大小。请参阅讨论中的"限制"部分 | |
| 非最佳光图案,这可以通过观察自荧光信号的锐度来诊断。图案边界应如图 2 所示锐利。如果图案的边界出现模糊,则需要改进照片图案步骤。 | 模糊的图案边缘表示在照明步骤期间塑料滑块不够靠近蒙版表面。确保将幻灯片固定到照片蒙版上,并确保在照明过程中对组件施加恒定且足够的压力。 | ||
| 染色 | 非均匀染色 | 抗体孵育时间太短 | 增加抗体孵育时间(室温下长达24小时) |
| 在安装过程中扁平的菌落 | 将微模式滑轨安装在腔室(如香胶或细胞室)中,以执行免疫染色和成像,而无需安装细胞。这将更好地保护殖民地的3D结构。 | ||
| 在染色过程中分离菌落 | 芯片的润湿 | 留下足够的介质或使用2个移液器,一个用于去除介质,另一个用于添加新的溶液 | |
| 殖民地在显微镜下出现被分 | 在显微镜幻灯片上安装芯片时,菌落被切屑 | 安装芯片时要非常温和。或者,在腔室(如香胶或囊腔)中安装微模式滑动,以执行免疫染色和成像,而无需安装细胞。这也保留了殖民地的超结构。 |
表 2:故障排除指南。此表概述了可能的次优结果。问题的潜在根源也列出了建议的解决方案。
讨论
在这里,我们描述了一种分析细胞培养物中紧急模式的方法。简化的微模式方法用于标准化细胞群的形状和大小,我们提供了图像分析工具和R脚本,能够检测和量化这些菌落中的模式。
我们提出的管道在某种程度上与先前公布的方法31类似,作者侧重于培养条件,使用市售微模式,在ESC菌落中取得可重复的生殖层形成。研究体外早期胃化事件。我们的目标是更专注于为在体外发现模式形成提供一个可通用的管道,在体外,细胞的集体组织只有在统计分析后才能显现出来。因此,我们提供强大的图像分析工作流程,能够准确识别和分析多个殖民地的三维空间中的核位置(另请参阅本殖民地的"模式检测方法的优点和局限性"部分)讨论)。我们还决定开发一种简单的内部微模式方法,长期提供更灵活、更便宜的替代商业解决方案,我们希望对社区有用。
最后,我们注意到,在修订本手稿期间,已经发布了一个新的包,用于分析体外模式,类似于我们的R脚本。此新包接受单元功能表作为输入,可以从高吞吐量映像平台获取。我们认为,在协议第7步生成的核特征表原则上可以作为这个新包的输入,尽管我们自己还没有测试这种可能性。
该方法对其他细胞类型和菌群几何体的适应性
我们在研究多能细胞培养物中存在多能细胞的中皮转录因子时提出这种方法。然而,该方法很容易适应其他细胞类型和无血清培养物,尽管可能需要优化ECM/poloxamer 407浓度(参见表1,了解测试浓度,见表2,了解故障排除指南)。该方法还可以根据用户的需求,适应较大或更小尺寸的微型图案和多种形状。但是,在建立该方法时,请务必注意并非所有形状/单元格类型组合都是最佳的。例如,mESC 表示高浓度的 E-cadherin33,34使这些细胞能够形成跨越无 ECM 区域的集体结构。这些单元格不严格遵循具有锐角或包括图案中小孔的几何形状。例如,请注意,在图 3B的环上,单元格正在殖民中心区域。在我们手中,一个较小的中心区域并没有迫使mESC形成环形殖民地。因此,强烈建议在设计照片蒙版时包括多种几何形状,以便能够测试和识别最适合所选择的细胞类型的尺寸和曲率。
另一个需要考虑的重要因素是实验的长度和细胞的增殖率。对于一些快速增殖的细胞类型(包括多能细胞),在多天内很难在微模式上维持细胞(对于mESC,最多三天)。此外,在微模式上播种细胞并不总是以最佳方式针对每个菌落,因此建议为有备件而播种过多的菌落。
模式检测方法的优点和局限性
该方法的一个特别优点是通过合并来自多个复制菌落的图像分析结果来检测"平均"模式(图5)。这可以揭示从单个殖民地的检查中并不明显的模式事件。这种"平均"方法的缺点是,它可能会错过某些类型的重复模式,例如小点或窄条纹。但是,这些类型的模式可能改为通过精心挑选的图案大小8的组合来显示。此外,此处描述的图像分析管道提供单单元和菌群分辨率的定量数据,提供了研究菌群间变异水平(图5)或以多个比例表10.
平均方法的另一个重要优点是,它提供了绘制许多标记的偏好位置的机会,而不受检测通道的可用荧光量的限制。事实上,尽管我们在这里介绍的工作中只使用了两个区分标记,但标准化殖民地和提取"平均"模式的能力使得可以按顺序将不同殖民地的分布图进行比较揭示标记彼此的广义空间关系。
此外,尽管我们在这里的重点是研究微分标记,但分析方法可以扩展到研究有核标记的其他生物过程。例如,对含有荧光泛化细胞周期指示器35 (FUCCI) 的细胞系进行微模式化,可以研究菌群水平几何体如何影响组中的细胞周期事件。
未来方向
该方法适用于中等吞吐量的图像分析,但是,图像采集目前尚未完全自动化,并且对于非常大的实验来说可能会受到限制。殖民地的常规安排应能创造全自动采集程序,类似于为平均20个单细胞开发的自动化采集程序。但是,由于对菌落进行成像所需的场面积很大,可能需要镶嵌,并且由于菌落是三维的,因此最好通过仅对相关菌落进行成像来减小数据集大小和采集时间。因此,今后可能会致力于开发一种"智能"显微镜,能够识别相关菌落并调整成像坐标以适应每个样品。这不仅可以减少时间和精力,而且还可以防止潜在的操作员偏见。
通过减少用户需要采取的步骤数,还可以提高分析管道的效率。我们计划构建管道构建机制,并将 R 直接集成到我们的软件中(请参阅代码存储库的问题跟踪器 [https://framagit.org/groups/pickcellslab/-/issues] 中的问题选择单元 api_3 和 pickcell-rjava_1)。分析过程的完全自动化将减少时间和精力并限制潜在的用户错误。
最后,我们注意到,我们的分析方法尚未完全捕获细胞模式的动态性质。通过检查快照图像8、10、36的时间序列,可以提取一些有限的动态信息。然而,如果我们希望更好地了解模式是如何出现的,能够记录细胞群的历史是非常可取的。一个限制是,精确跟踪单个细胞在3D密集细胞群仍然是一个非常具有挑战性的任务37。我们的细胞检测方法使用核包络,在致密和重叠的细胞群28上表现特别好。核信封的现场记者随时可以找到28,38和微模式技术的一个优点是,它可以用来防止细胞在长期成像期间移动到视野之外。总体而言,我们相信,使用最近建立的工具 28、39、40 的组合,可以实现细胞的自动跟踪,并且这应该为基本自我组织的原则。
披露声明
作者没有什么可透露的
致谢
这项工作由亨利·韦康爵士博士后奖学金(WT100133至G.B.)、威康信托高级奖学金(WT103789AIA至S.L.)和威康信托博士生奖学金(108906/Z/15/Z至D.W.)资助。我们也感谢曼努埃尔·托里博士关于调整照片图案技术的建议。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 31350-010 | handle in fume hood |
| 1× Master quartz anti-reflective chromium photomask | Toppan Photomask | Custom design | |
| 24-well plates | Corning | 3526 | |
| 4-well plates | Nunclon Delta | 176740 | |
| 5% Donkey Serum | Sigma | D9663 | |
| Anti Nuclear pore complex | Abcam | ab24609 | Mouse monoclonal, use 1:1000 |
| Anti-Id1 | Biocheck | 37-2 | Rabbit polyclonal, use 1:200 |
| Anti-Lamin B1 | Abcam | ab16048 | Rabbit polyclonal, use 1:1000 |
| Anti-Tbra | R&D | AF2085 | Goat ployclonal, use 1:400 |
| Blocking Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 5% Donkey Serum 0.003% Sodium Azide In PBS |
| CGR8 mESC | NA | NA | Reference: Mountford et al. PNAS, 1994 |
| Fixation solution | NA | NA | 4% PFA diluted in washing solution |
| Foetal bovine serum | Gibco | 10270-106 | Serum batches must be tested to ensure compatibility with ESC maintenance |
| Gelatin | Sigma | G1890 | |
| Glasgow Minimum Essential Medium | Sigma | G5154 | |
| Laboratory Film | VWR | 291-1212 | |
| Layout Editor Software | LayoutEditor | NA | https://layouteditor.com/ |
| Layout Editor Software | Klayout | NA | https://www.klayout.de/ |
| L-glutamine | Gibco | 25030-024 | |
| LIF | Millipore | ESG1107 | |
| MEM NEAA | Gibco | 11140-035 | |
| mESC Culture medium | NA | NA | GMEM 10% FCS 100 U/ml LIF 100 nM 2-mercaptoethanol 1× non-essential amino acids, 2 mM L- glutamine 1 mM sodium pyruvate |
| NH4Cl 50mM | Sigma | 9718 | |
| Paraformaldehyde | Sigma | 158127 | CAUTION: Toxic, handle undiluted stocks in fume hood and wear protective equipment |
| PBS (immunostaining) | Sigma | P4417 | Dilute in 200ml of ddH2O |
| PBS (tissue culture) | Gibco | 11140-035 | |
| Plastic slides | Ibidi | IB-10813 | |
| Poloxamer 407 | Sigma | P2443 | |
| ProLong Gold Antifade Mountant | Molecular Probes | P36930 | |
| Sodium Azide | Sigma | 8591 | CAUTION: Toxic, handle in fume hood and wear protective equipment |
| Sodium pyruvate | Gibco | 11360070 | |
| TritonX-100 | Sigma | T8532 | |
| Trypsin | Gibco | 25200056 | |
| UVO cleaner | Jetlight, USA | 42-220 | CAUTION: Follow manufacturer’s safety recommendations |
| Washing Solution | NA | NA | 0.1% TritonX-100 0.01% Pluronic F-127 In PBS |
参考文献
- Sasai, Y. Cytosystems dynamics in self-organization of tissue architecture. Nature. 493 (7432), 318-326 (2013).
- Turner, D. A., Baillie-Johnson, P., Martinez Arias, A. Organoids and the genetically encoded self-assembly of embryonic stem cells. BioEssays. 38 (2), 181-191 (2016).
- Simunovic, M., Brivanlou, A. H. Embryoids, organoids and gastruloids: new approaches to understanding embryogenesis. Development. 144 (6), 976-985 (2017).
- Tewary, M., Shakiba, N., Zandstra, P. W. Stem cell bioengineering: building from stem cell biology. Nature Reviews. Genetics. 19 (10), 595-614 (2018).
- Shahbazi, M. N., Zernicka-Goetz, M. Deconstructing and reconstructing the mouse and human early embryo. Nature Cell Biology. 20 (8), 878 (2018).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939 (2017).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Tewary, M., et al. A stepwise model of Reaction-Diffusion and Positional-Information governs self-organized human peri-gastrulation-like patterning. Development. , (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D., Brivanlou, A. H. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nature Methods. 11 (8), 847-854 (2014).
- Blin, G., Wisniewski, D., Picart, C., Thery, M., Puceat, M., Lowell, S. Geometrical confinement controls the asymmetric patterning of brachyury in cultures of pluripotent cells. Development. 145 (18), (2018).
- . . Micropatterning in cell biology. Pt. A. , (2014).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells. 26 (9), 2300-2310 (2008).
- Heemskerk, I., Burt, K., Miller, M., Chabra, S., Guerra, M. C., Warmflash, A. Morphogen dynamics control patterning in a stem cell model of the human embryo. bioRxiv. , 202366 (2017).
- Nemashkalo, A., Ruzo, A., Heemskerk, I., Warmflash, A. Morphogen and community effects determine cell fates in response to BMP4 signaling in human embryonic stem cells. Development. 144 (17), 3042-3053 (2017).
- Peerani, R., Onishi, K., Mahdavi, A., Kumacheva, E., Zandstra, P. W. Manipulation of signaling thresholds in “engineered stem cell niches” identifies design criteria for pluripotent stem cell screens. PloS One. 4 (7), e6438 (2009).
- Peerani, R., et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. The EMBO journal. 26 (22), 4744-4755 (2007).
- Etoc, F., et al. A Balance between Secreted Inhibitors and Edge Sensing Controls Gastruloid Self-Organization. Developmental Cell. 39 (3), 302-315 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein micropatterns: A direct printing protocol using deep UVs. Methods in Cell Biology. 97, 133-146 (2010).
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects Using Micropatterned Cells. JoVE (Journal of Visualized Experiments). (46), e2514 (2010).
- Beddington, R. S. P., Rashbass, P., Wilson, V. Brachyury - a gene affecting mouse gastrulation and early organogenesis. Development. 116 (Supplement), 157-165 (1992).
- Wilkinson, D. G., Bhatt, S., Herrmann, B. G. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature. 343 (6259), 657-659 (1990).
- Hollnagel, A., Oehlmann, V., Heymer, J., Rüther, U., Nordheim, A. Id Genes Are Direct Targets of Bone Morphogenetic Protein Induction in Embryonic Stem Cells. Journal of Biological Chemistry. 274 (28), 19838-19845 (1999).
- Mountford, P., et al. Dicistronic targeting constructs: reporters and modifiers of mammalian gene expression. Proceedings of the National Academy of Sciences of the United States of America. 91 (10), 4303-4307 (1994).
- Smith, A. G. Culture and differentiation of embryonic stem cells. Journal of tissue culture methods. 13 (2), 89-94 (1991).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Blin, G., Sadurska, D., Migueles, R. P., Chen, N., Watson, J. A., Lowell, S. Nessys: a novel method for accurate nuclear segmentation in 3D. bioRxiv. , 502872 (2018).
- Weiswald, L. -. B., Guinebretière, J. -. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC cancer. 10, 106 (2010).
- Deglincerti, A., et al. Self-organization of human embryonic stem cells on micropatterns. Nature Protocols. 11 (11), 2223-2232 (2016).
- Ostblom, J., Nazareth, E. J. P., Tewary, M., Zandstra, P. W. Context-explorer: Analysis of spatially organized protein expression in high-throughput screens. PLOS Computational Biology. 15 (1), e1006384 (2019).
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. E-cadherin null mutant embryos fail to form a trophectoderm epithelium. Proceedings of the National Academy of Sciences. 91 (17), 8263-8267 (1994).
- Pieters, T., van Roy, F. Role of cell-cell adhesion complexes in embryonic stem cell biology. J Cell Sci. 127 (12), 2603-2613 (2014).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. -. K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. eLife. 7, e32839 (2018).
- Ulman, V., et al. An objective comparison of cell-tracking algorithms. Nature Methods. 14 (12), 1141 (2017).
- Moir, R. D., Yoon, M., Khuon, S., Goldman, R. D. Nuclear Lamins a and B1. The Journal of Cell Biology. 151 (6), 1155-1168 (2000).
- McDole, K., et al. In Toto Imaging and Reconstruction of Post-Implantation Mouse Development at the Single-Cell Level. Cell. 175 (3), 859-876 (2018).
- Stegmaier, J., et al. Real-Time Three-Dimensional Cell Segmentation in Large-Scale Microscopy Data of Developing Embryos. Developmental Cell. 36 (2), 225-240 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。