A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تكييف شبه عالي الإنتاجية لفحص ATPase المقترن بـ NADH لفحص مثبطات الجزيئات الصغيرة
In This Article
Summary
وقد تم تكييف فحص أدينوكليوتيد أدينين (NADH) المقترنة ATPase لفحص الإنتاجية شبه العالية من مثبطات الموسين جزيء صغير. يتم تشغيل هذا التقييم الحركي في شكل لوحة دقيقة 384 جيدا مع أحجام التفاعل الكلي من 20 ميكرولتر فقط لكل بئر. يجب أن تكون المنصة قابلة للتطبيق على أي إنزيم منتج من ADP تقريبًا.
Abstract
تستخدم إنزيمات ATPase الطاقة الحرة المخزنة في الأدينوسين ثلاثي الفوسفات لتحفيز مجموعة واسعة من العمليات الكيميائية الحيوية الإنجرغوية في الجسم الحي التي لن تحدث تلقائيًا. هذه البروتينات هي حاسمة أساسا لجميع جوانب الحياة الخلوية, بما في ذلك التمثيل الغذائي, انقسام الخلايا, الاستجابات للتغيرات البيئية والحركة. يصف البروتوكول المعروض هنا فحص ادرينالين أدينوكليوتيد (NADH) المقترن بـ ATPase الذي تم تكييفه مع فحص الإنتاجية شبه العالية لمثبطات ATPase جزيء صغير. وقد تم تطبيق هذا القول على عضلة القلب والهيكل العظمي myosin الثاني، وهما المحرك الجزيئي القائم على الأكتين ATPases، كدليل على المبدأ. ويقترن التحلل المائي من ATP إلى أكسدة NADH عن طريق ردود الفعل الأنزيمية في التبيّاع. أولاً، يتم تجديد ADP التي تم إنشاؤها بواسطة ATPase إلى ATP بواسطة بييوروفات كيناز (PK). PK يحفز الانتقال من فوسفونولبيروفات (PEP) إلى بيروفات في نفس الوقت. في وقت لاحق، يتم تقليل بيروفات إلى اللاكتات عن طريق اللاكتات dehydrogenase (LDH)، الذي يحفز أكسدة NADH في نفس الوقت. وبالتالي، يرتبط الانخفاض في تركيز ATP مباشرة بالانخفاض في تركيز NADH، الذي يتبعه تغيير في الفلورة الجوهرية لـ NADH. طالما PEP متاح في نظام رد الفعل، تركيز ADP لا يزال منخفضا جدا، وتجنب تثبيط إنزيم ATPase من قبل المنتج الخاص به. وعلاوة على ذلك، فإن تركيز ATP لا يزال ثابتا تقريبا، مما أسفر عن دورات زمنية خطية. ويتم رصد الفلورة باستمرار، مما يسمح بتقدير سهل لنوعية البيانات ويساعد على تصفية القطع الأثرية المحتملة (على سبيل المثال، الناشئة عن هطول الأمطار المركبأو التغيرات الحرارية).
Introduction
Myosins هي محولات الطاقة الميكانوكيميائية التي تحلل أدينوسين ثلاثي الفوسفات (ATP) لتوليد حركة الاتجاه على طول خيوط الهيكل السيتولي أكتين في eukaryotes1,2. لديهم على حد سواء هيكليا وحركيا تتكيف مع وظائفها داخل الخلايا المختلفة، مثل نقل العضيات، وتقلص العضلات أو توليد التوتر الخلوي الهيكلي1،2. يتم تمثيل عائلة الموسين الخارقة من قبل ~ 40 جينات الموسين التي تنتمي إلى ~ 12 فئات myosin متميزة في الجينوم البشري3،4. أعضاء من فصول myosin تلعب أدوارمختلفة في مجموعة متنوعة للغاية من الاضطرابات, مثل العديد من السرطانات, الاضطرابات العصبية, اعتلال العضلات والهيكل العظمي, واعتلال عضلة القلب الضخامي5,6. وبالنظر إلى العدد الكبير من الوظائف الفسيولوجية والمرضية لهذه المحركات الجزيئية، فإنه ليس من المستغرب أنها أصبحت معترف بها بشكل متزايد كأهداف المخدرات لمجموعة متنوعة من الظروف7. وقد أحرز تقدم كبير مؤخرا في اكتشاف مثبطات الموسين الجديدة8و9و10 والمنشطات11، وتحسين خصائص الموجودةمنها 12، 13 , 14 سنة , 15.
وقد استخدمت منذ فترة طويلة نيكوتيناميد أدينين الدينوكليوتيد (NADH) المقترنة ATPase فحص لقياس نشاط ATPase من الإنزيمات المختلفة، مثل الريسكوبلازمية الشبكية Ca2 + مضخة ATPase16، وإصلاح الحمض النووي ATPase Rad5417، وAAA + ATPase p9718 أو ميكروتوبول الحركية kinesin19. يستخدم هذا التساي دورة تجديد ATP. يتم تجديد أدينوسين ثنائي الفوسفات (ADP) التي تم إنشاؤها بواسطة ATPase إلى ATP بواسطة بينوفات كيناز (PK)، الذي يحول جزيء واحد من فوسفونولبيروفات (PEP) إلى بيروفات في نفس الوقت. في وقت لاحق، يتم تقليل البيروفات إلى اللاكتات عن طريق اللاكتات dehydrogenase (LDH). وهذا، بدوره، يُخأكّد جزيء واحد من NADH إلى NAD. ولذلك، فإن الانخفاض في تركيز NADH كدالة للوقت يساوي معدل التحلل المائي ATP. دورة تجديد ATP تحافظ على تركيز ATP ثابت تقريبا وتركيز ADP منخفضة طالما PEP متاح. وهذا يؤدي إلى دورات زمنية خطية، مما يجعل من السهل تحديد معدلات التفاعل الأولية ويساعد على تجنب تثبيط المنتج من قبل ADP19. على الرغم من أن اختبار ATPase المقترنة بNADH قد تم تكييفها بالفعل مع شكل 96-well20، فإن أحجام التفاعل العالية (~ 150 ميكرولتر) تجعلها مكلفة نسبيا بسبب ارتفاع الطلب على الكواشف، مما يجعلها أقل قابلية للفحص السريع لأعداد كبيرة من المركبات. الأساليب البديلة، مثل الفحص الأخضر المالاشيت19،21،الذي يعتمد على الكشف عن الفوسفات الذي ينتجه إنزيم ATPase، ثبت أنها أكثر ملاءمة للتصغير والفحص عالي الإنتاجية22 , 23 , 24- ومع ذلك، من المرجح أن يتأثر الاختبار بنقطة النهاية بعدة قطع أثرية (ترد مناقشتها أدناه)، والتي قد تظل غير مكتشفة في غياب دورات دراسية بدوام كامل.
هنا، تم تحسين فحص ATPase المقترن بNADH لفحص الإنتاجية شبه العالية لمثبطات الجزيئات الصغيرة. الهيكل العظمي وعضلة القلب myosin الثاني ومثبطات myosin blebbistatin8, الفقرة أمينوبلبستاتين13 وpara-nitroblebbistatin 12 تستخدم لإثبات قوة من فحص, الذي يعتمد على NADH الفلورة كقراءة. هذا البروتوكول قابل لفحص المشاريع التي تركز على أي إنزيمات منتجة من شرطة أبوظبي.
Protocol
1. إعداد حلول الأسهم والكواشف
- إعداد dithiothreitol (DTT) حل الأسهم عن طريق حل DTT البلورية في الماء المقطر إلى تركيز نهائي من 1000 mM. ضبط الحموضة إلى 7.0 مع 1 M NaOH الحل. Aliquot وتخزينها في -20 درجة مئوية.
- إعداد حل مخزون ATP عن طريق حل ATP البلورية في الماء المقطر إلى تركيز نهائي من 100 MM. ضبط الحموضة إلى 7.0 مع 1 M NaOH الحل. Aliquot وتخزينها في -20 درجة مئوية.
- إعداد 10X NADH العازلة التي تحتوي على 70 مل 3-(N-morpholino) حمض البروبانسولفونيك (MOPS)، 10 مل مغكل2،0.9 مليون طن إيثيلين غليكول-بيس (β-aminoethyl الأثير) -N، N، N′،N′-حمض رباعي الأسيتيك (EGTA)، و 3 MM NaN3. ضبط الحموضة إلى 7.0 مع 1 M NaOH الحل. يُحفظ عند درجة حرارة 4 درجات مئوية.
- إعداد 1x المخزن المؤقت myosin التي تحتوي على 10 مل MOPS و 0.1 mM EGTA. ضبط الحموضة إلى 7.0 مع 1 M NaOH الحل. يُحفظ عند درجة حرارة 4 درجات مئوية. إضافة ألبوممصل البقر (BSA) وDTT إلى تركيز نهائي من 0.1٪ (ث / الخامس٪) و1 mM، على التوالي، قبل الاستخدام.
- إعداد 1X الأكتين العازلة التي تحتوي على 4 م م MOPS،0.1 mM EGTA، 2 M MCl 2، و 3 MN3. ضبط الحموضة إلى 7.0 مع 1 M NaOH الحل. يُحفظ عند درجة حرارة 4 درجات مئوية. إضافة BSA وDTT إلى تركيز نهائي قدره 0.1٪ (ث / v٪) و1 mM، على التوالي، قبل الاستخدام.
- إعداد حل مخزون NADH عن طريق حل NADH البلورية في 10X NADH العازلة إلى تركيز نهائي من 5.5 mM. Aliquot وتخزينها في -20 درجة مئوية.
- إعداد حل الأسهم PEP عن طريق حل PEP البلورية في 10X NADH العازلة إلى تركيز نهائي من 50 MM. Aliquot وتخزينها في -20 درجة مئوية.
- إعداد محلول مخزون LDH عن طريق حل مسحوق LDH lyophilized في خليط من الجلسرين و10X NADH العازلة (50٪: 50٪) إلى تركيز نهائي قدره 2000 U/mL. الطرد المركزي الحل لإزالة أي بروتين غير مذاب الحالي (7,197 × ز, 20 °C, 10 دقيقة). نقل supernatant في أنبوب الطرد المركزي نظيفة بعناية. Aliquot وتخزينها في -20 درجة مئوية.
- إعداد محلول مخزون PK عن طريق حل مسحوق PK الليوفيل في خليط من الجلسرين و10X NADH العازلة (50٪: 50٪) إلى تركيز نهائي قدره 10000 U/mL. الطرد المركزي الحل لإزالة أي بروتين غير مذاب الحالي (7,197 × ز, 20 °C, 10 دقيقة). نقل supernatant في أنبوب الطرد المركزي نظيفة بعناية. Aliquot وتخزينها في -20 درجة مئوية.
- إعادة تشكيل عينات عضلة القلب والهيكل العظمي الليوفيل myosin II عن طريق إضافة 100 ميكرولتر الماء المقطر للحصول على 10 ملغ / مل حلول الأسهم المقابلة ل ~ 37.9 ميكرومتر و ~ 40.8 ميكرومتر تركيزات الموسين (مونوميريك)، على التوالي. لمزيد من التفاصيل، راجع إرشادات الشركة المصنعة.
- إعداد F-أكتين من مسحوق الأسيتون العضلات الأرنب كما هو موضح من قبل باردي وسبوديش25.
2. قياس أنشطة ATPase والآثار المثبطة لمثبطات الجزيئات الصغيرة
- إعداد لوحة مركب.
- حل المركبات ذات الاهتمام في ثنائي ميثيل سولفوكسيد عالية الجودة (DMSO).
- إنشاء خمسة عشر خطوة المسلسل 1:2 التخفيفات بدءاً من تركيز مركب 10 mM في DMSO.
- نقل العينات إلى لوحة البولي بروبلين 384 جيدا في triplicates (12.5 ميكرولتر لكل منهما) باستخدام ماصة متعددة القنوات. استخدم صفين على اللوحة المركبة لمجمع واحد (بدلاً من ثلاثة أعمدة) لتقليل عدد الآبار التي يحتمل أن تتأثر بتأثيرات الحافة. استخدام الآبار الثلاثة الأخيرة في الصف الثاني لكل مركب كتحكم سلبي (DMSO فقط). لا تستخدم الصف الأول والأخير على اللوحة للتخفيف المركب.
- نقل DMSO نقية في آبار الصف الأول (محفوظة لمعايرة NADH).
- استخدم الصف الأخير للتحكم الإيجابي.
ملاحظة: تم استخدام باراأمينوبلبِيستاتين عند تركيز 4 مم في DMSO هنا.
- إعداد 4500 درجة مئوية من 20 ميكرومتر محلول الأكتين المخفف لكل لوحة فحص (384-well أسود الجدار البوليستيرين ميكروتليت) عن طريق تخفيف محلول الأوراق المالية أكتين في العازلة أكتين. خلط الحل تماما عن طريق الأنابيب صعودا وهبوطا 30X باستخدام ماصة 5 مل للحد من اللزوجة وعدم التجانس عن طريق كسر خيوط الأكتين. الطرد المركزي الحل لإزالة أي البروتين عجلت الحالية (7,197 × ز,20 درجة مئوية, 10 دقيقة). نقل بعناية supernatant في أنبوب الطرد المركزي نظيفة.
- إعداد مزيج رئيسي يحتوي على إنزيمات LDH وPK ("مزيج الإنزيمات"). لكل لوحة فحص، الجمع بين 171.4 ميكرولتر من محلول LDH، 171.4 ميكرولتر من محلول PK و 3189.3 ميكرولتر أو 3252.9 ميكرولتر من المخزن المؤقت myosin للفحص التي تنطوي على عضلة القلب أو الهيكل العظمي myosin الثاني، على التوالي، في أنبوب الطرد المركزي المخروطي 15 مل. لا تضيف أي myosin في هذه المرحلة لتجنب التجميع وهطول الأمطار.
- إعداد مزيج رئيسي يحتوي على جميع الركائز ("مزيج الركيزة"). لكل لوحة، الجمع بين 162.1 درجة مئوية من ATP، 162.1 ميكرولتر من PEP و 324.1 ميكرولتر من محلول NADH في أنبوب الطرد المركزي المخروطي 15 مل. لا تقم بإضافة الأكتين في هذه المرحلة لتجنب التجميع وهطول الأمطار.
- إنشاء سبع خطوات سلسلة 1:2 تخفيف NADH للمعايرة بدءا من 250 μM.
- مزيج 12.3 درجة مئوية من حل المخزون NADH مع 257.7 ميكرولتر من المخزن المؤقت myosin في أنبوب الطرد المركزي الصغير 1.5 مل.
- Aliquot 135 درجة مئوية من المايوسين العازلة في سبعة أنابيب الطرد المركزي الدقيقة 1.5 مل.
- نقل 135 درجة مئوية من الحل من الأنبوب الأول إلى الثاني ومزيج من الأنابيب. كرر حتى تصل إلىأنبوب 7.
- استخدم الأنبوب الأخير كعنصر تحكم لا NADH (المخزن المؤقت فقط).
- باستخدام ماصة 8 قنوات، نقل 20 ميكرولتر من حلول معايرة NADH إلى الصف الأول من لوحة القياس في triplicates.
- إضافة 68 ميكرولتر من القلب أو 4.2 ميكرولتر من العضلات الهيكلية myosin الثاني إلى مزيج الإنزيم. دوامة لفترة وجيزة.
- باستثناء الصف الأول، الاستغناء عن 8.4 ميكرولتر من مزيج إنزيم myosin-إعداد في كل بئر من لوحة اختبار باستخدام موزع الآلي.
- نقل 100 مل من الحلول من لوحة مركب إلى لوحة اختبار تحتوي على مزيج الإنزيم باستخدام نظام المناولة السائل الآلي مجهزة 100 نمل رئيس أداة دبوس.
- هز لوحة التبيّاق لمدّة دقيقة واحدة في درجة حرارة الغرفة عند 1200 دورة في الدقيقة باستخدام الهزاز الدقيق.
- إضافة 4052 درجة مئوية من محلول أكتين الطرد المركزي إلى مزيج الركيزة. دوامة لفترة وجيزة.
- الاستغناء عن 11.6 ميكرولتر من مزيج الركيزة الأكتين في كل بئر من لوحة اختبار (باستثناء الصف الأول) لبدء رد الفعل الأنزيمي باستخدام موزع الآلي.
- هز لوحة التبيّاق لمدّة دقيقة واحدة في درجة حرارة الغرفة عند 1200 دورة في الدقيقة باستخدام الهزاز الدقيق.
- الطرد المركزي لوحة الفاكس في 101 × ز لمدة 30 ق.
- تأكد من أن درجة الحرارة الداخلية لقارئ لوحة قد استقرت عند 25 درجة مئوية. تحميل لوحة ويهز لمدة 30 s أخرى. هذه الخطوة تهتز ضروري لجعل شكل سطح السائل مماثلة في كل بئر ويسمح الوقت لللوحة للوصول إلى درجة حرارة القياس.
- سجل NADH الفلورة لمدة 30 دقيقة مسح لوحة في 45 ق فترات. استخدام 380 نانومتر, 10 نانومتر عرض النطاق الترددي الإثارة مرشح و 470 نانومتر, 24 نانومتر مرشح الانبعاثات عرض النطاق الترددي بالاقتران مع مرآة dichroic قطع 425 نانومتر. تشغيل القياس في وضع التركيز العالي. تحسين عدد الومضات، واكتساب كاشف، وأبعاد لوحة وارتفاع القياس قبل تشغيل الاختبارات.
ملاحظة: حالات فحص النهائي هي 300 nM القلب / 20 nM العضلات الهيكلية myosin الثاني، 10 ميكرومتر أكتين، 40 U / مل LDH، 200 U / مل PK، 220 μM NADH، 1 م PEPM، 1 M ATP في جهاز احتياطي يحتوي على 10 مل MOPS (درجة الحموضة = 7.0)، 2 MM MgCl2 ، 0.15 m EGTA، 0.1 ملغ / مل BSA، 0.5٪ (V / v) DMSO و 1 MDTT. الحجم الإجمالي هو 20 درجة مئوية / جيدا. أعلى تركيز مركب النهائي هو 50 μM. 20 μM الفقرة-أمينوبلبِيستاتين في 0.5٪ DMSO بمثابة السيطرة الإيجابية و 0.5٪ DMSO وحدها هي السيطرة السلبية. يتم إجراء جميع القياسات في triplicates.
3. تحليل البيانات
- رسم كثافة الفلورة لوحظ مع الوقت لكل بئر.
- إجراء انحدار خطي بسيط لتحديد الميل واعتراض استجابات الفلورة لكل بئر. يتناسب الميل مع معدل استهلاك ATP (NADH)، في حين يتناسب الاعتراض مع تركيز NADH في بداية القياس (t = 0 s).
- إنشاء منحنى معايرة لNADH عن طريق رسم الاعتراضات التي تم الحصول عليها للصف الأول من اللوحة ضد تركيز NADH. تأكد من أن الاعتراضات تعتمد خطياً على تركيز NADH.
ملاحظة: تقدر عمليات الاعتراض كثافة الفلورة الحقيقية في t = 0 s مع ثقة أكبر بكثير من متوسط كثافة الفلورة الخام يقرأ في t - 0 s. - قم بإجراء انحدار خطي بسيط للحصول على الميل واعتراض خط معايرة NADH.
ملاحظة: يصف الاعتراض إشارة الخلفية الفلورية (لا يوجد NADH الحالي)، في حين يتوافق المنحدر مع كثافة الفلورة الاستقراء/النظرية لحل NADH 1 M في تلك التجربة بالذات. - تقسيم منحدر استجابة الفلورة التي تم الحصول عليها لبقية الآبار عن طريق منحدر خط معايرة NADH لتحويل التغيرات الفلورية إلى معدلات استهلاك ATP.
- رسم معدلات استهلاك ATP ضد تركيز المانع.
- لتحديد الثوابت المثبطة، استخدم البرامج الإحصائية المناسبة لاحتواء بيانات استجابة الجرعة مع المعادلة التربيعية التالية المقابلة لنموذج توازن ملزم واحد إلى واحد بسيط:
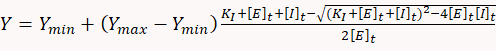
حيث Y هو معدل استهلاك ATP، Ymin هو معدل استهلاك ATP INT عدم وجود مثبط، Yماكس هو معدل استهلاك ATP النظري عند تثبيط 100٪، KI هو ثابت مثبط ، [E]ر و [I]ر هي التركيز الكلي للإنزيم (myosin) والمانع، على التوالي.
النتائج
تظهر خريطة تخطيط اللوحة النموذجية المستخدمة في تجارب الفرز في الشكل 1. يتم حجز الصفوف الأولى والأخيرة لمعايرة NADH والتحكم الإيجابي (20 ميكرومتر بارا-أمينوبلبِستياتين، 0.5٪ DMSO)، على التوالي. يتم استخدام الصفوف المتبقية (B إلى O) لاختبار النشاط المثبط للمر...
Discussion
الخطوات الحاسمة في البروتوكول
تحسين تخطيط لوحة عن طريق تشغيل عدة لوحات مع السيطرة السلبية فقط (رد فعل ATPase مع عدم وجود مثبط). فحص النتائج بعناية لأنماط في معدلات رد الفعل. على سبيل المثال، قد تنشأ هذه من آثار الحافة و / أو العيوب في طلاء سطح الماء من لوحات "غير ملزمة". إ?...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل بمنحة من المعهد الوطني للاضطرابات العصبية والسكتة الدماغية والمعهد الوطني لتعاطي المخدرات NS096833 (CAM).
Materials
| Name | Company | Catalog Number | Comments |
| 384-well Low Flange Black Flat Bottom Polystyrene NBS Microplate | Corning | 3575 | |
| ATP (Adenosine 5′-triphosphate disodium salt hydrate) | Sigma | A7699 | |
| Aurora FRD-IB Dispenser | Aurora Discovery, Inc. | 00017425 | |
| Biomek NXP Multichannel Laboratory Automation Workstation | Beckman Coulter | A31841 | |
| Blebbistatin | AMRI | N/A | Custom synthesis |
| BSA (Bovine Serum Albumin, Protease-Free) | Akron Biotech | AK1391 | |
| Centrifuge 5430 R, refrigerated, with Rotor FA-35-6-30 | Eppendorf | 022620663 | |
| Centrifuge 5430, non-refrigerated, with Rotor A-2-MTP | Eppendorf | 022620568 | |
| DMSO (Dimethyl sulfoxide) | Sigma | D2650 | |
| DTT (DL-Dithiothreitol) | Sigma | D5545 | |
| E1 ClipTip Multichannel Pipette; 384-format; 8-channel | Thermo Scientific | 4672010 | |
| E1 ClipTip Multichannel Pipette; 96-format; 8-channel | Thermo Scientific | 4672080 | |
| EGTA (Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid) | Sigma | E3889 | |
| EnVision 2104 Multilabel Plate Reader | PerkinElmer | 2104-0010 | |
| Glycerol | Sigma | G2025 | |
| LDH (L-Lactic Dehydrogenase from rabbit muscle) | Sigma | L1254 | |
| MgCl2.6H2O (Magnesium chloride hexahydrate) | Sigma | M2670 | |
| Microplate Shaker | VWR | 12620-926 | |
| Microplate, 384 well, PP, Small Volume, Deep Well, Natural | Greiner Bio-One | 784201 | |
| MOPS (3-(N-Morpholino)propanesulfonic acid) | Sigma | M1254 | |
| Myosin Motor Protein (full length) (Bovine cardiac muscle) | Cytoskeleton | MY03 | |
| Myosin Motor Protein (full length) (Rabbit skeletal muscle) | Cytoskeleton | MY02 | |
| NADH (β-Nicotinamide adenine dinucleotide, reduced disodium salt hydrate) | Sigma | N8129 | |
| NaN3 (Sodium azide) | Sigma | 71289 | |
| NaOH (Sodium hydroxide) | Sigma | S8045 | |
| Optical Filter CFP 470/24nm (Emission) | PerkinElmer | 2100-5850 | Barcode 240 |
| Optical Filter Fura2 380/10nm (Excitation) | PerkinElmer | 2100-5390 | Barcode 112 |
| Optical Module: Beta Lactamase | PerkinElmer | 2100-4270 | Barcode 418 |
| OriginPro 2017 software | OriginLab | N/A | |
| para-Aminoblebbistatin | AMRI | N/A | Custom synthesis |
| para-Nitroblebbistatin | AMRI | N/A | Custom synthesis |
| PEP (Phospho(enol)pyruvic acid monopotassium salt) | Sigma | P7127 | |
| PK (Pyruvate Kinase from rabbit muscle) | Sigma | P9136 | |
| Rabbit Muscle Acetone Powder | Pel Freez Biologicals | 41995-2 |
References
- Heissler, S. M., Sellers, J. R. Kinetic Adaptations of Myosins for Their Diverse Cellular Functions. Traffic. 17 (8), 839-859 (2016).
- Hartman, M. A., Spudich, J. A. The myosin superfamily at a glance. Journal of Cell Science. 125 (Pt 7), 1627-1632 (2012).
- Berg, J. S., Powell, B. C., Cheney, R. E. A millennial myosin census. Molecular Biology of the Cell. 12 (4), 780-794 (2001).
- Sebe-Pedros, A., Grau-Bove, X., Richards, T. A., Ruiz-Trillo, I. Evolution and classification of myosins, a paneukaryotic whole-genome approach. Genome Biology and Evolution. 6 (2), 290-305 (2014).
- Newell-Litwa, K. A., Horwitz, R., Lamers, M. L. Non-muscle myosin II in disease: mechanisms and therapeutic opportunities. Disease Models & Mechanisms. 8 (12), 1495-1515 (2015).
- He, Y. M., Gu, M. M. Research progress of myosin heavy chain genes in human genetic diseases. Yi Chuan. 39 (10), 877-887 (2017).
- Rauscher, A. A., Gyimesi, M., Kovacs, M., Malnasi-Csizmadia, A. Targeting Myosin by Blebbistatin Derivatives: Optimization and Pharmacological Potential. Trends in Biochemical Sciences. 43 (9), 700-713 (2018).
- Straight, A. F., et al. Dissecting temporal and spatial control of cytokinesis with a myosin II Inhibitor. Science. 299 (5613), 1743-1747 (2003).
- Sirigu, S., et al. Highly selective inhibition of myosin motors provides the basis of potential therapeutic application. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), E7448-E7455 (2016).
- Green, E. M., et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 351 (6273), 617-621 (2016).
- Morgan, B. P., et al. Discovery of omecamtiv mecarbil the first, selective, small molecule activator of cardiac Myosin. ACS Medicinal Chemistry Letters. 1 (9), 472-477 (2010).
- Kepiro, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable myosin II inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
- Varkuti, B. H., et al. A highly soluble, non-phototoxic, non-fluorescent blebbistatin derivative. Scientific Reports. 6, 26141 (2016).
- Verhasselt, S., et al. Discovery of (S)-3'-hydroxyblebbistatin and (S)-3'-aminoblebbistatin: polar myosin II inhibitors with superior research tool properties. Organic and Biomolecular Chemistry. 15 (9), 2104-2118 (2017).
- Verhasselt, S., Roman, B. I., Bracke, M. E., Stevens, C. V. Improved synthesis and comparative analysis of the tool properties of new and existing D-ring modified (S)-blebbistatin analogs. European Journal of Medicinal Chemistry. 136, 85-103 (2017).
- Warren, G. B., Toon, P. A., Birdsall, N. J., Lee, A. G., Metcalfe, J. C. Reconstitution of a calcium pump using defined membrane components. Proceedings of the National Academy of Sciences of the United States of America. 71 (3), 622-626 (1974).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. Rad54 protein exerts diverse modes of ATPase activity on duplex DNA partially and fully covered with Rad51 protein. Journal of Biological Chemistry. 277 (48), 46205-46215 (2002).
- Hanzelmann, P., Schindelin, H. Structural Basis of ATP Hydrolysis and Intersubunit Signaling in the AAA+ ATPase p97. Structure. 24 (1), 127-139 (2016).
- Hackney, D. D., Jiang, W. Assays for kinesin microtubule-stimulated ATPase activity. Methods in Molecular Biology. 164, 65-71 (2001).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. NADH-coupled microplate photometric assay for kinetic studies of ATP-hydrolyzing enzymes with low and high specific activities. Analytical Biochemistry. 321 (2), 266-271 (2003).
- Carter, S. G., Karl, D. W. Inorganic phosphate assay with malachite green: an improvement and evaluation. Journal of Biochemical and Biophysical Methods. 7 (1), 7-13 (1982).
- Henkel, R. D., VandeBerg, J. L., Walsh, R. A. A microassay for ATPase. Analytical Biochemistry. 169 (2), 312-318 (1988).
- Rowlands, M. G., et al. High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Analytical Biochemistry. 327 (2), 176-183 (2004).
- Rule, C. S., Patrick, M., Sandkvist, M. Measuring In Vitro ATPase Activity for Enzymatic Characterization. Journal of Visualized Experiments. (114), 54305 (2016).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Cell Biology. 24, 271-289 (1982).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Kovacs, M., Toth, J., Hetenyi, C., Malnasi-Csizmadia, A., Sellers, J. R. Mechanism of blebbistatin inhibition of myosin II. Chem Journal of Biological Chemistry. 279 (34), 35557-35563 (2004).
- Allingham, J. S., Smith, R., Rayment, I. The structural basis of blebbistatin inhibition and specificity for myosin II. Nature Structural & Molecular Biology. 12 (4), 378-379 (2005).
- Kettlun, A. M., et al. Purification and Characterization of 2 Isoapyrases from Solanum-Tuberosum Var Ultimus. Phytochemistry. 31 (11), 3691-3696 (1992).
- Hulme, E. C., Trevethick, M. A. Ligand binding assays at equilibrium: validation and interpretation. British Journal of Pharmacology. 161 (6), 1219-1237 (2010).
- Motulsky, H. J., Neubig, R. R. Analyzing binding data. Current Protocols in Neuroscience. 52 (1), 7.5.1-7.5.65 (2010).
- Sehgal, P., Olesen, C., Moller, J. V. ATPase Activity Measurements by an Enzyme-Coupled Spectrophotometric Assay. Methods in Molecular Biology. 1377, 105-109 (2016).
- Solinger, J. A., Lutz, G., Sugiyama, T., Kowalczykowski, S. C., Heyer, W. D. Rad54 protein stimulates heteroduplex DNA formation in the synaptic phase of DNA strand exchange via specific interactions with the presynaptic Rad51 nucleoprotein filament. Journal of Molecular Biology. 307 (5), 1207-1221 (2001).
- Banik, U., Roy, S. A continuous fluorimetric assay for ATPase activity. Biochemistry Journal. 266 (2), 611-614 (1990).
- Xiao, Y. X., Yang, W. X. KIFC1: a promising chemotherapy target for cancer treatment?. Oncotarget. 7 (30), 48656-48670 (2016).
- See, S. K., et al. Cytoplasmic Dynein Antagonists with Improved Potency and Isoform Selectivity. ACS Chemical Biology. 11 (1), 53-60 (2016).
- Datta, A., Brosh, R. M. New Insights Into DNA Helicases as Druggable Targets for Cancer Therapy. Frontiers in Molecular Biosciences. 5, 59 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved