A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הסתגלות למחצה בתפוקה גבוהה של מעכבי הנדח ביחד לסינון מולקולה קטנה
In This Article
Summary
באמצעות שיטת הסריקה (NADH)-ביחד התאמה ATPase הותאמה הקרנה חצי תפוקה גבוהה של מולקולה קטנה רירן מעכבי. זה שיטת הקינטי מופעל בפורמט 384-היטב אימונולוגיה עם כמויות התגובה הכולל של רק 20 μl לכל טוב. הפלטפורמה צריכה להיות ישימה כמעט כל הפקת האנזים.
Abstract
האנזימים atpase לנצל את האנרגיה החופשית מאוחסן אדנוזין טריפוספט כדי לזרז מגוון רחב של תהליכים ביוכימיים מאנדריוני ב vivo זה לא היה מתרחש באופן ספונטני. חלבונים אלה חיוניים למעשה כל ההיבטים של החיים הסלולריים, כולל חילוף החומרים, החטיבה התא, תגובות שינויים סביבתיים ותנועה. הפרוטוקול המוצג כאן מתאר את הסביבה הזאת באמצעות הקרנת מולקולות של מולקולה קטנה (NADH) בשילוב של מולקולת התפוקה למחצה. הדבר הוחל על שריר לב השלד רירן II של, שני actin מבוססי מנוע מולקולרי ATPases, כהוכחה לעיקרון. ההידרוליזה של ATP משולב לחמצון של NADH על ידי תגובות אנזימטיות בבחינה. ראשית, ה-ADP שנוצר על-ידי ה-ATPase נוצר מחדש ל-ATP על ידי פירובט קינאז (PK). PK מזרז את המעבר של פוספולרופפירובט (פפ) לפירובט במקביל. לאחר מכן, פירובט מצטמצם לקטט על ידי לקטט דהידרוגנאז (LDH), אשר מזרז את החמצון של NADH במקביל. לפיכך, הירידה בריכוז ה-ATP מכוונת ישירות לירידה בריכוז NADH, הבאה לאחר שינוי בזריחה הפנימית של NADH. כל עוד מערכת ה-פפ זמינה במערכת התגובה, ריכוז ה-ADP נותר נמוך מאוד, ונמנע מעיכוב באנזים ATPase באמצעות מוצר משלו. יתרה מזאת, הריכוז של ATP נשאר כמעט קבוע ומניב קורסי זמן ליניאריים. הזריחה מנוטרת ברציפות, אשר מאפשר הערכה קלה של איכות הנתונים ומסייע לסנן חפצים פוטנציאליים (למשל, הנובעים משקעים מורכבים או שינויים תרמיים).
Introduction
מיוחטאים הם מכניכי אנרגיה מכימיים הידרוליייז אדנוזין טריפוספט (ATP) כדי ליצור תנועה כיוונית לאורך החוטים של השלד של אקטין ב eukaryotes1,2. יש להם הן מבנית ומותאם באופן מבחינה מדומה פונקציות תאיים שונות שלהם, כגון התחבורה של אורגלים, התכווצות שרירים או את הדור של מתח ציטושלד1,2. רירן משפחה מיוצגת על ידי ~ 40 רירן גנים השייכים ~ 12 מחלקות רירן נפרדות בגנום האדם3,4. חברי הכיתות רירן לשחק תפקידים שונים בקבוצה מגוונת מאוד של הפרעות, כגון מספר סוגי סרטן, הפרעות נוירולוגיות, השלד myopathies, ו יפרטרופית שריר הלב5,6. בהתחשב במספר הגדול של התפקודים הפיזיולוגיים והפתולוגיים של המנועים המולקולריים הללו, אין זה מפתיע שהם נעשים יותר ויותר מוכרים כמטרות סמים עבור מגוון של תנאים7. התקדמות משמעותית נעשתה לאחרונה בגילוי של מעכבי רירן חדשים8,9,10 ומפעילים11, כדי לשפר את המאפיינים של הקיימים12, מיכל בן 13 , מיכל בן 14 , . חמש עשרה
המלון הינו בשילוב עם השימוש באותו מספר שימש למדידת פעילות ה-ATPase באנזימים שונים, כגון הsarcoplasmic הרשת2 + משאבת atpase16, תיקון DNA atpase Rad5417, AAA + ATPase p9718 או מנוע מיקרוכדורית19. התהליך מעסיק מעגל התחדשות של ATP. אדנוזין diphosphate (ADP) שנוצר על ידי ATPase הוא נוצר מחדש ל-ATP על ידי פירובט קינאז (PK), אשר הופך מולקולה אחת של פוספולרופפירופיבט (פפ) לפירובט במקביל. לאחר מכן, פירובט מופחת כדי לקטט ידי לקטט דהידרוגנאז (LDH). זה, בתורו, מחמצן אחד מולקולה של NADH ל-NAD. לפיכך, הירידה בריכוז NADH כפונקציה של זמן שווה לקצב ההידרוליזה של ATP. מחזור ה-ATP שומר על ריכוז ה-ATP כמעט קבוע והריכוז של ADP מועט כל עוד האפשרות של ה-פפ זמינה. התוצאה היא קורסי זמן ליניארי, מה שהופך אותו פשוט כדי לקבוע את שיעורי התגובה הראשונית ומסייע להימנע מעיכוב המוצר על ידי ADP19. למרות הדרישה NADH מצמידים ATPase כבר הותאם 96-היטב בפורמט20, התגובה הגבוהה ביותר (~ 150 μl) לעשות את זה יקר יחסית בשל הביקוש הגבוה של ריאגנטים, עיבוד זה קל פחות להקרנה מהירה של מספרים גדולים של תרכובות. שיטות אלטרנטיביות, כגון השיטה הירוקה למלאכית19,21, המסתמכת על גילוי הפוספט המיוצר על ידי האנזים atpase, הוכחו מתאימים יותר למזעור ולהקרנה בתפוקה גבוהה22 , מיכל בן 23 , 24. עם זאת, שיטת נקודות קצה עשויה להיות מושפעת ממספר פריטים (שנדונו להלן), שעלולים להישאר לא מתקיימים בהיעדר קורסים במשרה מלאה.
כאן, הבקשה NADH ביחד ATPase ממוטבת עבור הקרנת תפוקה למחצה גבוהה של מעכבי מולקולה קטנה. שריר השלד ושרירי הלב רירן II ו רירן מעכבי בלייבסטטין8, פארא-האמיביוסטטין11 ו פארא-ניטרוגליצרין בליביוסטטין12 משמשים כדי להדגים את כוחה של היכולת, אשר נשענת על nadh פלואורסצנטית כבדיקה. פרוטוקול זה הוא קל לסינון פרויקטים התמקדו כל הפקת האנזימים.
Protocol
1. הכנת פתרונות מניות וריאגנטים
- להכין את הפתרון המלאי (DTT) מניות על ידי המסת DTT גבישי במים מזוקקים לריכוז הסופי של 1000 מ"מ. להתאים את ה-pH כדי 7.0 עם פתרון 1 M NaOH. מחלקים ומאחסנים ב-20 ° c.
- הכנת פתרון מניות ATP על ידי המסת ATP גבישי במים מזוקקים לריכוז הסופי של 100 מ"מ. להתאים את ה-pH כדי 7.0 עם פתרון 1 M NaOH. מחלקים ומאחסנים ב-20 ° c.
- להכין מאגר 10x NADH המכיל 70 mM 3-(N-מורגוולינו) חומצה propanesulfonic (מגבים), 10 מ"מ MgCl2, 0.9 mm אתילן גליקול-bis (β-עמינח האתר)-N, N, n ′, n′-טטראצטט חומצה (egta), ו 3 מ"מ נאן3. להתאים את ה-pH כדי 7.0 עם פתרון 1 M NaOH. חנות ב -4 ° c.
- להכין מאגר רירן x המכיל 10 מ"מ מגבים ו 0.1 mM EGTA. להתאים את ה-pH כדי 7.0 עם פתרון 1 M NaOH. חנות ב -4 ° c. הוסף סרום של שור הבקר (BSA) ו-DTT לריכוז הסופי של 0.1% (w/v%) ו -1 מ"מ, בהתאמה, לפני השימוש.
- הכינו מאגר אקטין 1x המכיל 4 מ"מ, 0.1 mm egta, 2 מ"מ mgcl2, ו 3 מ"מ נאן3. להתאים את ה-pH כדי 7.0 עם פתרון 1 M NaOH. חנות ב -4 ° c. הוסף BSA ו-DTT לריכוז הסופי של 0.1% (w/v%) ו -1 מ"מ, בהתאמה, לפני השימוש.
- הכנת פתרון מלאי NADH על ידי המסת NADH הגבישי בשנת מאגר NADH 10x לריכוז הסופי של 5.5 מ"מ. מחלקים ומאחסנים ב-20 ° c.
- הכינו פתרון מלאי ה-אפ על ידי המסת ה-פפ הגבישית במאגר של 10x NADH לריכוז הסופי של 50 מ"מ. מחלקים ומאחסנים ב-20 ° c.
- הכנת פתרון מניות LDH על-ידי המסת אבקת ליאופהנד בתערובת של גליצרול ומאגר 10x הנדח (50%: 50%) לריכוז הסופי של 2000-U/mL. צנטריפוגה את הפתרון כדי להסיר כל חלבון מומס הנוכחי (7,197 x g, 20 ° c, 10 דקות). להעביר את הסופרנטאנט. לצינור צנטריפוגה נקי בזהירות מחלקים ומאחסנים ב-20 ° c.
- הכינו פתרון מניות PK על-ידי המסת אבקת PK ליאופ, בתערובת של גליצרול ו-10x מאגר NADH (50%: 50%) לריכוז הסופי של 10000-U/mL. צנטריפוגה את הפתרון כדי להסיר כל חלבון מומס הנוכחי (7,197 x g, 20 ° c, 10 דקות). להעביר את הסופרנטאנט. לצינור צנטריפוגה נקי בזהירות מחלקים ומאחסנים ב-20 ° c.
- ליצור מחדש את השריר הלב ואת השלד רירן II דגימות על ידי הוספת 100 μL מים מזוקקים כדי להשיג 10 mg/mL פתרונות מניות המתאימים ~ 37.9 μM ו ~ 40.8 μM רירן ריכוזים (monomeric), בהתאמה. לקבלת פרטים נוספים, ראה הוראות היצרן.
- הכינו F-actin מאבקה של שריר הארנב כמתואר על ידי Pardee ו Spudich25.
2. מדידת פעילויות ATPase והשפעות מעכבות של מעכבי מולקולה קטנה
- . הכן צלחת מורכבת
- התמוססות תרכובות עניין בdimethylsulfoxide באיכות גבוהה (DMSO).
- צור 15-צעד סדרתי 1:2 מדלל החל מ 10 מ"מ ריכוז מתחם ב DMSO.
- העבר את הדגימות לצלחת פוליפרופילן 384-היטב ב טריליטים (12.5 μL כל אחד) באמצעות פיפטה רב-ערוצית. השתמש בשתי שורות על הלוח המורכב עבור תרכובת אחת (במקום שלוש עמודות) כדי למזער את מספר הבארות שעלולות להיות מושפעות מאפקטי קצה. השתמש בשלוש הבארות האחרונות בשורה השניה עבור כל תרכובת כפקד שלילי (DMSO בלבד). אין להשתמש בשורה הראשונה והאחרונה בלוח עבור מדלל מורכבים.
- העבר DMSO טהור לתוך הבארות של השורה הראשונה (שמור עבור כיול NADH).
- השתמש בשורה האחרונה לבקרה חיובית.
הערה: פארא-האמיאובליביוסטטין בריכוז 4 מ"מ ב dmso שימש כאן.
- הכינו 4500 μl של 20 μm מדולל פתרון אקטין עבור כל צלחת השיטת (384-ובכן שחור הקיר פוליסטירן microplate) על ידי דילול פתרון מניות אקטין במאגר אקטין. לערבב את הפתרון ביסודיות על ידי ליטוף למעלה ולמטה 30x באמצעות הפיפטה 5 מ ל כדי להפחית את צמיגות וטרוגניות על ידי שבירת החוטים אקטין. צנטריפוגה את הפתרון כדי להסיר את כל חלבון זירז הנוכחי (7,197 x g, 20 ° c, 10 דקות). העבר בזהירות את הסופרנטאנט. לתוך צינור צנטריפוגה נקי
- הכן תמהיל מומחה המכיל אנזימי LDH ו-PK ("תערובת אנזימים"). עבור כל צלחת השיטת, לשלב 171.4 μl של פתרון ldh, 171.4 μl של פתרון PK ו 3189.3 μl או 3252.9 μl של רירן מאגר עבור בחני מעורבים שריר הלב או השלד רירן II של, בהתאמה, ב 15 מ ל שפופרת צנטריפוגה חרוטי. אל תוסיף רירן בנקודה זו כדי למנוע צבירה ומשקעים.
- להכין מיקס מאסטר המכיל את כל מצעים ("תערובת מצע"). עבור כל צלחת, לשלב 162.1 μL של ATP, 162.1 μL של פפ ו 324.1 μL של פתרון NADH בשפופרת צנטריפוגה של 15 מ"ל. אין להוסיף אקטין בשלב זה כדי למנוע צבירה ומשקעים.
- צור שבעה שלבים סידוריים 1:2 באורך של NADH עבור כיול החל מ 250 μM.
- מערבבים 12.3 μL של פתרון מלאי NADH עם 257.7 μL של מאגר רירן בשפופרת מיקרוצנטריפוגה 1.5 mL.
- Aliquot 135 μL של מאגר רירן לתוך שבעה 1.5 מ ל צינורות מיקרוצנטריפוגה.
- העברת 135 μL של הפתרון מהצינור הראשון לתוך השני ומערבבים על ידי ליטוף. חזור עלהרכבת עד . שנגיע לשפופרת השביעית
- השתמש בצינור האחרון כפקד ללא-NADH (מאגר בלבד).
- באמצעות פיפטה של 8 ערוצים, העבר 20 μL של פתרונות כיול NADH לתוך השורה הראשונה של צלחת השימוש בטריליטים.
- הוסף 68 μL של לב או 4.2 μL של שריר השלד רירן II כדי לערבב אנזימים. . מערבולת בקצרה
- מלבד השורה הראשונה, לתת 8.4 μL של מיקס רירן-אנזים מוכן לתוך כל טוב של צלחת היישום באמצעות מנפק אוטומטי.
- העברת 100 nL של פתרונות מלוחית המתחם ועד לצלחת העיבוד המכילה את תמהיל האנזימים באמצעות מערכת הטיפול האוטומטי בנוזל מצויד בראש כלי 100 nL pin.
- לנער את צלחת השימוש 1 דקות בטמפרטורת החדר ב 1200 סל ד באמצעות מיקרופלייט שייקר.
- הוסף 4,052 μl של הפתרון centrifuged אקטין לתמהיל המצע. . מערבולת בקצרה
- לוותר 11.6 μL של actin-מצע לערבב לתוך כל טוב של צלחת השיטת (למעט שורה ראשונה) כדי להתחיל את התגובה אנזימטית באמצעות מנפק אוטומטי.
- לנער את צלחת השימוש 1 דקות בטמפרטורת החדר ב 1200 סל ד באמצעות מיקרופלייט שייקר.
- צנטריפוגה את צלחת המנה ב 101 x g עבור 30 s.
- ודא שהטמפרטורה הפנימית של קורא הלוחית התייצב ב -25 ° c. . העמיסו את הצלחת ונענו לעוד 30 שנות זה צעד לרעוד הוא הכרחי כדי להפוך את הצורה של המשטח הנוזלי דומה בכל היטב ומאפשר זמן לצלחת להגיע לטמפרטורת המדידה.
- הקלטת זריחה NADH עבור 30 דקות סריקת הצלחת במרווחי זמן של 45 s. השתמש 380 ננומטר, 10 מסנן העירור של רוחב הפס ו 470 nm, 24 מסנן פליטת רוחב פס בשילוב עם 425 nm לגזור דיקרואיק mirror. הפעל את המדידה במצב ריכוז גבוה. למטב את מספר הבזקים, לצבור גלאי, מידות צלחת וגובה מדידה לפני הפעלת assays.
הערה: תנאי שנקבע סופי הם 300 ננומטר לב/20 שריר השלד nM רירן II, 10 μM actin, 40 U/mL LDH, 200 U/mL PK, 220 μM NADH, 1 מ"מ פפ, 1 מ"מ ATP במאגר המכיל 10 מ"מ מגבים (pH = 7.0), 2 מ"מ MgCl2 , 0.15 mM EGTA, 0.1 mg/mL BSA, 0.5% (v/v) DMSO ו 1 מ"מ DTT. הנפח הכולל הוא 20 μL/ובכן. הריכוז המורכב הסופי הגבוה ביותר הוא 50 μM. 20 μM פארא-האמילבלביוסטטין ב 0.5% dmso משמש כשליטה חיובית 0.5% dmso בלבד הוא שליטה שלילית. כל המדידות מתבצעות. בטריפליטים
3. ניתוח נתונים
- העלילה עוצמת הקרינה הנצפה נגד הזמן עבור כל טוב.
- בצע רגרסיה ליניארית פשוטה כדי לקבוע את השיפוע ואת החיתוך של תגובות הזריחה עבור כל טוב. השיפוע פרופורציונלי לקצב הצריכה של ATP (NADH), בעוד שהחיתוך פרופורציונלי לריכוז NADH בתחילת המדידה (t = 0 s).
- בנו עקומת כיול עבור NADH על ידי התוויית ההודעות שהתקבלו עבור השורה הראשונה של הצלחת נגד הריכוז של NADH. ודא כי ההודעות תלויות בצורה קווית בריכוז NADH.
הערה: המיירט מעריכים את עוצמת הקרינה הפלואורסצנטית האמיתית ב-t = 0 עם הרבה יותר ביטחון מאשר הממוצע של העוצמה הפלואורסצנטית הגולמי קורא ב-t ≈ 0. - בצע רגרסיה ליניארית פשוטה כדי להשיג את השיפוע והחיתוך של קו כיול NADH.
הערה: החיתוך מתאר את אות הרקע הפלואורסצנטי (אין כרגע NADH), בעוד השיפוע מתאים לעוצמת הקרינה הפלואורסצנטית/תאורטית של פתרון של 1 מ-NADH בניסוי מסוים זה. - חלק את השיפוע של תגובת הקרינה הפלואורסצנטית שהושג לשאר הבארות על-ידי השיפוע של קו כיול NADH כדי להמיר שינויי זריחה לתעריפי צריכת ה-ATP.
- התווה את תעריפי צריכת ה-ATP כנגד ריכוז המעכב.
- כדי לקבוע קבועים מעכבות, השתמש בתוכנה סטטיסטית מתאימה כדי להתאים לנתוני המינון-תגובה למשוואה הריבועית הבאה, המתאימה למודל שיווי משקל פשוט של אחד-לאחד:
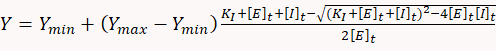
כאשר y הוא קצב צריכת ה-Atp, ymin הוא קצב ה-atp Int היעדר המעכב, ymax הוא קצב הצריכה התיאורטי של ה-atp ב-100% עיכוב, KI הוא הקבוע המעכב , [ה]t ו [אני]t הם ריכוז מוחלט של האנזים (רירן) ומעכב, בהתאמה.
תוצאות
המפה האופיינית לפריסת הלוח המשמשת לסינון ניסויים מוצגת באיור 1. השורות הראשונות והאחרונות שמורות עבור כיול NADH ושליטה חיובית (20 μM פארא-האמיבלביוסטטין, 0.5% dmso), בהתאמה. השורות הנותרות (ב-O) משמשות לבדיקת פעילות העכבות של תרכובות. כאן, 15-צעד סדרתי 1:2 לדילול ...
Discussion
שלבים קריטיים בפרוטוקול
למטב את פריסת צלחת על ידי הפעלת כמה צלחות עם שליטה שלילית בלבד (התגובה ATPase ללא מעכב). בדוק את התוצאות בקפידה עבור דפוסים בשיעורי התגובה. לדוגמה, אלה עשויים לנבוע מאפקטי קצה ו/או פגמים בציפוי המשטח של הידרופיפילית של צלחות "לא מחייבות". אם תבני?...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי מענק מן המכון הלאומי של הפרעות נוירולוגיות שבץ המכון הלאומי על התעללות בסמים NS096833 (CAM).
Materials
| Name | Company | Catalog Number | Comments |
| 384-well Low Flange Black Flat Bottom Polystyrene NBS Microplate | Corning | 3575 | |
| ATP (Adenosine 5′-triphosphate disodium salt hydrate) | Sigma | A7699 | |
| Aurora FRD-IB Dispenser | Aurora Discovery, Inc. | 00017425 | |
| Biomek NXP Multichannel Laboratory Automation Workstation | Beckman Coulter | A31841 | |
| Blebbistatin | AMRI | N/A | Custom synthesis |
| BSA (Bovine Serum Albumin, Protease-Free) | Akron Biotech | AK1391 | |
| Centrifuge 5430 R, refrigerated, with Rotor FA-35-6-30 | Eppendorf | 022620663 | |
| Centrifuge 5430, non-refrigerated, with Rotor A-2-MTP | Eppendorf | 022620568 | |
| DMSO (Dimethyl sulfoxide) | Sigma | D2650 | |
| DTT (DL-Dithiothreitol) | Sigma | D5545 | |
| E1 ClipTip Multichannel Pipette; 384-format; 8-channel | Thermo Scientific | 4672010 | |
| E1 ClipTip Multichannel Pipette; 96-format; 8-channel | Thermo Scientific | 4672080 | |
| EGTA (Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid) | Sigma | E3889 | |
| EnVision 2104 Multilabel Plate Reader | PerkinElmer | 2104-0010 | |
| Glycerol | Sigma | G2025 | |
| LDH (L-Lactic Dehydrogenase from rabbit muscle) | Sigma | L1254 | |
| MgCl2.6H2O (Magnesium chloride hexahydrate) | Sigma | M2670 | |
| Microplate Shaker | VWR | 12620-926 | |
| Microplate, 384 well, PP, Small Volume, Deep Well, Natural | Greiner Bio-One | 784201 | |
| MOPS (3-(N-Morpholino)propanesulfonic acid) | Sigma | M1254 | |
| Myosin Motor Protein (full length) (Bovine cardiac muscle) | Cytoskeleton | MY03 | |
| Myosin Motor Protein (full length) (Rabbit skeletal muscle) | Cytoskeleton | MY02 | |
| NADH (β-Nicotinamide adenine dinucleotide, reduced disodium salt hydrate) | Sigma | N8129 | |
| NaN3 (Sodium azide) | Sigma | 71289 | |
| NaOH (Sodium hydroxide) | Sigma | S8045 | |
| Optical Filter CFP 470/24nm (Emission) | PerkinElmer | 2100-5850 | Barcode 240 |
| Optical Filter Fura2 380/10nm (Excitation) | PerkinElmer | 2100-5390 | Barcode 112 |
| Optical Module: Beta Lactamase | PerkinElmer | 2100-4270 | Barcode 418 |
| OriginPro 2017 software | OriginLab | N/A | |
| para-Aminoblebbistatin | AMRI | N/A | Custom synthesis |
| para-Nitroblebbistatin | AMRI | N/A | Custom synthesis |
| PEP (Phospho(enol)pyruvic acid monopotassium salt) | Sigma | P7127 | |
| PK (Pyruvate Kinase from rabbit muscle) | Sigma | P9136 | |
| Rabbit Muscle Acetone Powder | Pel Freez Biologicals | 41995-2 |
References
- Heissler, S. M., Sellers, J. R. Kinetic Adaptations of Myosins for Their Diverse Cellular Functions. Traffic. 17 (8), 839-859 (2016).
- Hartman, M. A., Spudich, J. A. The myosin superfamily at a glance. Journal of Cell Science. 125 (Pt 7), 1627-1632 (2012).
- Berg, J. S., Powell, B. C., Cheney, R. E. A millennial myosin census. Molecular Biology of the Cell. 12 (4), 780-794 (2001).
- Sebe-Pedros, A., Grau-Bove, X., Richards, T. A., Ruiz-Trillo, I. Evolution and classification of myosins, a paneukaryotic whole-genome approach. Genome Biology and Evolution. 6 (2), 290-305 (2014).
- Newell-Litwa, K. A., Horwitz, R., Lamers, M. L. Non-muscle myosin II in disease: mechanisms and therapeutic opportunities. Disease Models & Mechanisms. 8 (12), 1495-1515 (2015).
- He, Y. M., Gu, M. M. Research progress of myosin heavy chain genes in human genetic diseases. Yi Chuan. 39 (10), 877-887 (2017).
- Rauscher, A. A., Gyimesi, M., Kovacs, M., Malnasi-Csizmadia, A. Targeting Myosin by Blebbistatin Derivatives: Optimization and Pharmacological Potential. Trends in Biochemical Sciences. 43 (9), 700-713 (2018).
- Straight, A. F., et al. Dissecting temporal and spatial control of cytokinesis with a myosin II Inhibitor. Science. 299 (5613), 1743-1747 (2003).
- Sirigu, S., et al. Highly selective inhibition of myosin motors provides the basis of potential therapeutic application. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), E7448-E7455 (2016).
- Green, E. M., et al. A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. Science. 351 (6273), 617-621 (2016).
- Morgan, B. P., et al. Discovery of omecamtiv mecarbil the first, selective, small molecule activator of cardiac Myosin. ACS Medicinal Chemistry Letters. 1 (9), 472-477 (2010).
- Kepiro, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable myosin II inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
- Varkuti, B. H., et al. A highly soluble, non-phototoxic, non-fluorescent blebbistatin derivative. Scientific Reports. 6, 26141 (2016).
- Verhasselt, S., et al. Discovery of (S)-3'-hydroxyblebbistatin and (S)-3'-aminoblebbistatin: polar myosin II inhibitors with superior research tool properties. Organic and Biomolecular Chemistry. 15 (9), 2104-2118 (2017).
- Verhasselt, S., Roman, B. I., Bracke, M. E., Stevens, C. V. Improved synthesis and comparative analysis of the tool properties of new and existing D-ring modified (S)-blebbistatin analogs. European Journal of Medicinal Chemistry. 136, 85-103 (2017).
- Warren, G. B., Toon, P. A., Birdsall, N. J., Lee, A. G., Metcalfe, J. C. Reconstitution of a calcium pump using defined membrane components. Proceedings of the National Academy of Sciences of the United States of America. 71 (3), 622-626 (1974).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. Rad54 protein exerts diverse modes of ATPase activity on duplex DNA partially and fully covered with Rad51 protein. Journal of Biological Chemistry. 277 (48), 46205-46215 (2002).
- Hanzelmann, P., Schindelin, H. Structural Basis of ATP Hydrolysis and Intersubunit Signaling in the AAA+ ATPase p97. Structure. 24 (1), 127-139 (2016).
- Hackney, D. D., Jiang, W. Assays for kinesin microtubule-stimulated ATPase activity. Methods in Molecular Biology. 164, 65-71 (2001).
- Kiianitsa, K., Solinger, J. A., Heyer, W. D. NADH-coupled microplate photometric assay for kinetic studies of ATP-hydrolyzing enzymes with low and high specific activities. Analytical Biochemistry. 321 (2), 266-271 (2003).
- Carter, S. G., Karl, D. W. Inorganic phosphate assay with malachite green: an improvement and evaluation. Journal of Biochemical and Biophysical Methods. 7 (1), 7-13 (1982).
- Henkel, R. D., VandeBerg, J. L., Walsh, R. A. A microassay for ATPase. Analytical Biochemistry. 169 (2), 312-318 (1988).
- Rowlands, M. G., et al. High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Analytical Biochemistry. 327 (2), 176-183 (2004).
- Rule, C. S., Patrick, M., Sandkvist, M. Measuring In Vitro ATPase Activity for Enzymatic Characterization. Journal of Visualized Experiments. (114), 54305 (2016).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Cell Biology. 24, 271-289 (1982).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Kovacs, M., Toth, J., Hetenyi, C., Malnasi-Csizmadia, A., Sellers, J. R. Mechanism of blebbistatin inhibition of myosin II. Chem Journal of Biological Chemistry. 279 (34), 35557-35563 (2004).
- Allingham, J. S., Smith, R., Rayment, I. The structural basis of blebbistatin inhibition and specificity for myosin II. Nature Structural & Molecular Biology. 12 (4), 378-379 (2005).
- Kettlun, A. M., et al. Purification and Characterization of 2 Isoapyrases from Solanum-Tuberosum Var Ultimus. Phytochemistry. 31 (11), 3691-3696 (1992).
- Hulme, E. C., Trevethick, M. A. Ligand binding assays at equilibrium: validation and interpretation. British Journal of Pharmacology. 161 (6), 1219-1237 (2010).
- Motulsky, H. J., Neubig, R. R. Analyzing binding data. Current Protocols in Neuroscience. 52 (1), 7.5.1-7.5.65 (2010).
- Sehgal, P., Olesen, C., Moller, J. V. ATPase Activity Measurements by an Enzyme-Coupled Spectrophotometric Assay. Methods in Molecular Biology. 1377, 105-109 (2016).
- Solinger, J. A., Lutz, G., Sugiyama, T., Kowalczykowski, S. C., Heyer, W. D. Rad54 protein stimulates heteroduplex DNA formation in the synaptic phase of DNA strand exchange via specific interactions with the presynaptic Rad51 nucleoprotein filament. Journal of Molecular Biology. 307 (5), 1207-1221 (2001).
- Banik, U., Roy, S. A continuous fluorimetric assay for ATPase activity. Biochemistry Journal. 266 (2), 611-614 (1990).
- Xiao, Y. X., Yang, W. X. KIFC1: a promising chemotherapy target for cancer treatment?. Oncotarget. 7 (30), 48656-48670 (2016).
- See, S. K., et al. Cytoplasmic Dynein Antagonists with Improved Potency and Isoform Selectivity. ACS Chemical Biology. 11 (1), 53-60 (2016).
- Datta, A., Brosh, R. M. New Insights Into DNA Helicases as Druggable Targets for Cancer Therapy. Frontiers in Molecular Biosciences. 5, 59 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved